皮质酮诱导小鼠抑郁伴发的学习记忆损伤
2018-05-04范琳犀杨玉洁陈远伟刘新民
范琳犀,杨玉洁,姜 宁,陈远伟,刘新民*,王 琼*
(1.西南医科大学附属中医医院/中葡中医药国际合作中心,四川 泸州 646000; 2.西南医科大学药理教研室,四川 沪州 646000;3.中国医学科学院北京协和医学院药用植物研究所, 北京 100193; 4.云南中医学院药学院,昆明 650500)
现代社会高强度、高压力的生活和工作,使人们的身心长期处于应激状态,导致抑郁症频发[1]。大量研究表明随着病情的发展,抑郁症患者出现不同程度的学习记忆障碍[2-3]。用皮质酮给药常用于抑郁动物模型的建立[4-5],国外对皮质酮口服4周用于诱导的动物抑郁样行为表现伴发学习记忆能力影响也有报道。本实验通过皮颈下注射不同剂量的皮质酮,观察动物抑郁样行为的改变,进而研究其对小鼠学习记忆功能的影响,为抑郁伴发学习记忆障碍及其防护药物的研究提供参考。
1 材料和方法
1.1 实验动物
SPF级雄性C57BL/6J小鼠,60只,6~8周龄,体重(20±1)g,由北京维通利华实验动物公司提供[SCXK(京)2016-0011]。实验期间喂养于中国医学科学院院药用植物研究所实验动物房[SYXK(京)2013-0023],供给充足的标准饲料和清洁水,光照时间12 h/12 h(照明/黑暗),室温22℃~25℃,湿度条件为(55±10)%。动物适应喂养7 d。本实验遵循实验动物3R原则。
1.2 主要试剂与仪器
皮质甾酮(梯希爱(上海)化成工业发展有限公司,7XJCB-GP);吐温-80(Sigma,P1754);二甲基亚砜(DMSO,Amresco,3116C455);0.9%氯化钠注射液(山东华鲁制药有限公司,D16081311)。
小鼠自主活动实时监测系统、小鼠悬尾实时监测系统、小鼠强迫游泳实时检测系统、小鼠水迷宫实时测试系统(由中国医学科学院药用植物研究所、中国航天员科研训练中心和北京康森益友科技有限公司联合研发)。
1.3 实验方法
1.3.1 分组及给药
C57BL/6J小鼠40只按体重分成4组,空白组、皮质酮20 mg/kg低剂量组、皮质酮40 mg/kg中剂量组和皮质酮80 mg/kg高剂量组,每组10只。C57BL/6J小鼠20只按体重分为2组,空白组、皮质酮40 mg/kg组,每组10只。空白组皮下注射含0.1% DMSO(二甲亚砜)和0.1% 吐温-80的0.9%氯化钠注射液的溶媒,皮质酮组皮下注射皮质酮溶液(含溶媒,使用前混匀),给药体积为10 mL/kg,每日1次,连续造模21 d[6-7],行为学检测期间依然给予皮质酮注射。
1.3.2 空场实验[8-9]
在自主活动实时监测系统测试箱中心将小鼠轻轻放下,适应3 min,然后计算机监测动物在后10 min内总的及中央区的运动路程、运动时间、运动速度等指标,分析动物的自发活动情况。
1.3.3 小鼠悬尾实验[10-11]
将小鼠以倒挂的状态固定于悬尾实时监测系统实验箱中, 调整支架高度,从而使小鼠悬空大约离箱底5 cm,适应2 min, 软件自动统计小鼠后4 min的不动时间。
1.3.4 小鼠强迫游泳实验[12-13]
用强迫游泳监测小鼠的活动状况。将小鼠置于小鼠强迫游泳实时监测系统实验桶中,水温为25℃,适应2 min, 软件自动统计小鼠后4 min内的不动时间。
1.3.5 物体位置识别实验[14-15]
该实验分为3个阶段:适应期、熟悉期、测试期。适应期3 d,每天将实验动物单个放入物体认知实验箱内,熟悉10 min。第4天,熟悉期时,将两个完全相同的物体放入试验箱内相邻的磁铁处固定,记录小鼠5 min内对两物体的探索总时间。间隔30 min后,进入测试期。测试期将其中一个物体移到另一物体的斜对角,记录5 min内小鼠对两物体的探索时间。用辨别指数(DI)来评价动物的学习记忆能力,辨别指数计算公式为DI=(N-F)/(N+F)×100%,其中N为新物体探索时间,F为熟悉物体探索时间。
1.3.6 Morris水迷宫实验[16-17]
用小鼠水迷宫实时监测系统监测小鼠的活动状况。实验分为定位导航阶段和空间探索阶段。定位航行阶段,共6 d,每天训练3次,每次训练前后各适应15 s,检测时间为90 s,若时间范围内找到平台,算作寻台成功并记录其逃避潜伏期;若动物没有发现平台,训练结束,其逃避潜伏期记录为90 s。空间探索阶段,撤去平台,将动物从原平台象限的对角象限面向池壁放入水中,监测其在90 s内动物的总游程、平均速度,以及穿过原平台所在位置的速度和穿台次数。
1.4 统计学方法

2 结果
2.1 不同剂量皮质酮对小鼠空场实验的影响
如表1所示,与空白组比较,皮质酮组20 mg/kg能减少空场实验中的中央区运动路程和中央区运动路程比率(P<0.05);皮质酮组40 mg/kg能明显减少空场实验中的中央区路程/时间、中央区运动路程/时间、中央区运动路程比率/时间比率(P<0.05);皮质酮组80 mg/kg能明显减少空场实验中的中央区路程、中央区运动路程/时间、中央区运动路程比率(P<0.05);而皮质酮各剂量组的总路程、运动时间和运动速度等指标与空白组相比,差异无显著性。
2.2 不同剂量皮质酮对小鼠悬尾实验的影响
如图1所示,与空白组相比较,皮质酮组40,80 mg/kg的悬尾不动时间显著增长(P<0.05或P< 0.01)。
2.3 皮质酮40 mg/kg对小鼠悬尾实验和强迫游泳实验不动时间的影响
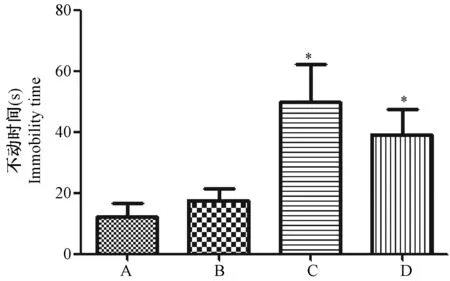
研究皮质酮40 mg/kg对小鼠抑郁样行为的影响,结果如图3所示,皮质酮组的悬尾不动时间与空白组相比较明显增加(P< 0.05);强迫游泳实验皮质酮组的不动时间显著高于空白组(P< 0.01)。
2.4 中剂量皮质酮对小鼠物体位置识别实验的影响
选用40 mg/kg皮质酮造模,研究其对小鼠物体位置识别影响,如图4所示,在熟悉期,与空白组比,皮质酮给药组小鼠对物体探索总时间减少,但差异无显著性;在检测期,与空白组比较,皮质酮给药组小鼠的相对辨别指数显著降低(P< 0.05)。
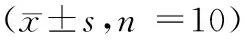
表1 不同剂量皮质酮对小鼠的空场实验的影响Tab.1 Effect of different doses of corticosterone on open-field test in the mice
注:与空白组相比较,*P< 0.05。
Note.Compared with the control group,*P< 0.05.
注:(A)空白组;(B)皮质酮组20 mg/kg;(C)皮质酮组40 mg/kg;(D)皮质酮组80 mg/kg;与空白组相比较,*P< 0.05。图1 不同剂量皮质酮对小鼠悬尾实验不动时间的影响Note.(A)Control group.(B)Corticosterone 20 mg/kg group.(C)Corticosterone 40 mg/kg group.(D)Corticosterone 80 mg/kg group. Compared with the control group,*P< 0.05.Fig.1 Effect of different doses of corticosterone on immobility time in tail suspension test of the mice
注:与空白组相比较,*P< 0.05,**P< 0.01。图2 皮质酮40 mg/kg对小鼠悬尾实验和强迫游泳实验不动时间的影响Note.Compared with the control group,*P< 0.05,**P< 0.01.Fig.2 Effect of corticosterone 40 mg/kg on immobility time in tail suspension test and forced swimming test of the mice
2.5 中剂量皮质酮对小鼠Morris水迷宫实验的影响
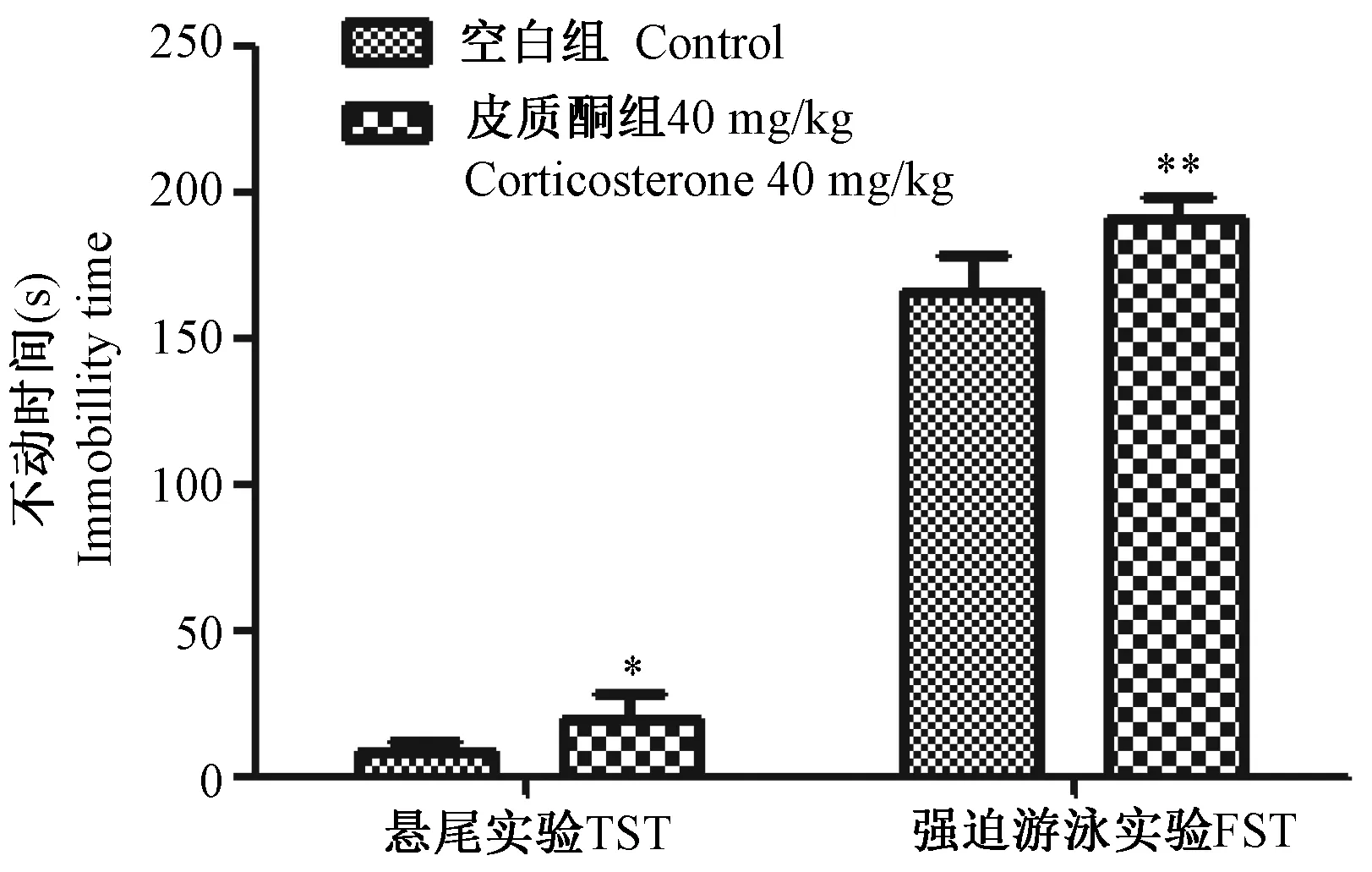
选用40 mg/kg皮质酮造模,研究其对小鼠Morris水迷宫实验的影响,结果如图3所示,在小鼠水迷宫空间探索阶段,皮质酮组相对于空白组逃避潜伏期均增加,在第3、4、6天的潜伏期明显多于空白组(P< 0.05);如图5所示,在小鼠水迷宫空间探索阶段,与空白组比较,皮质酮组在水迷宫空间探索的目标象限穿台次数、总游程、平均速度、目标想象游程、目标象限速度有明显下降(P< 0.05)。
注:与空白组相比较,*P< 0.05。图3 皮质酮40 mg/kg对小鼠水迷宫定位导航阶段潜伏期的影响Note.Compared with the control group,*P< 0.05.Fig.3 Effects of corticosterone 40 mg/kg on the escape latency in Morris water maze (place navigation) of the mice
3 讨论
皮质酮是啮齿类动物肾上腺皮质中合成的主要肾上腺皮质激素(即糖皮质激素),用于调节应激反应和代谢过程。下丘脑-垂体-肾上腺皮质HPA轴与肾上腺皮质激素相互调节维持机体的功能[18],而长期大量的肾上腺皮质激素的摄入可导致HPA轴功能的紊乱,从而导致抑郁症症状的出现[19-20]。研究发现长期、高水平的糖皮质激素可激活海马糖皮质激素受体,造成海马组织的损伤,出现情绪及学习记忆障碍[21-22],同时发现抑郁症可导致认知功能的改变[23]。据Gregus等[24]的研究发现不断重复的给予动物大量的皮质酮可导致动物抑郁样行为的改变,且伤害性小周期相对较短,为进一步探讨皮质酮注射对机体的影响,本实验通过皮质酮皮颈下注射的方式,通过空场、悬尾、强迫游泳、物体位置识别、水迷宫等实验来系统观察皮质酮对动物的抑郁样行为伴发学习记忆能力改变。
研究报道在空场实验中,当动物在中央区的运动路程等指标显著减少时,显示动物对新环境的好奇度降低,表现出抑郁症样的特征[25];在悬尾和强迫游泳实验中的不动时间增加则是“绝望”无助样行为的表现[26],当动物出现抑郁样行为时主要表现为快感缺失和无助样行为。本实验发现中、高剂量给药组在空场实验中能明显减少动物在中央区的路程、时间、运动路程比率、运动时间比率,表明模型动物对新环境的好奇度降低,在悬尾实验和强迫游泳实验中,模型动物的悬尾和强迫游泳的不动时间显著增加,说明慢性皮质酮皮下注射给药引起了小鼠抑郁样行为的改变,与文献报道相一致[27-28]。

注:(A)空白组;(B)皮质酮组40 mg/kg;与空白组相比较,*P< 0.05。图4 皮质酮40 mg/kg对小鼠物体位置识别实验的探索总时间和相对辨别指数的影响Note.(A)Control group.(B)Corticosterone 40 mg/kg. Compared with the control group,*P< 0.05.Fig.4 Effect of corticosterone 40 mg/kg on the total exploration time and discrimination index of object location recognition in the mice
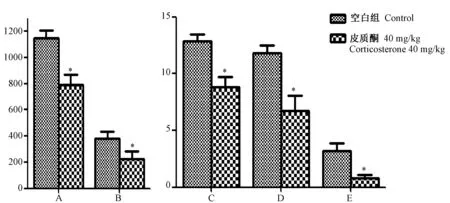
注:(A)总游程/cm;(B)目标象限游程/cm;(C)平均速度/cm/s;(D)目标象限速度/cm/s;(E)目标象限穿台次数;与空白组相比较,*P< 0.05。图5 皮质酮40 mg/kg对小鼠水迷宫空间探索阶段活动的影响Note.(A)Swimming distance, cm.(B)Swimming distance in target quadrant, cm.(C)Swimming speed, cm/s.(D)Swimming speed in target quadrant, cm/s.(E)Number of target crossing. Compared with the control group,*P< 0.05.Fig.5 Effects of corticosterone 40 mg/kg on mice in the Morris water maze (spatial probe) test
物体位置识别实验用于评估短期空间学习能力的方法,是检测动物对新颖物体偏好性原理基础上的自发状态下的物体识别记忆能力的一种方法[29]。在物体位置识别实验中发现,皮质酮慢性皮下注射给药能使小鼠对物体位置识别的相对辨别指数显著减少,说明皮质酮损害了小鼠的物体位置识别能力[30]。Morris水迷宫实验是用于评价动物的长期空间记忆和参考记忆的实验方法[31],且定位航行的潜伏期和空间探索阶段的穿台次数主要用于动物的空间学习和记忆能力。本研究采用慢性皮下注射的方式给予小鼠皮质酮3周后,发现皮质酮组动物在Morris水迷宫实验中的定位航行潜伏期显著增加,在空间探索期在平台象限的总游程、平均速度、游程、速度均有明显下降,且穿台次数明显降低,表明皮质酮慢性皮下注射损害了动物的空间学习和记忆能力。本实验从短期和长期的实验方法检测中发现,小鼠的空间学习能均受到损伤。
综上,本研究通过连续21 d慢性皮下注射的方式给予小鼠皮质酮40 mg/mL,诱导了小鼠抑郁样行为的改变,同时也对动物的空间学习记忆能力造成了损伤,为抗抑郁药物的开发提供初步的参考。
参考文献:
[1] Li G, Wang L Y, Shofer J B, et al. Temporal relationship between depression and dementia: findings from a large community-based 15-year follow-up study [J]. Arch Gen Psychiatry, 2011, 68(9): 970-977.
[2] 史华伟, 王椿野, 赵振武, 等. 抑郁症学习记忆障碍的研究进展 [J]. 世界中西医结合杂志, 2014, 9(02): 202-206.
[3] 梁光利, 左晓伟, 王成东. 抑郁症患者认知障碍与心理痛苦状况及其相关性研究 [J]. 精神医学杂志, 2015(4): 251-253.
[4] 张绘宇, 赵玉男, 王中立, 等. 慢性皮质酮注射对小鼠抑郁样行为及脑糖原水平的影响 [J]. 中国病理生理杂志, 2015, 31(5): 828-833.
[5] Zhao Y, Xie W, Dai J, et al. The varying effects of short-term and long-term corticosterone injections on depression-like behavior in mice [J]. Brain Res, 2009, 1261: 82-90.
[6] Ji WW, Li RP, Li M, et al. Antidepressant-like effect of essential oil of Perilla frutescens in a chronic, unpredictable, mild stress-induced depression model mice [J]. Chin J Nat Med, 2014, 16(10):753-759.
[7] Ali SH, Madhana RM, Athira KV, et al. Resveratrol ameliorates depressive-like behavior in repeated corticosterone-induced depression in mice [J]. Steroids, 2015, 101: 37-42.
[8] 王琼, 买文丽, 李翊华, 等. 自主活动实时测试分析处理系统的建立与开心散安神镇静作用验证 [J]. 中草药, 2009, 40(11): 1773-1779.
[9] 李腾飞, 孙秀萍, 石哲, 等. 不同品系小鼠在三种常见抑郁检测方法中的行为学表现 [J]. 中国比较医学杂志, 2011, 21(8): 20-23.
[10] Steru L, Chermat R, Thierry B, et al. The tail suspension test: A new method for screening antidepressants in mice [J]. Psychopharmacology, 1985, 85(3): 367-370.
[11] 孙秀萍, 张晓萌, 卢聪, 等. 悬尾实验实时检测分析处理系统的研制及初步应用 [J]. 中国比较医学杂志, 2014, 24(5):66-71.
[12] Porsolt RD, Bertin A, Jalfre M. Behavioral despair in mice: a primary screening test for antidepressants [J]. Arch Int Pharmacodyn Ther, 1977, 229(2): 327-336.
[13] Dang H, Chen Y, Liu X, et al. Antidepressant effects of ginseng total saponins in the forced swimming test and chronic mild stress models of depression [J]. Progr Neuro-Psychopharmacol Biol Psychiatry, 2009, 33(8): 1417-1424.
[14] 宋广青, 高莉, 孙秀萍, 等. 大鼠物体识别实验装置的研制 [J]. 中国比较医学杂志, 2013, 23(8): 80-86.
[15] 王逸, 卢聪, 宋广青, 等. 慢性束缚应激对SD和Wistar大鼠学习记忆能力的影响[J]. 中国实验动物学报, 2014, 22(2): 40-44.
[16] 刘新民, 陈善广, 王圣平, 等. 益智中草药研究中的一种新方法 [J]. 中草药, 1998, 29(3):174-177.
[17] Qiong W, Yong-Liang Z, Ying-Hui L, et al. The memory enhancement effect of Kai Xin San on cognitive deficit induced by simulated weightlessness in rats [J]. J Ethnopharmacol, 2016, 187: 9-16.
[18] Bao AM, Swaab DF. Corticotropin-releasing hormone and arginine vasopressin in depression: focus on the human postmortem hypothalamus.[J]. Vitamins Hormones, 2010, 82(5): 339-365.
[19] Price JL, Drevets WC. Neural circuits underlying the pathophysiology of mood disorders [J]. Trends Cogn Sci, 2012, 16(1): 61-71.
[20] Pariante CM, Lightman SL. The HPA axis in major depression: classical theories and new developments [J]. Trends Neurosci, 2008, 31(9):464-468.
[21] 马强, 王福庄, 赵彤, 等. 皮质酮对大鼠海马脑片CA1区长时程增强效应的影响 [J]. 中国应用生理学杂志, 2003, 19(1): 96-97.
[22] Zhao Y, Wang Z, Dai J, et al. Beneficial effects of benzodiazepine diazepam on chronic stress-induced impairment of hippocampal structural plasticity and depression-like behavior in mice [J]. Behav Brain Res, 2012, 228(2): 339-350.
[23] Karstens AJ, Rubin LH, Shankman SA, et al. Investigating the separate and interactive associations of trauma and depression on neurocognition in urban dwelling adults [J]. J Psychiatr Res, 2017, 89: 6-13.
[24] Gregus A, Wintink A J, Davis A C, et al. Effect of repeated corticosterone injections and restraint stress on anxiety and depression-like behavior in male rats [J]. Behav Brain Res, 2005, 156(1): 105-114
[25] 买文丽, 王琼, 刘新民, 等. 小鼠自主活动实验中的评价指标 [J]. 中国实验动物学报, 2008, 16(3): 172-175.
[26] Naumenko VS, Kondaurova EM, Bazovkina DV, et al. Effect of brain-derived neurotrophic factor on behavior and key members of the brain serotonin system in genetically predisposed to behavioral disorders mouse strains [J]. Neuroscience, 2012, 214: 59-67.
[27] Lee B, Sur B, Shim I, et al. Angelica gigas ameliorate depression-like symptoms in rats following chronic corticosterone injection [J]. BMC Compl Altern Med, 2015, 15(1): 210.
[28] Zhan H, Huang F, Yan F, et al. Alterations in splenic function and gene expression in mice with depressive-like behavior induced by exposure to corticosterone [J]. Int J Mol Med, 2017, 39(2): 327-336.
[29] Ennaceur A, Delacour J. A new one-trial test for neurobiological studies of memory in rats. 1: Behavioral data [J]. Behav Brain Res, 1988, 31(1): 47-59.
[30] Lu C, Dong L, Lv J, et al. 20(S)-protopanaxadiol (PPD) alleviates scopolamine-induced memory impairment via regulation of cholinergic and antioxidant systems, and expression of Egr-1, c-Fos and c-Jun in mice [J]. Chem Biol Interact, 2018, 27(9): 64-72.
[31] Darcet F, Mendezdavid I, Tritschler L, et al. Learning and memory impairments in a neuroendocrine mouse model of anxiety/depression [J]. Front Behav Neurosci, 2014, 8(8): 136.
