小麦赤霉菌毒素合成机制及检测技术研究进展
2018-05-04范三红胡小平
范三红,胡小平
(旱区作物逆境生物学国家重点实验室/西北农林科技大学生命科学学院/植物保护学院,陕西杨凌 712100)
小麦赤霉病(Fusarium head blight)是影响全球小麦生产的主要病害,其发生不仅会引起小麦严重减产,影响粮食供给安全,同时会导致小麦籽粒的毒素污染,产生威胁人畜生命健康的食品安全问题[1]。赤霉病的发生通常会使小麦产量减少20%左右,大面积感染时小麦的产量减少可达50%~60%,甚至绝收。随着小麦矮秆品种和玉米小麦轮作栽培模式的推广,我国小麦赤霉病发生区域从长江流域向黄淮流域不断北移,发生频率也在不断增加[2]。2012年,我国爆发小麦赤霉病大流行,受灾面积约占全国小麦总面积的一半,造成了小麦产量损失严重[3]。赤霉菌侵染小麦时,病菌产生的多种毒素会在小麦籽粒中累积,其中最主要的成分为脱氧雪腐镰孢菌烯醇(deoxynivalenol,DON)及其3-乙酰衍生物(3-ADON)和15-乙酰衍生物(15-ADON)。DON可引起人畜恶心、呕吐、胃部不适,危害生殖系统,甚至具有致癌、致畸、致突变的危险[4-5]。赤霉菌毒素导致的粮食、食品和饲料污染问题引起了人们极大的关注,成为农业与食品科学领域的研究热点。
小麦赤霉病由禾谷镰孢菌(F.graminearum)、黄色镰孢菌(F.culmorum)、梨孢镰孢菌(F.poae)、燕麦镰孢菌(F.avenaceum)、雪腐镰孢菌(F.nivale)、亚洲镰孢菌(F.asiaticum)等形成的禾谷镰孢菌复合种(Fusariumgraminearumspecies complex,FGSC)引起。由于不同地域气候不同,引发赤霉病发生的优势菌种也有所不同。引起我国小麦赤霉病的主要病原为禾谷镰孢菌和亚洲镰孢菌,其中90%以上由禾谷镰孢菌引起[2]。不同镰孢菌产生毒素的能力和毒素的种类不同,即便都是禾谷镰孢菌,不同株系的产毒能力和毒素类型也不尽相同[6]。自上世纪20世纪70年代日本学者发现并命名了镰孢菌毒素DON[7],研究者一直致力于赤霉菌毒素的合成机制、影响因素及检测方法的探索。本文汇总了近年来关于赤霉菌毒素合成、转运及调控分子机制的研究进展,并对目前主流的赤霉菌毒素检测方法进行比较分析,以期为赤霉菌毒素的监测和防控技术的研究提供参考。
1 小麦赤霉菌毒素的类别与结构
小麦赤霉菌产生的毒素主要为DON和NIV,以及它们的乙酰化衍生物,它们均为倍半萜衍生物,属于单端孢霉烯类化合物(trichothecene)。单端孢霉烯类化合物最早从粉红单端孢霉分离获得,并存在于多种镰孢菌中,它们合成过程中均出现单端孢霉二烯中间体。单端孢霉烯类化合物分为A、B两类,DON和NIV属于B类。A类和B类化合物的主要区别在于B类化合物的8位和7位碳原子上分别存在一个羰基和一个羟基,而对应官能团在A类化合物中不存在[8-9]。DON的化学名为12,13-环氧-3a,7a,15-三羟基单端孢霉烯-9-烯-8-酮,其3位和15位碳原子上的羟基与乙酰基形成酯键产生了DON的两种衍生物3-ADON和15-ADON。NIV的结构与DON的结构极为类似,最主要的区别在于NIV在4位多出了一个羟基。NIV也存在两种乙酰化的衍生物4-ANIV和4,15-diANIV。NIV的俗名雪腐镰孢菌烯醇,而DON的俗名为脱氧雪腐镰孢菌烯醇,所谓的脱氧就是指DON与NIV相比4位的羟基被氢取代。从英国分离到的76个产生DON的禾谷镰孢菌株中,95%为15-ADON化学型,5%为3-ADON化学型[10]。从我国分离到的60株赤霉菌中禾谷镰孢菌均为15-ADON化学型,亚洲镰孢菌为3-ADON或NIV化学型,NIV化学型镰孢菌产生毒素的能力远低于DON化学型[6]。通常液体培养获得的毒素为乙酰化衍生物,但侵染植物时会出现去乙酰化的毒素,这可能是病原或植物产生的酯酶催化对应乙酰基水解的结果[11]。
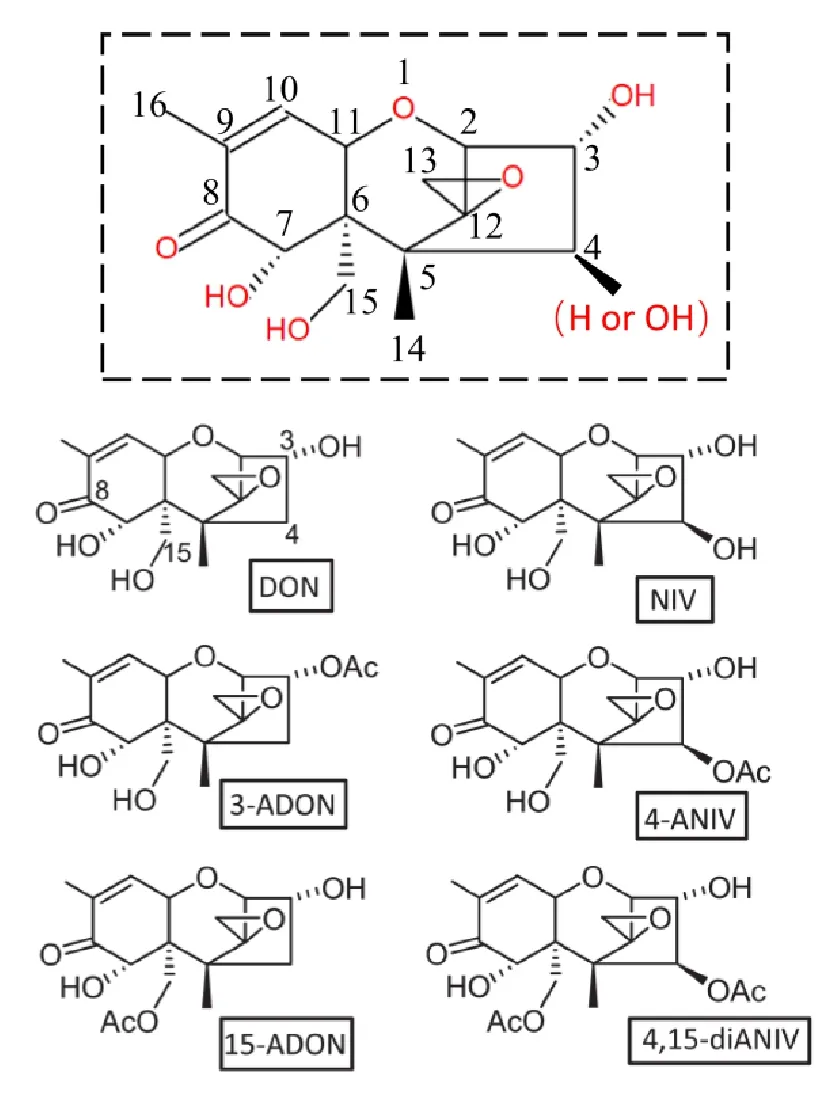
图1 DON、NIV及其乙酰化衍生物的化学结构[12]
2 镰孢菌毒素合成相关基因
镰孢菌毒素合成相关基因最早由美国农业部研究者从拟枝镰孢菌(F.sporotrichioides)中发现,该镰孢菌可产生T2毒素[13]。后来研究者从禾谷镰孢菌中获得了类似的发现,并有了更深入的研究[14]。参与镰孢菌毒素合成的基因有12~16,不同菌种甚至株系有所差异[11,15]。其中有12个基因形成一个 Tri5的基因簇(图2),该基因簇依次包含 Tri8、7、3、4、6、5、10、9、11、12、13、14。除此之外还包括 Tri1、 Tri16、 Tri15和 Tri101,其中 Tri1和 Tri16相邻(表1)。与拟枝镰孢菌相比,禾谷镰孢菌均缺失了 Tri16基因,且不同化学型的禾谷镰孢菌毒素的合成基因还有所不同,与NIV型菌株不同,DON型菌株的 Tri7和 Tri13发生缺失或突变[16]。其中 Tri5编码单端孢霉二烯合成酶[17],该酶催化单端孢霉烯类毒素共同前体-单端孢霉二烯的形成,是毒素合成的关键酶。 Tri1、Tri11、Tri13、Tri14编码P450家族单加氧酶,催化环核及侧链碳原子的羟化。 Tri7、Tri3、Tri16、Tri101编码乙酰转移酶,负责羟基与乙酰基相连形成酯键。 Tri12编码外排泵,负责毒素的外排[18-19]。 Tri8编码分泌型酯酶[12,20],水解乙酰化毒素上的乙酰基。 Tri6、Tri10、Tri15编码转录因子,其中 Tri6和 Tri10是调节毒素的合成关键[21-22]。Tri基因在禾谷镰孢菌、黄色镰孢菌及亚洲镰孢菌中具有高度共线性和一致性,但具体到每一个基因,不同镰孢菌的序列具有差异,这也是不同镰孢菌产生毒素的种类和数量存在差异的主要原因。

图2 拟枝镰孢菌与不同化学型禾谷镰孢菌的单端孢霉烯类毒素合成基因簇比较[11]

基因名Genename功能Function蛋白家族Proteinfamily参考文献ReferenceTri8C-3orC-15esteraseSecretoryesterase[12,20]Tri7C-4acetyltransferaseMembranebandedO-acetyltransferase[16]Tri3C-15acetyltransferase15-O-acetyltransferase[23]Tri4C-2hydroxylaseP450mono-oxygenase[24,25]Tri6transcriptionfactorC2H2zincfingerprotein[21]Tri5TrichodienesynthaseTrichodienesynthaseTri5[22]Tri10transcriptionfactorFungaltranscriptionfactor2[22]Tri9UnknownTRI9-Tri11C-15hydroxylaseP450mono-oxygenase[26]Tri12EffluxpumpTrichodieneeffluxpump[18,19]Tri13C-4hydroxylaseP450mono-oxygenase[16]Tri14UnknownUnkown[27]Tri1C-8hydroxylaseP450mono-oxygenase[28]Tri16C-8acetyltransferaseTransferasefamily[18,19]Tri15transcriptionfactorC2H2zincfingerprotein[29]Tri101C-3acetyltransferaseTransferasefamily[29]
3 小麦镰孢菌毒素合成通路
镰孢菌毒素DON和NIV为倍半萜衍生物,其合成前体为包含15个碳原子的法尼基焦磷酸(FPP),FPP不仅是单端孢霉烯类毒素合成的前体,也是甾醇、泛醌、多萜醇等萜类衍生物合成的前体。FPP自身的合成过程在所有生物体内具有一致性,单个FPP环化可形成多种不同的碳骨架,并在此基础上衍生出不同的倍半萜及衍生物。DON和NIV的合成可以分为6个阶段(图3)。第1阶段为FPP环化形成单端孢霉二烯(TDN),TDN是整个合成途径中第一个被鉴定的环化中间体,由 Tri5基因编码产物催化FPP环化产生[22]。第2阶段为TDN的氧化,TDN的2、3、和11位的碳原子上单加氧形成羟基,在12和13位碳原子间加氧形成环氧结构,4步反应均由 Tri4编码的P450家族单加氧酶催化完成[24-25],最终形成异构单端孢霉三醇(12,13-epoxy-9,10-trichoene-2,3,11-triol,Isotrichotriol)。第3阶段为异构单端孢霉三醇的再环化,该过程为2-和11-位羟基自发脱水成环反应,形成了第一个单端孢霉烯化合物异构木霉菌醇(isotrichodermol)。第4阶段为丽赤壳菌素(calonectrin,CAL)的形成,该过程由 Tri101、 Tri11和 Tri3编码产物催化完成, Tri101和 Tri3编码乙酰转移酶[23,26],催化将乙酰基转移到3和15位的羟基上形成酯键。3位上的羟基在第2阶段的氧化过程中已经形成,15位的羟基则是在 Tri11编码的P450单加氧酶的催化下形成[26]。第5阶段为DON及其衍生物的形成,该阶段CAL在 Tri1编码的P450蛋白催化下在7-和8-位进行加氧形成两个羟基[28],然后自发形成3,15-diADON,再在 Tri8编码的分泌型酯酶的催化下,水解掉3或15位的乙酰基形成3-ADON或15-ADON[12],最后在病菌或植物酯酶的催化下形成DON。第6阶段为NIV及其衍生物的形成,禾谷镰孢菌中其形成NIV的起始物为3,15-diADON。在 Tri13编码的单加氧酶催化下,3,15-diADON的4位碳原子上加氧形成羟基,生成3,15-diANIV,在 Tri7编码乙酰转移酶催化下在4位羟基形成乙酰酯,生产3,4,15-triANIV[16]。最后在 Tri8以及其它真菌或植物酯酶催化下水解不同酯键形成NIV和其他形式乙酰化衍生物。
4 小麦镰孢菌毒素的转运
包括DON、NIV在内的单端孢霉烯类毒素会抑制人及动物细胞代谢和蛋白质合成等过程[30],也会抑制宿主植物细胞代谢以达到快速扩散的目的。为什么DON和NIV类毒素不影响丝状真菌自身生长发育?要回答这个问题需要弄清楚毒素的合成和转运过程。2015年Jon Menke研究DON合成关键酶Tri4和Tri1时发现,融合有GFP的Tri4和融合有RFP的Tri1共定位于一个独特“细胞器”之中,并将其命名为“毒素体”(toxisome)[31]。进一步研究表明,经典的定位于内质网的萜类合成关键酶Hmp1也定位于“毒素体”之中,暗示毒素体可能来源于内质网。Tri12蛋白为毒素外排泵,亚细胞定位结果显示Tri12定位于分泌小泡和质膜,并且有少量小泡和毒素体有所重叠,于是提出毒素合成运输的模型(图4)。2017年Marike Johanne Boenisch等的研究证明,毒素体源于滑面内质网的特异化[32],这一独特的用于特殊次生物质代谢的“毒素体”类似于肝细胞、神经细胞中形成的特化滑面内质网(organized smooth ER,OSER),参与解毒、分泌等过程。2017年Liu等研究发现,HSP70蛋白FgSsb和FgSsz与它们的互作蛋白FgZuo可形成复合体,辅助微管蛋白FgTub2和小泡融合调节蛋白FgVam7的折叠[33]。它们的缺失会导致DON毒素合成受阻,从而证明DON毒素的合成与小泡运输相关。小麦镰孢菌毒素合成最后一个酶Tri8为分泌型酯酶,催化3,15-diADON上乙酰基的水解,这意味着DON毒素以前体形式3,15-diADON分泌,然后在细胞外被Tri8活化,这也可以看作是毒素分泌型丝状真菌自我保护的一种机制。
5 小麦镰孢菌毒素合成的调控
在镰孢菌毒素合成基因簇中包含两个转录因子Tri6和Tri10,基因敲除实验结果表明两者的缺失会导致Tri基因不表达,导致DON毒素不能被合成[34]。基因芯片和Chip-seq实验结果表明,Tri6转录因子可以特异结合于Tri基因上游启动子区,调节Tri基因的表达[35]。已有研究显示,氮源、pH、活性氧环境因素会影响通过Tri6和Tri10调节Tri基因表达[36,37]。与其他毒素产生真菌类似,镰孢菌的毒素合成过程受cAMP-PKA信号通路调控。2016年Jiang等勾勒出了镰孢菌毒素合成的cAMP-PKA调控模型[38]。除Tir6、Tri10外转录因子外,AreA也参与Tri基因的调控[39],其中Tri6和Tri10间存在互作,AreA和Tri10间存在互作,Tri6和AreA可通过与Tri基因上游顺式作用元件的互作实现对Tri基因的调控。内源和外源cAMP的上调会激活PKA,PKA会磷酸化Tir6和AreA从而启动Tri基因的表达。内源cAMP的产生主要依赖于腺苷酸环化酶FgAC1,该酶的活性又受其互作蛋白FgCAP1的激活[40,41]。FgCAP基因上游存在Tri6结合位点,Tri6调控FgCAP的表达,从而提高细胞中cAMP的浓度,从而刺激毒素的合成。cAMP的水解主要受PDE1和PDE2的催化,删除镰孢菌中PDE2基因会导致cAMP的累积,DON毒素水平显著上升,而删除PDE1则影响较小。此外,过量的cAMP会导致 Tri6基因表达的自抑制,而其他Tri基因的表达则上调。

图3 小麦赤霉菌单端孢霉烯类毒素合成通路[11,15]
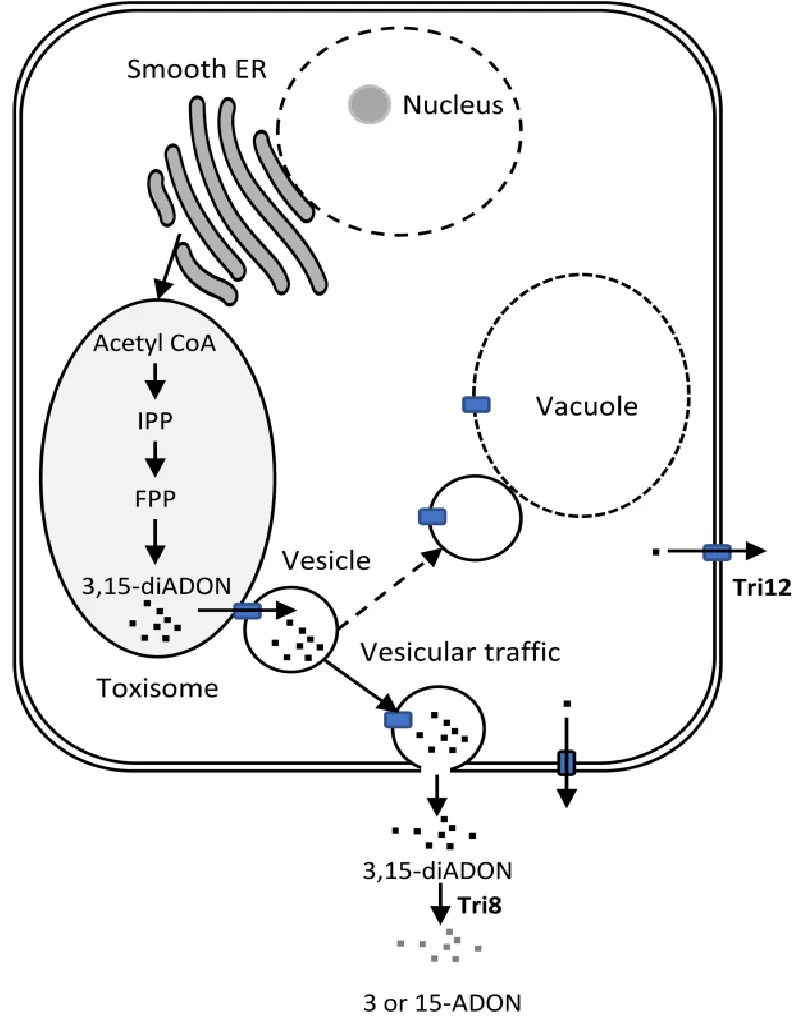
图4 赤霉菌毒素的合成和外排机制[31]

图5 赤霉菌毒素合成基因调控模型[38]
6 赤霉菌毒素检测方法比较
随着人们对粮食和饲料毒素污染问题的持续关注,赤霉菌毒素检测技术在不断演进,毒素检测技术的应用范围也在不断扩大。赤霉病抗病育种、赤霉病化学农药研发、赤霉菌毒素预测预报等研究领域不仅需要高灵敏度、高分辨率的赤霉菌毒素检测技术,粮食收购、食品加工、饲料加工和家畜养殖企业对便捷、快速、准确的毒素检测方法的需求更迫切。
根据分析原理的不同,目前的检测方法主要分为两大类,第一类基于色谱分离技术,第二类基于酶联免疫技术[42]。前者包括早期的薄层色谱法(TLC)和后来的高效液相色谱(HPLC)和气相色谱(GC),目前主要采用液相色谱或液质联用仪(LC-MS),液相色谱和气相色谱的检测灵敏度高且分辨率好,可通过质谱仪的联用鉴定毒素的新变种,两者的主要缺点是需要专业设备及专业人员。基于酶联免疫的测定方法首先需要制备出针对毒素的特异多克隆或单克隆抗体[43],抗体对毒素的专一性决定了最终检测方法对不同毒素的分辨率。目前国内外均有商品化的单克隆抗体用于DON毒素的检测。基于酶联免疫的方法又可以分为两种主要的方案,一种为酶联免疫吸附测定(ELISA),一种为胶体金免疫层析(GICA),前者通常开发成商品化的试剂盒,可对大量样品进行高通量检测,检测灵敏度可达0.9 μg·kg-1。后者主要制作成检测卡,通过类似受孕试纸的方法直观的给出定性结果,当然也可以结合荧光检测仪进行定量分析。
7 展 望
到目前为止,小麦赤霉菌毒素合成过程中每个基因( Tri9和 Tri14除外)的功能已经明确,毒素生物合成生化代谢通路、毒素的转运与外排、毒素的胞外激活及毒素合成的cAMP-PKA调控通路已基本阐明。如何在深刻理解赤霉菌毒素合成机制基础上,在大力倡导合理使用农药的背景下研发出小麦赤霉病和赤霉菌毒素污染的预防与控制新技术是农学、植保等领域专家面临的挑战。

表2 DON毒素检测方法比较Table 2 Comparison of detection methods for DON
解决小麦赤霉病及其引起的毒素污染问题的首选方案是抗病育种,培育出的新品种不仅要抗赤霉病,也要累积毒素。传统上抗病品种的筛选主要以产量为主要指标,但产量没有明显降低并不意味着毒素或者毒素类似物没有在籽粒中累积,应该将抑制赤霉菌毒素累积的能力作为品种筛选的标准之一。 Tri101为赤霉菌毒素合成通路中的一个基因,该基因编码产物可催化DON形成乙酰化衍生物,从而降低了其对植物的毒性。研究者将赤霉菌的 Tri101基因导入小麦和大麦中[51-53],提高了植物对赤霉菌和赤霉菌毒素的抗性和耐受性,为作物赤霉菌抗病育种提供了一个新思路。抗赤霉病的小麦中存在糖基化的DON,糖基化修饰降低了DON对植物细胞的毒性[54],如何提高作物DON糖基化酶的活力则是提高作物抗性的另一策略。赤霉菌毒素降解菌的筛选一直是饲料工业领域的研究热点,国内外研究者已经筛选到多种DON毒素降解菌[55-57],如果将这些降解菌中的关键酶编码基因导入小麦,则可能提高小麦的赤霉病抗性,大幅减少赤霉菌毒素在小麦籽粒中的累积。
解决上述难题的另一方案是精准的监测预警及其指导下的适度化学防控。在目前赤霉病免疫品种缺乏、发病区域不断扩大、发病频率有所增加的条件下,利用精准监测预警对小麦赤霉病的发生进行提前预判,根据预测预报结果进行针对性的适度化学防控,是降低产量损失、农药污染和毒素污染的有效方案。我们项目组发明了基于物联网技术的小麦赤霉病预报器,构建了基于云计算的赤霉病监测预警平台,并在全国主要小麦主产区进行测试和示范[58],近4年在陕西省的平均预测准确率达90%以上。传统的预测预报方法以发病程度和产量损失为目标,随着人们对赤霉菌毒素危害认识的增强,在赤霉病发病程度预测的基础上对赤霉菌毒素污染的程度进行预测与预警是下一步研究的重要方向。传统的化学防治方法同样以产量损失的挽回程度为目标,研究者应当将化学农药对赤霉菌毒素累积的影响作为农药筛选的重要考量。由于毒素可辅助赤霉菌的侵染和扩散,因而赤霉菌毒素合成过程中的关键酶可以作为新农药开发的靶标,一方面可以抑制赤霉病的发作,同时也可以阻断赤霉菌毒素的合成,预防小麦籽粒的毒素污染。
参考文献:
[1] 刘易科,佟汉文,朱展望,等.小麦赤霉病抗性改良研究进展[J].麦类作物学报,2016,36(1):51.
LIU Y K,DONG H W,ZHU Z W,etal.Review on improvement of Fusarium head blight resistance in wheat [J].JournalofTriticeaeCrops,2016,36(1):51.
[2] ZHANG H,VAN DER LEE T,WAALWIJK C,etal.Population analysis of theFusariumgraminearumspecies complex from wheat in China show a shift to more aggressive isolates [J].PLoSOne,2012,7(2):e31722.
[3] 程顺和,张 勇,别同德,等.中国小麦赤霉病的危害及抗性遗传改良[J].江苏农业学报,2012,28(5):938.
CHENG S H,ZHANG Y,BIE T D,etal.Damage of wheat Fusarium head blight epidemics and genetic improvement of wheat for scab resistance in China [J].JiangsuJournalofAgriculturalScience,2012,28(5):938.
[4] SHIFRIN VI,ANDERSON P.Trichothecene mycotoxins trigger a ribotoxic stress response that activates c-Jun N-terminal kinase and p38 mitogen-activated protein kinase and induces apoptosis [J].JournalofBiologicalChemistry,1999,274(20):13985.
[5] ROCHA O,ANSARI K,DOOHAN F M.Effects of trichothecene mycotoxins on eukaryotic cells:a review [J].FoodAdditContam,2005,22(4):369.
[6] 刘杨杨,孙海燕,李 伟,等.利用 Tri8基因区分中国小麦赤霉病菌的毒素化学型[J].植物病理学报,2018,48(1):1.
LIU Y Y,SUN H Y,LI W,etal.Identification of three chemotypes ofFusariumgraminearumspecies complex from China by Tri8 gene [J].ActaPhytopathologicaSinica,2018,48(1):1.
[7] FUJIMOTO Y,MORITA Y,TATSUNO T.Toxicologic study on the toxic substances of Fusarium nivale:chemical study of principal toxins,nivalenol,fusarenon-X and nivalenol-4,15-di-O-acetate [J].Chemical&PharmaceuticalBulletin(Tokyo),1972,20(6):1194.
[8] 张 鹏,马鸿翔.小麦赤霉病镰孢菌毒素的生物合成及其分子调控[J].生物技术通报,2009(1):11.
ZHANG P,MA H X.Biosynthesis and regulation of trichothecenes in Fusarium species [J].BiotechnologyBulletin,2009(1):11.
[9] 曹慧英,伍松陵,孙长坡.呕吐毒素(DON)生物合成和降解研究进展[J].中国粮油学报,2013,28(5):116.
CAO H Y,WU S L,SUN C P.Research advancement on biosynthesis and biodegradation of deoxynivalenol(DON) [J].JournaloftheChineseCerealsandOilsAssociation,2013,28(5):116.
[10] TOTH B,MESTERHAZY A,HORVATH Z,etal.Genetic variability of central European isolates of theFusariumgraminearumspecies complex [J].EuropeanJournalofPlantPathology,2005,113(1):35.
[11] KIMURA M,TOKAI T,TAKAHASHI-ANDO N,etal.Molecular and genetic studies of Fusarium trichothecene biosynthesis:pathways,genes,and evolution [J].Bioscience,Biotechnology,andAgrochemistry,2007,71(9):2105.
[12] ALEXANDER N J,MCCORMICK S P,WAALWIJK C,etal.The genetic basis for 3-ADON and 15-ADON trichothecene chemotypes in Fusarium[J].FungalGeneticsandBiology,2011,48(5):485.
[13] HOHN T M,MCCORMICK S P,DESJARDINS A E.Evidence for a gene cluster involving trichothecene-pathway biosynthetic genes inFusariumsporotrichioides[J].CurrentGenetics,1993,24(4):291.
[14] BROWN D W,DYER R B,MCCORMICK S P,etal.Functional demarcation of the Fusarium core trichothecene gene cluster [J].FungalGeneticsandBiology,2004,41(4):454.
[15] ALEXANDER N J,PROCTOR R H,MCCORMICK S P.Genes,gene clusters,and biosynthesis of trichothecenes and fumonisins in Fusarium[J].ToxinReview,2009,28(2-3):198.
[16] LEE T,HAN Y K,KIM K H,etal. Tri13 and Tri7 determine deoxynivalenol- and nivalenol-producing chemotypes of gibberellazeae [J].AppliedandEnvironmentalMicrobiology,2002,68(5):2148.
[17] MAIER F J,MIEDANER T,HADELER B,etal.Involvement of trichothecenes in fusarioses of wheat,barley and maize evaluated by gene disruption of the trichodiene synthase( Tri5) gene in three field isolates of different chemotype and virulence [J].MolecularPlantPathology,2006,7(6):449.
[18] ALEXANDER N J,MCCORMICK S P,HOHN T M.TRI12,a trichothecene efflux pump fromFusariumsporotrichioides:gene isolation and expression in yeast [J].MolecularandGeneralGenetics,1999,261(6):977.
[19] MENKE J,DONG Y,KISTLER H C.FusariumgraminearumTri12p influences virulence to wheat and trichothecene accumulation [J].MolecularPlant-MicrobeInteractions,2012,25(11):1408.
[20] MCCORMICK S P,ALEXANDER N J.Fusarium Tri8 encodes a trichothecene C-3 esterase [J].AppliedandEnvironmentalMicrobiology,2002,68(6):2959.
[21] PROCTOR R H,HOHN T M,MCCORMICK S P,etal. Tri6 encodes an unusual zinc-finger protein involved in regulation of trichothecene biosynthesis inFusariumsporotrichioides[J].AppliedandEnvironmentalMicrobiology,1995,61(5):1923.
[22] PEPLOW A W,TAG A G,GARIFULLINA G F,etal.Identification of new genes positively regulated by Tri10 and a regulatory network for trichothecene mycotoxin production [J].AppliedandEnvironmentalMicrobiology,2003,69(5):2731.
[23] MCCORMICK S P,HOHN T M,DESJARDINS A E.Isolation and characterization of Tri3,a gene encoding 15-O-acetyltransferase fromFusariumsporotrichioides[J].AppliedandEnvironmentalMicrobiology,1996,62(2):353.
[24] MCCORMICK S P,ALEXANDER N J,PROCTOR R H.Fusarium Tri4 encodes a multifunctional oxygenase required for trichothecene biosynthesis [J].CanadianJournalofMicrobiology,2006,52(7):636.
[25] TOKAI T,KOSHINO H,TAKAHASHI-ANDO N,etal.Fusarium Tri4 encodes a key multifunctional cytochrome P450 monooxygenase for four consecutive oxygenation steps in trichothecene biosynthesis [J].BiochemicalandBiophysicalResearchCommunications,2007,353(2):412.
[26] ALEXANDER N J,HOHN T M,MCCORMICK S P.The TRI11 gene ofFusariumsporotrichioidesencodes a cytochrome P-450 monooxygenase required for C-15 hydroxylation in trichothecene biosynthesis [J].AppliedandEnvironmentalMicrobiology,1998,64(1):221.
[27] DYER R B,PLATTNER R D,KENDRA D F,etal.FusariumgraminearumTRI14 is required for high virulence and DON production on wheat but not for DON synthesisinvitro[J].JournalofAgriculturalandFoodChemistry,2005,53(23):9281.
[28] MCCORMICK S P,HARRIS L J,ALEXANDER N J,etal. Tri1 inFusariumgraminearumencodes a P450 oxygenase [J].AppliedandEnvironmentalMicrobiology,2004,70(4):2044.
[29] ALEXANDER N J,MCCORMICK S P,LARSON T M,etal.Expression of Tri15 inFusariumsporotrichioides[J].CurrentGenetics,2004,45(3):157.doi:10.1007/s00294-003-0467-3.
[30] UENO Y,HOSOYA M,ISHIKAWA Y.Inhibitory effects of mycotoxins on the protein synthesis in rabbit reticulocytes [J].JournalofBiochemistry,1969,66(3):419.
[31] MENKE J,WEBER J,BROZ K,etal.Cellular development associated with induced mycotoxin synthesis in the filamentous fungusFusariumgraminearum[J].PLoSOne,2013,8(5):e63077.
[32] BOENISCH M J,BROZ K L,PURVINE S O,etal.Structural reorganization of the fungal endoplasmic reticulum upon induction of mycotoxin biosynthesis [J].ScienceReports,2017,7:44296.
[33] LIU Z Y,WANG Z H,HUANG M M,etal.The FgSsb-FgZuo-FgSsz complex regulates multiple stress responses and mycotoxin production via folding the soluble SNARE Vam7 and 2-tubulin inFusariumgraminearum[J].EnvironmentalMicrobiology,2017,19(12):5040.
[34] SEONG K Y,PASQUALI M,ZHOU X,etal.Global gene regulation by Fusarium transcription factors Tri6 and Tri10 reveals adaptations for toxin biosynthesis [J].MicrobiologyandMolecular,2009,72(2):354.
[35] NASMITH C G,WALKOWIAK S,WANG L,etal.Tri6 is a global transcription regulator in the phytopathogenFusariumgraminearum[J].PlosPathogens,2011,7(9):e1002266.
[36] MERHEJ J,RICHARD-FORGET F,BARREAU C.The pH regulatory factor Pac1 regulatesTrigene expression and trichothecene production inFusariumgraminearum[J].FungalGeneticsandBiology,2011,48(3):275.
[37] JIANG C,ZHANG S J,ZHANG Q,etal.FgSKN7 and FgATF1 have overlapping functions in ascosporogenesis,pathogenesis and stress responses inFusariumgraminearum[J].EnvironmentalMicrobiology,2015,17(4):1245.
[38] JIANG C,ZHANG C K,WU C L,etal.TRI6 and TRI10 play different roles in the regulation of deoxynivalenol(DON) production by cAMP signalling inFusariumgraminearum[J].EnvironmentalMicrobiology,2016,18(11):3689.
[39] HOU R,JIANG C,ZHENG Q,etal.The AreA transcription factor mediates the regulation of deoxynivalenol(DON) synthesis by ammonium and cyclic adenosine monophosphate(cAMP) signalling inFusariumgraminearum[J].MolecularPlantPathology,2015,16(9):987.
[40] BORMANN J,BOENISCH M J,BRUCKNER E,etal.The adenylyl cyclase plays a regulatory role in the morphogenetic switch from vegetative to pathogenic life style ofFusariumgraminearumon wheat [J].PLoSOne,2014,9(3):e91135.
[41] YIN T,ZHANG Q,WANG J,etal.The cyclase-associated protein FgCap1 has both protein kinase A-dependent and -independent functions during deoxy nivalenol production and plant infection inFusariumgraminearum[J].MolecularPlantPathology,2017.doi:10.1111/mpp.12540.
[42] KRSKA R,BAUMGARTNER S,JOSEPHS R.The state-of-the-art in the analysis of type-A and -B trichothecene mycotoxins in cereals [J].FreseniusJournalofAnalyticalChemistry,2001,371(3):285.
[43] 祭 芳,陈正贤,徐剑宏,等.抗脱氧雪腐镰孢菌烯醇单克隆抗体的制备[J].微生物学报,2008,35(7):929.
JI F,CHEN Z X,XU J H,etal.Development of the monoclonal antibody to deoxynivalenol [J].ActaMicrobiologicaSinica,2008,35(7):929.
[44] 何庆华,许 杨,刘仁荣,等.脱氧雪腐镰孢菌烯醇ELISA定量检测试剂盒的研制[J].食品与发酵工业,2008(12):160.
HE Q H,XU Y,LIU R R,etal.Development of ELISA-kit of quantitative analysis for deoxynivalenol [J].FoodandFermentationIndustries,2008(12):160.
[45] ANTONIOS D,GUITTON V,DARROZES,etal.Monitoring the levels of deoxynivalenol(DON) in cereals in Lebanon and validation of an HPLC/UV detection for the determination of DON in crushed wheat(bulgur) [J].FoodAdditContamB,2010,3(1):45.
[46] 李瑞园,刘红河,康 莉.HPLC-MS/MS法同时测定粮食中脱氧雪腐镰孢菌烯醇及其衍生物[J].分析测试学报,2014,30(6):660.
LI R Y,LIU H H,KANG L.Determination of six deoxynivalenols in grain by high performance liquid chromatography-tandem mass spectrometry [J].JournalofInstrumentalAnalysis,2014,30(6):660.
[47] CZERWIECKI L,WILCZYNSKA G.Determination of deoxynivalenol in cereals by HPLC-UV [J].MycotoxinResearch,2003,19(1):31.
[48] LOMBAERT G A,PELLAERS P,ROSCOE V,etal.Mycotoxins in infant cereal foods from the Canadian retail market [J].FoodAdditivesandContaminants,2003,20(5):494.
[49] LI Y S,LIU G Z,FU X J,etal.High-sensitive chemiluminescent ELISA method investigation for the determination of deoxynivalenol in rice [J].FoodandMethod,2015,8(3):656.
[50] HUANG Z B,XU Y,LI L S,etal.Development of an immunochromatographic strip test for the rapid simultaneous detection of deoxynivalenol and zearalenone in wheat and maize [J].FoodControl,2012,28(1):7.
[51] MUHITCH M J,MCCORMICK S P,ALEXANDER N J,etal.Transgenic expression of the TRI101 or PDR5 gene increases resistance of tobacco to the phytotoxic effects of the trichothecene 4,15-diacetoxyscirpenol [J].PlantScience,2000,157(2):201.
[52] OKUBARA P A,BLECHL A E,MCCORMICK S P,etal.Engineering deoxynivalenol metabolism in wheat through the expression of a fungal trichothecene acetyl transferase gene [J].TheoreticalandAppliedGenetics,2002,106(1):74.
[53] MANOHARAN M,DAHLEEN L S,HOHN T M,etal.Expression of 3-OH trichotheceneacetyl transferase in barley(HordeumvulgareL.) and effects on deoxynivalenol [J].PlantScience,2006,171(6):699.
[54] POPPENBERGER B,BERTHILLER F,LUCYSHYN D,etal.Detoxification of the Fusarium mycotoxin deoxynivalenol by a UDP-glucosyl transferase fromArabidopsisthaliana[J].JournalofBiologicalChemistry,2003,278(48):47905.
[55] IKUNAGA Y,SATO I,GROND S,etal.Nocardioides sp.strain WSN05-2,isolated from a wheat field,degrades deoxynivalenol,producing the novel intermediate 3-epi-deoxynivalenol [J].AppliedMicrobiologyandBiotechnology,2011,89(2):419.
[56] 计 成,赵丽红,李笑樱,等.呕吐毒素生物降解研究进展[J].饲料工业,2015(10):1.
JI C,ZHAO L H,LI X Y,etal.Research advance of deoxynivalenol biodegradation [J].FeedIndustry,2015(10):1.
[57] 余祖华,丁 轲,刘赛宝,等.一株降解呕吐毒素蜡样芽孢杆菌的筛选与鉴定[J].食品科学,2016(5):121.
YU Z H,DING K,LIU S B,etal.Screening and identification of aBacilluscereusstrain able to degradated eoxynivalenol [J].FoodScience,2016(5):121.
[58] 袁冬贞,崔章静,杨 桦,等.基于物联网的小麦赤霉病自动监测预警系统应用效果[J].中国植保导刊,2017(1):46.
YUAN D Z,CUI Z J,YANG H,etal.Application effects of wheat Fusarium head blight automatic monitoring and prediction system based on internet of things [J].ChinaPlantProtection,2017(1):46.
