湖南省C群及W135群脑膜炎奈瑟菌的流行病学及病原学特征分型
2018-04-28周海健湛志飞贺子翔高立冬戴德芳
夏 昕,周海健,湛志飞,覃 迪,贺子翔, 蔡 亮,高立冬,戴德芳
(1湖南省疾病预防控制中心, 湖南 长沙 410005;2 中国疾病预防控制中心传染病预防控制所 传染病预防控制国家重点实验室,北京 102206)
流行性脑脊髓膜炎(简称流脑)是由脑膜炎奈瑟菌引起的国家法定乙类传染病之一,尽管随着A+C群流脑疫苗的普及,流脑的发病率呈逐年下降趋势,但由于脑膜炎奈瑟菌菌株在疫苗的选择性压力下可导致人群中存在菌群和毒力的变迁,一旦发生血清群的转换,则又可能引起新的大流行,切不可放松警惕。在解放后全国A群流脑大流行的背景下,我省也发生过数次A群流脑的大流行,但自2006年后,便再未报道过A群流脑病例,甚至健康人群的带菌调查中,也未再发现A群流脑菌株的踪迹。健康人群带菌,近年来以一般不致病的不可分群流脑和偶可致病的B群流脑菌株多见,B群流脑多为散发,经试验后发现分子分型型别多样化,未见优势菌群[1];但是,B群流脑因其荚膜不稳定而无有效的多糖疫苗,基于外膜蛋白核酸的疫苗,尚在积极的研发中[2],随着现有流脑疫苗的普及应用,我省脑膜炎奈瑟菌的菌群也在悄然发生变迁,我省自2006年末首次报道发现C群流脑病例[3],2012年首次报道发现W135群流脑病例后[4],C群和W135群病例所占的比例有所上升,且近年来,从密切接触者和健康人群监测中,均分离到不少C群和W135群菌株。因此,现将我省近几年来从患者、患者密切接触者以及健康人群带菌调查中收集到的部分C群和W135群流脑菌株,对其进行药敏及脉冲肠凝胶电泳(pulsed-field gel electrophoresis, PFGE)分型以及多位点序列分型(multilocus sequence typing, MLST),以探讨其病原学遗传特性以及流行病学的相关性,其结果报告如下。
1 材料与方法
1.1 材料
1.1.1 资料及菌株来源 资料来源于《湖南省疫情资料汇编》和中国疾病预防控制信息系统报告。菌株分离于2006—2016年湖南省内流脑患者、患者密切接触者以及健康人群带菌调查的标本。

1.2 方法
1.2.1 生化和血清学鉴定 将上送的疑似脑膜炎奈瑟菌菌株接种到巧克力平板上,置5% CO2,37℃温箱培养24 h后,再挑取单个菌落做进一步的分纯培养,然后取新鲜纯培养物按说明书接种到生物梅里埃公司的API NH生化鉴定试纸条上,37℃继续孵育2.0~2.5 h,根据培养后的颜色变化记录生化结果,并根据编码读取鉴定结果。生化确认后,再将菌落用Remel Europe Ltd的脑膜炎奈瑟菌诊断血清做进一步的血清学分型,先用流脑多价血清进行凝集,再用因子血清分群,并记录结果,做血清凝集的同时用生理盐水做对照。
1.2.2 药敏试验 参考美国临床实验室标准化协会(CLSI,2013版)推荐的指南,按照我国脑膜炎奈瑟菌监测方案推荐的12种抗菌药物,对青霉素和氨苄西林采用E-test试纸条法,其余10种抗菌药物采用K-B纸片法进行药敏试验,将脑膜炎奈瑟菌用生理盐水调节浊度为0.5麦氏单位后,均匀涂布于5%的脱纤维羊血MH琼脂,再将K-B药敏纸片或E-test药敏试纸条贴于血MH琼脂表面,静置片刻后,置5%CO2,37℃温箱培养18~24 h读取结果,最后根据CLSI的标准判定结果为敏感、中介或者耐药。药敏质控菌株:肺炎链球菌ATCC 49619以及PFGE Marker沙门菌H9812,为湖南省疾病预防控制中心微生物实验室留存备用。
1.2.3 PFGE分型 根据中国疾病预防控制中心 PulseNet China网中心实验室发布的脑膜炎奈瑟菌脉冲场凝胶电泳(PFGE)标准操作方案(SOP)进行试验(http://www.pulsenet-china.net/)。将菌株用巧克力平板置5% CO2,37℃温箱培养18~24 h,挑取菌落纯培养物均匀悬浮于CSB缓冲液中,用1%SeaKem Gold制备上样小胶块,用蛋白酶K裂解再洗涤后,脑膜炎奈瑟菌用Nhe I限制性内切酶进行酶切,Marker H9812标准菌株用Xba I限制性内切酶酶切,37℃温浴约3 h,再根据操作方案设置参数和条件,电泳16 h。起始脉冲时间:l s;终止脉冲时间:25 s;电压:6 V/cm;电泳温度:14℃,电泳完毕后用Gelred核酸染料染色约25 min,最后用凝胶成像仪读取tif图像。获得图谱后,再使用BioNumerics软件处理,聚类树形图类型选择UPGMA(unweighted pair group method with averages)方法,不同带型的电泳条带的相似性采用Dice相关系数百分比表示。
1.2.4 MLST 参考PubMLST(http://pubmlst.org/neisseria)网站的标准方案,分析脑膜炎奈瑟菌的7个管家基因,即abcZ(ABC转运子)、adk(腺苷酸激酶)、aroE(莽草酸脱氢酶)、fumC(延胡索酸酶)、gdh(葡萄糖-6-磷酸脱氢酶)、pdhC(丙酮酸脱氢酶亚单位)、pgm(磷酸葡萄糖变位酶),对管家基因及引物进行PCR扩增:50 μL反应体系,引物1 μmol/L终浓度,dNTP 200 μmol/L,Taq酶2.5 U,模板1 μL,反应条件为94℃ 2 min;94℃ 1 min、56℃ 1 min、72℃ 2 min 共29个循环;72℃ 2 min 结束,再对扩增后的产物分别进行测序,测序结果与PubMLST数据库(http://pubmlst.org/neisseria)进行检索比对,获得各管家基因位点的等位基因数值,并确定其序列型(ST),MLST试验的PCR扩增引物序列见表1,MLST试验的测序引物序列见表2。
表1脑膜炎奈瑟菌MLST分型PCR扩增引物序列
Table1MLST and PCR amplification primer sequences ofNeisseriameningitidis
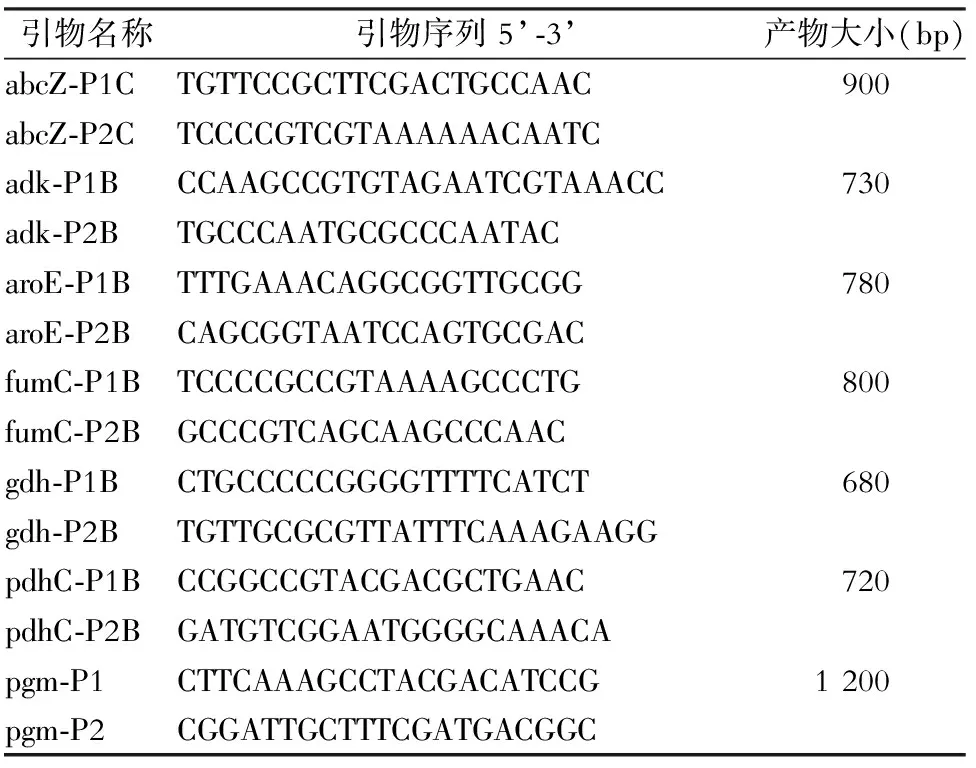
引物名称引物序列5’⁃3’产物大小(bp)abcZ⁃P1CTGTTCCGCTTCGACTGCCAAC900abcZ⁃P2CTCCCCGTCGTAAAAAACAATCadk⁃P1BCCAAGCCGTGTAGAATCGTAAACC730adk⁃P2BTGCCCAATGCGCCCAATACaroE⁃P1BTTTGAAACAGGCGGTTGCGG780aroE⁃P2BCAGCGGTAATCCAGTGCGACfumC⁃P1BTCCCCGCCGTAAAAGCCCTG800fumC⁃P2BGCCCGTCAGCAAGCCCAACgdh⁃P1BCTGCCCCCGGGGTTTTCATCT680gdh⁃P2BTGTTGCGCGTTATTTCAAAGAAGGpdhC⁃P1BCCGGCCGTACGACGCTGAAC720pdhC⁃P2BGATGTCGGAATGGGGCAAACApgm⁃P1CTTCAAAGCCTACGACATCCG1200pgm⁃P2CGGATTGCTTTCGATGACGGC
表2脑膜炎奈瑟菌MLST分型测序引物序列
Table2Primer sequences for MLST sequencing ofNeisseriameningitidis

引物名称引物序列5’⁃3’产物大小(bp)abcZ⁃S1AAATCGTTTATGTACCGCAGR433abcZ⁃S2GAGAACGAGCCGGGATAGGAadk⁃S1AAGGCWGGCACGCCCTTGG465adk⁃S2CAATACTTCGGCTTTCACGGaroE⁃S1AGCGGTCAAYACGCTGRTK490aroE⁃S2ATGATGTTGCCGTACACATAfumC⁃S1TCCGGCTTGCCGTTTGTCAG465fumC⁃S2TTGTAGGCGGTTTTGGCGACgdh⁃S3CCTTGGCAAAGAAAGCCTGC501gdh⁃S4CRCGCACGGATTCATRYGGpdhC⁃S1TCTACTACATCACCCTGATG480pdhC⁃S2ATCGGCTTTGATGCCGTATTTpgm⁃S1CGGCGATGCCGACCGCTTGG450pgm⁃S2AGGTGATGATTTCGGTYGCRCC
2 结果
2.1 一般资料 2006—2016年,湖南省共报告实验室诊断病例21例,通过对分离脑膜炎奈瑟菌的血清学分群后确认为C群11株、B群6株、W135群4株。从已报告的流脑实验室确诊病例密切接触者以及三个省级流脑监测点中共培养分离出脑膜炎奈瑟菌114株,其中B群55株、C群19株、W135群5株、不可分群35株。
2.2 菌株鉴定与选取结果 从2006—2016年间湖南省内流脑患者、患者密切接触者以及健康人群带菌调查标本中分离的脑膜炎奈瑟菌,再次经API NH生化鉴定卡以及多价血清及群因子血清凝集试验确认后,选取其中22株C群、9株W135群脑膜炎奈瑟菌为本次研究菌株。22株C群脑膜炎奈瑟菌中,来自于患者的血6株、脑脊液1株,患者密切接触者的咽拭子10株,健康带菌者咽拭子5株;9株来自于张家界市,7株来自衡阳市,3株来自于湘潭市,长沙市、株洲市、郴州市各1株。9株W135群脑膜炎奈瑟菌中,来自于患者的血3株、脑脊液1株,患者密切接触者的咽拭子3株,健康带菌者咽拭子2株;3株来自于长沙市,张家界市、衡阳市各2株,株洲市、益阳市各1株。

2.4 PFGE分型结果 22株C群脑膜炎奈瑟菌经PFGE分型后,以70%相似度为标准,共分为2个簇、5种PFGE带型;按相似度≥90%为同一亚型,其中18株HNC-01和HNC-02菌株属于同一亚型。2006年湖南的第1例C群患者分离的菌株PFGE带型为HNC-02,与2012、2013年患者以及患者密切接触者分离菌株的图谱完全一致,与带型为HNC-01的2008、2010、2013年患者分离的菌株仅有一个带型的差异,均属于优势带型, 另2008年分离菌株中有1例患者与1名健康带菌者带型一致,为带型HNC-05。见图1。9株W135群脑膜炎奈瑟菌经PFGE分型后共分为2个带型,其中首例患者与2013、2016年患者分离的菌株带型一致,均为HNW-01型,带型HNW-02的2株W135群流脑菌株分离自2012年1例C群死亡患者的密切接触者[5],与患者血清型不一致,为正常人群携带的非流行株。见图2。
表331株脑膜炎奈瑟菌对12种抗菌药物的药敏结果(%)
Table3Antimicrobial susceptibility testing results of 31Neisseriameningitidisstrains to 12 kinds of antimicrobial agents(%)
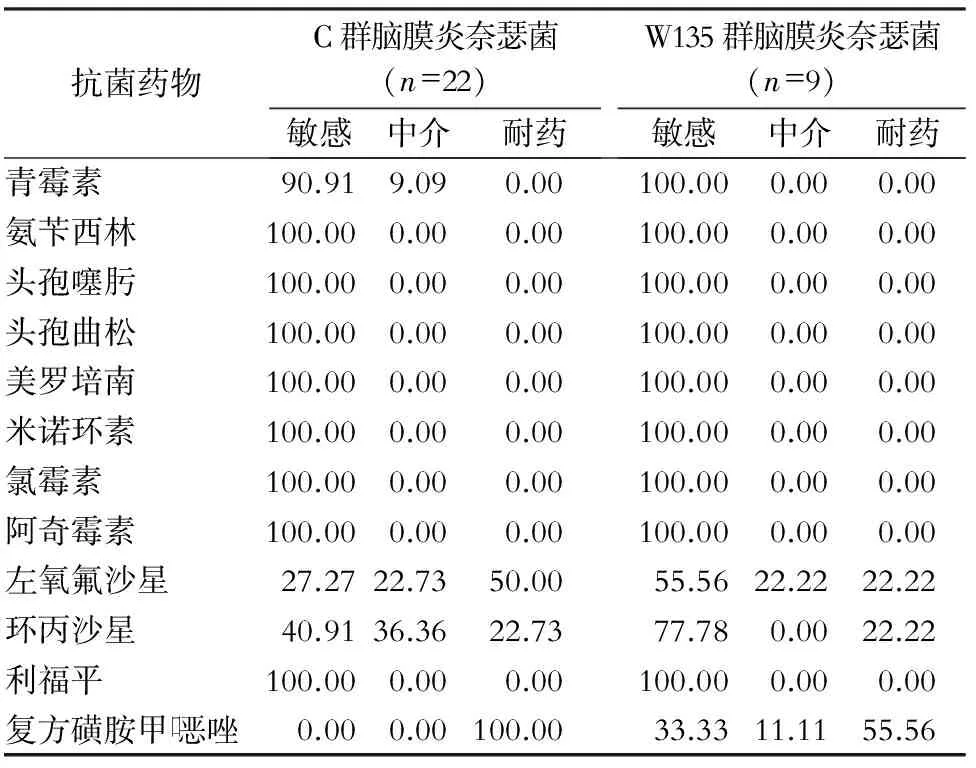
抗菌药物C群脑膜炎奈瑟菌(n=22)敏感中介耐药W135群脑膜炎奈瑟菌(n=9)敏感中介耐药青霉素90.919.090.00100.000.000.00氨苄西林100.000.000.00100.000.000.00头孢噻肟100.000.000.00100.000.000.00头孢曲松100.000.000.00100.000.000.00美罗培南100.000.000.00100.000.000.00米诺环素100.000.000.00100.000.000.00氯霉素100.000.000.00100.000.000.00阿奇霉素100.000.000.00100.000.000.00左氧氟沙星27.2722.7350.0055.5622.2222.22环丙沙星40.9136.3622.7377.780.0022.22利福平100.000.000.00100.000.000.00复方磺胺甲口恶唑0.000.00100.0033.3311.1155.56
2.5 MLST结果 选取C群的优势带型HNC-01、HNC-02和W135群的优势带型HNW-01的部分菌株,进行MLST,扩增产物均在700-1 400 bp之间。产物纯化后,经DNA双通道序列测定,将不同的等位基因序列提交至MLST数据库,经PubMLST检索比对,结果显示,测序后的7个基因位点的等位基因数值相对应的等位基因谱C群HNC-01、HNC-02带型菌株均为ST4821型,W135群HNW-01带型为ST11型。

图1 22株C群脑膜炎奈瑟菌PFGE分型软件分析结果
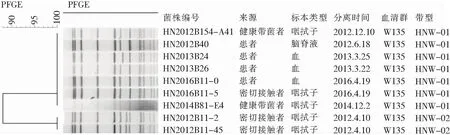
图2 9株W135群脑膜炎奈瑟菌PFGE分型软件分析结果
3 讨论
流行性脑脊髓膜炎是一种在我国流传的既古老又新鲜的传染病,发病历史悠久,但菌群仍在持续发生变迁,一旦感染,儿童极易引发暴发型流脑,如不及时治疗,6~24 h内即可危及生命,病情凶险,病死率高,切不可掉以轻心。据《湖南省疫情资料汇编》和中国疾病预防控制信息系统报告,湖南省在1951—2016年间,共报告流脑病例504 498例,死亡48 305例,发病率波动于0.003/10万~34.08/10万之间,并于1959、1967年以及1974—1977年期间出现3次流行高峰。自二十世纪八十年代流脑A群多糖疫苗广泛使用后,发病率逐年大幅下降,全省范围内未再出现暴发流行,流行周期已不明显。2007年6月,我省将A+C群流脑疫苗纳入免疫规划,并实施扩大国家免疫规划,流脑疫情得到有效控制。近10年(2007—2016年)流脑发病率波动于0.003/10万~0.035/10万之间,徘徊在历史低位,2014、2016年全省仅各报告病例2例。病例以15岁以下年龄段人群为主,主要分布在湖南的西部和中南部,2004—2016年数据显示,发病率居前五位的市州为:湘西自治州、张家界市、湘潭市、长沙市、益阳市,占全省病例的57.14%[6]。
由于A群多糖疫苗多年来的普及,我省A群脑膜炎奈瑟菌已逐渐消退。自2006年我省衡阳地区首次发现C群流脑病例以来,其后几年病例以C群流脑流行为主。随着A+C流脑疫苗免费接种步伐的推进,2012年我省又首次发现了W135群流脑病例,随后W135群病例开始逐渐增多。B群流脑疫苗由于荚膜的多变性,疫苗尚在研制和验证阶段,需要多剂次及佐剂的配合,方能产生保护性抗体[7]。我省在健康人群监测中B群流脑多见,型别多样,个别型别可致病,但症状较C群和W135群流脑轻。本次研究主要分析了我省近年来的C群和W135群脑膜炎奈瑟菌的病原学特征,以探讨其流行病学特征。
22株C群脑膜炎奈瑟菌和9株W135群脑膜炎奈瑟菌,均来自于患者、密切接触者以及健康人群带菌调查中分离到的菌株,C群菌株的时间跨度为2006—2016年;W135群菌株的时间跨度为2012—2016年,患者以长株潭、衡阳及张家界为主,病例既有儿童、学生,也有成人,发病时间集中在历年的10月到次年6月间,夏季没有病例。我省自2014年开始,鲜有检出C群病例,新发的W135群病例开始逐步增多。有研究[8]认为,W135群脑膜炎奈瑟菌与我国早年曾引起多次大流行的A群菌株表达相同的菌毛结构蛋白PilE和主要黏附蛋白NadA,提示W135群脑膜炎奈瑟菌可能具有与A群脑膜炎奈瑟菌相似的传播流行模式,以往A群的流行常引起聚集性和暴发,故对W135群菌株可能造成的流行应持谨慎态度。
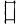
对C群和W135群脑膜炎奈瑟菌分别进行PFGE分型分析比较,发现22株C群脑膜炎奈瑟菌共分为5个带型,其中优势带型HNC-01和带型HNC-02的18株菌的带型两者间仅有一个条带的差异,相似度在95%以上,根据Tenover[10]研究原则,认为这些差异可能是菌株偶发的一次基因事件引起的带型变化,这种情况常可发生在菌株重复培养或同一患者多次分离时发生,故可以认为其在遗传角度是有高度同源性的,在流行病学上也是紧密相关的。带型HNC-03和带型HNC-04分别来自于健康人群的携带菌,与优势菌群按70%相似度为标准,仍然归为同一簇。带型HNC-05的2株菌与其余20株菌,从遗传角度来说,相差较远,分别来自于2008同一年的患者及健康带菌调查,时间上有差异,地点也不一样,但既然能够引起病例的发生,就可能为另一种C群的潜在流行群,应引起重视。9株W135群脑膜炎奈瑟菌经过PFGE电泳后共分为2种带型,优势带型HNW-01的7株菌株分离自2012—2016年间的患者、密切接触者及带菌者,其PFGE图谱完全一致,带型HNW-02为2012年4月一起C群流脑死亡患者的密切接触者调查中分离到的2株W135群脑膜炎奈瑟菌,当年那起流行事件中的“主角”是C群脑膜炎奈瑟菌,这2株W135群菌株只是偶然分离到,并未引起密切接触者发病,PFGE分型显示,其与致病的优势流行克隆群带型并不相同,相似度低于90%,是否可能致病,还有待进一步研究。值得引起注意的是,我省报道的C群和W135群首例病例分离菌株,带型与优势带型一致,可以认为自首例病例后,即开始了该型别菌株的流行。
目前,全球流脑病例主要由7个高致病性Nm序列群的菌株引起,分别是ST1序列群、ST5序列群、ST8序列群、ST11序列群、ST32序列群、ST41/44序列群以及ST4821序列群。湖南省的C群流脑优势流行菌株进行了MLST后,结果均为ST4821群,属于我国特有的主要流行克隆群[11]。湖南省W135群流脑优势流行菌株的型别,通过MLST后,为高致病性的ST11群,与目前全球主要流行的侵袭性W135群脑膜炎奈瑟菌的ST型别一致[9, 12-13],也与目前我国其他省市的新发W135群的型别一致[14]。
从病例菌群的统计结果中发现,自2006年我省第一次发现C群流脑病例以来,就再未检出过A群病例。从2006—2013年,几乎每年都可以检出C群病例,说明C群已经取代了A群,成为我省的优势菌株,但自从2012年我省首次发现W135群流脑病例以来,C群流脑病例便呈现下降趋势。2014—2016年未报道C群流脑病例,而W135群菌株已经通过健康人群监测进入了我们的视野,同时也引起了相关的流脑疾病。B群流脑病例由于暂时无疫苗可预防,一直时有发生,说明我省的流脑流行菌群正在向多元化发展,这与我国将A+C群多糖疫苗纳入免疫规划的政策息息相关。在疫苗的选择性压力下,流脑菌群的悄然变迁也给我们的防控工作带来更大挑战,在我国流脑的局部暴发仍不断出现。在非洲仍有周期性的流脑大流行,如果不控制这种流行趋势,可能会殃及其他洲[15]。
鉴于我省W135群流脑病例自2012年后时有发生,且存在优势流行克隆群的条件下,应大力宣传和推广有效的疫苗免疫策略,国际市场上的脑膜炎球菌多糖疫苗(MPV)有2价(A+C群)和4价(A、C、Y、W135群)两种,是由相应血清群Nm制成纯化的、对热稳定的冻干的荚膜多糖,疫苗具有良好的安全性和免疫原性[16],可将C群和W135群流脑造成的隐患进一步控制。新的防控策略制定和实施后,也不能放松对流脑病原学的监测,由于该菌群存在着一个血清群的变迁,积极的主动监测能为我省流脑的防控起到有效的预测预警作用。应当进一步加强实验室的检测能力,密切关注我省流脑流行菌群的变迁趋势,并制定相应对策,将这一古老又新鲜的传染病始终控制在低发病水平。
[参考文献]
[1] 夏昕, 湛志飞, 刘运芝, 等. 湖南省B群脑膜炎奈瑟菌药物敏感性及分型[J]. 中国公共卫生, 2011, 27(12):1568-1569.
[2] 李开铭, 谢梅花, 余敏君, 等. B群脑膜炎奈瑟菌外膜蛋白NMB0315核酸疫苗的免疫活性和免疫保护作用初步研究[J].中国免疫学杂志, 2015, 31(12): 1648-1653, 1658.
[3] 刘英豪, 罗小成, 伍运生, 等. 湖南省首起由C群脑膜炎奈瑟菌引起流脑局部流行的调查[J].实用预防医学, 2008, 15(2):446-447.
[4] 夏昕, 戴德芳, 湛志飞, 等. 湖南省首例W135群流行性脑脊髓膜炎病例流行病学及病原学分析[J]. 疾病监测, 2013, 28(9):714-716.
[5] 田晓辉, 夏昕, 王敏, 等. 张家界市首例C群流脑死亡病例及其密接人群中分离的脑膜炎奈瑟菌实验室分析和PFGE分型[J]. 实用预防医学, 2012, 19(9):1311-1313.
[6] 戴德芳, 李放军, 夏昕. 1951—2016年湖南省流行性脑脊髓膜炎流行病学特征及菌群变迁趋势分析[J]. 实用预防医学, 2017, 24(12):1440-1442.
[7] 王立新, 熊恩东.单价B群脑膜炎奈瑟菌OMV疫苗免疫后的抗体亲和力及其IgG亚型[J].国外医学(微生物学分册), 2003, 26(2):44-45.
[8] Sun X, Zhou H, Xu L, et al.Prevalence and genetic diversity of two adhesion-related genes,pilE andnadA,inNeisseriameningitidisin China[J]. Epidemiol Infect, 2013, 141 (10): 2163-2172.
[9] Mowlaboccus S, Jolley KA, Bray JE, et al. Clonal expansion of new penicillin-resistant lade ofNeisseriameningitidisserogroup W clonal complex 11, Australia[J]. Emerg Infect Dis, 2017, 23(8): 1364-1367.
[10] Tenover FC, Arbeit RD, Goering RV, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing [J]. J Clin Microbiol, 1995, 33(9): 2233-2239.
[11] Shao Z, Li W, Ren J, Liang X, et al. Identification of a newNeisseriameningitidisserogroup C clone from Anhui Pro-vince, China[J]. Lancet, 2006, 367(9508): 419-423.
[12] Kilic A, Urwin R, Li H,et al.Clonal spread of serogroup W135 meningococcal disease in Turkey[J]. J Clin Microbiol, 2006, 44(1): 222-224.
[13] Lemos AP, Harrison LH, Lenser M, et al. Phenotypic and molecular characterization of invasive serogroup W135Neisseriameningitidisstrains from 1990 to 2005 in Brazil[J]. J Infect, 2010, 60(3): 209-217.
[14] 邵祝军. 中国流行性脑脊髓膜炎流行变异趋势[J]. 中华预防医学杂志, 2013, 47(10):891-893 .
[15] 胡绪敬.流脑流行的监测与预防[J].中国公共卫生, 2004, 20(5):638-640.
[16] 殷大鹏.脑膜炎球菌疫苗:多糖疫苗与多糖结合疫苗[J].中国疫苗和免疫, 2008, 14(6):573-575.
