不同水分条件下枣果实果皮细胞壁的变化特性
2018-04-26刘鑫
刘 鑫
(山西省林业科学研究院,山西 太原 030012)
枣(ZizyphusjujubaMill.)是我国特有的重要经济栽培树种,广泛分布于干旱、半干旱地区,已有3 000年的栽培历史。其鲜果与加工制品是我国传统出口商品之一,但枣裂果问题严重制约着枣产业的发展。关于枣裂果,国内外学者对温度等环境因子和气孔、光合作用、内源激素代谢等生理生化指标进行了广泛研究,但是关于枣果皮细胞壁代谢的研究较少。试验通过对枣果实发育过程中果皮细胞壁组分及细胞壁酶活性变化特性进行研究,以期进一步了解裂果枣的果皮特点,探索果皮结构与裂果性的关系,及不同水分条件对枣果皮细胞壁代谢的影响,深入揭示枣果实发育过程中裂果形成的生理机制,从而为解决枣裂果问题提供理论参考。
1 材料与方法
1.1 材料
试验材料为2年生壶瓶枣,株行距2 m×3 m,纺锤性整枝,常规管理。选取生长发育良好、树体树势相对一致、无病虫害的枣树进行喷灌处理(A1);选取不喷灌的枣树作为对照(CK)。在果实发育期每周采样1次,选取发育良好、无病虫害、无机械损伤的同期果实,将果皮削下,用液氮冷冻后放入冰壶,带回实验室,储存于超低温冰箱中。
1.2 方法
细胞壁物质的提取和分离参考Zhou等、Fishman等的方法。
细胞壁组分含量的测定:果胶含量用咔唑法测定,半纤维素经水解后用蒽酮法测定,纤维素含量用重量法测定。每个处理3次重复。
SOD,POD,PPO的提取和活性测定参照李合生的方法进行。其中,SOD以抑制NBT光化还原的50%为1个酶活性单位;POD以每分钟内A470变化0.01为1个POD活力单位;PPO以每分钟内A525变化0.01为1个PPO活力单位。
参考Hagerman等的方法提取果胶甲脂酶PE.1个活性单位表示30 min内每克果肉释放出1 mmol甲氧基(-OCH3)。多聚半乳糖醛酸酶(PG)活性的测定参考谭兴杰等方法。1个PG活性单位定义为1 g果肉在1 h内释放出1 mmol半乳糖醛酸。纤维素酶活性参考赵亚华等的方法进行测定。
2 结果与分析
2.1 枣果皮细胞氧化性酶活性的动态变化分析
枣果皮SOD,POD和PPO酶活性的动态变化分析见表1.
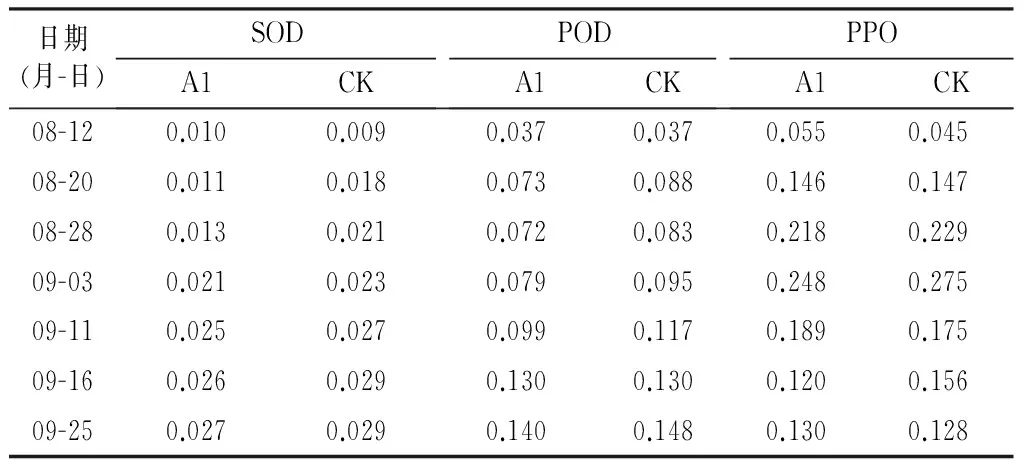
表1氧化性酶活性的动态变化分析U/(min·mg)
日期(月-日)SODA1CKPODA1CKPPOA1CK08-120.0100.0090.0370.0370.0550.04508-200.0110.0180.0730.0880.1460.14708-280.0130.0210.0720.0830.2180.22909-030.0210.0230.0790.0950.2480.27509-110.0250.0270.0990.1170.1890.17509-160.0260.0290.1300.1300.1200.15609-250.0270.0290.1400.1480.1300.128
由表1分析可知,果实发育过程中不同处理枣果实果皮SOD,POD,PPO活性变化趋势基本相同。8月12日到9月3日,果皮SOD酶活性迅速上升;9月3日之后,上升速度减慢;A1处理酶活性低于CK.果皮POD活性呈上升趋势,A1处理酶活性低于CK.8月12日到9月3日,果皮PPO酶活性迅速上升;9月3日之后,PPO酶活性下降。
据结果分析认为,试验期间,果实处于膨大期,树体营养分配和代谢不平衡,果皮内自由基含量明显增加,加上外界不良自然环境对果实造成伤害,需要大量SOD清除果实体内过多的自由基。所以,SOD活性在这一时期迅速增加,以此来保护树体。POD和SOD具有协同作用,当果实逐渐衰老时,SOD氧化自由基的产物H2O2增加,需要大量的POD来分解。另一方面,生长后期POD活性的增加也可能是用来分解叶绿素和生长素,使树体尽早停止生长,减少营养消耗,从而加强树体抵抗自由基及其衍生物和外界不良自然环境的能力。相关研究表明,在水分胁迫下,植物体内酶活性与植物的抗氧化胁迫能力成正相关。本研究还发现对照处理下,SOD,POD活性高于A1处理。这可能是在干旱胁迫下,POD,SOD诱导合成能力较强。而在灌溉条件下,水分可促进果实生长,降低果实表面温度,从而使果实生长在相对有利的环境中,所以抗氧化酶活性低于CK处理。
PPO是一类与植物抗病性密切相关的末端氧化酶。相关研究认为,PPO通过参与酚类物质(如绿原酸、香豆素等)的氧化过程,促进木质素合成。试验中PPO酶活性在前期果实生长膨大期增加,后期果实进入白熟期后,果皮木质素不再合成,PPO活性下降。
2.2 果胶和纤维素的变化分析
枣果皮水溶性果胶WSP,共价结合型果胶CSP和离子型果胶ISP含量的变化分析见表2.
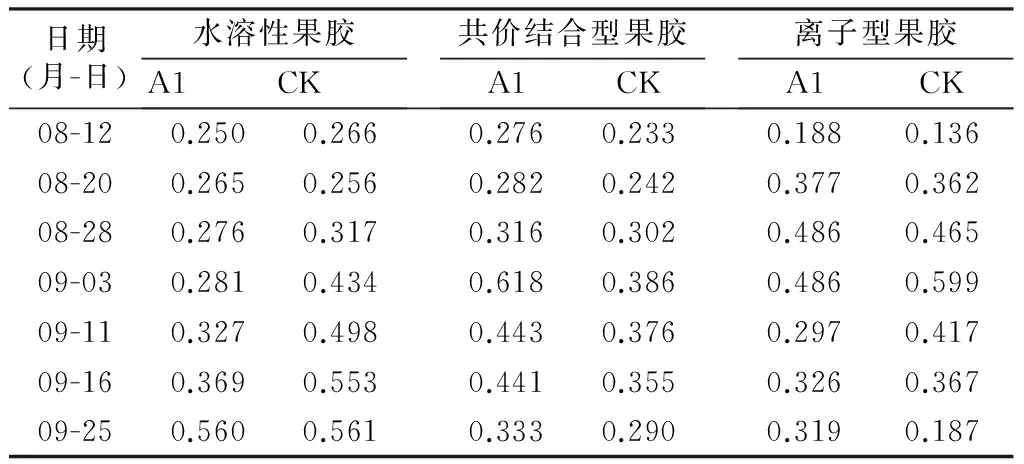
表2 枣果皮果胶含量变化分析 mg/g
由表2可以看出,枣果皮水溶性果胶含量呈不断上升趋势,8月12日到8月28日,上升趋势比较缓慢,水溶性果胶含量A1处理由0.250 mg/g上升到0.276 mg/g,CK由0.266 mg/g上升到0.317 mg/g,分别增加了10%,8%.8月28日后,水溶性果胶迅速升高,到9月25日,A1处理和CK水溶性果胶分别增加了50%,46%.CK水溶性果胶含量高于A1处理的含量。
共价结合型果胶呈先增加后降低的趋势。8月12日到9月3日呈上升趋势,A1处理由0.276 mg/g上升到0.498 mg/g,CK由0.233 mg/g上升到0.386 mg/g.之后共价结合型果胶迅速下降,较A1处理,CK的最高含量分别下降了73%,71%.不同处理间共价结合型果胶含量变化趋势相似,处理A1共价结合型果胶含量高于CK.
离子型果胶呈先增加后降低的趋势。8月12日到9月3日呈上升趋势,之后下降。不同处理间离子型果胶含量变化趋势相似。
枣果皮纤维素和半纤维素含量变化分析见表3.
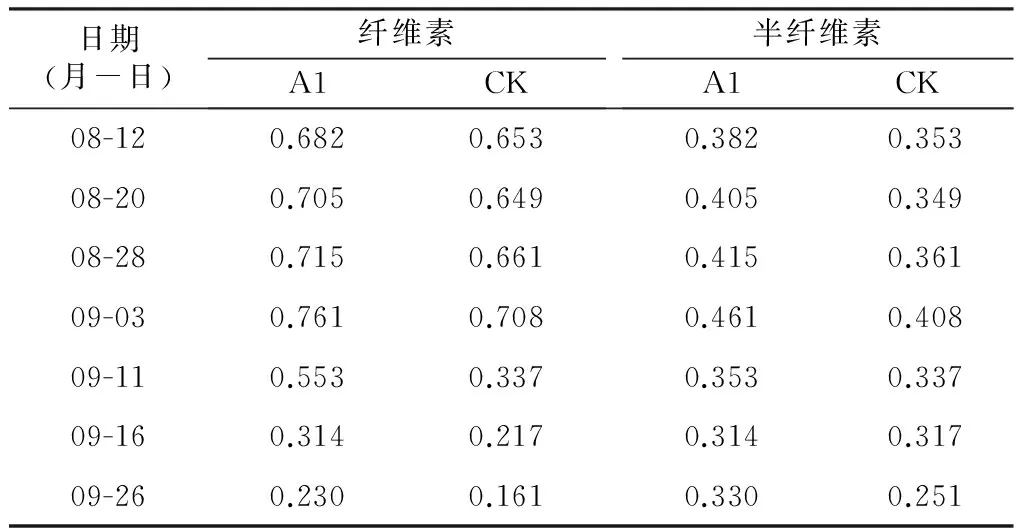
表3 枣果皮纤维素和半纤维素含量变化分析 mg/g
由表3分析可知,各处理枣果实果皮的半纤维素和纤维素含量变化趋势基本相同,都呈先上升后下降的趋势,且A1处理高于CK.8月12日到9月3日,果皮的纤维素和半纤维素含量上升,9月3日之后,纤维素和半纤维素含量下降。半纤维素含量在枣果实发育过程中变化幅度较小,而纤维素含量在枣果实白熟期后迅速下降。
在本试验过程中,枣果实经历了果实膨大期、白熟期和果实全红期。其中,8月12日到9月3日,枣果实处于果实膨大期,细胞数量增加,需要细胞壁物质快速合成参与细胞的形态建成。所以,果皮果胶、纤维素、半纤维素都处于上升趋势。9月3日后,枣果实到达白熟期,果实不再增大,细胞壁物质含量急剧减少,中性糖多聚体水解导致细胞壁松弛,枣果皮容易裂开。
2.3 枣果皮细胞壁代谢相关酶活性的变化分析
果皮多聚半乳糖醛酸酶(PG)、果胶甲脂酶(PE)和纤维素酶(CX)活性的变化分析见表4.
表4细胞壁代谢相关酶活性变化分析U/(min·mg)
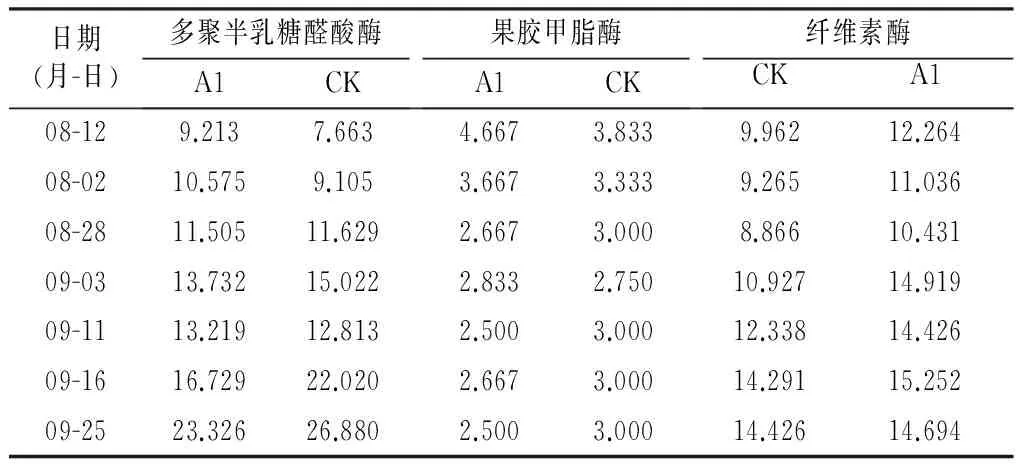
日期(月-日)多聚半乳糖醛酸酶A1CK果胶甲脂酶A1CK纤维素酶A1CK08-129.2137.6634.6673.8339.96212.26408-0210.5759.1053.6673.3339.26511.03608-2811.50511.6292.6673.0008.86610.43109-0313.73215.0222.8332.75010.92714.91909-1113.21912.8132.5003.00012.33814.42609-1616.72922.0202.6673.00014.29115.25209-2523.32626.8802.5003.00014.42614.694
由表4可以看出,不同处理枣果皮PG活性变化规律相似,在枣成熟过程中呈上升趋势,CK的PG活性高于A1处理。在果实膨大期,多聚半乳糖醛酸酶活性平稳上升,在白熟期后活性突然升高。不同处理果胶甲脂酶活性变化规律相似,CK的果胶甲脂酶活性变化较A1处理平缓。枣果实果皮果胶甲脂酶活性在绿果期较高,随着枣果实的成熟逐渐下降,在白熟期和脆熟期变化平稳。不同处理枣果实纤维素酶活性变化规律相似,CK的纤维素酶活性高于A1处理。随着果实的成熟,枣果实果皮纤维素酶活性不断升高;在果实膨大期平稳上升,在果实白熟期后活性突然升高。
试验中,纤维素酶活性在果实白熟期后不断增加。纤维素酶活性的提高,使纤维素降解,从而导致细胞壁纤维素微纤丝—半纤维素—果胶质“经纬结构”(细胞壁解体)松散。果胶酶同时分解果胶质,导致果实软化。
3 小结
细胞壁使果实具有一定的形状和弹性,其结构和成分的改变是引起果实质地变化的主要原因。纤维素是细胞壁的骨架物质,半纤维素在细胞壁的“经纬结构”中起着“闩锁”的作用。果胶质有序地交叉联接分布在纤维素和半纤维素微丝中。果胶的降解在果实成熟后期尤为集中,会影响细胞壁交联网络细孔的大小,导致软化后期细胞壁膨胀,使底物更容易受到酶的作用。果实发育过程中,纤维素酶活性和多聚半乳糖醛酸酶活性不断增加,降解了细胞壁物质,使果皮细胞壁超微结构变得松弛。如果细胞壁过度松弛,在膨压作用下就会发生溃裂。
试验表明,喷灌处理下多聚半乳糖醛酸酶活性、纤维素酶活性低于对照。酶活性的降低导致果皮细胞壁物质成分含量也随之降低,离子结合型果胶、共价结合型果胶、半纤维素、纤维素分解代谢降低,细胞壁保持完整性的能力增强,不容易发生溃裂。因此,保持干旱季节有稳定的水供应,在果实生长后期注意控制水分,保持水分处于充足而稳定的状态,可以抑制果皮细胞代谢酶的活性,延缓果皮物质的分解代谢,从而减少枣裂果的发生。
参考文献:
[1] 王永惠.中国果树志[M].北京:中国林业出版社,1993.
[2] Zhou H W,Sonego L,Khalchitski A,et al.Cell wall enzymes and cell wall changes in‘Flavortop’nectarines:mRNA abundance,enzymeactivity,andchangesin pecticandneu-tral polymers during ripening and in woolly fruit[J].J. Amer. Soc. Hortic. Sci.,2000,125(5):630-637.
[3] Fishman M L,Levaj B,Gillespie D,et al.Changesinthephysico-chemicalproperties of peachfruitpectinduringontreeripen-ingandstorage[J].J. Amer. Soc. Hort. Sci.,1993,118(3):343-349.
[4] 韩雅珊.食品化学实验指导[M].北京:中国农业大学出版社,1996:39-41.
[5] Zhou H W,SonegoI L,Khalchitski A.Cell wall enzymes and cell wall changes in Flacortop Nectarines:mRNA abundance,en-zyme activity,and changes in pectic and neutral polymers during ripening and in woolly fruit[J].J.Amer.Soc.Hort.Sci.,1999,16(1):18-19.
[6] 李合生主编.植物生理生化实验原理和技术[M].北京:高等教育出版社,1999.
[7] Hagerman A E, Austin P J. Continuous spectrophotometric assay for plant pectin methyl esterase[J].Journal of Agriculture and Food Chemistry, 1986,34:440-444.
[8] 谭兴杰,陈 芳,周永成,等.NFDB2柑果实采后枯水的研究[J].园艺学报,1985,12(3):165-170.
[9] Pathak N, Mishra S, Sanwal G G. Purification and characterization ofpolygalacturonase from banana fruit[J]. Phytochemistry,2000,54:147-152.
[10] 赵亚华,高向阳.生物化学实验技术教程[M].广州:华南理工大学出版社,2000.
[11] 张海保,朱西儒,刘鸿先.感染束顶病后香蕉过氧化物酶和多酚氧化物酶的活性变化[J].植物生理学通讯,1996,32(5):321-327.
[12] 姚允聪,张大鹏,王有年,等.水分胁迫条件下苹果幼苗叶绿体抗氧化代谢研究[J].果树科学,2000,17(1):1-6.
[13] 王孝威,段艳红.水分胁迫对短枝型果树光合作用的非气孔限制[J].西北植物学报,2003,23(9):1 609-1 613.
[14] 张 勃,吴 红,朱建兰,等.套袋对梨果实发育期间POD、PPO活性的影响[J].中国农学通报,2008,24(1):351-354.
[15] 王有年,杜 方,于同泉,等.水分胁迫对桃叶片碳水化合物及其相关酶活性的影响[J].北京农学院学报,1999,20(20):31-36.
[16] 李建国,黄旭明,黄辉白.裂果易发性不同的荔枝品种果皮中细胞壁代谢酶活性的比较[J].植物生理与分子生物学学报,2003,29(2):141-146.
[17] 李 娟,陈杰忠.水分胁迫对柑橘果皮细胞壁结构与代谢的影响[J].生态学报,2008,28(2):486-492.
