小分子干扰RNA沉默黏着斑激酶基因对人宫颈癌Hela细胞生物学特征的影响
2018-04-24刘彤鸥李晓兰
余 俊,刘彤鸥,李晓兰
(1.湖北中医药大学第一临床学院 湖北省中医院妇产科,湖北 武汉 430061;2.宜昌市第二人民医院妇产科,湖北 宜昌 443000)
宫颈癌为女性生殖系统常见的恶性肿瘤之一,具有恶性程度高、侵袭力强、预后差等特点,近年来发病率逐年上升,且呈年轻化趋势[1],严重威胁女性健康。目前,宫颈癌的发生机制尚未完全明确。黏着斑激酶(focal adhesion kinase,FAK)作为存在于细胞质中的非受体酪氨酸蛋白激酶,参与机体多条信号传导通路,在调控细胞增殖、黏附、迁移、运动中发挥重要作用[2]。近年来研究发现,FAK在肿瘤的发生中发挥关键性作用,与肿瘤细胞的增殖、迁移、侵袭及血管新生密切相关[3]。本研究利用小分子干扰RNA(small interfering RNA,siRNA)技术特异性沉默人宫颈癌Hela细胞的FAK基因,观察其对细胞生物学特征的影响,并探讨可能的机制。
1 材料与方法
1.1细胞来源人宫颈癌Hela细胞购自中国科学院上海细胞生物学研究所,由湖北省中医院检验科细胞室保存。
1.2主要试剂与仪器达尔伯克改良伊格尔培养基F12(Dulbecco′s modified Eagle′s medium:nutrient mixture F-12,DMEM/F12)、胰蛋白酶、胎牛血清购自美国Gibo公司,LipofectamineTM2000转染试剂盒、TRIzol总RNA提取试剂盒购自美国Invitrogen公司,反转录试剂盒和聚合酶链式反应(polymerase chain reaction,PCR)试剂盒购自大连宝生物工程有限公司,FAK及内参引物由上海生工生物工程股份有限公司设计合成,siRNA-FAK、siRNA-阴性对照序列均由上海吉玛制药技术有限公司设计合成,噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT]细胞增殖及细胞毒性检测试剂盒购自上海博谷生物科技有限公司,Annexin V异硫氰酸荧光素/碘化丙啶(annexin V fluoresceinisothiocyanate/propidiumiodide,annexin V-FITC/PI)细胞凋亡检测试剂盒购自上海优宁维生物科技有限公司,Transwell小室购自美国Corning公司,兔抗人RAF原癌基因丝氨酸/苏氨酸激酶-1(RAF proto-oncogene serine/threonine kinase 1,Raf-1)单克隆抗体购自美国Abcam公司,兔抗人FAK多克隆抗体、兔抗人磷酸化Raf-1(phosphorylation of Raf-1,p-Raf-1)抗体购自美国Santa Cruz公司,兔抗人丝裂原活化蛋白激酶1/2(mitogen-activated protein kinase 1/2,MEK1/2)多克隆抗体、兔抗人磷酸化-MEK1/2(phosphorylation of MEK1/2,p-MEK1/2)多克隆抗体购自武汉博士德生物工程有限公司,兔抗人细胞外信号调节激酶(extracellular regulated protein kinase,ERK)单克隆抗体、兔抗人磷酸化-ERK(phosphorylation of ERK,p-ERK)多克隆抗体购自美国CST公司,聚偏氟乙烯(polyvinylidene fluoride,PVDF)购自济南朋远生物科技有限公司,增强化学发光法(enhanced chemilluminescence,ECL)试剂盒购自美国Promega公司,AMR-100全自动酶标分析仪购自成都昱强科技有限公司,实时荧光定量PCR仪购自美国Bio-Rad 公司,凝胶电泳分析系统购自美国GENE公司。
1.3细胞培养及分组处理取人宫颈癌Hela细胞,置于含体积分数10%胎牛血清及链霉素和青霉素各100×103U·L-1的DMEM/F12中,于含体积分数5% CO2的37 ℃恒温培养箱中培养,1~2 d换液1次,待细胞融合度达到80%以上时进行传代培养。取对数生长期细胞,按每孔2×105个细胞接种于6孔培养板中,然后在37 ℃、含体积分数5% CO2的恒温培养箱中培养24 h,将细胞分为siRNA-FAK组(细胞转染FAK基因干扰序列:5′-CGCGTCGTAAATGCCTTGATGTACATCTTTGATATC-CGAGATGTACATCAAGGCATTTATTTTTTCCAAC-3′)、siRNA-阴性对照组(细胞转染阴性对照序列:5′-CGCGTCGTCGAAGTACTCAGCGTAAGTTGATATCC-GCTTACGCTGAGTACTTCGATTTTTTCCAAC-3′)和空白对照组(细胞不作任何处理)。具体操作按LipofectamineTM2000试剂盒说明进行。
1.4实时荧光定量PCR技术检测各组细胞中FAK基因表达取各组转染后培养48 h的细胞,每组约5×103个细胞,加入细胞裂解液,用TRIzol总RNA提取试剂盒提取细胞中总RNA,检测总RNA纯度,取合格样品,用反转录试剂盒反转录为模板链cDNA,以cDNA为模板进行PCR。FAK引物序列:上游为5′-CCCTGCTGACAGCTACAACG-3′,下游为5′-GCCCGTCACATTCTCGTACA-3′;β-actin引物序列:上游为5′-TTCTACAATGAGCTGCGTGTG-3′,下游为5′-ATCACAATGCCAGTGGTACG-3′。PCR反应条件:第1个循环为95 ℃预变性5 min,接着行38个PCR循环:95 ℃变性30 s,60 ℃延伸30 s。每个样品均设6个平行反应复孔。采用2-ΔΔCt法获得各组细胞中FAK mRNA相对表达量。
1.5MTT法检测各组细胞增殖能力取各组细胞,胰蛋白酶消化后接种于96孔板,每孔2×104个细胞,各组均设6个复孔,于37 ℃、含体积分数5%CO2的恒温箱培养,分别于培养12、24、48、72、96 h 时,每孔加入5 g·L-1的MTT液20 μL,37 ℃孵育 4 h,每孔加入体积分数0.5%的二甲基亚砜 200 μL,充分摇晃均匀后,利用全自动酶标分析仪于490 nm处检测各孔吸光度值。
1.6流式细胞术检测各组细胞凋亡情况取各组转染后培养48 h的细胞,胰蛋白酶消化后接种于6孔板,每孔1×105个细胞,加入5 μmol·L-1的Annexin V标记液5 μL,加入10 μmol·L-1的PI液 5 μL,室温下避光孵育20 min,加入1×结合缓冲液,60 min内上机检测,每组重复实验6次,取均值。
1.7Transwell法检测各组细胞迁移能力取各组转染后培养48 h的细胞,胰蛋白酶消化后应用无血清培养基重悬细胞,调整细胞浓度为2×108L-1。取200 μL细胞悬液加入Transwell小室上室,将含体积分数10%胎牛血清的DMEM/F12培养液置于小室下室,将Transwell小室置于恒温培养箱中培养12 h。取出后,将上室内散落的细胞去除,磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗3次,用甲醛固定20 min,结晶紫染色15 min,PBS冲洗3次,倒置显微镜下观察,随机取10个高倍视野计数穿膜细胞数,取均值。
1.8Transwell法检测各组细胞侵袭能力将 50 mg·L-1基质胶按18稀释后平铺于Transwell小室上室,风干后备用。用无血清培养基重悬细胞,调整细胞浓度为2×108L-1。取200 μL细胞悬液加入Transwell小室上室,将含体积分数10%胎牛血清的DMEM/F12培养液置于小室下室,将Transwell小室置于恒温培养箱中培养12 h。取出后,将上室内散落的细胞去除,PBS冲洗3次,用甲醛固定 20 min,结晶紫染色15 min,PBS冲洗3次,倒置显微镜下观察,随机取10个高倍视野计数穿膜细胞数,取均值。
1.9Westernblot法检测各组细胞中FAK、Raf-1、p-Raf-1、MEK1/2、p-MEK1/2、ERK和p-ERK蛋白表达取各组转染后培养48 h的细胞,每组约 5×103个细胞,加入细胞裂解液,用总蛋白提取试剂盒提取细胞中总蛋白,利用Bradford法对各组蛋白浓度进行检测。取各组50 μg总蛋白,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,电转移至PVDF膜。用脱脂奶粉封闭60 min,将各组细胞再次进行分组,分别加入一抗兔抗人FAK多克隆抗体、Raf-1单克隆抗体、p-Raf-1抗体、MEK1/2多克隆抗体、p-MEK1/2多克隆抗体、ERK单克隆抗体、p-ERK多克隆抗体(稀释比例分别为1500、11 200、11 000、1500、11 500、1800、11 000),4 ℃过夜孵育,用洗膜缓冲液(tris buffered saline tween,TBST)洗膜3次,加入二抗,孵育60 min,用TBST洗膜3次,加入ECL发光液,避光反应15 min,曝光充分后拍照。所有实验重复6次。

2 结果
2.1各组细胞中FAKmRNA表达比较空白对照组、siRNA-阴性对照组、siRNA-FAK组细胞中FAK mRNA相对表达量分别为1.00±0.00、1.03±0.01、0.34±0.05,3组细胞中FAK mRNA相对表达量比较差异有统计学意义(F=74.559,P<0.05)。空白对照组与siRNA-阴性对照组细胞中FAK mRNA相对表达量比较差异无统计学意义(P>0.05);与空白对照组和siRNA-阴性对照组比较,siRNA-FAK组细胞中FAK mRNA的相对表达量显著降低,差异有统计学意义(P<0.05)。
2.2各组细胞增殖能力比较结果见表1。培养24、48、72、96 h时,空白对照组、siRNA-阴性对照组、siRNA-FAK组培养细胞增殖能力比较差异有统计学意义(F=9.389、14.804、14.945、18.135,P<0.05)。培养24、48、72、96 h时,空白对照组与siRNA-阴性对照组细胞增殖能力比较差异均无统计学意义(P>0.05);培养24、48、72、96 h时,siRNA-FAK组细胞增殖能力显著低于空白对照组和siRNA-阴性对照组,差异均有统计学意义(P<0.05)。
表1各组细胞细胞增殖能力比较


组别n细胞增殖能力24h48h72h96h空白对照组60.43±0.090.55±0.060.70±0.110.79±0.08siRNA⁃阴性对照组60.42±0.110.58±0.100.68±0.080.81±0.12siRNA⁃FAK组60.31±0.12ab0.40±0.08ab0.49±0.07ab0.58±0.10abF9.38914.80414.94518.135P0.0020.0000.0000.000
注:与空白对照组比较aP<0.05;与siRNA-阴性对照组比较bP<0.05。
2.3各组细胞凋亡率比较结果见图1。空白对照组、siRNA-阴性对照组、siRNA-FAK组细胞凋亡率分别为(7.2±1.8)%、(10.6±2.8)%、(16.6±3.8)%,3组细胞凋亡率比较差异有统计学意义(F=15.884,P<0.05)。空白对照组和siRNA-阴性对照组细胞凋亡率比较差异无统计学意义(P>0.05);与空白对照组和siRNA-阴性对照组比较,siRNA-FAK组细胞凋亡率显著升高,差异有统计学意义(P<0.05)。

A:siRNA-FAK组;B:siRNA-阴性对照组;C:空白对照组。
图1流式细胞术检测各组细胞凋亡情况
Fig.1Detectionofapoptosisbyflowcytometryineachgroup
2.4各组细胞迁移和侵袭能力比较结果见表2、图2和图3。空白对照组、siRNA-阴性对照组、siRNA-FAK组细胞迁移细胞数和侵袭细胞数比较差异有统计学意义(F=12.301、20.598,P<0.05)。空白对照组和siRNA-阴性对照组迁移细胞数和侵袭细胞数比较差异无统计学意义(P>0.05);与空白对照组和siRNA-阴性对照组比较,siRNA-FAK组迁移细胞数和侵袭细胞数显著减少,差异均有统计学意义(P<0.05)。
表2各组细胞迁移和侵袭能力比较


组别n迁移细胞数侵袭细胞数空白对照组6119.2±23.5130.7±12.9siRNA⁃阴性对照组6106.6±18.6131.0±13.9siRNA⁃FAK组667.6±12.6ab84.9±15.9abF12.30120.598P0.0010.000
注:与空白对照组比较aP<0.05;与siRNA-阴性对照组比较bP<0.05。

A:siRNA-FAK组;B:siRNA-阴性对照组;C:空白对照组。
图2各组细胞迁移能力比较(结晶紫染色,×200)
Fig.2Comparisonofthecellmigrationabilityineachgroup(crystalvioletstaining,×200)

A:siRNA-FAK组;B:siRNA-阴性对照组;C:空白对照组。
图3各组细胞侵袭能力比较(结晶紫染色,×200)
Fig.3Comparisonofthecellinvasionabilityineachgroup(crystalvioletstaining,×200)
2.5各组细胞中FAK、Raf-1、p-Raf-1、MEK1/2、p-MEK1/2、ERK和p-ERK蛋白表达比较结果见表3和图4。空白对照组、siRNA-阴性对照组、siRNA-FAK组细胞中FAK、Raf-1、p-Raf-1、MEK1/2、p-MEK1/2、ERK和p-ERK蛋白相对表达量比较差异有统计学意义(F=58.032、12.063、16.684、9.143、31.464、8.443、32.585,P<0.05)。空白对照组和siRNA-阴性对照组细胞中FAK、Raf-1、p-Raf-1、MEK1/2、p-MEK1/2、ERK和p-ERK蛋白相对表达量比较差异无统计学意义(P>0.05);与空白对照组和siRNA-阴性对照组比较,siRNA-FAK组细胞中FAK、p-Raf-1、p-MEK1/2、p-ERK蛋白相对表达量显著降低,而Raf-1、MEK1/2和ERK蛋白相对表达量显著升高,差异均有统计学意义(P<0.05)。
表3各组细胞中FAK、Raf-1、p-Raf-1、MEK1/2、p-MEK1/2、ERK和p-ERK蛋白表达比较


组别nFAK蛋白Raf⁃1蛋白p⁃Raf⁃1蛋白MEK1/2蛋白p⁃MEK1/2蛋白ERK蛋白p⁃ERK蛋白空白对照组60.75±0.100.36±0.060.77±0.200.32±0.080.67±0.120.51±0.210.62±0.09siRNA⁃阴性对照组60.80±0.070.44±0.140.65±0.120.33±0.050.66±0.120.44±0.060.67±0.04siRNA⁃FAK组60.30±0.09ab0.61±0.03ab0.31±0.08ab0.60±0.20ab0.27±0.02ab0.79±0.15ab0.40±0.04abF58.03212.06316.6849.14331.4648.44332.585P0.0000.0010.0000.0030.0000.0030.000
注:与空白对照组比较aP<0.05;与siRNA-阴性对照组比较bP<0.05。
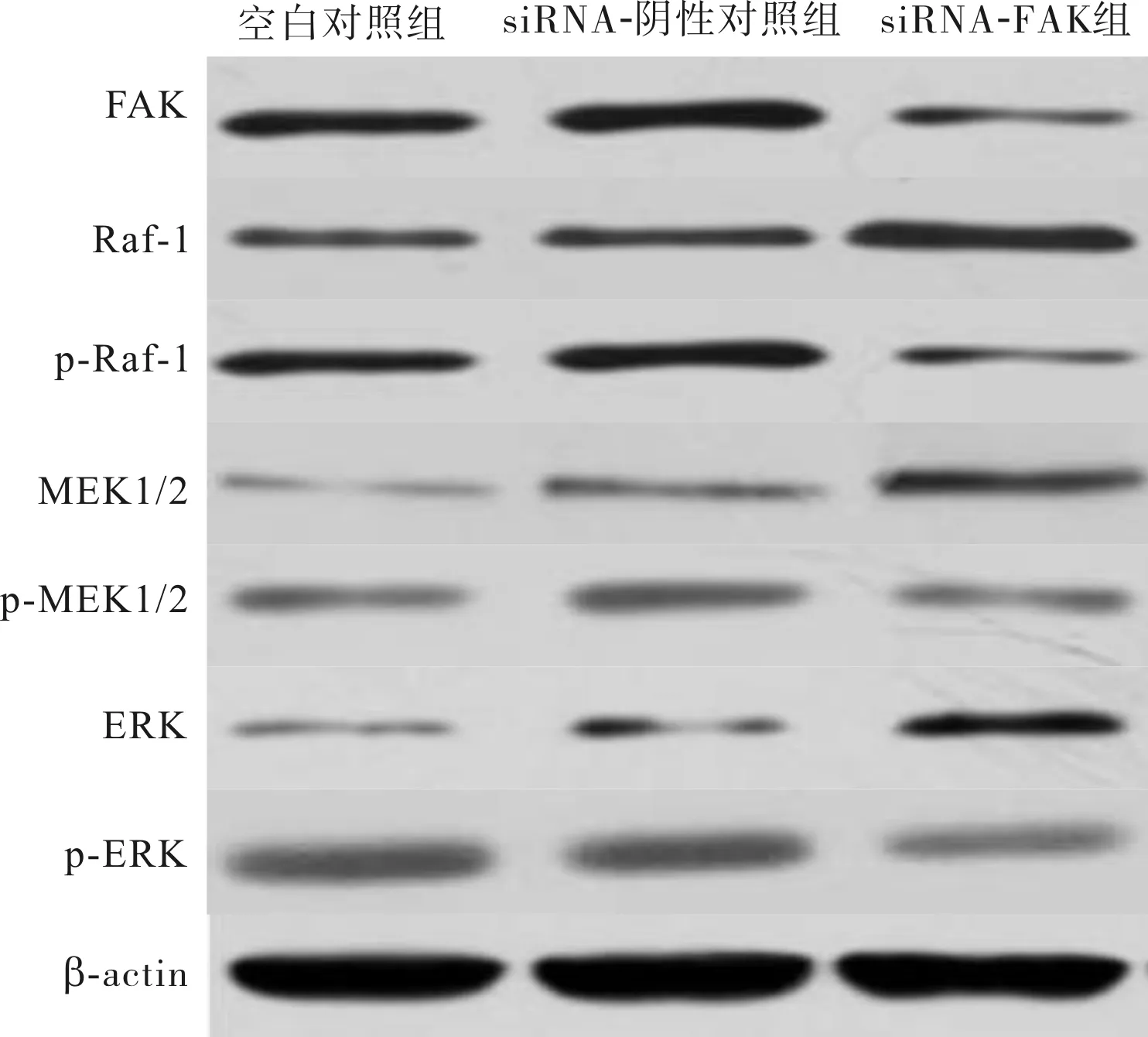
图4各组细胞中FAK、Raf-1、p-Raf-1、MEK1/2、p-MEK1/2、ERK和p-ERK蛋白表达(Westernblot)
Fig.4ExpressionsofFAK,Raf-1,p-Raf-1,MEK1/2,p-MEK1/2,ERKandp-ERKproteininthecellsineachgroup(Westernblot)
3 讨论
宫颈癌为女性第2位高发恶性肿瘤,每年我国有2万至3万名妇女死于该病[4],目前,临床上尚无特效的治疗手段,尤其是对于晚期出现转移的患者,预后多数不良[5]。有研究指出,宫颈癌细胞增殖、迁移和侵袭能力较强是导致患者预后较差的主要因素[6]。因此,积极探讨宫颈癌增殖、迁移、侵袭的相关机制,对指导治疗及改善患者预后具有重要意义。FAK主要存在于细胞质,为一种具有酪氨酸激酶活性的激酶,是整合素分子信号通路下游重要因子,在整合素介导的细胞信号传导中发挥关键性作用[7],与细胞增殖、生长、运动、凋亡等生物学功能密切相关[8],FAK参与了肿瘤细胞的生长、转移过程[9]。同时,FAK可通过调控上皮-间质转化而加速肿瘤细胞迁移和侵袭[10]。本研究利用siRNA技术特异性抑制人宫颈癌Hela细胞中FAK基因,结果显示,空白对照组与siRNA-阴性对照组细胞中FAK基因和蛋白的相对表达量比较差异无统计学意义,而siRNA-FAK组细胞中的FAK基因和蛋白相对表达量与空白对照组和siRNA-阴性对照组比较均显著降低,提示Hela细胞中FAK基因表达被成功抑制。
本研究结果显示,与空白对照组和siRNA-阴性对照组相比,培养24、48、72、96 h时,siRNA-FAK组细胞增殖能力均显著降低,说明特异性抑制Hela细胞中FAK基因可抑制细胞增殖能力,提示FAK基因参与了Hela细胞增殖过程。有研究指出,FAK基因激活可通过一系列信号传导而促进周期素D1、周期蛋白依赖性蛋白激酶大量表达,从而推动细胞从G1期进入S期,加速细胞增殖[11]。李吉友等[12]研究指出,下调FAK基因表达可促进人胃癌细胞凋亡,其机制可能是抑制FAK可激活细胞凋亡相关蛋白,从而启动细胞凋亡程序而加速细胞凋亡发生。这些研究提示FAK基因可能在肿瘤细胞凋亡中发挥重要作用,有望为肿瘤分子治疗提供新的靶点。本研究流式细胞术检测结果显示,空白对照组和siRNA-阴性对照组细胞凋亡率比较差异无统计学意义,而siRNA-FAK组细胞凋亡率与空白对照组和siRNA-阴性对照组比较显著增加,说明特异性抑制Hela细胞中FAK基因可促进细胞凋亡。
王军等[13]指出,FRK可能通过抑制FAK的磷酸化来调控胶质瘤的侵袭与迁移。阿力亚等[14]研究显示,下调FAK表达可影响肝癌细胞黏附迁移侵袭能力,其机制可能是通过调节相关细胞黏附分子的表达或活化而实现。本研究结果显示,空白对照组和siRNA-阴性对照组迁移细胞数和侵袭细胞数比较差异无统计学意义,而siRNA-FAK组迁移细胞数和侵袭细胞数与空白对照组和siRNA-阴性对照组比较均显著降低,说明特异性抑制Hela细胞中FAK基因可抑制细胞迁移和侵袭能力,提示FAK基因参与了宫颈癌细胞迁移和侵袭过程。
Raf/MEK/ERK作为ERK信号通路中的主要路径,在细胞增殖、分化、恶性转化中发挥重要作用[15],而该信号通路异常激活则与肿瘤发生、进展过程有关,在肿瘤细胞侵袭、转移中发挥重要作用[16]。有研究指出,Raf/MEK/ERK是整合素-FAK调控的主要信号通路之一,在细胞外信号传导至细胞核过程中发挥重要作用[17]。本研究结果显示,空白对照组和siRNA-阴性对照组细胞FAK、Raf-1、p-Raf-1、MEK1/2、p-MEK1/2、ERK和p-ERK蛋白相对表达量比较差异无统计学意义;与空白对照组和siRNA-阴性对照组比较,siRNA-FAK组p-Raf-1、p-MEK1/2、p-ERK蛋白相对表达量显著降低,而Raf-1、MEK1/2和ERK蛋白相对表达量显著升高,说明特异性抑制人宫颈癌Hela细胞中FAK基因,可显著抑制Raf/MEK/ERK信号活化,提示抑制FAK基因可能通过抑制Raf/MEK/ERK信号通路而减少细胞增殖,加速细胞凋亡,抑制细胞迁移和转移。
综上所述,特异性抑制人宫颈癌Hela细胞中FAK基因可减少细胞增殖,促进细胞凋亡,抑制细胞迁移和侵袭,其机制可能与抑制Raf/MEK/ERK信号通路有关。
参考文献:
[1] BRAZ N S,LORENZI N P,SORPRESO I C,etal.The acceptability of vaginal smear self-collection for screening for cervical cancer:a systematic review[J].Clinics,2017,72(3):183-187.
[2] SHANTHI E,KRISHNA M H,ARUNESH G M,etal.Focal adhesion kinase inhibitors in the treatment of metastatic cancer:a patent review[J].ExpertOpinTherPat,2014,24(10):1077-1100.
[3] LV P C,JIANG A Q,ZHANG W M,etal.FAK inhibitors in cancer,a patent review[J].ExpertOpinTherPat,2018,28(2):139-145.
[4] 孙盼盼,刘莉,平智广,等.不同地区癌症发病分布特征及聚类分析[J].中国癌症杂志,2016,26(6):499-507.
[5] CHENG J,ZENG Z,YE Q,etal.The association of pretreatment thrombocytosis with prognosis and clinicopathological significance in cervical cancer:a systematic review and meta-analysis[J].Oncotarget,2017,8(15):24327-24336.
[6] 吴向晖,黄鹏翀,秦海霞.miR-320靶向Rab11对宫颈癌细胞增殖、侵袭及迁移的影响[J].新乡医学院学报,2017,34(10):885-888,895.
[7] 于美沁,谭少健,陈琼,等.去整合素kistrin干预兔后发性白内障形成中晶状体上皮细胞FAK及ERK基因表达的研究[J].眼科新进展,2011,31(6):504-507.
[8] LIU F,TONG D,LI H,etal.Bufalin enhances antitumor effect of paclitaxel on cervical tumorigenesis via inhibiting the integrin α2/β5/FAK signaling pathway[J].Oncotarget,2016,7(8):8896-8907.
[9] BENZINA S,HARQUAIL J,GUERRETTE R,etal.Breast cancer malignant processes are regulated by pax-5 through the disruption of FAK signaling pathways[J].JCancer,2016,7(14):2035-2044.
[10] 诸葛春凤,刘诗权,谭林,等.SphK1和 FAK 对人结肠癌 HCT116细胞上皮间质转化的影响[J].中国病理生理杂志,2016,32(3):439-444.
[11] FLINEER L I,WIERØD L,ROSSELAND C M,etal.FAK regulates Cdk2 in EGF-stimulated primary cultures of hepatocytes[J].JCellPhysiol,2013,228(6):1304-1313.
[12] 李吉友,贾栋.抑制FAK的表达对人胃癌细胞SGC-7901凋亡的影响[J].现代肿瘤医学,2017,25(1):34-37.
[13] 王军,石琼,张春亭,等.FRK通过 FAK信号通路抑制脑胶质瘤细胞迁移与侵袭作用的研究[J].临床神经外科杂志,2016,13(4):263-266,271.
[14] 阿力亚,胡文杰,彭宝岗,等.黏着斑激酶表达下调对肝癌细胞黏附迁移侵袭行为的影响[J].中华普通外科学文献:电子版,2016,10(2):93-98.DOI:10.3877/cma.j.issn.1674-0793.2016.02.002.
[15] SUN P,WANG L,LU Y,etal.MicroRNA-195 targets VEGFR2 and has a tumor suppressive role in ACHN cells via PI3K/Akt and Raf/MEK/ERK signaling pathways[J].IntJOncol,2016,49(3):1155-1163.
[16] KARKHANIS M,PARK J I.Sp1 regulates Raf/MEK/ERK-induced p21(CIP1) transcription in TP53-mutated cancer cells[J].CellSignal,2015,27(3):479-486.
[17] LI L,ZHAO G D,SHI Z,etal.The Ras/Raf/MEK/ERK signaling pathway and its role in the occurrence and development of HCC[J].OncolLett,2016,12(5):3045-3050.
