盐胁迫对扁蓿豆幼苗脯氨酸积累及其代谢关键酶活性的影响
2018-04-18钟华董洁董宽虎
钟华,董洁,董宽虎*
(1.山西农业大学动物科技学院,山西 太谷 030801;2.北京市科学技术情报研究所,北京 100044)
扁蓿豆(Medicagoruthenica)是豆科苜蓿属植物,又名花苜蓿、野苜蓿、扁豆子、扁豆草、扁蓄豆、网果葫芦巴等[1],具有抗干旱,耐盐碱,耐瘠薄,耐寒冷,产量高,叶量丰富和适应性强等优点,是我国北方分布较广的牧草之一[2]。目前对扁蓿豆抗性的研究多集中于其抗旱性,耐盐性研究较少,主要是通过盐胁迫下扁蓿豆种子萌发、幼苗生长及生理响应等评价其耐盐性差异,而对脯氨酸合成和降解关键酶在盐胁迫过程中的变化研究较少[3-9]。
脯氨酸是分布广泛的一类渗透调节物质,植物在逆境胁迫条件下可以通过增加合成、减少降解而在体内累积大量脯氨酸,这对于防止渗透胁迫对植物造成伤害、清除自由基、保护细胞结构具有重要意义[10]。植物体内脯氨酸的积累与其合成和降解有关,鸟氨酸(Orn)途径和谷氨酸(Glu)途径是植物体内脯氨酸合成的两条重要途径,而这两种途径则因物种不同、生境变化等因素而有所差异[11]。吡咯啉-5-羧酸合成酶(P5CS)和鸟氨酸-δ氨基转移酶(δ-OAT)分别是Glu途径和Orn途径的关键酶。脯氨酸脱氢酶(ProDH)是脯氨酸降解过程中的限速酶[12]。
本试验采用盐碱化草地上的野生扁蓿豆种子,在不同浓度梯度的不同盐(中性盐、碱性盐)胁迫下,对其脯氨酸积累及代谢关键酶活性进行研究,以期为扁蓿豆耐盐性研究及抗盐育种提供理论依据。
1 材料与方法
1.1 种子来源
试验用扁蓿豆种子于2009年秋季采自山西省右玉县威远镇后所堡的盐碱化草地(112°19′17.6″ E,39°59′17.0″ N,海拔1340 m),保存于山西农业大学草业科学系种质资源库。
1.2 试验方法
试验于2010年,在山西农业大学草业科学实验室日光温室内进行,温室平均温度为20~25 ℃,相对湿度为65%~75%。试验采用盆栽法,盆口内径25 cm、高20 cm,装入2∶1的蛭石与珍珠岩(V/V),插入PVC管以便浇水及营养液。选取大小均等、籽粒饱满的扁蓿豆种子直接播种,播种量50粒/盆,共播种39盆。出苗后隔天浇灌Hoagland营养液,其他时间定期浇水以平衡蒸发量。出苗6周后开始盐胁迫处理。本实验的盐胁迫处理分别为NaCl、Na2CO3溶液,各设7个浓度,即0(CK)、50、100、200、300、400、500 mmol·L-1,每个处理3个重复。蒸发量以称重法确定,每天按50 mmol·L-1的浓度梯度进行递增,直至达到指定的浓度为止。胁迫一周后取样,保存于-80 ℃冰箱中待测。
1.3 测定指标
脯氨酸(Pro)含量的测定采用酸性茚三酮比色法[13];吡咯啉-5-羧酸合成酶(P5CS)的提取与活性测定参照文献[14-15]的方法进行;鸟氨酸-δ氨基转移酶(δ-OAT)的提取与活性测定参照文献[16-17]的方法进行;脯氨酸脱氢酶(ProDH)的提取与活性测定参照Lutts等[18]的方法进行。
1.4 数据处理
采用Excel 2010进行数据处理,采用SPSS 18.0软件进行ANOVA方差分析,结果以平均值±标准误表示。
2 结果与分析
2.1 盐胁迫对扁蓿豆叶片和根系Pro含量的影响
NaCl和Na2CO3胁迫下,扁蓿豆根系和叶片中Pro含量均随浓度的增加而呈先升后降的趋势,并均在盐浓度400 mmol·L-1时达到最大值(表1)。在不同浓度NaCl胁迫下,当NaCl浓度≥100 mmol·L-1时,扁蓿豆叶片中Pro含量均高于根系;而不同浓度Na2CO3胁迫下,扁蓿豆叶片中Pro含量均低于根系。
2.2 盐胁迫对扁蓿豆叶片和根系P5CS活性的影响
NaCl胁迫下,扁蓿豆根系和叶片中P5CS活性均随浓度增加而升高(表2)。Na2CO3胁迫下,扁蓿豆根系和叶片中P5CS活性除在浓度为50 mmol·L-1时与CK差异不显著(P>0.05)外,均随盐浓度增加而升高,在浓度为500 mmol·L-1时达到最高。在相同盐的同一胁迫浓度下,叶片中P5CS活性均高于根系。
注:同列不同小写字母表示差异显著(P<0.05)。下同。
Note: Means in the same column with different small letters are the significant difference (P<0.05). The same below.
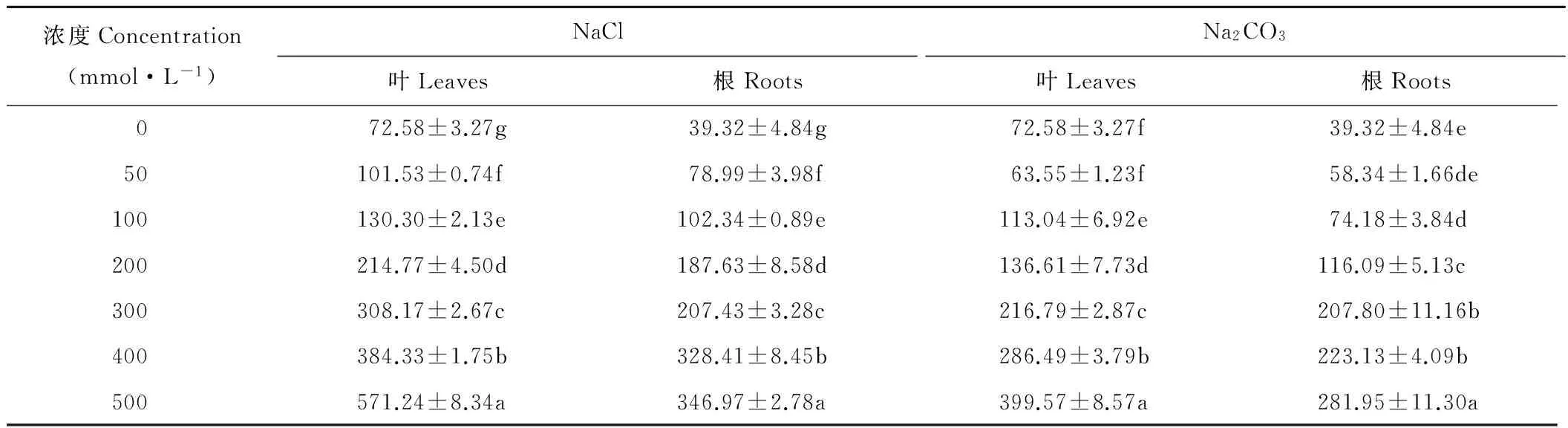
表2 不同盐胁迫下扁蓿豆P5CS活性的变化Table 2 Changes in P5CS activity in M. ruthenica under different salinity stresses (U·mg-1 protein)
2.3 盐胁迫对扁蓿豆叶片和根系δ-OAT活性的影响
NaCl胁迫下,扁蓿豆叶片中δ-OAT活性随浓度增加而升高,而根系中δ-OAT活性则随浓度增加呈先升后降的趋势,浓度为400 mmol·L-1时显著(P<0.05)高于其他浓度;且在相同浓度胁迫下,扁蓿豆叶片中δ-OAT活性普遍高于根系(表3)。Na2CO3胁迫下,扁蓿豆叶片和根系中δ-OAT活性均随浓度增加呈先升后降的趋势,浓度为400 mmol·L-1时显著(P<0.05)高于其他浓度;且在浓度为200~400 mmol·L-1时,扁蓿豆根系中δ-OAT活性高于叶片。
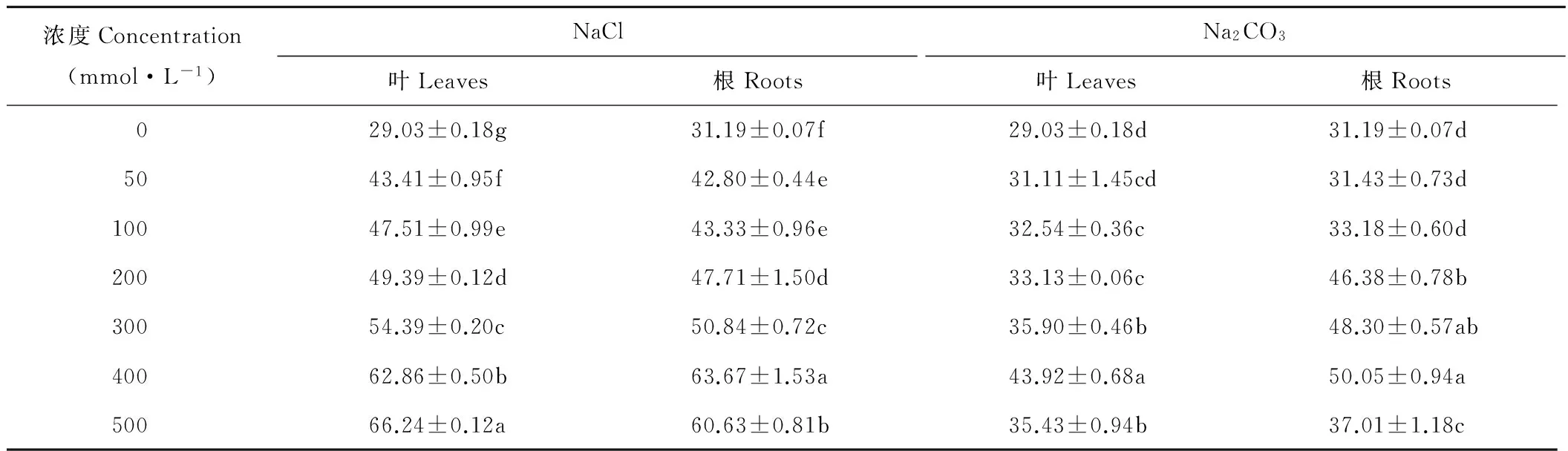
表3 不同盐胁迫下扁蓿豆δ-OAT活性的变化Table 3 Changes in δ-OAT activity in M. ruthenica under different salinity stresses (U·mg-1 protein)
2.4 盐胁迫对扁蓿豆叶片和根系ProDH活性的影响
NaCl和Na2CO3胁迫下,扁蓿豆根系和叶片中ProDH活性均随浓度增加而降低(表4)。在NaCl胁迫下,当盐浓度达到200 mmol·L-1时,扁蓿豆叶片和根系中ProDH活性显著降低(P<0.05)。在Na2CO3盐浓度300 mmol·L-1时,扁蓿豆根系中ProDH活性显著降低(P<0.05)。在相同盐的同一浓度胁迫下,扁蓿豆根系中ProDH活性均高于叶片。
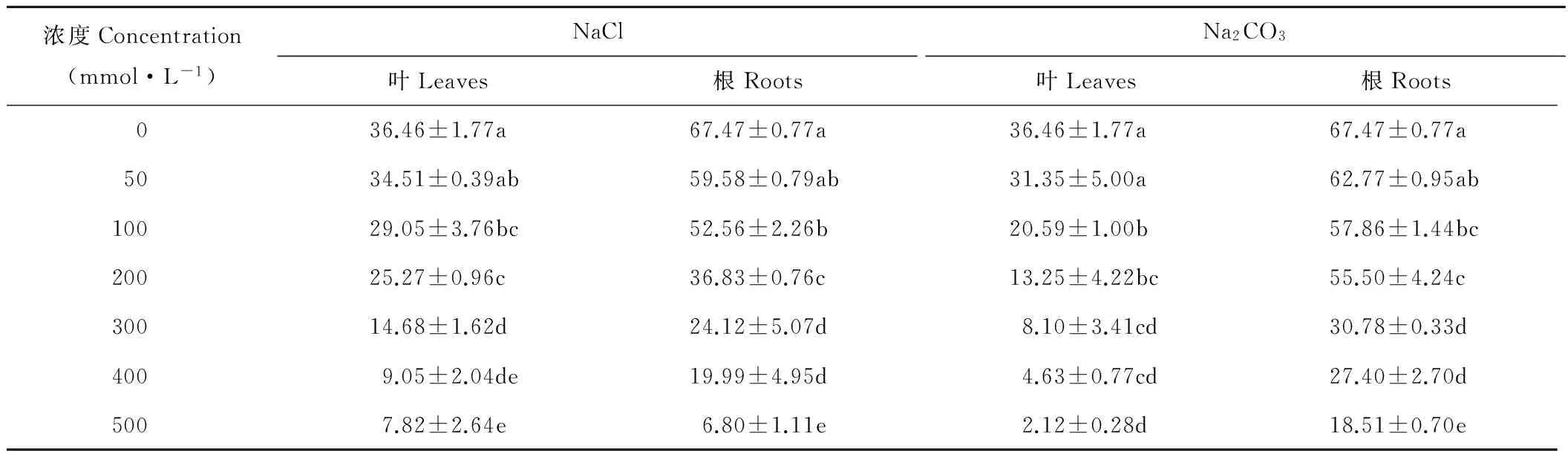
表4 不同盐胁迫下扁蓿豆ProDH活性的变化Table 4 Changes in ProDH activity in M. ruthenica under different salinity stresses (U·mg-1 FW)
3 讨论
3.1 盐胁迫对扁蓿豆幼苗Pro含量变化的影响
在逆境条件下,植物往往通过产生渗透调节物质来形成适应性反应,因此,渗透调节物质的积累是植物适应逆境胁迫的基本特征之一。脯氨酸的积累可以增加植物对渗透胁迫的耐性,提高其抗胁迫能力[19]。本研究结果表明,在不同浓度NaCl和Na2CO3胁迫下,扁蓿豆幼苗根系和叶片中Pro含量均随浓度增加而显著(P<0.05)升高,这说明扁蓿豆幼苗通过根系和叶片中积累Pro来缓解盐胁迫损伤。然而,NaCl和Na2CO3胁迫对其根系和叶片中Pro积累的影响存在差异。NaCl胁迫下,叶片中Pro含量高于根系,这与在菊苣(Cichoriumintybus)[12]中的结果一致;而Na2CO3胁迫下,根系中积累的Pro含量高于叶片,这与在梭梭(Haloxylonammodendron)[20]及沙棘(Hippophaerhamnoides)[21]等植物的研究结果相似,即植物受到碱性盐的伤害作用大于中性盐。NaCl和Na2CO3浓度为400 mmol·L-1时,扁蓿豆叶片和根系中的Pro含量显著高于其他浓度,说明此时扁蓿豆对这两种盐胁迫的耐受性最强,盐浓度继续增加将导致扁蓿豆幼苗渗透调节系统紊乱,因此,扁蓿豆承受NaCl和Na2CO3胁迫时浓度不宜超过400 mmol·L-1。
3.2 盐胁迫对扁蓿豆幼苗Pro代谢关键酶活性变化的影响
盐胁迫下,植物体内Pro代谢关键酶活性变化直接决定着Pro的合成和分解代谢。本试验中扁蓿豆根系和叶片中P5CS和δ-OAT活性均随NaCl和Na2CO3浓度的增加而升高,而ProDH活性随NaCl和Na2CO3浓度的增加而降低,这说明盐胁迫条件下扁蓿豆叶片和根系内Pro含量升高是主动积累(合成代谢的加强和分解代谢的抑制)的结果,这与Kavi等[22]的研究结果相似。扁蓿豆根系和叶片中P5CS和δ-OAT活性的增强,表明其Pro合成代谢的加强,而ProDH活性降低则表明其Pro分解代谢受到抑制,这表明扁蓿豆受到了外界胁迫[23],这与孙聪聪等[24]、董秋丽等[25]的研究结果相一致。
盐胁迫下,植物体内P5CS活性会受到Pro反馈调节,而δ-OAT活性则不受Pro反馈抑制[26]。赵福庚等[27]研究表明,盐胁迫会激活Pro合成的Glu途径和Orn途径,NaCl浓度为200 mmol·L-1时,大麦(Hordeumvulgare)的Pro合成途径由Glu途径为主逐渐转变为以Orn途径为主,临界浓度则因植物种类及植物对盐胁迫的敏感程度而异。本试验中,NaCl和Na2CO3胁迫下,P5CS和δ-OAT活性升高,且高浓度胁迫下显著高于CK,这说明NaCl和Na2CO3胁迫下扁蓿豆Pro合成是Glu途径和Orn途径共同作用的结果。然而,NaCl和Na2CO3浓度为500 mmol·L-1时,扁蓿豆根系和叶片中Pro含量已显著(P<0.05)下降,其P5CS活性却仍显著(P<0.05)升高,而其δ-OAT活性显著(P<0.05)下降,这说明扁蓿豆根系和叶片中Pro积累受Orn途径变化影响最大,所以NaCl和Na2CO3胁迫下扁蓿豆根系和叶片中Pro积累以Orn途径为主。这与NaCl和Na2CO3胁迫下菊苣[12]、裸燕麦(Avenanuda)[28]、银杏(Ginkgobiloba)[24]和碱地风毛菊(Saussurearuncinata)[29]等植物幼苗脯氨酸代谢的研究结果相似。
4 结论
NaCl和Na2CO3胁迫下,扁蓿豆幼苗通过提高其Pro含量以缓解渗透胁迫造成的伤害。扁蓿豆幼苗内Pro含量的升高是主动积累的过程,并由Glu途径和Orn途径共同作用的结果,但以Orn途径为主。扁蓿豆所承受的NaCl和Na2CO3浓度不宜超过400 mmol·L-1。
参考文献References:
[1] Editorial Board of Flora of China of the Chinese Academy of Sciences. Flora of China (Vol.42). Beijing: Science Press, 1998: 318-320.
中国科学院中国植物志编辑委员会. 中国植物志(第42卷). 北京: 科学出版社, 1998: 318-320.
[2] Ning H M. Studies of identification and evaluation on 6 wildMedicagoruthenicagermplasm resources. Hohhot: Inner Mongolia Agricultural University, 2008: 6-7.
宁红梅. 6份野生扁蓿豆种质资源鉴定与评价研究. 呼和浩特: 内蒙古农业大学, 2008: 6-7.
[3] Shi W G, Wang Z L, Du J C,etal. Evaluation the salt tolerance ofMelilotoidesruthenicastrains in the germination period. Chinese Journal of Grassland, 2008, 30(1): 40-44.
史万光, 王照兰, 杜建材, 等. 扁蓿豆不同品系种子发芽期耐盐性鉴定. 中国草地学报, 2008, 30(1): 40-44.
[4] Yang Y P, Cai L Y, Li Z Y,etal. Effects of NaCl stress on the electric conductivity and fluorescence parameters ofMedicagoruthenica. Acta Agrestia Sinica, 2013, 21(5): 913-920.
杨玉平, 蔡丽艳, 李志勇, 等. NaCl胁迫对扁蓿豆叶片膜透性和叶绿素荧光特性的影响. 草地学报, 2013, 21(5): 913-920.
[5] Yao J, Liu X B, Guo M S,etal. Effects of different NaCl concentrations on the growth and physiological indices ofMelilotoidesruthenicaseedling. Acta Agrestia Sinica, 2014, 22(3): 564-571.
姚佳, 刘信宝, 郭米山, 等. 不同浓度NaCl胁迫对扁蓿豆苗期生长及生理指标的影响. 草地学报, 2014, 22(3): 564-571.
[6] Yu J, Mi F G, Li H Y,etal. Evaluation of salt resistance of fiveMedicagoruthenicaaccessions during seed germination. Chinese Journal of Grassland, 2014, 36(5): 71-75.
于洁, 米福贵, 李鸿雁, 等. 五份扁蓿豆种质材料种子萌发期耐盐性鉴定. 中国草地学报, 2014, 36(5): 71-75.
[7] Zhang J W, Xu C L, Yu X J,etal. Salt resistance of nine wildMedicagoruthenicaaccessions during seed germination stages. Chinese Journal of Grassland, 2014, 36(5): 83-88.
张建文, 徐长林, 鱼小军, 等. 九份扁蓿豆种子萌发期耐盐性研究. 中国草地学报, 2014, 36(5): 83-88.
[8] Yu X J, Xiao H, Xu C L,etal. Comparative study on drought resistance and salt tolerance ofMedicagoruthenicaandMedicagovariaat seed germination period. Journal of Plant Genetic Resources, 2015, 16(2): 405-410.
鱼小军, 肖红, 徐长林, 等. 扁蓿豆和苜蓿种子萌发期抗旱性和耐盐性比较. 植物遗传资源学报, 2015, 16(2): 405-410.
[9] Yu J, Jia Z Y, Huang F,etal. Comparative study on salt resistance of five differentMedicagoruthenicaat seeding stage. Acta Agrestia Sinica, 2016, 24(2): 459-462.
于洁, 贾振宇, 黄帆, 等. 5份不同来源扁蓿豆幼苗期的耐盐性比较. 草地学报, 2016, 24(2): 459-462.
[10] Zhao G L, Chen Q, Hu G X,etal. Responses of the key enzymes involved in proline metabolism in rice seedling under water stress. Agricultural Research in the Arid Areas, 2011, 29(3): 80-83.
赵贵林, 陈强, 胡国霞, 等. 水稻脯氨酸代谢关键酶对水分胁迫的响应. 干旱地区农业研究, 2011, 29(3): 80-83.
[11] Ku H M, Hu C C, Chang H J,etal. Analysis by virus induced gene silencing of the expression of two proline biosynthetic pathway genes inNicotianabenthamianaunder stress conditions. Plant Physiology Biochemistry, 2011, 49(10): 1147-1154.
[12] Wang K, Liu Y X, Dong J,etal. Effects of NaCl stress on proline accumulation and metabolic pathways of chicory (CichoriumintybusL.) seedlings. Acta Agrestia Sinica, 2011, 19(1): 102-106.
王康, 刘艳香, 董洁, 等. 盐胁迫对菊苣幼苗脯氨酸积累及其代谢途径的影响. 草地学报, 2011, 19(1): 102-106.
[13] Zou Q. Plant physiology experiment instruction. Beijing: China Agriculture Press, 2005: 161-162.
邹琦. 植物生理学实验指导. 北京: 中国农业出版社, 2005: 161-162.
[14] Kishor P, Hong Z, Miao G H,etal. Overexpression of 1-pyrroline-5-carboxylate synthetase increases proline production and confers osmotolerance in transgenic plants. Plant Physiology, 1995, 108(4): 1387-1394.
[15] Garcia-Rios M, Fujita T, Larosa P C,etal. Cloning of a polycistronic cDNA from tomato encoding γ-glutamyl kinase and γ-glutamyl phosphate reductase.Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(15): 8249-8254.
[16] Roosens N H C J, Thu T T. Isolation of theomithine-δ-aminotransferase cDNA and effect of salt stress on its expression inArabidopsisthaliana. Plant Physiology, 1998, 117: 263-271.
[17] Kim H R, Rho H W, Park J W,etal. Assay of ornithine aminotransferase with ninhydrin. Analytical Biochemistry, 1994, 223(2): 205.
[18] Lutts S, Kinet J M, Bouharnlont J. NaCl-induced senescence in leaves of rice cultivars differing in salinity resistance. Annals of Botany, 1996, 78(3): 389-398.
[19] Jaleel C A, Gopi R, Sankar B,etal. Studies on germination, seedling vigour, lipid peroxidation and proline metabolism in catharanthus roseus seedlings under salt stress. South African Journal of Botany, 2007, 73(2): 190-195.
[20] Lu Y, Lei J Q, Zeng F J,etal. Effects of salt treatments on the growth and ecophysiological characteristics ofHaloxylonammodendron. Acta Prataculturae Sinica, 2014, 23(3): 152-159.
鲁艳, 雷加强, 曾凡江, 等. NaCl处理对梭梭生长及生理生态特征的影响. 草业学报, 2014, 23(3): 152-159.
[21] Yu C, Wang J H, Xue F,etal. Morphological and physiological response ofHippophaerhamnoideson alkaline salt stress. Journal of Central South University of Forestry & Technology, 2014, 34(9): 70-75.
于畅, 王竞红, 薛菲, 等. 沙棘对碱性盐胁迫的形态和生理响应. 中南林业科技大学学报, 2014, 34(9): 70-75.
[22] Kavi K P B, Sangam S, Amrutha R N,etal. Regulation of proline biosynthesis, degradation, uptake and transport in higher plants: Its implications in plant growth and abiotic stress tolerance. Current Science, 2005, 54(4): 424-438.
[23] Kiyosue T, Yoshiba Y, Yamaguchi-Shinozaki K,etal. A nuclear gene encoding mitochondrial proline dehydrogenase, an enzyme involved in proline metabolism, is upregulated by proline but downregulated by dehydration inArabidopsis. Plant Cell, 1996, 8(8): 1323-1335.
[24] Sun C C, Zhao H Y, Zheng C X. Effects of NaCl stress on osmolyte and proline metabolism inGinkgobilobaseedling. Plant Physiology Journal, 2017, 53(3): 470-476.
孙聪聪, 赵海燕, 郑彩霞. NaCl胁迫对银杏幼树渗透调节物质及脯氨酸代谢的影响. 植物生理学报, 2017, 53(3): 470-476.
[25] Dong Q L, Xia F S, Dong K H. Effects of NaCl stress on proline metabolism ofAchnatherumsplendensseedling. Acta Prataculturae Sinica, 2010, 19(5): 71-76.
董秋丽, 夏方山, 董宽虎. NaCl胁迫对芨芨草苗期脯氨酸代谢的影响. 草业学报, 2010, 19(5): 71-76.
[26] Zhen W B, Ma Q H. Proline metabolism in response to salt stress in common reed [Phragmitesaustralis(Cav.) Trin.ex Steud]. Botanica Marina, 2009, 52: 307-315.
[27] Zhao F G, Liu Y L, Zhang W H. Proline metabolism in the leaves of barley seedlings and its relation to salt tolerance. Journal of Nanjing Agricultural University, 2002, 25(2): 7-10.
赵福庚, 刘友良, 章文华. 大麦幼苗叶片脯氨酸代谢及其与耐盐性的关系. 南京农业大学学报, 2002, 25(2): 7-10.
[28] Liu J X, Wang J C, Liu X L. Effects of salt-alkaline mixed stress on proline and polyamine metabolism in leaves of naked oat seedlings. Chinese Journal of Ecology, 2016, 35(11): 2974-2982.
刘建新, 王金成, 刘秀丽. 盐碱混合胁迫对裸燕麦幼苗叶片脯氨酸和多胺代谢的影响. 生态学杂志, 2016, 35(11): 2974-2982.
[29] Xia F S, Dong Q L, Dong K H. Effect of alkaline salts on proline metabolism ofSaussurearuncinataat seedling stage. Chinese Journal of Grassland, 2011, 33(1): 48-53.
夏方山, 董秋丽, 董宽虎. 碱性盐胁迫对碱地风毛菊苗期脯氨酸代谢途径的影响. 中国草地学报, 2011, 33(1): 48-53.
