半滑舌鳎(Cynoglossus semilaevis)CD80的基因表达以及重组CD80与外周血淋巴细胞的结合分析
2018-04-17李墨非
陈 晨, 李墨非, 孙 黎
(1.中国科学院海洋研究所 海洋生物学重点实验室, 青岛 266071; 2. 中国科学院大学, 北京 100049)
CD80为抗原递呈细胞上一种膜糖蛋白,隶属于免疫球蛋白超家族[1-2]。在免疫系统中,抗原递呈细胞表面的CD80分子和免疫球蛋白超家族中的另一成员CD86与T淋巴细胞表面的配体CD28结合,从而协同刺激T细胞增殖、活化[3],在机体清除病原体以及体液免疫与细胞免疫过程中发挥重要作用。
关于CD80的功能研究主要集中在哺乳动物中和少数鸟类中[3]。在人类的抗原递呈过程中,CD80通过与辅助T细胞前体细胞(Thp)表面的CD28分子结合,使Thp分化形成辅助T细胞(Th)细胞,Th细胞通过分泌细胞因子增强免疫效应并激活下一步免疫反应[4]。目前在鱼类中关于CD80的报道较少,Zhang等对虹鳟鱼的CD80/86分子进行了克隆鉴定及功能分析,发现CD80/86基因在大肠杆菌脂多糖和弧菌毒素刺激下表达显著上调,且CD80/86能调节IL-2基因的表达,说明CD80/86在抵抗细菌侵染、调控机体免疫反应中起重要作用[3]。Shao等发现斑马鱼树突细胞上存在CD80/86,并具有与哺乳动物中的CD80相似功能[1]。汤菊芬等对尼罗罗非鱼(Oreochromisniloticus) CD80分子进行了克隆鉴定,并分析了健康状态及细菌感染后CD80在罗非鱼不同组织中的基因表达情况[5]。但是,在我国经济养殖鱼类半滑舌鳎中,CD80尚未有研究。
半滑舌鳎是中国珍贵的海水养殖鱼类,因味道鲜美、营养丰富深受广大消费者的喜爱,具有很大的市场经济价值。然而,由细菌、病毒引起的疾病给半滑舌鳎养殖业造成了巨大经济损失,哈维氏弧菌(Vibrioharveyi)和细胞肿大病毒是引起半滑舌鳎细菌性疾病的主要病原微生物[6-7]。本研究从半滑舌鳎基因组数据库中克隆得到CD80的基因(命名为CsCD80),检测了CsCD80在健康半滑舌鳎和病原感染的半滑舌鳎不同组织中的表达情况,并且检测了重组表达的CsCD80蛋白与半滑舌鳎外周血淋巴细胞(PBL)的结合能力。
1 材料和方法
1.1 材料
半滑舌鳎购于山东青岛商业化养殖场,暂养于20℃通气海水中2周。哈维氏弧菌(V.harveyi)[8]、细胞肿大病毒RBIV-C1[9]由实验室分离保存。反转录试剂盒、荧光实时定量试剂盒(SYBR EXScript qRT-PCR Kit)等购自TaKaRa生物有限公司; RNA提取试剂盒(EZNA Total RNA Kit)、凝胶回收试剂盒购自Omega公司,RNA反转录试剂盒购自Thermo公司,Leibovitz′s L15培养液购自吉诺生物医药技术有限公司,小鼠抗His抗体, FITC标记的羊抗小鼠IgG抗体购自康为试剂公司。蛋白表达载体pET32a 购自Novagen公司。序列测序及引物合成由青岛擎科梓熙生物技术有限公司完成。
1.2 方法
1.2.1 CsCD80 基因序列获得及序列分析
从NCBI数据库中半滑舌鳎的全基因组中获得CsCD80的基因序列,信号肽序列预测采用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/),保守结构域预测采用SMART(http://smart.embl-heidelberg.de/),多重序列比对使用DNAMAN,比对结果以序列相似度(sequence identity)形式表示。
1.2.2实时荧光定量PCR检测CsCD80在不同组织中的表达量
为检测正常生理状况下CsCD80在不同组织中的表达量,将健康半滑舌鳎随机分组,每组5条,麻醉后取心脏、血、肝、脾、头肾、鳃、肌肉、脑和肠组织,按照EZNA Total RNA Kit说明提取总RNA,用Nanodrop测定其纯度,通过 1% 琼脂糖凝胶电泳分析其完整性。并根据反转录试剂盒使用说明反转录成 cDNA,以该cDNA 为模板,β-actin 基因为内参基因进行实时荧光定量 PCR。根据 β-actin 基因和CsCD80 基因序列分别设计引物为:β-actin-F(5′-GCACGGTATTGTGACCAACTGG-3′)、β-actin-R(5′-CAGGGGAGCCTCTGTGAGC-3′)、CsCD80-RT-F(5′-CCAGAAACCAAGATGAGGATGA-3′)、CsCD80-RT-R(5′-TGAAGACAGCGGTGGAGGA-3′)。反应体系为20 μL, 包括SYBR Premix ExTaq10 μL,CsCD80-RT-F(β-actin-F) 0.2 μL,CsCD80-RT-R(β-actin-R) 0.2 μL,ddH2O 7.6 μL,cDNA模板2 μL。在Eppendorf Mastercycle实时定量 PCR 仪上进行, 反应程序为: 95℃预变性30 s;95℃退火5 s,59℃退火30 s, 72℃延伸10 s, 40个循环。采用 2-ΔΔCT法计算CsCD80表达量[10], 并使用 Excel软件进行数据分析。
为检测在哈维氏弧菌(V.harveyi)刺激下CsCD80表达量的变化,使用LB培养基将V.harveyi培养至OD600=0.8,用PBS缓冲液洗3次并重悬至2×106CFU/mL,制成细菌悬液备用。将健康半滑舌鳎随机分成2组,每组20条,实验组每条注射50 μL细菌注射液,对照组每条注射50 μL PBS,均采用腹腔注射。感染6、12、24和48 h后取样,每个处理每个时间点随机选取5条鱼,收集肝、脾和头肾组织。分别以18S rRNA、ribosomal protein L18(RPL18)和β-actin作为内参基因,按照上述方法检测细菌刺激后半滑舌鳎肝、脾、头肾组织中的CsCD80表达量变化。

图1 CsCD80相似序列比对Fig 1 Alignment of the sequences of CsCD80 homologues括号内为CsCD80与比较序列的相似度。保守氨基酸残基用黑色阴影标出,相似度>75%的氨基酸残基用红色阴影标出,相似度>50%的氨基酸残基用蓝色阴影标出。
为检测在细胞肿大病毒RBIV-C1刺激下CsCD80表达量的变化,用PBS缓冲液将RBIV-C1病毒组织液稀释到5×105拷贝/mL制成病毒注射液备用。将健康半滑舌鳎随机分成2组,每组20条,实验组每条注射50 μL病毒注射液。对照组每条腹腔注射50 μL PBS,均采用腹腔注射。侵染后1、3、5和7 d时取样,每个处理组每个时间点随机选取5条鱼,收集肝、脾和头肾组织。以β-actin作为内参基因,按照上述方法检测病毒刺激后半滑舌鳎肝、脾和头肾组织中的CsCD80表达量变化。每组实验重复3次。
1.2.3重组CsCD80蛋白(rCsCD80)和重组Trx蛋白(rTrx)的表达和纯化
重组蛋白表达使用蛋白表达载体pET32a。首先构建重组表达质粒pETCsCD80,设计特异性引物CsCD80-F(5′-CCCGGGATGGGAGGTCTCCTGCA-3′ ,加下划线的序列为SmaI酶切位点)、CsCD80-R(5′-CCCGGGAGTATTTGGCCAGTCGGG-3′,加下划线的序列为SmaI酶切位点)扩增CsCD80的胞外段(34~241位氨基酸),PCR产物克隆至T-A的克隆载体pEASY-T1后,提取质粒,重组质粒用SmaI内切酶消化后,切胶回收酶切目的片段,将回收的酶切目的片段插入表达质粒pET32a。经转化、挑选单克隆、菌落PCR和测序确认后,将重组表达质粒转入大肠杆菌BL21中,在LB培养基中37℃培养至OD600=0.5,加入0.4 mmol/L IPTG后,于16℃诱导培养12 h,收集菌液,经液氮速冻、超声破碎后,使用Ni-NTA琼脂糖柱纯化蛋白质,将纯化后的重组CsCD80蛋白(rCsCD80)装入透析袋中进行复性[11]。同时,使用pET32a表达重组标签蛋白rTrx,作为后续实验的对照蛋白。蛋白浓度使用Nanodrop测定。
1.2.4rCsCD80与半滑舌鳎外周血淋巴细胞(PBL)的相互作用
用Percoll密度梯度离心法[12]提取健康半滑舌鳎(750±10)g的外周血淋巴细胞,在L15培养液中稀释至1×108细胞/mL,将rCsCD80、rTrx加入PBL悬液中,使其终浓度为80 μmol/L,28℃孵育2 h后,PBS洗3次,加入稀释1000倍的小鼠抗His抗体,37℃孵育1 h后,PBS洗3次,加入稀释1000倍的FITC标记的羊抗小鼠IgG抗体,37℃避光孵育1 h后,PBS洗3次,滴加至载玻片上,盖上盖玻片,置于荧光显微镜下观察、拍照。
2 结果
2.1 CsCD80序列分析
CsCD80基因序列开放阅读框含有882个碱基,共编码293个氨基酸,其理论分子质量为32.45 ku,理论等电点pI=7.97,N-末端1~31位氨基酸残基为信号肽序列,37~129位氨基酸残基为免疫球蛋白V区(IgV)结构域,是免疫球蛋白超家族的保守特征,233~267位氨基酸为α螺旋的跨膜(TM)结构域。氨基酸组成中丝氨酸(Ser)含量最高,占11.26%。选取与CsCD80序列相似度最高的前7个物种进行多重序列比对(这7个物种按相似度从高到低,其GenBank登录号依次为:XP_019950451.1、XP_019903483.1、XP_014070714.1、ACH58053.1、XP_017346141.1、XP_018918527.1、XP_017206576.1)。结果表明,CsCD80与牙鲆(Paralichthysolivaceus)CD80相似性最高,为41.37%,与其他鱼类的CD80相似性较低(19.01%~41.37%),见图1。
2.2 CsCD80在半滑舌鳎不同组织中的表达
通过实时荧光定量PCR技术检测CsCD80在健康半滑舌鳎的不同组织中的表达情况。实验结果显示,CsCD80在检测的9种组织中均有表达,其中在肝中表达量最高,其次为脾、心、脑、鳃、肌肉、肾、肠和血,肝中的表达量为血中的表达量的508.2倍(图2)。
2.3 哈维氏弧菌、细胞肿大病毒感染后半滑舌鳎中CsCD80的表达
在V.harveyi感染半滑舌鳎6、12、24和48 h后,通过荧光定量PCR技术检测CsCD80在肝、脾、头肾中的表达情况。实验结果显示,肝中CsCD80在感染后6、12、24和48 h表达量均有显著上调,脾中CsCD80在感染后6 h表达量显著上调,头肾中CsCD80在感染后6、12和24 h表达量均有显著上调,在肝、脾、头肾中CsCD80的最大表达量分别出现在感染后的24、6和24 h,表达量为对照组的66.7倍、14.3倍和3.3倍(图3-A~C)。在病毒RBIV-C1感染半滑舌鳎的1、3、5和7 d后,通过荧光定量PCR技术检测CsCD80在肝、脾、头肾中的表达情况。实验结果显示,肝中CsCD80在感染后3、5和7 d表达量均有显著上调,脾中CsCD80在感染后1 d和3 d表达量均有显著上调,头肾中CsCD80在感染后1、3、5和7 d表达量均有显著上调,在肝、脾和头肾中CsCD80的最大表达量分别出现在感染后的3 d、3 d和7 d,表达量为对照组的9.6倍、12.3倍和6.2倍(图3-D~F)。
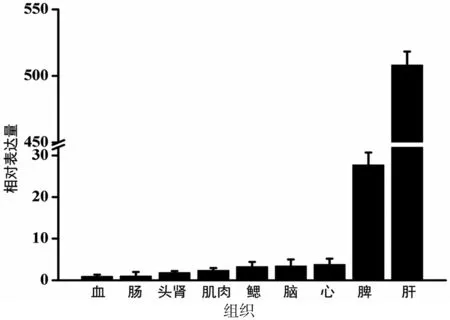
图2 CsCD80在健康的半滑舌鳎组织中的表达情况
为方便比较,将血中的相对表达量设为1;数据为3次实验数据的平均值,以平均值±标准误差表示

图3 细菌、病毒感染后CsCD80在半滑舌鳎组织中的表达情况
实验组半滑舌鳎感染哈维氏弧菌(A~C)和细胞肿大病毒(D~F);对照组半滑舌鳎未感染细菌和病毒,用实时荧光定量PCR技术测定不同时间点CsCD80在肝、脾、肾中的相对表达量。对照组的相对表达量设为1,数据为3次实验数据的平均值,以平均值±标准误差表示。*P< 0.05;**P< 0.01
2.4 rCsCD80与半滑舌鳎外周血淋巴细胞(PBL)的结合
通过原核表达的方法获得rCsCD80和rTrx(图4)。rCsCD80和rTrx与半滑舌鳎的PBL孵育后,用带有绿色荧光的抗体检测与细胞结合的重组蛋白。结果表明,rCsCD80与PBL孵育后,在荧光显微镜下观察到PBL表面有绿色荧光,而rTrx与半滑舌鳎PBL孵育后,在PBL表面未观察到绿色荧光(图5)。该结果说明rCsCD80能够与PBL结合。

图4 rCsCD80和 rTrx的聚丙烯酰胺凝胶电泳图Fig 4 SDS-PAGE analysis of rCsCD80 and rTrx
泳道1:蛋白Marker;泳道2:重组表达的CsCD80蛋白;泳道3:重组Trx蛋白

图5 rCsCD80与半滑舌鳎外周血淋巴细胞(PBL)的结合Fig 5 Binding of rCsCD80 to the peripheral blood lymphocytes(PBL) of C. semilaevis
半滑舌鳎PBL先与rCsCD80(A-C)或rTrx(D-F)孵育后,再与抗His-tag抗体孵育,随后与FITC标记的二抗孵育,在荧光显微镜下观察。C为A、B融合后的图;F为D、E融合后的图
3 讨论
本研究从半滑舌鳎全基因组数据库中克隆得到了CsCD80序列。序列分析表明,CsCD80与牙鲆CD80同源性最高。氨基酸序列分析表明,CsCD80包含两个保守结构域,即免疫球蛋白V区结构域和α螺旋结构跨膜结构域,而在虹鳟鱼中,CD80不仅包含这两个保守结构域,还包含一个免疫球蛋白C区(IgC)结构域[3]。这些结果说明在不同鱼类中CD80存在序列和结构上的差异。
组织特异性表达分析表明,在健康状态的半滑舌鳎中,CsCD80在9种组织中有不同程度的表达,其中在肝和脾中的表达量较高,该结果与已报道的尼罗罗非鱼组织表达情况较相似[5],而在虹鳟鱼中,CD80在血中表达量最高,脾中表达量次之[3]。这可能是由于虹鳟和半滑舌鳎免疫机制存在差别有关。在人类CD80研究中, CD80分子存在于肝细胞表面,且在丙型肝炎病毒刺激下,CD80在肝细胞中表达量上调,说明在人体中CD80可能发挥保护肝细胞的作用[13]。此外,肝是补体合成的主要器官,因此推测半滑舌鳎中CsCD80在肝中表达量最高可能是一种自身保护机制,保护细胞免受由补体引起的损伤。脾脏是鱼类重要的免疫器官,是鱼类机体中中性粒细胞、 红细胞等产生、 储存和成熟的主要场所,具有产生各种免疫细胞的功能,在鱼类特异性免疫过程中发挥重要作用[14-15]。在本研究中,CsCD80在半滑舌鳎脾脏中有大量表达,可能说明CsCD80在脾脏中参与半滑舌鳎的免疫进程。
在虹鳟CD80研究中发现,用大肠杆菌脂多糖和弧菌毒素对虹鳟进行免疫刺激后,CD80表达量显著上调[3]。在尼罗罗非鱼中,用灭活无乳链球菌对其进行免疫刺激后,CD80在罗非鱼的肠、鳃、脑、脾、肾、胸腺中表达量均显著上调[5]。在本研究中也存在类似现象,V.harveyi和细胞肿大病毒是半滑舌鳎养殖业中的常见病原微生物[6-7],在V.harveyi和细胞肿大病毒感染半滑舌鳎后,CsCD80在肝、脾、头肾中的表达量均呈现显著上调,且呈现出时间依赖性表达模式。这些结果表明CsCD80可能在半滑舌鳎抵抗V.harveyi和细胞肿大病毒侵染的免疫应答过程中发挥重要作用。
在人类CD80研究中发现,CD80能刺激PBL使其增殖,从而增强机体的免疫反应[16]。在本研究中,rCsCD80与半滑舌鳎PBL孵育后,通过免疫荧光检测,可观察到半滑舌鳎PBL表面出现绿色荧光,说明rCsCD80能结合到PBL表面,由此推测半滑舌鳎PBL表面可能存在rCsCD80的配体,rCsCD80通过与PBL表面配体结合,可能会进一步刺激PBL增殖从而加强机体的免疫反应强度。
4 结论
本研究克隆了半滑舌鳎CsCD80的DNA序列,通过序列比对发现其与牙鲆CD80序列相似度最高。在健康状态的半滑舌鳎中,CsCD80在肝和脾中具有高表达量,在细菌和病毒感染后,CsCD80 在肝、脾、头肾中表达量均有显著上调,且呈现时间依赖模式,揭示CsCD80可能在半滑舌鳎的抗感染免疫应答过程中起重要作用。进一步研究发现rCsCD80能够结合到PBL表面,暗示rCsCD80可能通过与PBL上的配体结合而引发细胞免疫应答反应。本研究结果为深入研究半滑舌鳎CD80的免疫机制奠定了基础。
[1]SHAO T, ZHU L Y, NIE L, et al. Characterization of surface phenotypic molecules of teleost dendritic cells[J]. Developmental & Comparative Immunology, 2015, 49(1): 38-43.
[2]任亚琳. B7-CD28 家族成员的免疫调节功能及其最新研究进展[J]. 国外医学免疫学分册, 2006, 28(6): 324-327.
[3]ZHANG Y A, HIKIMA J, LI J, et al. Conservation of structural and functional features in a primordial CD80/86 molecule from rainbow trout(Oncorhynchusmykiss), a primitive teleost fish[J]. The Journal of Immunology, 2009, 183(1): 83-96.
[4]KUCHROO V K, DAS M P, BROWN J A, et al. B7-1 and B7-2 costimulatory molecules activate differentially the Th1/Th2 developmental pathways: application to autoimmune disease therapy[J]. Cell, 1995, 80(5): 707-718.
[5]汪志文, 张海艳, 黄 瑜, 等. 尼罗罗非鱼 CD80 基因的分子克隆与 mRNA 表达分析[J]. 基因组学与应用生物学, 2017(1): 190-200.
[6]戴 欢, 刘 洋, 王文文, 等. 半滑舌鳎抗哈维氏弧菌病相关微卫星标记筛选及 QTL 定位[J]. 中国水产科学, 2017, 24(1): 22-30.
[7]张宝存. 虹彩病毒 RBIV-C1 分子病原特征及其诱导海水鱼类免疫应答反应的研究[D]. 北京:中国科学院大学, 2014.
[8]SUN K, ZHANG W W, HOU J H, et al. Immunoprotective analysis of VhhP2, aVibrioharveyivaccine candidate[J]. Vaccine, 2009, 27(21): 2733-2740.
[9]ZHANG J, LI M F. ORF75 of megalocytivirus RBIV-C1: a global transcription regulator and an effective vaccine candidate[J]. Fish & Shellfish Immunology, 2015, 45(2): 486-494.
[10]LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2- ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[11]LI M F, WANG C, SUN L.EdwardsiellatardaMliC, a lysozyme inhibitor that participates in pathogenesis in a manner that parallels Ivy[J]. Infection and Immunity, 2015, 83(2): 583-590.
[12]LONG H, CHEN C, ZHANG J, et al. Antibacterial and antiviral properties of tongue sole(Cynoglossussemilaevis) high mobility group B2 protein are largely independent on the acidic C-terminal domain[J]. Fish & Shellfish Immunology, 2014, 37(1): 66-74.
[13]FIORE G, PIAZZOLLA G, GALETTA V, et al. Liver tissue expression of CD80 and CD95 antigens in chronic hepatitis C: relationship with biological and histological disease activities[J]. Microbios, 1999, 97(386): 29-38.
[14]孙德文, 詹 勇, 许梓荣. 鱼类免疫系统的研究进展[J]. 水利渔业, 2002, 22(6): 17-19.
[15]王俊相, 李玉萍, 孔令富, 等. 鱼类免疫系统的研究进展[J]. 四川畜牧兽医, 2010(7): 29-31.
[16]KOC S, KATHER A, MARKERT U R, et al. Enhancement of immunogenicity of Jeg3 cells by ectopic expression of HLA‐A* 0201 and CD80[J]. American Journal of Reproductive Immunology, 2003, 50(3): 243-253.
