不同生物素水平对3T3-L1脂肪细胞脂肪合成相关基因转录表达的影响
2018-04-17雒诚龙任万平赵艳坤王东海
雒诚龙,邵 伟,,任万平,赵艳坤,王东海,余 雄
(1.新疆农业大学动物科学学院,乌鲁木齐 830052;2.新疆肉乳用草食动物营养重点实验室,乌鲁木齐 830052)
0 引 言
【研究意义】生物素是动物体内一种重要的羧化酶,由于其可通过机体内源合成,因此生物素缺乏现象极为罕见,这也造成了对生物素的研究相对较少。随着研究的推进,近来发现生物素有助于机体促进正常糖脂代谢,并改善机体内环境。但就细胞层面而言,生物素在糖脂代谢过程中对相关物质究竟有何影响仍处在摸索阶段。【前人研究进展】在脂肪细胞中,细胞会将多余的葡萄糖经葡萄糖转运体4(glucose transporter 4,GLUT-4)加速转运至细胞内[1],并在己糖激酶(hexokinase,HK)、磷酸果糖激酶(phosphofructokinase,PFK)、丙酮酸激酶(pyruvate kinase,PK)等酶催化下转化为丙酮酸,再经转化生成合成甘油三酯(triacylglyceride,TG)的前体物质乙酰CoA[2]。乙酰CoA在经过乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、脂肪合成酶(fatty acid synthase,FAS)等一些列酶的催化下合成TG[2],TG再经转运至细胞脂滴储存[3]。生物素是机体内必不可少的辅酶因子[4],可参与或间接调控机体内多项脂合成反应[5]。已有研究证明,在奶牛日粮中添喂生物素可提高乳脂、乳糖含量[6],生物素还可通过调节固醇调节元件结合蛋白调节细胞脂合成相关基因转录表达[7],生物素亦可通过改善细胞状态[8],促细胞糖利用并向脂质转化。【本研究切入点】前人对生物素的研究多集中于动物整体水平,而于细胞层面研究较少。研究在体外培养糖脂代谢活跃的3T3-L1脂肪细胞,并添加生物素进行干预,探究生物素对脂肪细胞中脂肪合成相关基因表达间的影响。【拟解决的关键问题】研究不同生物素浓度对脂肪细胞中脂肪合成相关基因表达的影响,为更好的利用生物素调控脂肪细胞发育提供理论基础。
1 材料与方法
1.1 材 料
1.1.1主要仪器
倒置显微镜、二氧化碳细胞培养箱、酶标仪、低速离心机、实时定量PCR仪。
1.1.2主要试剂
高糖DMEM培养基、油红O染料、胰岛素、地塞米松(DEX)、3-异丁基-1-甲基黄嘌呤(IBMX),吲哚美辛,胰蛋白酶、逆转录试剂盒、qPCR试剂盒、引物由上海博谷生物科技公司合成。
1.2 方 法
1.2.1试验设计
按单因素试验设计,在细胞培养液中加入不同剂量的生物素为试验组,使培养基内生物素浓度分别达0 μmol/L、0.2 μmol/L、0.5 μmol/L、1 μmol/L,每组试验3个平行样,每个平行样3次重复,分别在12 h、24 h、48 h时,检测细胞上清液中甘油释放量及细胞内GLUT-4、PK、FAS及ACC1 mRNA的相对表达量。
1.2.23T3-L1前脂肪细胞株的培养与分化[9]
将3T3-L1前脂肪细胞株用含10% FBS的高糖DMEM培养基在37℃、5% CO2条件下培养。待细胞长满培养瓶底壁时,将细胞接种于6孔培养板中,待细胞长满2 d后,加入含10% FBS的DMEM培养基及含0.5 mmol/L IBMX、0.25 μmol/L DEX、10 mg/L胰岛素的分化液,培养48 h,再以含10 mg/L胰岛素的培养液培养48 h,然后用含10% FBS的DMEM培养液继续培养,每隔2 d换液1次,诱导分化8~12 d后,待90%以上的3T3-L1细胞呈脂肪细胞表型再进行下一步处理。
1.2.3添加不同浓度生物素干预
将诱导分化好的脂肪细胞以1×105/mL接种于24孔板,用完全培养液培养12 h,待细胞完全贴壁后,换不同浓度生物素培养基孵化。各组培养基中生物素浓度为0(对照组)、0.2、0.5、1 μmol/L,每组设3个平行复孔,每孔设3个平行。
1.2.4实时荧光定量方法[10]
参照试剂盒说明书提取各组细胞总RNA,全自动酶联免疫分析仪测出RNA浓度以及OD260nm/OD280nm,以提取的总RNA为模板,按照逆转录试剂盒说明书(10 μL,37℃ 15 min,85℃ 5 s)合成cDNA。RCR按20 μL反应体系进行,反应条件:95℃ 30 s变性,95℃ 5 s,60℃ 31 s,50个循环,上机自动分析荧光信号,并将其转换Ct值,采用ΔΔCt法分析,以磷酸甘油醛脱氢酶(GAPDH)为内参基因计算GLUT-4、PK、FAS、ACC1 mRNA相对定量值(2-ΔΔCt)。基因序列均从Genbank中获取,引物用Primer 5.0软件进行设计,由上海博谷生物科技有限公司合成。表1
1.2.5荧光定量PCR引物(表1)
1.3 数据处理
所有原始数据先用Excel 2016进行整理,用SPSS 22软件进行单因素方差分析,并用Duncan法进行多重比较。以P<0.05作为差异显著性判断标准,P<0.01作为差异极显著判断标准。数据统计的最终结果用平均值±标准差表示。
表1定量PCR 引物信息
Table1Primer sequences of Real-time fluorescent quantitative PCR

基因名称Genename引物序列Primersequences(5’-3’)扩增长度Amplificationlength(bp)退火温度Annealingtemperature(℃)GLUT-4F:CACCGGCAGCCTCTGATCR:TAAGAGCACCGAGACCAACG18059PKF:TGGATGGGGCTGACTGTATCR:CGTAGCTCCTCAAACAACTGG13958ACC1F:CATCGATAACCCTTCAGCAGAGR:GCCTCGGTTTTGTCGTCC15959FASF:GGGCTACAGAGATGGACTTCGR:AGGCAGCCACTCCAACAAG19059GAPDHF:GAGAAACCTGCCAAGTATGATGR:AGAGTGGGAGTTGCTGTTGAAG12959
2 结果与分析
2.1 生物素浓度对细胞GLUT-4 mRNA表达量的影响
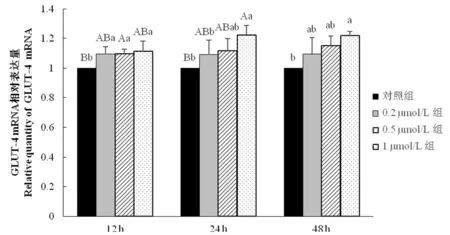
研究表明,在试验12 h时,各试验组GLUT-4 mRNA相对表达量均显著(P<0.05)高于对照组;在试验24 h时,1 μmol/L组GLUT-4 mRNA相对表达量显著(P<0.05)高于0.2 μmol/L与对照组;在试验48 h时,1 μmol/L组GLUT-4 mRNA相对表达量显著(P<0.05)高于对照组。图1
注:同列数据肩标不同小写字母表示差异显著(P<0.05);肩标不同大写字母表示差异极显著(P<0.01);肩标相同字母或无字母标注表示差异不显著(P>0.05)[10],下同
Note: data in the same column of the shoulder mark different lowercase letters indicate a significant difference (P< 0.05); shoulder standard different capital letters show very significant difference (P< 0.01); shoulder standard the same letter or letter annotation denotes the difference was not significant (P> 0.05).The same as below
图1不同生物素浓度下细胞GLUT-4 mRNA表达量变化
Fig.1The Impact of Various Biotin Concentrations on GLUT-4 mRNA Expression Quantity of Cells
2.2 生物素浓度对细胞PK mRNA表达量的影响
研究表明,在试验12 h时,各试验组PK mRNA相对表达量均显著高(P<0.05)于对照组,其中1 μmol/L组PK mRNA相对表达量极显著(P<0.01)高于对照组、0.2 μmol/L组及0.5 μmol/L组,与之相比分别提升了58.9%、39.1%与29.9%;在试验24 h时,1 μmol/L组PK mRNA相对表达量显著(P<0.05)高于对照组;在试验48 h时,1 μmol/L 组PK mRNA相对表达量极显著(P<0.01)高于对照组。图2

图2不同生物素浓度下细胞PK mRNA表达量变化
Fig.2The Impact of Various Biotin Concentrations on PK mRNA Expression Quantity of Cells
2.3 生物素浓度对细胞FAS mRNA表达量的影响
研究表明,在试验12 h时,1 μmol/L组与0.5 μmol/L组FAS mRNA相对表达量极显著(P<0.01)高于于对照组与0.2 μmol/L组;在试验24 h时,各试验组FAS mRNA相对表达量与对照组间差异不显著;在试验48 h时,0.5 μmol/L组FAS mRNA相对表达量极显著(P<0.01)高于对照组,并显著(P<0.05)高于1 μmol/L组。图3
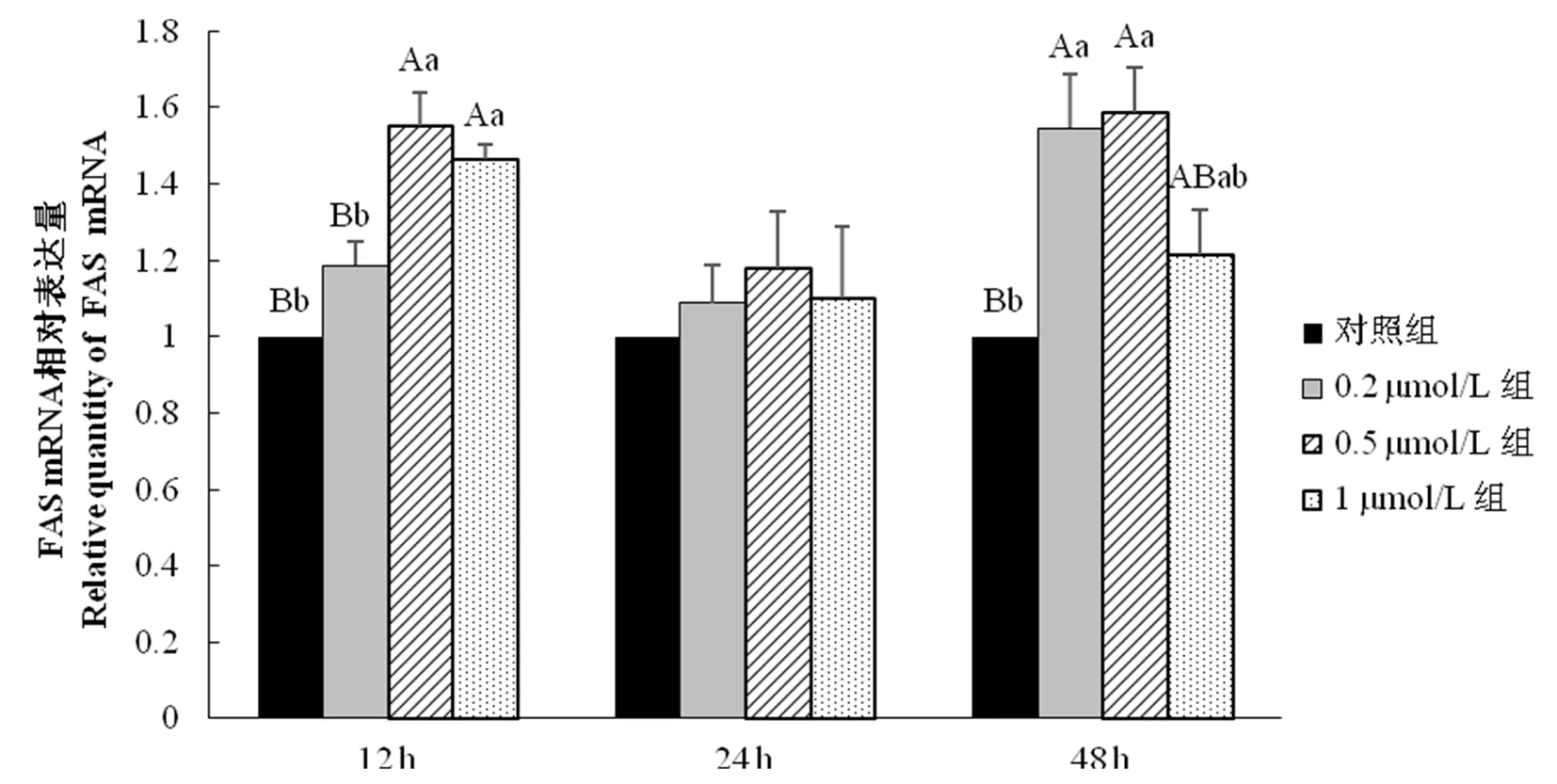
图3不同生物素浓度下细胞FAS mRNA表达量变化
Fig.3The Impact of Various Biotin Concentrations on FAS mRNA Expression Quantity of Cells
2.4 生物素浓度对细胞ACC1 mRNA表达量的影响
研究表明,在试验12 h时,1 μmol/L组、0.5 μmol/L组与0.2 μmol/L组ACC1 mRNA相对表达量极显著(P<0.01)高于对照组;在试验24 h时,1 μmol/L组ACC1 mRNA相对表达量极显著(P<0.01)高于对照组,0.2 μmol/L组与0.5 μmol/L组ACC1 mRNA相对表达量显著(P<0.05)高于对照组;在试验48 h时,1 μmol/L组ACC1 mRNA相对表达量极显著高于对照组与0.2 μmol/L组,0.5 μmol/L组ACC1 mRNA相对表达量显著(P<0.05)高于对照组与0.2 μmol/L组。图4

图4不同生物素浓度下细胞ACC1 mRNA表达量变化
Fig.4The Impact of Various Biotin Concentrations on ACC1 mRNA Expression Quantity of Cells
3 讨 论
葡萄糖跨膜转运是脂肪细胞吸收利用葡萄糖的主要限速步骤之一[11]。研究表明,这一步骤是依靠细胞膜上的特殊转运蛋白来完成的[12],这种特殊的转运蛋白便是葡萄糖转运蛋白。而脂肪细胞中的转运蛋白主要以GLUT-4为主[13]。该试验结果中:添加生物素的试验组在12、24、48 h时GLUT-4 mRNA 相对表达量均高于对照组,这表明生物素的添加可以提高GLUT-4 mRNA的表达。而三个生物素试验组中,1 μmol/L组在24 h及48 h时的GLUT-4 mRNA相对表达量高于0.2 μmol/L组及0.5 μmol/L组,其中24 h时极显著(P<0.05)高于0.5 μmol/L组,虽然在12 h时GLUT-4 mRNA相对表达量低于0.5 μmol/L,但差异并不显著。这就表明在48 h内以1 μmol/L浓度作用脂肪细胞对提升细胞中GLUT-4的相对表达效果最佳。GLUT-4作为葡萄糖转运的主要蛋白,其表达量地提升可以细胞对葡萄糖地吸收[14]并可改善脂肪细胞的胰岛素抵抗现象[15]。推测当进入胞内的葡萄糖越多,用于合成TG的前体物质可能会随之增加,使TG沉积量提升。而当细胞胰岛素抵抗得到缓解时,细胞对相应细胞因子的感受可能会得到提升,加速细胞内TG沉积。以1 μmol/L浓度生物素作用脂肪细胞时,可通过提升GLUT-4的表达进而达到促TG沉积的目的。
当葡萄糖进入细胞后经糖酵解产生丙酮酸,再经各类酶催化逐步转变为甘油三酯存储于细胞当中[2]。PK作为糖酵解过程中关键酶,也是整个过程的关键限速酶之一[2]。在试验结果中:添加了生物素的试验组在12、24及48 h时PK mRNA相对表达量均高于对照组,这说明生物素的添加会提高细胞中PK mRNA相对表达量。而在添加了生物素的三个试验组中,1 μmol/L组在12、24及48 h时PK mRNA相对表达量均高于0.2 μmol/L组及0.5 μmol/L组,尤其是在12 h时差异极显著(P<0.01),这就说明在48 h内以1 μmol/L浓度生物素作用脂肪细胞对提升细胞内PK的相对表达,且以12 h时提升效果最为显著。王彦等[16]发现当PK蛋白浓度上升时,细胞对葡萄糖的摄取与转化能力都得到了提升,滕翠琴[17]发现当PK含量呈上升趋势时,葡萄糖利用亦趋于稳定。当葡萄糖吸收量上升时,TG的沉积亦会增长[18]。推断PK相对表达的提升可能加速了糖酵解进程,使脂合成原料丙酮酸的快速合成,进而使TG含量有所提升。以1 μmol/L浓度生物素作用脂肪细胞时,可通过提升PK的表达进而达到促TG沉积的目的。
ACC1在脂肪酸的代谢过程中起了重要作用,其可以催化乙酰辅酶A生成丙二酸单酰辅酶A[2],并被证实可以通过多种机制调控脂肪代谢过程[18]。在试验结果中,添加生物素的试验组在12、24及48 h时ACC1 mRNA相对表达量均高于对照组,这表明生物素的添加能促进ACC1的表达。而三个试验组中,1 μmol/L组在12 h、24 h及48 h时ACC1 mRNA相对表达量均高于0.2 μmol/L组与0.5 μmol/L组。这表明在48 h内以1 μmol/L浓度生物素作用脂肪细胞对提升细胞内ACC1的相对表达效果最佳。生物素的缺乏将大幅降低羧化全酶合成酶的mRNA表达量[19],而ACC作为生物素依赖性羧化酶其表达亦会受到影响。以1 μmol/L浓度生物素作用脂肪细胞可能会有效提升羧化全酶mRNA表达量进而促进ACC mRNA的表达。周红宇等[20]试验利用瘦素抑制ACC mRNA表达,结果发现当ACC mRNA表达下降时,脂肪酸合成亦受到了影响。刘莉莉等[21]试验证实,当ACC表达量提升时,乳腺上皮细胞的乳脂合成增加。这说明生物素可以通过提升ACC1 mRNA的相对表达来促进脂肪酸合成,以达到促脂合成的目的。
动物的体脂沉积所需要的脂肪酸大多是来自脂肪酸的从头合成[2],即由FAS催化下乙酰辅酶A和丙二酸单酰辅酶A合成甘油三酯的过程。在试验结果中,添加生物素的试验组在12、24及48 h时FAS mRNA相对表达量均高于对照组,这表明生物素的添加能促进FAS的表达。而在三个试验组中,0.5 μmol/L组在12、24及48 h时FAS mRNA相对表达量均高于0.2 μmol/L组与1 μmol/L组。这表明在48 h内以0.5 μmol/L浓度生物素作用脂肪细胞对提升细胞内FAS的相对表达效果最佳。FAS的表达受到转录因子固醇调节元件结合蛋白(SREBP1c)调控[22-23],而Ortega-Cuellar试验[24]指出生物素可以激活SREBP1c。以0.5 μmol/L浓度生物素作用脂肪细胞可能会有效提升SREBP1c活化程度,进而促进FAS mRNA的表达。舒常平等[25]等研究表明,FAS mRNA的表达可使脂肪快速沉积。这说明生物素可以通过提升FAS mRNA的相对表达来促进脂肪酸合成,以达到促脂合成的目的。
4 结 论
生物素可提升脂肪细胞GLUT-4、PK、FAS与ACC1 mRNA相对表达量;当以1 μmol/L生物素作用时,细胞GLUT-4、PK与ACC1 mRNA相对表达量均高于其它试验组并显著(P<0.05)高于对照组;当以0.5 μmol/L生物素作用时,细胞FAS mRNA相对表达量均高于其它组。通过不同组间的比较,以1 μmol/L生物素作用脂肪细胞时对GLUT-4、PK与ACC1 mRNA提升效果最佳,以0.5 μmol/L生物素作用时对FAS mRNA提升效果最佳。
参考文献(References)
[1] Huang, S., & Czech, M. P. (2007). The glut4 glucose transporter.CellMetabolism, 5(4): 237-252.
[2] 王镜岩.生物化学.上册[M]. 北京:高等教育出版社, 2002.
WANG Jing-yan. (2002).Biochemistry(VolumeOne) [M]. Beijing: Higher Education Press. (in Chinese)
[3] 张淑妍,杜雅兰,汪洋,等.脂滴-细胞脂类代谢的细胞器[J]. 生物物理学报, 2010, 26(2):97-105.
ZHANG Shu-yan, DU Ya-lan, WANG Yang, et al. (2010). Lipid droplet - A cellular orangelle for lipid metabolism [J].ActaBiophysicaSinica, 26(2):97-105.(in Chinese)
[4] 郑巍振.生物素高产菌种选育的研究[D]. 杭州:浙江工业大学硕士学位论文, 2010.
ZHENG Wei-zhen. (2010).Studyonstrainscreeningofhighbiotin-producing[D]. Master Dissertation. Zhejiang University of Technology,Hangzhou. (in Chinese)
[5] Fernandez-Mejia, C. (2011). Biological effects of pharmacological concentrations of biotin.JournalofEvidence-BasedComplementary&AlternativeMedicine, 16(1): 40-48.
[6] 张旭晖,王恬.生物素营养生理作用及其应用研究进展[J].中国饲料, 2010,(8):5-8.
ZHANG Xu-hui, WANG Tian. (2010). Biophysical nutrient physiological function and its application research progress [J].ChinaFeed, (8):5-8. (in Chinese)
[7] Foufelle, F. F. P. (2002). New perspectives in the regulation of hepatic glycolytic and lipogenic genes by insulin and glucose: a role for the transcription factor sterol regulatory element binding protein-1c [review].BiochemicalJournal, 366(2): 377-91.
[8] 朱晓波,闫智宏,徐志伟,等.生物素对高糖状态下大鼠胰岛β细胞功能的影响[J].华西药学杂志,2010,25(1):29-31.
ZHU Xiao-bo, YAN Zhi-hong, XU Zhi-wei, et al. (2010). The effect of biotin on the function of rat islet β cell cultured with high glucose [J].WestChinaJournalofPharmaceuticalSciences, 25(1):29-31. (in Chinese)
[9] 李萍,岳晶晶, 张达,等.小檗碱对3T3-L1脂肪细胞炎症因子、脂肪因子及脂肪酸代谢的影响[J]. 天津医药, 2014, 42(6):513-516.
LI Ping, YUE Jing-jing, ZHANG Da, et al. (2014). Effects of berberine on inflammatory factors, Adipokines and Fatty Acid Metabolism in 3T3-L1 adipocytes [J].TianjinMedicalJournal, 42(6):513-516. (in Chinese)
[10] 赵艳坤, 邵伟, 王立文,等.移植脐带间充质干细胞对荷斯坦公犊生长性能的影响[J]. 新疆农业科学, 2015, 52(2):354-359.
ZHAO Yan-kun, SHAO Wei, WANG Li-wen, et al. (2015). Transplantation of umbilical cord mesenchymal stem cells on the growth performance of Holstein male calves [J].XinjiangAgriculturalSciences, 52(2):354-359. (in Chinese)
[11] 蔡琳婷,陈文新.心肌细胞葡萄糖转运蛋白4的转运调控及与心肌活力关系的研究进展[J]. 国际放射医学核医学杂志, 2016, 37(1):47-51.
CAI Lin-ting, CHEN Wen-xin. (2016). Recent advances on the regulation ofghcose transporter 4 transport and its relationship with myocardial viability in cardiomyocytes [J].InternationalJournalofRadiationMedicineandNuclearMedicine, 37(1):47-51. (in Chinese)
[12] Bryant, N. J., Govers, R., & James, D. E. (2002). Regulated transport of the glucose transporter glut4.NatRevMolCellBiol, 3(4): 267-277.
[13] Al-Hasani, H. (2004). Regulated transport of the glucose transporter glut4.NatureReviewsMolecularCellBiology, 3(4): 291-313.
[14] 岳晶晶.小檗碱对3T3-L1脂肪细胞炎症因子、脂肪因子和脂肪酸代谢的影响[D]. 天津: 天津医科大学硕士学位论文, 2012.
YUE Jing-jing. (2012).Effectsofberberineoninflammatoryfactors,adipokinesandmetabolismODfattyacidin3T3-L1adipocytes[D]. Master Dissertation. Tianjin Medical University, Tianjin. (in Chinese)
[15] Fujiwara, Y., Tsukahara, C., Ikeda, N., Sone, Y., Ishikawa, T., & Ichi, I., et al. (2017). Oleuropein improves insulin resistance in skeletal muscle by promoting the translocation of glut4.JournalofClinicalBiochemistry&Nutrition, 61(3): 196-202.
[16] 王彦,高婷婷,廉如,等.脂联素球状结构域对2型糖尿病大鼠己糖激酶和丙酮酸激酶活力影响的研究[J]. 中国糖尿病杂志, 2013, 21(3):271-273.
WANG Yan, GAO Ting-ting, LIAN Ru, et al. (2013). Effect of globular domain of adiponectin on hexokinase and pyruvate kinase vitality in T2DM rat [J].ChineseJournalofDiabetes, 21(3):271-273. (in Chinese)
[17] 滕翠琴. 六堡茶对3T3-L1脂肪细胞糖脂代谢的影响[D]. 长沙:湖南农业大学硕士学位论文, 2014.
TENG Cui-qin. (2014).EffectofLiupaoTeaonglucolipidmetabolismin3T3-L1adipocytes[D]. Master Dissertation. Hunan Agricultural University, Changsha. (in Chinese)
[18] Kaneto, H., Obata, A., Kimura, T., Shimoda, M., Okauchi, S., & Shimo, N., et al. (2017). Beneficial effects of sodium-glucose cotransporter 2 inhibitors for preservation of pancreatic β‐cell function and reduction of insulin resistance.JournalofDiabetes, 9(3): 219-225.
[19] Larrieta, E., Velasco, F., Vital, P., López-Aceves, T., Lazo-De-La-Vega-Monroy, M. L., & Rojas, A., et al. (2010). Pharmacological concentrations of biotin reduce serum triglycerides and the expression of lipogenic genes.EuropeanJournalofPharmacology, 644(1-3): 263-268.
[20] 周红宇,阳学风.瘦素对L-02肝细胞甘油三酯沉积及乙酰辅酶A羧化酶表达的影响[J]. 实用药物与临床, 2011, 14(5):373-375.
ZHOU Hong-yu, YANG Xue-feng. (2011). Effects of leptin on disposition of triglyceride in L-02 fatty liver cells [J].PracticalPharmacyandClinicalRemedies, 14(5):373-375. (in Chinese)
[21] 刘莉莉,曹玲,李慧玲,等.辛酸钠对奶牛乳腺上皮细胞脂肪酸合成相关酶表达的影响[J]. 河南农业科学, 2014, 43(5):160-163.
LIU Li-li, CAO Ling, LI Hui-ling, et al. (2014). Effects of sodium octanoate on key fatty acid synthesis enzyme in mammary epithelial cells of dairy cows [J].HenanAgriculturalSciences, 43(5):160-163. (in Chinese)
[22] You, M., Fischer, M., Deeg, M. A., & Crabb, D. W. (2002). Ethanol induces fatty acid synthesis pathways by activation of sterol regulatory element-binding protein (srebp).JournalofBiologicalChemistry, 277(32): 29,342-29,347.
[23] Foufelle, F., & Ferré, P. (2001). regulation of carbohydrate metabolism by insulin: role of transcription factor srebp-1c in the hepatic transcriptional effects of the hormone.JournalDeLaSociétéDeBiologie, 195(3): 243-248.
[24] Ortega-Cuellar, D., Hernandez-Mendoza, A., Moreno-Arriola, E., Carvajal-Aguilera, K., Perez-Vazquez, V., & Gonzalez-Alvarez, R., et al. (2010). Biotin starvation with adequate glucose provision causes paradoxical changes in fuel metabolism gene expression similar in rat (rattus norvegicus), nematode (caenorhabditis elegans) and yeast (saccharomyces cerevisiae).JournalofNutrigenetics&Nutrigenomics,3(1): 18-30.
[25] 舒常平,王宝维,李桢,等.填饲鹅肝脏组织中脂肪酸沉积与FAS基因mRNA的表达丰度[J]. 中国农业科学, 2012, 45(10):2 002-2 011.
SHU Chang-ping, WANG Bao-wei, LI Zhen, et al. (2012). Fatty acids deposition and FAS mRNA expression abundance in liver tissue of overfeeding goose [J].ScientiaAgriculturaSinica, 45(10): 2,002-2,011. (in Chinese)
