CRISPR/Cas9技术编辑新疆甜瓜全缘叶基因
2018-04-17王旭辉高兴旺
王 丹,王旭辉,2,高兴旺,李 冠
(1.新疆大学生物工程研究中心,乌鲁木齐 830046;2.新疆农业科学院生物质能源研究所,乌鲁木齐 830091)
0 引 言
【研究意义】甜瓜(CucumismeloL.)是世界十大水果之一,是中国、美国、西班牙、日本、法国、印度、韩国、中亚等多个国家和地区的重要经济作物[1]。老汉瓜是新疆甜瓜著名的地方品种之一,其叶片呈椭圆形。叶片作为植物进行光合作用的重要场所,能高效地将太阳能转变为生物能,为人类生存提供氧气、食物、纤维、生物质能源等[2]。叶片面积大小和叶片形状均会对植物产量和品质造成一定影响[3-6],因此关于叶片发育分子机理的研究自然成为国内外科学家关注的焦点之一[7-9]。研究前期以甜瓜掌状裂叶自然突变体bm7为主要材料,将甜瓜掌状裂叶候选基因pll定位到只有一个候选基因的范围内[10],并发现甜瓜叶片性状受一对等位基因控制。为了进一步研究甜瓜掌状裂叶形成的分子机理,实验以老汉瓜为研究材料,该品种甜瓜叶形为全缘叶,与甜瓜掌状裂叶性状为等位性状,将控制甜瓜全缘叶性状的基因命名为PLL。实验利用CRISPR/Cas9基因编辑技术对PLL基因进行敲除,利用该技术可为甜瓜掌状裂叶候选基因的功能验证奠定基础,同时为甜瓜叶片形态分子建成的机制的揭示提供参考,在国内外学术界也将具有重要的理论意义和学术价值。【前人研究进展】CRISPR/Cas是广泛存在于古生菌以及细菌的基因组中的保守序列,属于生物自身免疫系统,可对外来入侵的病毒或者质粒起降解作用[11]。当有外源DNA侵染细菌时,细菌体内自身的防御系统开始调控Crispr转录成为不成熟的crRNA,也就是前体RNA ,然后在Cas蛋白和核酸酶的作用下对前体RNA进行剪切和加工,使其形成含有spacer序列的crRNA,成熟的crRNA与tracrRNA形成复合物,此复合物引导Cas蛋白与crRNA配对的序列靶位点结合,对双链DNA进行剪切,从而造成基因的突变,达到编辑效果[11]。CRISPR/Cas9基因编辑技术自2012年问世以来,显示了强大的优势以及广阔的应用前景[12-14]。在动物方面,马小娅等[12]利用CRISPR/Cas9对水牛的基因进行敲除,唐雨婷等[13]利用CRISPR/Cas9敲除了猪的β4GalNT2基因。在植物方面,Feng Z Y等[14]利用CRISPR/Cas9技术敲除了拟南芥几个在功能缺失时有明显的生长表型的内源基因如GA应答基因(GIBBERELLICACIDINSENSITIVE,GAI),当GA基因被敲除以后,拟南芥植株表现出矮小的表型。除了模式植物拟南芥,禹明森等[15]成功建立生菜CRISPR/Cas9敲除体系,唐雨薇等[16]构建了茶树咖啡碱合成酶CRISPR/Cas9敲除载体。在葫芦科作物中,国外科学家利用CRISPR/Cas9敲除了番茄的RIN基因[17],该基因是一个转录因子,在果实成熟方面起着重要的作用,最终得到了51株突变体,这些突变体产生了不完全成熟的果实。与野生型比较,其红色素沉淀也明显降低。通过对三个独立靶点产生的突变是否可以在T1后代中稳定遗传的研究发现,该突变体系产生的编辑效果可以稳定遗传给后代。因此,可以选择利用CRISPR/Cas9对甜瓜全缘叶基因进行敲除,从而研究甜瓜裂叶基因的功能。目前在甜瓜中尚未有编辑成功的例子。实验所使用的表达载体带有潮霉素抗性基因,因此,需要对甜瓜耐受潮霉素的最大浓度进行检测,为下一步的实验打下基础。在植物的遗传转化中,抗潮霉素基因是最常用的标记基因之一,由于HPT基因(潮霉素磷酸转移酶基因)片段较小,约只有1.1 kb左右,其很容易与没有选择标记的目的片段结合并导入植物基因组[18]。其毒性机理是通过干扰植物细胞叶绿体和线粒体中的核糖体与延长因子EF-2的结合,从而对肽链的延长进行抑制。当潮霉素抗性基因转化到植株中时,它使转化后的细胞或组织具有对潮霉素的抗性,而非转化细胞和组织则不具备此抗性从而逐渐褐化、死亡,据此可初步筛选出转化的细胞或组织。但因潮霉素是高毒性的物质,对外植体的毒害作用较大,因此,需要研究其对外植体分化的影响来确定其使用浓度,这对下一步的遗传转化意义重大。【本研究切入点】Crispr/cas在植物领域的广泛应用,使实验有了基础保障。因此,通过构建甜瓜全缘叶基因PLL的CRISPR/Cas敲除载体来研究裂叶基因的功能。前期高兴旺等[10]将甜瓜裂叶基因pll定位与甜瓜三号染色体上,并证明甜瓜裂叶性状受隐性单基因控制。目前,尚未对甜瓜裂叶基因pll进行功能验证,也未对其等位基因——甜瓜全缘叶基因PLL进行功能验证。实验的成功开展可为甜瓜裂叶性状分子机制的揭示奠定基础。【拟解决的关键问题】构建新疆甜瓜CRISPR/Cas9基因编辑载体,并转化到大肠杆菌中,检测甜瓜对潮霉素的最大耐受浓度,为揭示甜瓜裂叶性状的分子机制奠定基础。
1 材料与方法
1.1 材 料
以新疆著名的甜瓜地方品种老汉瓜为实验材料,实验材料种植于新疆昌吉市试验田。载体为植物敲除载体pP1C4。
1.2 方 法
1.2.1甜瓜全缘叶基因PLL敲除载体的构建
1.2.1.1sgRNA靶位点引物设计
根据甜瓜基因组全序列,查找全缘叶基因MELO10784,根据其外显子序列,设计敲除引物(引物设计网址为http://cbi.hzau.edu.cn/cgi-bin/CRISPR),设计一对20 bp左右的oligo DNA片段作为靶位点,根据靶位点设计其正反向引物,引物由北京华大基因合成,纯化级别为PAGE。表1
1.2.1.2sgRNA 表达盒构建
使用高保真的DNA聚合酶,以pP1C4载体为模板,利用特异性引物,通过PCR扩增获得其对应的sgRNA表达盒。
1.2.1.3线性化敲除载体制备
利用限制性内切酶EcoRI、XbaI 对pP1C.4 载体进行双酶切,酶切后的产物进行凝胶电泳,然后切胶回收目的片段,回收片段约14 kb,回收产物OD260/OD280在1.8~2.0。
1.2.1.4重组载体的构建及转化
将扩增后的PCR产物进行切胶回收,利用限制性内切酶XbaⅠ、EcoRⅠ对载体及PCR产物进行双酶切,切胶回收目的条带。然后利用重组酶将载体与目的片段进行连接构建重组载体。采用热激法将重组载体转化至大肠杆菌。
1.2.1.5阳性菌落鉴定及测序
以构建好的载体为模板,U6p.4-F及载体下游通用引物gRNA-R作为检测引物,进行PCR检测,回收目的片段(pP1C.4 载体回收片段大小为400 bp左右),再利用U6p.4-F作为测序引物,检验载体是否连接成功。
1.2.2潮霉素耐受性筛选
因载体所携带的抗性基因为潮霉素抗性基因,因此,需要对甜瓜耐受潮霉素的最大浓度进行检测。首先对甜瓜种子进行表面消毒,先利用70%的乙醇消毒30 s,然后用2%的次氯酸钠消毒7 min,将表面消毒的种子放置在MS固体培养基上萌发。萌发4 d后将叶片切下,将叶片左右两边切去,再将叶片分为8份,以不加潮霉素的培养基作为对照组,再设计5个浓度梯度,每个培养皿放40个叶片,培养20 d后统计愈伤组织生长情况,以及出芽情况,每组设3个重复。
2 结果与分析
2.1 全缘叶基因PLL敲除载体的构建
2.1.1sgRNA靶位点引物设计
根据CRISPR/Cas9在线设计工具,参考软件自带评分参数,选择GC含量高达60%且特异性较高的位点用与sgRNA载体的构建,靶位点序列信息为GAAGTCCATGAATGATAATGAGG。研究所用引物均由软件Primer Primer5.0设计,具体引物序列信息见表1。
表1引物序列信息
Table1Primer sequencing information

引物名称Primername引物序列(5’-3')Primersequence用途FunctionU6p.4-FCATTCGGAGTTTTTGTATCTTGTTTCATAGTTTGTCCCAGGATTAGAATGATTAGGC扩增sgRNA,测序验证FW-RGCTATTTCTAGCTCTAAAACCATTATCATTCATGGACTTCAATCACTACTTCGACTCT扩增sgRNAgRNA-RAGCACCGACTCGGTGCCAC阳性菌落验证
2.1.2sgRNA表达盒的获取
以pP1C.4载体为模板,通过特异性引物U6p.4-F,FW-R成功扩增到目的片段。图1(1),图1(2)是全缘叶基因gRNA的PCR产物,以DL3000 DNA Marker为参照,成功克隆出了300 bp左右目的片段。扩增产物经琼脂糖凝胶电泳及切胶回收,经测序验证,成功获得sgRNA表达盒。图1
2.1.3线性化载体的制备
利用限制性内切酶XbaⅠ和EcoRⅠ对载体进行双酶切,电泳后显示条带大小与预期一致,说明载体被成功酶切。回收酶切片段,将回收条带低温保存备用。(OD260/OD280的值为2.0)。图2
2.1.4阳性菌落PCR检测
将重组载体利用重组酶连接后,转化大肠杆菌感受态细胞并进行鉴定,在含有50 mg/L卡那霉素的LB固体培养基上长出的大肠杆菌单菌落随机挑取6个进行PCR检测,结果得到约400 bp左右的片段,目的条带明亮单一且符合预期,再将PCR产物进行测序,证明成功将载体转化到大肠杆菌中。图3

注:1~2:sgRNA框;M:DL3000 DNA Marker
Note: 1-2;sgRNA frame M:DL3000 DNA Marker
图1sgRNA表达盒的扩增
Fig.1Amplification of sgRNA

注:1~2:XbaⅠ,EcoR Ⅰ双酶切后的载体片段;M:DL10K DNA Marker
Note: 1-2;XbaⅠ、EcoRⅠ Enzyme cut vector fragment; M:DL10K DNA Marker
图2 双酶切的载体片段
Fig.2 Enzyme cut vector fragment
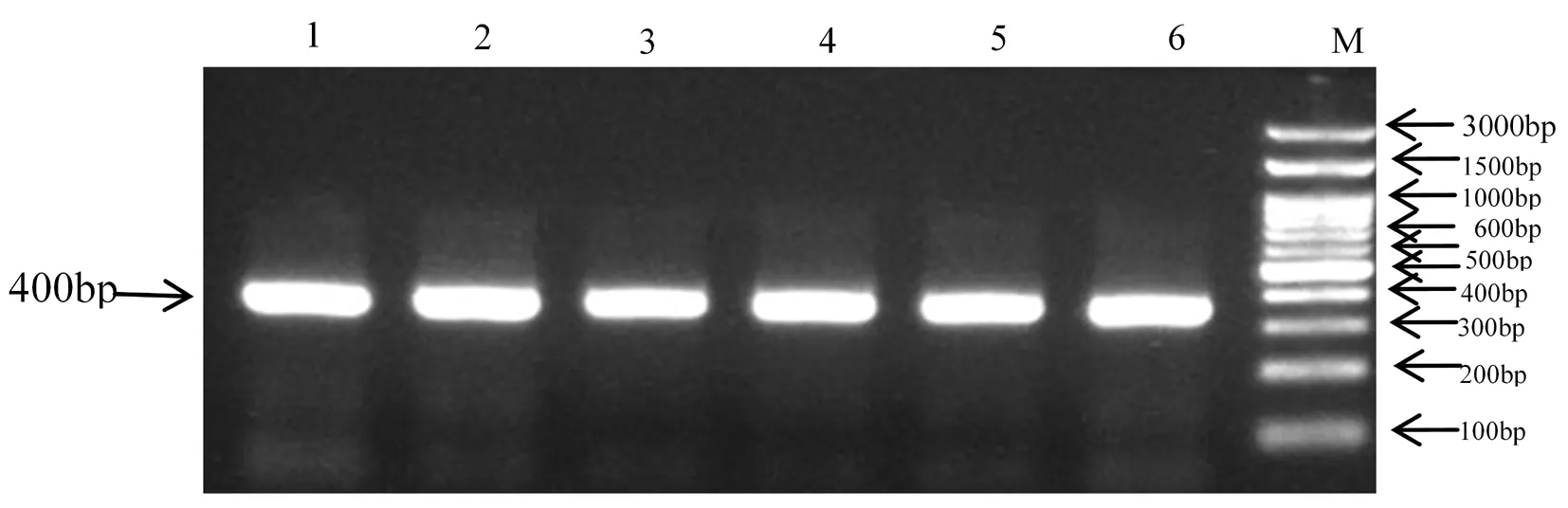
注:1~6:阳性大肠杆菌;M:DL3000 DNA Marker
Note: 1-6:recombinant plasmid;M:DL3000 DNA Marker
图3重组质粒PCR鉴定
Fig.3PCR of recombinant plasmid
2.1.5阳性菌落测序鉴定
华大基因测序结果显示,重组质粒成功插入了靶位点序列,含有靶位点的sgRNA片段与载体片段完全一致,证明成功构建了甜瓜PLL基因敲除载体。图4

图4阳性菌落测序结果
Fig.4Sequencing results of positive colonies
2.2 潮霉素耐受性筛选
研究表明,当不加潮霉素时,愈伤组织均可长出,其生长率为100%。加入5 mg/L的潮霉素时虽然有41%的叶片长出了愈伤组织,但没有发育成正常的单芽或者丛生芽。加入潮霉素浓度为10、15、20 mg/L的培养基中的叶片均没有长出愈伤组织,且组织块逐渐褐化,最终死亡。该结果说明甜瓜愈伤组织对潮霉素最大的耐受浓度为10 mg/L。表2
表2甜瓜对不同浓度潮霉素的耐受性检测
Table2Tolerance detection of different concentrations of melon to Hygromycin

潮霉素浓度 Hygromycinconcentration(mg/L)05101520叶片总数Totalnumberofleaves(个)404040404040404040404040404040愈伤组织个数Numberofcallus(个)402200040130004014000
3 讨 论
很多物种利用基因编辑技术进行了性状改良,基因编辑的方法主要有巨核酶技术、锌指合酶技术、转录激活因子样效应因子核酸酶技术和CRISPR相关的核酸酶技术[19]。这些技术均被应用到多种基因工程相关的实验中。但他们也有各自的缺点,相比于CRISPR相关的核酸酶技术,其余的基因编辑技术操作流程复杂,需要对相应的酶进行改造才能识别靶位点序列从而产生编辑效应。而利用CRISPR载体不需要那么繁琐的改造,只需要构建特异的sgRNA与Cas蛋白结合就可以对基因进行编辑,极大简化了基因编辑的过程,相比较其他的方法在基因编辑方面具有更大的潜力。关于CRISPR/Cas9产生的突变效率问题一直是科学界关注的焦点之一,CRISPR/Cas9编辑效率受很多因素的影响,因此,可以从多方面去提高编辑效率。杨秀荣[20]利用BbsⅠ单酶对载体进行酶切并进行载体构建。在该实验中,利用限制性内切酶XbaⅠ、EcoRⅠ对载体及PCR产物进行双酶切,然后利用重组酶将酶切后的载体与PCR产物进行连接,从而构成一个完整的载体。杨学飞等[21]通过对利用单个酶切位点与两个酶切位点的选择时发现,利用BbSⅠ单酶切位点克隆到载体中,会使假阳性的概率升高,连接效率变低,通过改造将BbSⅠ酶切位点替换成AfeⅠ和XbaⅠ的酶切位点后,连接效率大幅度提高,出现假阳性的概率很小。因此,选用XbaⅠ、EcoRⅠ两个酶切位点进行载体的构建,从而降低假阳性的概率,提高连接和编辑效率。另一方面可以通过串联多个sgRNA来提高编辑效率。刘丁源等[22]通过串联多个sgRNA敲除拟南芥IAA2基因,结果表明,通过串联多个sgRNA可以产生碱基插入突变以及大片段缺失突变等多种可遗传突变。与单个 sgRNA相比,串联多重sgRNA的基因敲除效率高、种系突变多。因此,在以后的工作中可以采取串联多个sgRNA来提高编辑效率。
潮霉素在很多基因工程的实验中作为筛选剂,王哲等[18]研究烟草 K326叶片直接诱导分化再生苗的潮霉素筛选浓度为5~20 mg/ L。王节之等[23]还研究了谷子对潮霉素的最大耐受浓度,发现愈伤组织从5 mg/L开始变黄,临界抗性浓度不超过10 mg/L,同样利用潮霉素作为筛选剂,检测甜瓜对潮霉素最大耐受浓度,确定阳性植株的筛选浓度。通过检测发现甜瓜对潮霉素的耐受浓度为10 mg/L。在潮霉素浓度为5 mg/L的时候,约有40%的叶片不会分化出愈伤组织,在潮霉素浓度达到10 mg/L的时候,所有的叶片均出现褐化,并逐渐死亡,这与颜雪等[24]的结果一致,颜雪等对伽师瓜耐受潮霉素的浓度进行检测时,发现伽师瓜耐受潮霉素的最大浓度也为10 mg/L,因此,可以初步判定甜瓜一般可耐受潮霉素的最大浓度为10 mg/L。因此,在阳性植株检测时,添加10 mg/L的潮霉素可初步筛选出阳性植株。
甜瓜在田间叶片形状一般为椭圆形,但在田间发现裂叶突变体,其叶片与普通甜瓜种质资源全缘叶不同,表现为掌状裂叶的形态。利用SSR分子标记技术,通过图位克隆策略已将pll基因定位到甜瓜基因组三号染色体上,通过进一步的研究发现裂叶基因与全缘叶基因共同控制叶片的形状,高兴旺等对其进行了简单的分析,但未对基因进行克隆,更未对其进行功能验证。因此该研究利用CRISPR/Cas9构建全缘叶基因的敲除载体,下一步利用冻融法将载体转化到农杆菌中,为进一步的遗传转化奠定基础。
4 结 论
结合甜瓜基因组序列数据构建甜瓜全缘叶基因PLL的CRISPR/Cas9敲除载体,经电泳及测序检测,构建了甜瓜全缘叶基因PLL的CRISPR/Cas9敲除载体,并确定了甜瓜对潮霉素的最大耐受浓度为10 mg/L。现已将载体通过冻融法转化到农杆菌中,经菌落PCR检测,已获得阳性农杆菌菌落,下一步进行甜瓜愈伤组织的转化以期得到阳性植株,为揭示裂叶基因的功能打下坚实的基础。
参考文献(References)
[1] Barzegar, T., Badeck, F. W., Delshad, M., Kashi, A. K., Berveiller, D., & Ghashghaie, J. (2013). 13 c-labelling of leaf photoassimilates to study the source-sink relationship in two Iranian melon cultivars.ScientiaHorticulturae, 151(4): 157-164.
[2] Edgerton, M. D. (2009). Increasing crop productivity to meet global needs for feed, food, and fuel.PlantPhysiology, 149(1): 7-13.
[3] 张淑娟,闫芳芳,鱼昭君, 等. 白菜叶形发育相关基因BrLOM2的克隆与表达分析[J]. 园艺学报,2016,43(10):2 029-2 038.
ZHANG Shu-juan,YAN Fang-fang,YU Zhao-jun,et al. (2016). Cloning and Expression Analysis of BrLOM2,a Gene Involved in Lobed Leaf Development in Pakchoi [J].ActaHorticulturaeSinica, 43(10):2,029-2,038. (in Chinese)
[4]谭忠奇,林益明,向平, 等. 5种榕属植物不同发育阶段叶片的热值与灰分含量动态[J]. 浙江林学院学报,2003,(3):40-43.
TAN Zhong-qi, LIN Yi-ming, XIANG Ping, et al. (2003). Caloric value and ash content in the leaves at the different development stages of five Ficus species [J].JournalofZhejiangForestryCollege, (3):40-43. (in Chinese)
[5]孙岚,马德伟. 甜瓜叶面积测量方法的研究[J].中国蔬菜,1985,(1):33-35.
SUN Lan, MA De-wei. (1985). Study on the method of measuring the leaf area of Muskmelon [J].ChineseVegetables, (1):33-35. (in Chinese)
[6]赵春燕,赵春晓,方子森,等. 马铃薯叶面积速测方法的研讨[J]. 湖南农业科学,2010,(13):49-51.
ZHAO Chun-yan, ZHAO Chun-xiao, FANG Zi-sen, et al. (2010). Rapid Determination Method for Leaf Area of Potato [J].HunanAgriculturalSciences, (13):49-51. (in Chinese)
[7] Tsukaya, H. (2013). Leaf development.ArabidopsisBook, 11, e0163.
[8] Gonzalez, N., Pauwels, L., Baekelandt, A., De, M. L., Van, L. J., & Besbrugge, N., et al. (2015). A repressor protein complex regulates leaf growth in arabidopsis.PlantCell, 27(8): 2,273-2,287.
[9] Avramova, V., Sprangers, K., & Beemster, G. T. S. (2015). The maize leaf: another perspective on growth regulation.TrendsinPlantScience,20(12): 787-797.
[10] 高兴旺,王贤磊,宁雪飞, 等. 甜瓜掌状裂叶基因pll的精细定位[J]. 北方园艺,2015,(6):98-102.
GAO Xing-wang, WANG Xian-Lei, NING Xue-Fei, et al. (2015). Fine Mapping of Palmatly Lobed Leaf GenePLLin Melon [J].NorthernHorticulture,(6):98-102. (in Chinese)
[11] Wiedenheft, B., Sternberg, S. H., & Doudna, J. A. (2012). Rna-guided genetic silencing systems in bacteria and archaea.Nature, 482(7385): 331-338.
[12]马小娅. CRISPR/Cas9介导的水牛多位点基因打靶载体的构建[C]//. 广东省遗传学会.广东省遗传学会第九届代表大会暨学术研讨会论文及摘要汇编.广东省遗传学会,2014:1.
MA Xiao-ya. (2014). Construction of CRISPR / Cas9 mediated multipoint gene targeting vector for buffalo [C]//.AcompilationofPapersandAbstractsoftheNinthCongressandSymposiumoftheGuangdongGeneticSociety. Guangdong Genetic Society. (in Chinese)
[13]唐雨婷,高景波,龙川, 等. CRISPR/Cas9介导的β4GalNT2基因敲除猪制备[J]. 农业生物技术学报,2017,25(10):1 697-1 705.
TANG Yu-ting, GAO Jing-bo, LONG Chuan, et al. (2017). Generation of β4GalNT2 Gene Knockout Pigs (Sus scrofa) via CRISPR/Cas9 [J].JournalofAgriculturalBiotechnology, 25(10): 1,697-1,705. (in Chinese)
[14] Feng, Z., Zhang, B., Ding, W., Liu, X., Yang, D. L., & Wei, P., et al. (2013). Efficient genome editing in plants using a crispr/cas system.CellResearch, 23(10): 1,229-1,232.
[15] 禹明森,李翔,高马也,等. 生菜CRISPR/Cas9基因编辑体系的建立[J]. 植物生理学报,2017,53(4):736-746.
YU Ming-sen, LI Xiang, GAO Ma-ye, et al. (2017). Establishment of CRISPR/Cas9-meidiated genome editing system in lettuce (LactucasativaL.) [J].PlantPhysiologyJournal, 53(4): 736-746. (in Chinese)
[16]唐雨薇,刘丽萍,王若娴, 等. 茶树咖啡碱合成酶CRISPR/Cas9基因组编辑载体的构建[J]. 茶叶科学,2016,36(4):414-426.
TANG Yu-wei, LIU Li-ping, WANG Ruo-xian, et al. (2016). Development of a CRISPR/Cas9 Constructed for Genome Editing of Caffeine Synthase in Camellia sinensis [J].JournalofTeaScience, 36(4):414-426. (in Chinese)
[17] Ito, Y., Nishizawayokoi, A., Endo, M., Mikami, M., & Toki, S. (2015). Crispr/cas9-mediated mutagenesis of the rin locus that regulates tomato fruit ripening.Biochemical&BiophysicalResearchCommunications,467(1): 76-82.
[18]王哲, 孙敬克, 王世翔,等. 烟草潮霉素抗性浓度的筛选与研究[J]. 河南城建学院学报, 2009, 18(4):65-67.
WANG Zhe, SUN Jing-ke,WANG Shi-xiang, et al. (2009). Hygromycin resistance to the concentration of tobacco selection and research [J].JournalofHenanUniversityofUrbanConstruction, 18(4):65-67. (in Chinese)
[19] Gaj, T., Gersbach, C. A., & Barbas, R. C. (2013). ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering.TrendsinBiotechnology, 31(7): 397-405.
[20]杨秀荣,邓继贤,赵德彪,等. 鸡DMRT1基因CRISPR/Cas9载体构建及打靶效率的检测[J]. 中国家禽,2017,39(2):6-9.
YANG Xiu-rong, DENG Ji-xian, ZHAO De-biao, et al. (2017). Construction and Testing of DMRT1 CRISPR/Cas9 Plasmid in Chicken [J].ChinaPoultry, 39(2):6-9. (in Chinese)
[21]杨学飞,刘亚娟,高原,等. CRISPR/Cas9系统在本氏烟草基因敲除中的应用[J]. 分子植物育种,2017,15(1):30-38.
YANG Xue-fei, Liu Ya-juan, GAO Yuan, et al. (2017). The Application of CRISPR/Cas9 System in Gene Knock-out of Nicotiana benthamiana [J].MolecularPlantBreeding, 15(1): 30-38. (in Chinese)
[22]刘丁源,邱婷,丁晓辉, 等. 快速构建多重sgRNA载体利用CRISPR/Cas9技术敲除拟南芥IAA2基因[J]. 遗传,2016,38(8):756-764.
LIU Ding-yuan, QIU Ting, DING Xiao-hui, et al. (2016). Rapid construction of multiple sgRNA vectors and knockout of the Arabidopsis IAA2 gene using the CRISPR/Cas9 genomic editing technology [J].Hereditas(Beijing) , 38(8): 756 -764. (in Chinese)
[23]王节之,郝晓芬,郑向阳,等.谷子潮霉素抗性浓度的筛选与研究[J].华北农学报,1999,14(4):60-62.
WANG Jie-zhi, HAO Xiao-fen, ZHENG Xiang-yang, et al. (1999). Selection of Millet Resistance Concentration of Hygromycin [J].ActaAgriculturaeBoreali-Sinica, 14(4):60-62. (in Chinese)
[24]颜雪,赵惠新,王贤磊, 等. 甜瓜抗枯萎病基因表达载体的构建及其转化[J]. 生物技术,2008,(3):9-11.
YAN Xue, ZHAO Hui-xin, WANG Xian-lei, et al. (2008). Construction of Expression Vector with R -Fom -2 Gene and Its Genetic Transformation in Melon [J].Biotechnology, (3).9-11. (in Chinese)
