犬源大肠杆菌质粒介导的喹诺酮类药物耐药基因的检测及药物敏感性分析
2018-04-16田亚凯
田亚凯
(河南农业大学 牧医工程学院,河南 郑州 450046)
犬源大肠杆菌可以引起犬急性肠道炎,这是一种以发生败血症、腹泻为临床特征的急性传染病[1]。随着抗菌药物在犬上的广泛应用,以及抗菌药物的不合理使用、细菌耐药性的水平转移和垂直传播,犬大肠杆菌的多重耐药和交叉耐药现象也越来越普遍,造成了抗菌药物效果的不理想。喹诺酮类药物属于化学合成广谱抗菌药物,其作用机制主要是通过抑制细菌DNA的复制来杀灭细菌[2]。从第1种喹诺酮类药物——萘啶酸(nalidixic acid)[3]被发现至今,已经有4代喹诺酮类药物在临床上得到了应用。近年来,喹诺酮类药物在兽医临床上的使用非常普遍,细菌对喹诺酮类药物的耐药率也越来越高。1998年,qnr基因在肺炎克雷伯菌的质粒上被首次发现,这是第一个被发现由质粒介导的喹诺酮耐药基因(Plasmid-Mediated Quinolone Resistance Genes, PMQR),它可以降低受体菌对氟喹诺酮类药物的敏感性。由于新的变体被发现,qnr被重新命名为qnrA[4]。随后qnrB、qnrS、qnrC和qnrD一系列由质粒介导的喹诺酮耐药性基因被相继发现。qnr系列基因发挥耐药作用的机制是:通过表达Qnr蛋白,这些蛋白与药物的靶点结合,从而防止喹诺酮药物破坏细菌的DNA解旋酶。而oqxA和oqxB基因是通过介导细菌的外排作用而发挥耐药性[5]。
目前,国内外关于食品动物源大肠杆菌对喹诺酮类药物耐药性的研究较多[6-7],但犬源大肠杆菌对质粒介导的喹诺酮耐药基因oqxA、oqxB、qnrA、qnrB、qnrC、qnrD、qnrS的研究却很少有报道,因此本试验对犬源大肠杆菌进行了PMQR基因检测及药物敏感性分析,旨在为临床治疗犬大肠杆菌感染提供重要依据和参考,也为深入研究喹诺酮耐药基因的传播提供基础资料。
1 材料与方法
1.1 材料
1.1.1菌株102株犬源大肠杆菌于2012~2014年分离自河南宠物交易市场和河南农业大学动物医院。采用直肠拭子的方法采集样品,然后无菌接种于LB肉汤,在麦康凯培养基上纯化培养,培养之后进行革兰氏染色和镜检。疑似株经VITEK-32全自动细菌鉴定系统鉴定,确认为大肠杆菌。大肠埃希菌ATCC25922和PCR阳性对照菌株皆由河南农业大学吴华博士提供。
1.1.2试验药品所用6种抗菌药物均为国产原料药,其中:喹乙醇(OLA),含量≥96%;痢菌净(MEQ),含量≥96%;氟苯尼考(FFC),含量≥98%;盐酸环丙沙星(CIP),含量≥96%;氧氟沙星(OFL),含量≥95%;恩诺沙星(ENR),含量≥98%。用电子天平精密称取各适量药物,其中OLA用无菌去离子水配制成终浓度为2560 μg/mL的原液,MEQ、FFC、CIP、OFL、ENR用无菌去离子水配制成终浓度为5120 μg/mL的母液;将配制好的原液或母液用水系针式过滤器过滤除菌,置于4 ℃冰箱中保存备用,各贮存原液或母液在7 d内用完。氟苯尼考用40%二甲基甲酰胺和60%乙醇助溶。
1.1.3试剂和仪器设备LB肉汤、MHB营养肉汤、麦康凯琼脂均购自北京陆桥科技有限公司;2×TaqMaster Mix酶和DM2000 Maker均购自北京康为世纪生物有限公司;琼脂糖购自上海生工生物工程有限公司; VITEK-32型全自动微生物鉴定系统购自梅里埃公司; DYY-8C型电泳仪购自北京市六一仪器厂; PCR仪购自杭州晶格科技有限公司;凝胶成像分析系统购自DINCO公司。
1.2 方法
1.2.1PCR模板的制备 挑纯培养菌落,置入5 mL玻璃试管内,95 ℃水浴10 min,离心(17000×g)30 s。上清液即为基因检测的模板液,然后置于冰箱-20 ℃保存备用。
1.2.2引物的设计和PCR扩增参照表1中参考文献[8-14]中的引物序列,由上海生工生物工程有限公司合成qnrA、qnrB、qnrC、qnrD、qnrS、oqxA、oqxB、qepA基因的通用引物(见表1)。PCR体系为25 μL: Mix酶12.5 μL,上、下游引物各0.5 μL, DNA模板1.0 μL, ddH2O 10.7 μL。反应条件:94 ℃变性50 s,根据不同引物条件选择不同的退火温度,退火45 s,72 ℃延伸60 s,32个循环;72 ℃延伸10 min。对PCR产物用1%琼脂糖凝胶电泳跑胶,然后用琼脂糖凝胶电泳进行成像系统摄像。产物送至上海生工生物工程有限公司进行测序,进行Blast比对,确定阳性。
1.2.3药物MIC值的测定6种试验药物经微量肉汤法测定,耐药标准参考CLSI标准,采用美国实验室临床和实验室标准协会批准的MIC值测定方法进行测定。使用质控菌株ATCC 25922进行全程质控,并设阴、阳性对照,做两次平行试验。

表1 PCR所用引物序列
2 结果与分析
2.1 药敏试验结果
6种药物对102株犬源大肠杆菌的敏感率、中介率、耐药率见表2。结果(表2)表明:犬源大肠杆菌对3种喹诺酮类药物和氟苯尼考的耐药性都比较严重,尤其是对恩诺沙星的耐药率达到了71.57%,对环丙沙星和氧氟沙星的耐药率也分别达到了64.71%和48.04%,对氟苯尼考的耐药率达到了58.82%;而喹乙醇和痢菌净的抗菌效果比较好,犬源大肠杆菌对这2种药物的耐药率分别只有14.71%和0%。

表2 6种抗菌药物对102株犬源大肠杆菌的药敏试验结果
2.2 PMQR基因的检测情况
PCR检测结果表明:在102株犬源大肠杆菌中,qnrS基因检测结果为阳性的有15株,检出阳性率为14.70%;oqxA基因检测结果为阳性的有10株,检出率为9.80%;oqxB基因检测结果为阳性的有12株,检出率为11.76%;其余基因未被检测出。其中含有两种耐药基因的有9株,检出率为8.82%;含有3种耐药基因的有5株,检出率为4.90%(见表3)。PCR检测结果见图1。
3 讨论
喹诺酮类抗生素在人医临床和兽医临床上曾以抗菌活性强、抗菌谱广以及很少产生交叉耐药性和毒副作用小等特点得到广泛应用。然而随着喹诺酮类药物在临床上的普遍使用,由细菌耐药性引起的抗菌药物治疗效果下降的问题也引起了人们的重视,越来越多的专家学者投入到细菌耐药性的研究中。本次药物敏感性试验发现,犬源大肠杆菌对喹诺酮类药物的耐药性已经很高,其中对恩诺沙星的耐药率达到了70%,对氧氟沙星的耐药率也达到了48%;而且犬源大肠杆菌的多重耐药现象也非常严重,在102株犬源大肠杆菌中,有71株对两种或两种以上的药物耐药,占69.6%。日益严重的多重耐药现象对犬细菌病的治疗带来了极大的威胁,需要通过规范、合理使用药物来控制细菌耐药性的上升。

表3 PMQR基因在犬源大肠杆菌中的分布
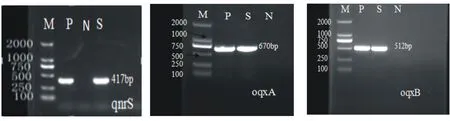
P:阳性对照; S:样品; N:阴性对照。图1 qnrS、oqxA、oqxB基因的检测结果
PMQR基因是质粒介导的耐药基因,可以造成耐药基因在细菌间的水平传播,会加快喹诺酮类药物耐药性在细菌间的传播,造成喹诺酮类药物在临床上抗菌效果的降低。本试验对102株犬源大肠杆菌的PMQR基因进行了检测,结果只有qnrS、oqxA、oqxB这3种基因被检测出。含有qnrS基因的菌株在一定程度上具有对萘啶酸和氟喹诺酮类药物的耐药性[15];含有oqxAB基因的菌株可以通过该基因外排泵的作用增强对氯霉素类抗菌药物、喹诺酮类抗菌药物、消毒剂和甲氧苄啶等的耐药性[13]。本试验qnrS、oqxA、oqxB基因的检出率低于国内报道的食品动物源大肠杆菌的检出率[16-18],这可能与喹诺酮类药物在食品动物上应用更普遍、更频繁有关。在单一耐氟苯尼考的菌株中也发现了oqxA和oqxB耐药基因,这可能导致犬源大肠杆菌通过oqxA和oqxB基因的外排作用对氯霉素类药物产生耐药性。犬源大肠杆菌耐药基因与耐药表型的符合率要低于食品动物上大肠杆菌耐药基因型与耐药表型的符合率,原因可能是犬源大肠杆菌耐药基因的检出率显著低于食品动物源大肠杆菌,但犬源大肠杆菌对药物的耐药率并没有明显低于食品动物源大肠杆菌的耐药率。
本试验中虽然PMQR耐药基因的检出率较低,但是犬源大肠杆菌对喹诺酮类药物的耐药率很高,原因可能是PMQR基因本身只能介导低水平的对喹诺酮类药物的耐药性,但是PMQR基因的流行可以促进编码DNA促旋酶的gyrA和gyrB基因的突变和编码拓扑异构酶 IV的parC和parE基因的突变,从而引起高水平的耐药[19-20]。喹乙醇和痢菌净在犬细菌病上较少使用,但本试验发现有一定的检出率,表明oqxAB基因可能在不同来源菌株中水平传播,从而造成oqxAB基因在犬源大肠杆菌中的流行,提示应加强抗菌药物的合理使用和监管,以减少耐药性的传播和扩散。
参考文献:
[1] 王显峰.犬大肠杆菌病的诊治[J].中国畜牧兽医,2010,37(3):220.
[2 ] Bearden D T, Danziger L H. Mechanism of action of and resistance to quinolones [J]. Pharmacotherapy, 2001, 21(10Pt 21): 224S-232S.
[3 ] Lesher G Y, Froelich E J, Gruett M D, et al. 1,8-naphthyridine derivatives. A new class of chemotherapeutic agents [J]. J Med Pharm Chem, 1962, 91: 1063-1065.
[4] Martinez L, Pascual A, Jacoby G A. Quinolone resistance from a transferable plasmid [J]. Lancet, 1998, 351(9105): 797-799.
[5] Kim H B, Wang M, Park C H, et al.oqxABencoding a multidrug efflux pump in human clinical isolates of Enterobacteriaceae [J]. Antimicrob Agents Chemother, 2009, 53(8): 3582-3584.
[6] 肖方,李新生,张素梅,等.质粒介导的喹诺酮类耐药基因在鸡源大肠杆菌中的流行[J].华北农学报,2010,25(1):222-225.
[7] Liu B T, Liao X P, Yang S S, et al. Detection of mutations in thegyrAandparCgenes inEscherichiacoliisolates carrying plasmid-mediated quinolone resistance genes from diseased food-producing animals [J]. J Med Microbiol, 2012, 61(Pt11): 1591-1599.
[8] Robicsek A, Strahii E J, Sahm D F, et al.qnrprevalence in cehazidime-resistant Enterobacteriaceae isolates from the United States [J]. Antimicrob Agents Chemother, 2006, 50(8): 2872-2874.
[9] Gay K, Robicsek A, Strahilevitz J, et al. Plasmidmediated quinolone resistance in non-typhi serotypes ofSalmonellaenterica[J]. Clin Infect Dis, 2006, 43(3): 297-304.
[10] Guerra B, Helmuth R, Thomas K, et al. Plasmidmediated quinolone resistance determinants inSalmonellaspp. isolates from reptiles in Germany [J]. J Antimicrob Chemother, 2010, 65(9): 2043-2045.
[11] Cavaco L M, Hasman H, Xia S, et al.qnrD, a noveI gene conferring transferable quinolone resistance inSalmonellaentericaserovar kentucky and bovismorbificans strains of human origin [J]. Antimicrob Agents Chemother, 2009, 53(2): 603-608.
[12] Hansen L H, Johannesen E, Burmolle M, et al. Plasmid-encoded multidrug efflux pump conferring resistance to olaquindox inEscherichiacoli[J]. Antimicrob Agents Chemother, 2004, 48(9): 3332-3337.
[13] Hansen L H, Jensen L B, Sorensen H I, et al. Substrate specificity of the OqxAB muhidrug resistance pump inEscherichiacoliand selected enteric bacteria [J]. J Antimicrobial Chemotherapy, 2007, 60(1): 145-147.
[14] 夏利宁.不同来源喹诺酮耐药大肠杆菌耐药基因的流行性调查及其传播机制研究[D].北京:中国农业大学,2010.
[15] Hata M, Suzuki M, Matsumoto M, et al. Cloning of a novel gene for quinolone resistance from a transferable plasmid inShigellaflexneri[J]. Antimicrob Agents Chemother, 2005, 49(2): 801-803.
[16] 苏晶,杨芳芳,孙慧,等.山东省禽源致病性大肠杆菌质粒介导喹诺酮类药物耐药基因的检测[J].山东农业科学,2012,44(9):5-8.
[17] 孔令超,李志国,张瑞华,等.2012~2013年山东省禽源大肠杆菌中质粒介导喹诺酮类药物耐药基因的检测[J].中国动物传染病学报,2014,22(4):56-62.
[18] 夏绪进,程伟华,夏利宁,等.新疆昌吉地区猪源喹诺酮耐药大肠杆菌PMQR因子检测及分析[J].中国农业大学学报,2016,21(4):95-101.
[19] Ode T, Saito R, Kumita W, et al. Analysis of plasmid-mediated multidrug resistance inEscherichiacoliandKlebsiellaoxytocaisolates from clinical specimens in Japan [J]. Int J Antimicrob Agents, 2009, 34(4): 347-350.
[20] Pasom W, Chanawong A, Lulitanond A, et al. Plasmid-mediated quinolone resistance genes,aac(6’)-Ib-cr,qnrS,qnrBandqnrA, in urinary isolates ofEscherichiacoliandKlebsiellapneumoniaeat a teaching hospital, Thailand [J]. Jpn J Infect Dis, 2013, 66(5): 428-432.
