激素和光照对青蒿素合成途径酶基因表达的调控研究
2018-04-12于宗霞
于宗霞
(大连大学 生命科学与技术学院,辽宁 大连 116622)
青蒿素是一种含有内过氧桥的倍半萜内酯,是治疗疟疾的有效成分,需求量极大[1]。目前,通过化学全合成、合成生物学进行青蒿素的体外合成,步骤复杂、成本较高,距离产业化和临床应用还有一定距离。野生青蒿(黄花蒿)仍是青蒿素的唯一来源,但植株中青蒿素含量低,仅占干重的0.1%~0.8%[2]。因此,通过基因工程手段提高植株中青蒿素含量具有重要意义。
青蒿素生物合成途径已经基本清晰:首先,法尼基焦磷酸(FDP)被紫穗槐-4,11-二烯合酶(amorpha-4,11-diene synthase,ADS)催化环化生成紫穗槐-4,11-二烯[3];接着,细胞色素P450单加氧酶CYP71AV1,催化紫穗槐二烯依次形成青蒿醇、青蒿醛,最终得到青蒿酸[4]。一个双键还原酶,DBR2,催化青蒿醛的△11,13位生成二氢青蒿醛[5];青蒿醛、二氢青蒿醛进一步被乙醛脱氢酶(Aldehyde dehydrogenase ALDH)氧化成青蒿酸、二氢青蒿酸。但后续如何生成青蒿素尚无明确报道,推测可能是通过非酶促光氧化反应。该途径大部分的酶定位于青蒿腺毛的两个顶端细胞中,推测青蒿素在这些细胞中起始合成[6]。
相比于青蒿素合成途径解析以及微生物代谢工程改造方面取得的成绩[7,8],青蒿素内源合成调控方面的报道还很少。青蒿素作为植物长期适应环境产生的一种次生代谢产物,其合成首先受到各种环境因子的影响,体外施加各种激素或者光处理,可以模拟植物生存环境的变化,激活体内相应信号途径的转录因子,调控青蒿素的合成。如水杨酸和茉莉酸可以激活下游的AaWRKY和AaERF等转录因子,进而调控青蒿素合成途径关键酶基因ADS和CYP71AV1的表达水平,最终促进青蒿素的合成[9,10],蓝光受体AtCRY1可以响应光信号,从而影响青蒿素合成[11]。植物激素除了响应外界生长环境,还与植物的生长发育密不可分,赤霉素(GA)促进种子萌发,生长和开花,而脱落酸(ABA)则抑制这些生长发育过程[12],植物细胞的全能性和再生能力受到细胞分裂素(CTK)和生长素(auxin)的共同调控[13],茉莉酸(JA)促进雄蕊的正常发育[14],乙烯(ETH)在促进光形态建成和植物的成熟衰老过程中发挥重要作用[15]。
青蒿素需求量大,价格昂贵(USD300~600/kg),但青蒿中青蒿素含量极低。最近的临床研究表明,食用干燥的青蒿叶片比服用单体青蒿素的药效高40倍,健康人群饮用青蒿茶可以预防疟疾[16],暗示青蒿中其他次生代谢产物有增强青蒿素活性和药效的功能。因此通过研究激素和光照对青蒿素合成的影响,在采收之前可以通过添加适当的激素或光照,从而提高青蒿素的产量,具有重要的经济价值和药用价值。
1 材料与方法
1.1 材料:
青蒿(Artemisia annua L.)野生栽培品系QT源自四川省;M-MLV反转录试剂盒(Invitrogen);SYBR® Premix Ex TaqTM.(Perfect Real Time)试剂盒(TaKaRa);脱氧核苷酸引物(Sangon,上海)。
1.2 方法:
1.2.1 植物RNA提取
取0.1 g植物材料于液氮中充分成细粉。移入1.5 mL离心管中,加入0.5 mL Trizol(Invitrogen,Cat.15596-018)混匀,室温放置5 min;加入100 μL三氯甲烷充分混匀后1200 0rpm冷冻离心10 min。取上清,加入等体积异丙醇沉淀RNA。12000 rpm冷冻离心10 min,沉淀用75%酒精洗涤,真空干燥,溶于 20~50 μL H2O (RNase free)。
1.2.2 RNA反转录及定量分析
取1 g植物总RNA为模板依据M-MLV反转录试剂盒(Invitrogen)说明进行反转录。反转录产物稀释10倍后作为定量分析的模板,采用SYBR®Premix Ex TaqTM试剂盒(TaKaRa),使用表1中的引物对不同基因的表达量进行Q-RT PCR检测。反转录产物进行梯度稀释(10-3、10-4、10-5、10-6、10-7、10-8和10-9稀释度)制作标准曲线。以青蒿的AaACTIN(EU531837)作为内标参考,基因(X)表达量以X/Actin2表示。数据分析采用Rotor-Gene(Corbett Research,NSW,Australia)。实验重复三次,取各组数据的平均值和方差,绘制图表。
1.2.3 引物设计
用于Q-RT PCR检测的青蒿素合成途径酶基因ADS(AJ 25171),CYP7(EU684540),DBR2(EU704257)和内参基因AaACTIN的引物序列如表1所示。
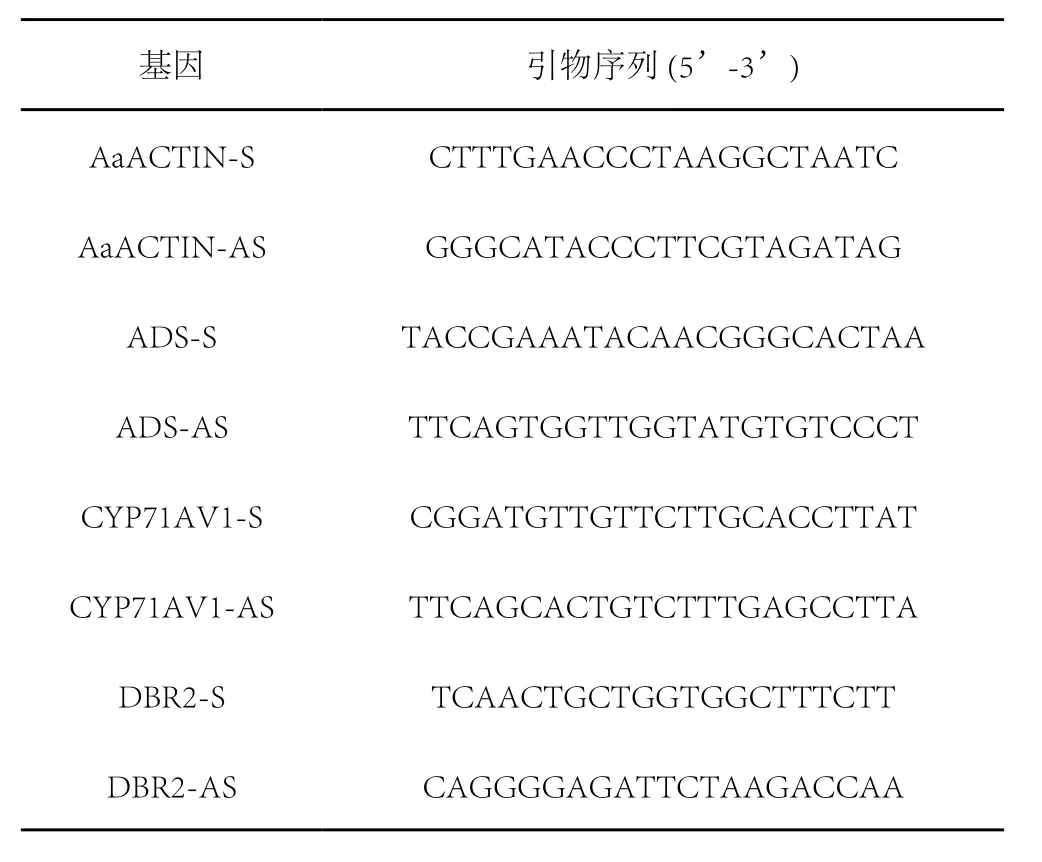
表1 Q-RT PCR使用的基因引物序列
2 结果与分析
2.1 青蒿素合成途径酶基因表达的组织特异性
有报道青蒿素含量在开花之前达到顶峰,暗示青蒿素的合成在花期最为旺盛。选取青蒿的不同组织,如花(F)、嫩叶(NL)、老叶(OL)、茎(S)和根(R),分别在这5组植物样本中检测青蒿素合成途径酶基因的表达水平,ADS、CYP71AV1和DBR2这三个酶基因在花序中均有较高水平的表达(图1),与青蒿素含量在开花之前最高的报道吻合,说明青蒿素的合成具有时空特异性,与青蒿素的生长阶段密切相关,即生殖生长阶段含量丰富。

图1 青蒿素合成途径酶基因的组织表达特异性
2.2 激素对青蒿素合成的影响
青蒿素是青蒿在长期进化过程中适应环境产生的一种次生代谢产物,它的合成会受到外界环境影响。在实验室中通过激素以及不同波长的光照来模拟外界环境的变化,通过该研究,可以在高产转基因青蒿植株采收之前,对植物进行大批量的施加激素或者光照处理,从而达到进一步提高青蒿素含量的目的。
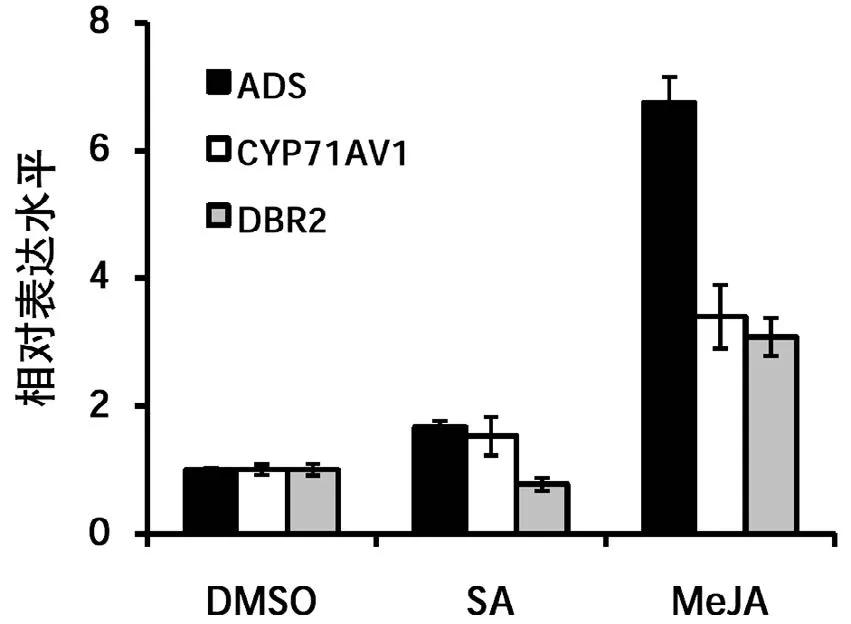
图2 激素SA、MeJA处理后青蒿素合成途径酶基因表达水平
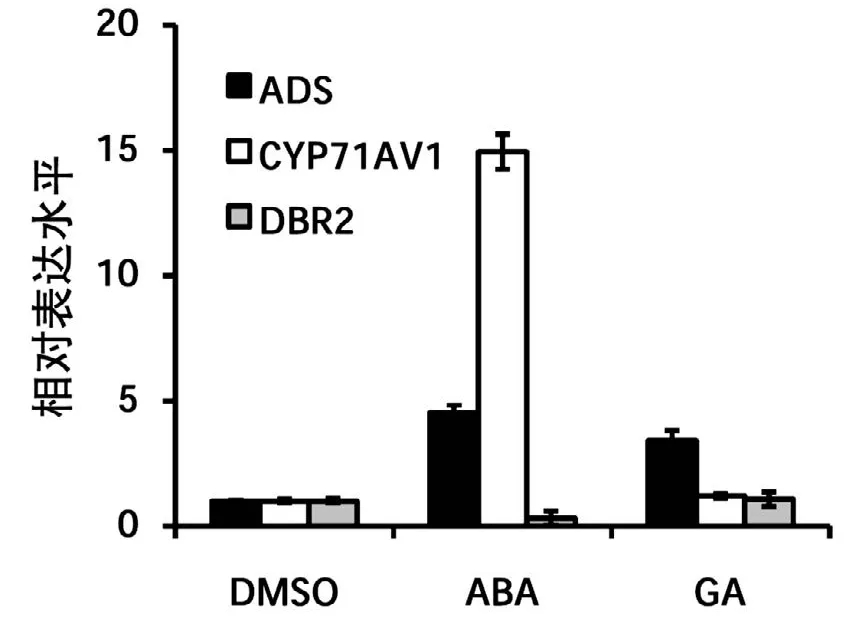
图3 激素ABA、GA处理后青蒿素合成途径酶基因表达水平

图4 不同浓度激素IAA处理后青蒿素合成途径酶基因表达水平。IAA-1到IAA-4依次代表IAA处理浓度为0.03、0.3、3和 30μM。
SA和MeJA处理青蒿后,检测基因表达可见MeJA处理后,ADS、CYP71AV1和DBR2的转录水平均有明显提高,其中ADS的表达水平受MeJA诱导显著,SA处理后,仅ADS和CYP71AV1的转录水平提高,DBR2无明显变化(图2)。后续分别用50M的赤霉素(GA)、脱落酸(ABA)(图3)以及不同浓度的生长素(IAA,低浓度促进生长,高浓度抑制生长)(图4)进行处理,操作方法同SA和MeJA的处理。选取叶片进行实时定量PCR检测,结果表明不同激素对青蒿素合成途径酶基因的表达水平都有一定的影响,其中ABA和特定浓度的生长素的诱导效果要明显一些。
2.3 光照对青蒿素合成的影响
植物次生代谢产物的合成还会受到光照的影响,如光的波长和光强等,在现有实验条件下,分别将长势类似的1个月大的青蒿小苗放在正常光照、暗室和红光下(640±20 nm,15 umol·m-2·s-1)处理8小时后,选取叶片进行基因表达水平检测。结果表明:暗处理抑制青蒿素合成途径酶基因的表达,红光则会诱导其表达(图5)。
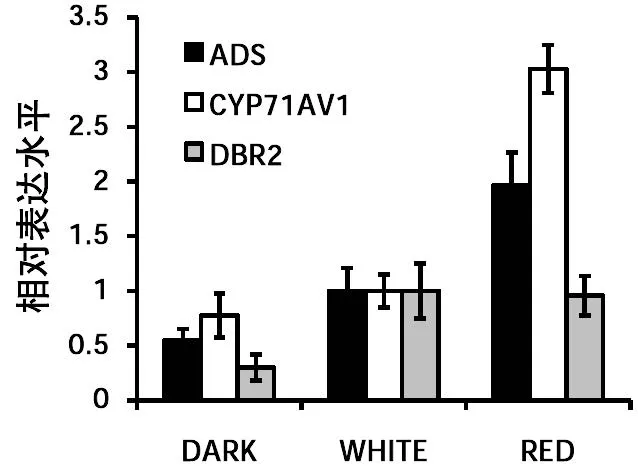
图5 青蒿素合成途径酶基因对光处理的响应
3 讨论
从青蒿素合成途径酶基因的组织表达特异性可见,基因的表达水平在花序中较高,与青蒿素合成在开花之前达到最高的报道吻合,说明青蒿素的合成具有时空特异性,青蒿素的合成与植物生长阶段相关,即在生殖生长时期合成旺盛,暗示青蒿素的合成可能受到年龄因子的调控。
此外,青蒿素作为一种次生代谢产物,其合成还受到环境因子的影响,我们通过施加激素和不同波长的光照来模拟环境的变化,MeJA、ABA、一定浓度的IAA和红光都会提高青蒿素合成途径酶基因的表达水平。激素除了作为环境因子的响应信号途径外,也参与了植物生长发育的整个过程,从这个层面上说,环境和年龄是两个不可分割的因子,共同影响了青蒿素的合成。本研究主要从激素和光照角度阐释环境对青蒿素合成的影响,从而为找出诱导青蒿素合成的方法打下基础,可以于青蒿采收之前施加,达到短期进一步提高青蒿素产量的目的。
