利用微藻规模化生产EPA的最佳条件探讨
2018-04-10王慧岭罗建涛白雪梅张晋阳刘敏胜
王慧岭,罗建涛,白雪梅,滕 杰,张晋阳,刘敏胜
(新奥科技发展有限公司,煤基低碳能源国家重点实验室,河北廊坊 065001)
二十碳五烯酸(EPA)在预防和治疗人类多种疾病(如心血管疾病、癌症和炎症性疾病)方面有显著作用,而且还能起到延缓衰老的生理作用[1]。目前EPA的唯一商业来源是深海鱼油,但存在味道、气味和稳定性等问题。此外,鱼油中大量的其他多不饱和脂肪酸使得EPA的提纯更为复杂,导致纯品的价格很高[2]。
许多海洋微藻都有较高的EPA含量,其中很多微藻是重要的海产经济微藻,Nannochloropsisoceanica易培养,是海产苗种生产中广泛应用的一种饵料微藻[3]。在澳大利亚和以色列等国家,微绿球藻被规模化培养用于生产高纯度的EPA[4]。规模化培养微藻生产EPA受到许多因素的影响,如光照、温度、盐度、酸碱度、营养方式等。笔者探讨了微藻规模化生产EPA的最佳条件,旨在为EPA的规模化生产奠定基础。
1 材料与方法
1.1藻种与培养基试验所用藻种ENN1001A,由新奥科技发展有限公司藻种库提供。实验室内保种和培养均采用消毒水配制的f/2培养基。
1.2试验方法
1.2.1温度对ENN1001A EPA含量的影响。将试验藻株先活化3 d,接入内径5 cm、高50 cm的玻璃管式反应器中,养殖体积800 mL,初始浓度为OD750=2.0,光照强度(100±10)μmol/(m2·s),光暗比16∶8;通入空气与CO2的混合气体,CO2含量为2%,通气量为0.1 L/min;设置10、15、20、23、27、30、33、37、40 ℃共9个温度梯度,分别用冷暖水机控制温度恒定在设定温度,每个温度梯度3个重复,每天08:30停气,补水至原体积,充分混合30 min后,取样,测定干重。培养2 d后,于15、20、30、40 ℃离心、洗涤收集藻泥后冷冻干燥,藻粉用于脂肪酸分析,试验重复3次,结果取3次试验的平均值。由于养殖体系为实验室管式反应器,所以遵循业内室内产量计算方式,以g/(L·d)计。
1.2.2液位对温度的影响。试验藻株来自户外规模化藻种扩培室,接入养殖面积为180 m2开放式跑道池,养殖深度设为15、20、25 cm,搅拌速度以液体流速来控制,藻液平均流速控制在0.4 m/s。自然条件下培养(内蒙古鄂尔多斯市达拉特旗10月),通入CO2气体,控制pH在7.0~8.0,每个液位养殖1个跑道池,养殖浓度为100 g/m2,使用在线系统24 h监测记录各液位下藻液温度及空气温度,连续监测30 d,温度差异以30 d各养殖池平均温度计。
1.2.3EPA的规模化生产。试验藻株来自户外规模化养殖藻种,接入养殖面积为1 200 m2开放式跑道池,养殖深度随季节的变化适时调整,调整原则为不增加外部能耗和不降低生物质产量的前提下,尽可能控制藻液温度在15~25 ℃,养殖浓度控制在1.0~1.5 g/L,搅拌速度以液体流速来控制,藻液平均流速控制在0.4 m/s。自然条件下培养(内蒙古鄂尔多斯市达拉特旗4—10月),通入CO2气体,控制pH在7.0~8.0,温度记录使用在线系统24 h监测记录。每天16:30补水测量干重,根据生物量增长情况采收,并补充等量营养盐,采收藻粉喷雾干燥,每月生产藻粉混合均匀后,取样进行脂肪酸检测,EPA产量由单位面积养殖藻粉量乘以该月藻粉EPA含量计算获得。
2 结果与分析
2.1温度对ENN1001A生长及EPA产量的影响
2.1.1温度对ENN1001A生长的影响。在室内恒定光照强度100 μmol/(m2·s)条件下,5 cm管式反应器通气培养测得温度对ENN1001A生长的影响(图1)。恒定温度下,连续养殖2 d,10~27 ℃内,随着温度的上升,ENN1001A平均产量增加,23~27 ℃下ENN1001A产量基本相当。当温度超过30 ℃,其生长明显受到抑制。当温度为37 ℃时,ENN1001A几乎不生长,40 ℃时细胞死亡。

图1 温度对ENN1001A生长的影响Fig.1 Effects of temperature on the growth of ENN1001A
2.1.2温度对ENN1001A EPA含量的影响。从图2可以看出,随着培养温度的升高,EPA含量逐渐降低。当温度为15 ℃时EPA含量最高(3.7%),当温度为20 ℃时EPA含量略有降低,为3.4%;当温度为30 ℃时EPA含量略有降低,为3.3%;当温度为40 ℃时EPA含量降至1.6%。

图2 温度对ENN1001A EPA含量的影响Fig.2 Effects of temperature on EPA content in ENN1001A
从图3可以看出,当温度为20 ℃时EPA总产量最高,当温度为30 ℃时EPA产量也高于温度15 ℃时,当温度为40 ℃时由于不能正常生长,所以EPA产量为负值。

图3 不同温度条件下ENN1001A EPA产量Fig.3 EPA yield of ENN1001A under different temperature conditions
2.2液位对温度的影响对2013年10月份内蒙古达拉特旗养殖藻液各时间段测得的温度进行计算,养殖液位对藻液温度的影响见图4。从图4可以看出,20:00—次日10:00,随着养殖液位的增加,藻液温度随之增加;在20:00和次日10:00 3个液位梯度的温度一致,而10:00—20:00,随着养殖液位的增加,藻液温度降低,当液位为15与25 cm时最高温度相差3 ℃。

图4 养殖液位对藻液温度的影响Fig.4 Effects of aquaculture liquid level on the temperature of algae fluid
2.3EPA的规模化生产对2016年内蒙古达拉特旗全年养殖季藻液各月24 h温度进行检测,结果如图5所示。从图5可以看出,7月藻液最高温度为32.0 ℃,最低温度为17.3 ℃,平均藻液温度为25.2 ℃,为全年温度最高月份;6和8月温度差别不大,最高温度分别为29.1和30.6 ℃,最低温度分别为14.2和15.5 ℃,平均温度则分别为22.2和23.6 ℃;5和9月藻液温度相对较低,最高温度分别为24.6和23.5 ℃,最低温度分别仅为12.5和8.8 ℃,平均温度分别为19.2和18.7 ℃。
全养殖季各月平均总辐射量如图6所示。从图6可以看出,5—7月平均总辐射量为22 MJ/(m2·d),8月份平均总辐射量为19 MJ/(m2·d),9月份平均总辐射量为17 MJ/(m2·d);全年光照情况较好。

图5 全年养殖中藻液温度Fig.5 Temperature of algae solution in whole year of culture
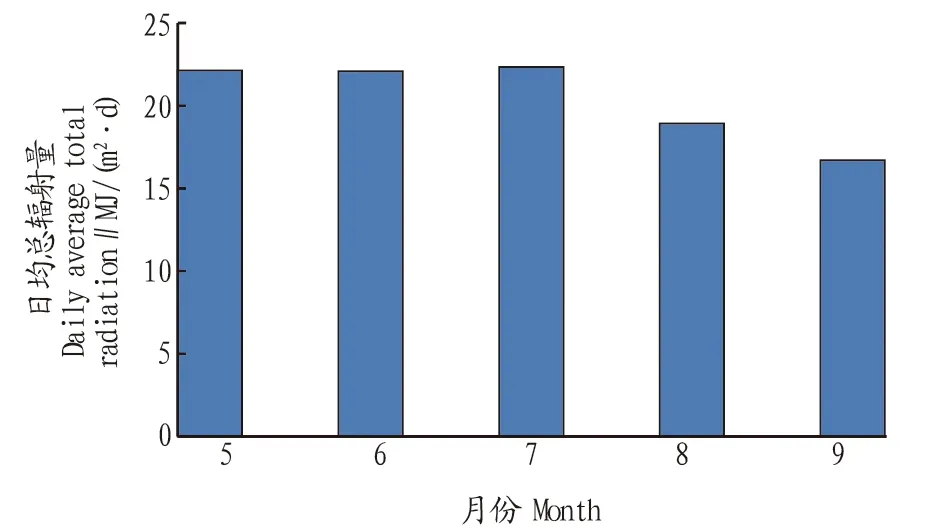
图6 全年各月总辐射量Fig.6 Monthly total radiation in the whole year
对内蒙古达拉特旗规模化养殖全年光照、平均藻液温度及产量关系进行分析,结果如图7所示。从图7可以看出,当温度在17 ℃以下时,产量不会因为光照总能量的增加而提高,生长受温度的影响较大,整体产量较低。当温度为17~27 ℃,产量主要受光照的控制,光照越强,产量越高。
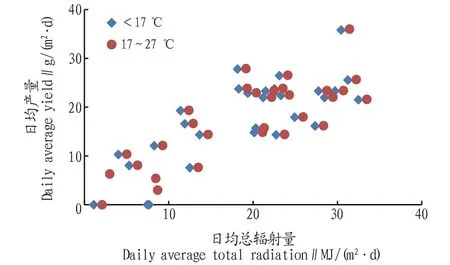
图7 微藻规模化养殖过程中温度、光照与产量的关系Fig.7 Relationship between temperature,light and yield in large scale production of microalgae
规模化生产各月ENN1001A EPA含量见图8。从图8可以看出,在5和9月时EPA含量分别为4.2%和4.6%,6和8月EPA含量均为3.9%,7月EPA含量降至最低(3.2%),全养殖季EPA变化和藻液温度变化一致,整体呈先下降后上升的变化趋势。

图8 不同月份ENN1001A EPA含量的变化 Fig.8 Content of EPA in ENN1001A algae in different months
藻粉中EPA含量和养殖季平均温度关系见图9。从图9可以看出,在整个养殖季中EPA含量与藻液平均温度密切相关,随着藻液温度的升高,EPA含量呈线性下降。

图9 温度与EPA含量的关系Fig.9 The relationship between temperature and EPA content
从图10可以看出,随着培养温度的升高,EPA产量逐渐降低。EPA产量在5和9月分别为738和786 mg/(m2·d),6和8月EPA产量分别为663和646 mg/(m2·d),7月份EPA产量最低[495 mg/(m2·d)],全年平均产量为666 mg/(m2·d),全养殖季EPA变化和藻液温度变化一致,整体上呈先下降后上升的变化趋势。

图10 养殖季各月份EPA日均产量的比较Fig.10 The comparison of EPA average daily yield in different months in the breeding season
3 讨论与结论
3.1温度对EPA生产的影响温度是决定植物代谢过程速率的主要环境因子之一[5]。 微藻能够适应的温度范围较宽,但不同温度对微藻生长和脂肪酸含量的影响较大。微藻细胞中多不饱和脂肪酸的积累与温度呈负相关,并受光照的诱导,这2个因素在诱导特异的脂肪酸去饱和酶的表达和脂肪酸组成的改变方面具有协同性。这是由于低温激活了细胞中△12去饱和酶和Ω-3去饱和酶的转录与翻译,增加了细胞内的酶量,使膜脂的去饱和作用得以加强,以维持细胞完成正常生理功能所需的生物膜的流动性[6-9]。杨官品等[10]推测长链脂肪酸有可能提高微藻适应高温环境的能力。研究表明,EPA的含量随着温度的升高而降低,但生物量的生产受光照、温度的综合影响较大,在整个 EPA的生产过程中生物质产量对EPA产量的影响较大。因此,在保证产量的同时,尽可能提高EPA含量,在光照时间段使藻液温度处于适宜生长的环境积累生物量,在弱光低温的早晨和傍晚积累EPA。
3.2微藻养殖过程中的温度控制微藻养殖大多数采用冷凝管、加热管、喷淋、棚膜等方式进行温度控制[11],上述方法建设和运行成本较高,不利于规模化应用,且操作繁琐,影响混合和/或透光效果。该研究主要利用气候干燥地区蒸发量和昼夜温差大的自然条件,通过液位控制来实现规模化低成本开放式养殖系统的温度控制。
水体的热量主要来自辐射热、辐射热量及其对水体温度,根据公式Q吸收=Q辐射-Q蒸发-Q藻转化-Q反射计算吸收热量。在吸收同样多的热量的情况下,如果初始藻液温度相同的条件下,藻液温度的变化与养殖水体的质量成反比;对单位面积水体而言,藻液温度与养殖深度成反比,养殖深度越深,同样条件下藻液温度越低。因此,在确定当地蒸发量、光照、微藻生长情况下,可对温度和液位进行理论计算,获得适宜的养殖深度,对实际养殖进行指导。
3.3规模化生产EPA原料室外培养时,温度随昼夜的更替和季节的变化产生较大的波动,这与室内培养的温度条件有较大的差异。该研究发现,在规模化养殖过程中,EPA含量比实验室同等温度下较高,这可能是由规模化养殖过程中昼夜温差影响造成的。在养殖过程中,各月藻液最低温度均低于20 ℃,有利于EPA的累积。大量研究表明,不同季节微藻细胞内EPA的含量不同[12-13]。Sukenik等[14]研究了室外大规模培养微绿藻时,温度的季节性波动对脂肪酸种类的影响很大。冬季水温在8~16 ℃ 时生物量产率较低,但EPA含量最高(占干重的3.8%);在夏季,当生物量产率最高时,EPA的含量降到不足冬季的50%。Zittelli等[15]报道春季和初秋EPA含量最高。这与该研究长期养殖结果相一致。
目前规模化生产EPA的很少,基本上都是基于研究室的探索性养殖,且以反应器为主。Dunstan等[16]采用不同光径的露天平板式反应器培养拟微球藻,冬季和夏季EPA的最高产率分别为278.2和515.70 g/(m2·d)。
[1] TAPIERO H,BA G N,COUVREUR P,et al.Polyunsaturated fatty acids (PUFA) and eicosanoids in human health and pathologies[J].Biomedicine & pharmacotherapy,2002,56(5):215-222.
[2] BARCLAY W R,MEAGER K M,ABRIL J R.Heterotrophic production of long chain omega-3 fatty acids utilizing algae and algae-like microorganisms[J].Journal of applied phycology,1994,6(2):123-129.
[3] 黄旭雄,周洪琪,朱建忠,等.不同生长阶段微绿球藻的营养价值[J].水产学报,2004,28(4):477-480.
[4] 魏东,张学成,隋正红,等.氮源和 N/P 对眼点拟微球藻的生长,总脂含量和脂肪酸组成的影响[J].海洋科学,2000,24(7):46-51.
[5] BERRY J,BJORKMAN O.Photosynthetic response and adaptation to temperature in higher plants[J].Annual review of plant physiology,1980,31(1):491-543.
[6] 魏东,张学成.微藻脂肪酸去饱和酶及其基因表达的生态调控研究新进展[J].海洋科学,2000,24(8):42-46.
[7] SAKAMOTO T,LOS D A,HIGASHI S,et al.Cloning of ω3 desaturase from cyanobacteria and its use in altering the degree of membrane-lipid unsaturation[J].Plant molecular biology,1994,26(1):249-263.
[8] KODAMA H,AKAGI H,KUSUMI K,et al.Structure,chromosomal location and expression of a rice gene encoding the microsome ω-3 fatty acid desaturase[J].Plant molecular biology,1997,33(3):493-502.
[9] 魏东,张学成.富含 EPA 的海洋微藻眼点拟微球藻的大规模培养[J].中国海洋药物,2003,22(1):5-10.
[10] 杨官品,张继民,魏东,等.温度逆境处理提高拟微球藻 (Nannochloropsisoculata) EPA 含量的研究[J].海洋学报,2002,24(4):132-135.
[11]ZOU N,RICHMOND A.Effect of light-path length in outdoor flat plate reactors on output rate of cell mass and of EPA inNannochloropsissp.[J].Journal of Biotechnolog,1999,70(1/2/3):351-356.
[12] SAKAMOTO T,HIGASHI S,WADA H,et al.Low-temperature-induced desaturation of fatty acids and expression of desaturase genes in the cyanobacteriumSynechococcussp.PCC 7002[J].FEMS Microbiology Letters,1997,152(2):313-320.
[13] SAKAMOTO T,SHEN G Z,HIGASHI S,et al.Alteration of low-temperature susceptibility of the cyanobacteriumSynechococcussp.PCC 7002 by genetic manipulation of membrane lipid unsaturation[J].Archives of microbiology,1997,169(1):20-28.
[14] SUKENIK A,ZMORA O,CARMELI Y.Biochemical quality of marine unicellular algae with special emphasis on lipid composition.II.Nannochloropsissp.[J].Aquaculture,1993,117(3/4):313-326.
[15] ZITTELLI G C,LAVISTA F,BASTIANINI A,et al.Production of eicosapentaenoic acid byNannochloropsissp.cultures in outdoor tubular photobioreactors[J].Journal of biotechnology,1999,70(1):299-312.
[16] DUNSTAN G A,VOLKAMN J K,BARRETT S M,et al.Changes in the lipid composition and maximisation of the polyunsaturated fatty acid content of three microalgae grown in mass cu1ture[J].J Appl Phycol,1993,5(1):71-83.
