不同发芽时期桃仁形态结构及氨基酸含量变化
2018-04-09,,,
, , ,
(1.上海市园林科学规划研究院, 上海 200232; 2.伽蓝(集团)股份有限公司, 上海 201401;3.上海城市困难立地绿化工程技术研究中心, 上海 200232)
桃(Prunspersica)为蔷薇科李属,落叶小乔木,具有较高的观赏和食用价值。桃仁是桃的成熟种子,可入药,《神农本草经》记载,“桃仁味苦平”,具有疏通淤血作用[1]。据报道,桃仁中的化学成分有脂肪油类(油酸、亚油酸和棕榈酸)、苷类、氨基酸和蛋白质、挥发油、黄酮及其糖苷类化合物等[2-3],是一种优质的可利用植物资源。目前关于桃的研究较多,主要集中在种子萌发、育种、栽培、病虫害防治、果实品质、贮藏保鲜等方面[4-8],但对桃仁内部形态结构、内含物等方面的研究报道较少。因此,本实验利用合适的温度条件对桃仁进行发芽,通过显微切片观察种子内部形态结构特征,并测定种子内含物中的氨基酸含量,研究种子发芽前后主要化学成分的分布情况和变化趋势,以期为桃仁在食品、化妆品产业中的开发利用提供科学依据。
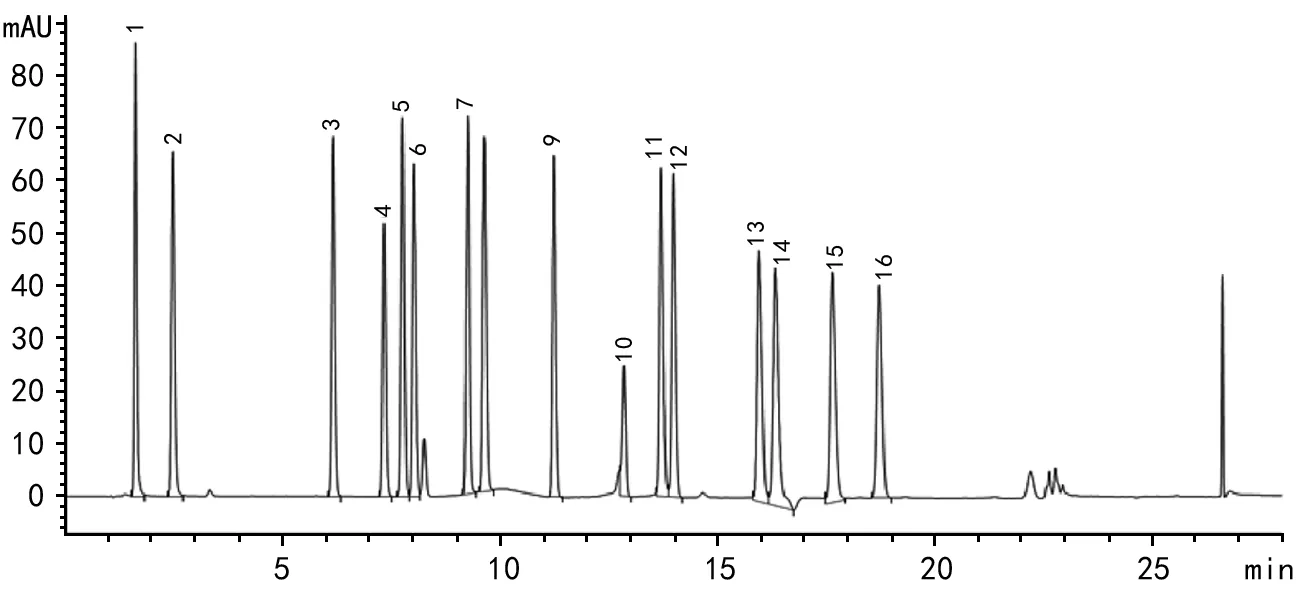
注:1~16分别是天门冬氨酸,谷氨酸,丝氨酸,组氨酸,甘氨酸,苏氨酸,精氨酸,丙氨酸,酪氨酸,胱氨酸,缬氨酸,蛋氨酸,苯丙氨酸,异亮氨酸,亮氨酸,赖氨酸。图1 氨基酸标准品的HPLC图谱
1 材料与方法
1.1 材 料
供试材料桃仁为2016年8月采自昆明地区的野生山桃,试验在上海市园林科学规划研究院植物生理试验室内进行。
1.2 方 法
1.2.1种子萌发
4月份,取大小一致的成熟桃仁,用蒸馏水浸种24 h,每10粒种子放入有2层滤纸的培养皿内,盖上盖,置于不同温度的人工智能气候箱中进行培养,温度分别设定为15,20,25,30 ℃,以室温下培养为对照,其他条件:光照度2 000 lx,光照时间12 h/d,重复3次。每天记录种子的萌发状态和数量,计算种子发芽指数和发芽率。
发芽指数=发芽数/发芽日数;
发芽率(%)=全部正常发芽的种子/供试种子总数×100%。
1.2.2内部结构特征显微观察
采用树脂切片方法。取完整的种子,将胚芽部分分割下来,为1 mm左右的小块,先用4 %戊二醛(0.2 mol/L磷酸缓冲液配制,pH=7.2)固定,4 ℃保存。再用2 %锇酸(0.2 mol/L磷酸缓冲液配制,pH=7.2)固定2 h,然后经梯度乙醇脱水和纯丙酮转换后,环氧树脂包埋,样品用半超薄切片机切片,最后用甲苯胺蓝染色,干燥后用光学显微镜进行观测、拍照。
1.2.3氨基酸提取物的制备及测定
氨基酸提取物的制备:取一定质量的不同发芽阶段的桃种子,研钵研碎之后转移至100 mL锥形瓶中,加入8倍体积的55%乙醇,500 W超声反应2 h,过滤,取滤液;滤渣中再加入8倍体积的55 %乙醇,500 W超声2 h,过滤,取滤液;合并滤液后离心,取上清旋转蒸发干燥。
衍生试剂的配置:称取OPA 40 mg,加入3.5 mL 的0.4 mol/L硼酸盐缓冲液(pH=10.4), 62.5μL 的3-巯基丙酸和0.5 mL的乙腈,混合均匀。
流动相的配置:流动性A:乙腈∶甲醇∶水(45∶45∶10,体积比)。流动性B:称取0.7 g NaHPO4和1.9 g Na2B4O7·10 H2O,溶于400 mL水中,加浓盐酸调到pH=8.2,最后定容到500 mL,0.45μm滤膜过滤。
衍生反应:衍生在Agilent 1260型高效液相色谱仪自动进样器上在线自动完成。程序如下: 1) 吸取15μL硼酸盐缓冲液(pH=10.0); 2) 吸取2.5μL样品溶液; 3) 混合5次; 4) 等待0.2 min; 5) 吸取2.5μL的OPA试剂; 6) 混合5次; 7) 等待0.1 min; 8) 进样20μL。
HPLC测定:采用梯度洗脱,流速1.5 mL/min,检测波长338 nm,柱温40 ℃,以保留时间定性(图1),外标法定量。
2 结果与分析
2.1 桃仁萌发温度及发芽动态观察
山桃的种子呈卵形,种皮淡褐色,革质光滑,种子长1.20~1.40 cm,宽0.60~0.90 cm,千粒重319~354 g。在室温条件下,经水浸泡处理的桃仁4 d后开始膨大萌动,之后胚轴伸长,10 d胚根生长,20 d后陆续发芽,整个萌发过程可分为吸胀、萌动、发芽3个阶段(表1)。
表1不同温度条件下桃仁发芽状态
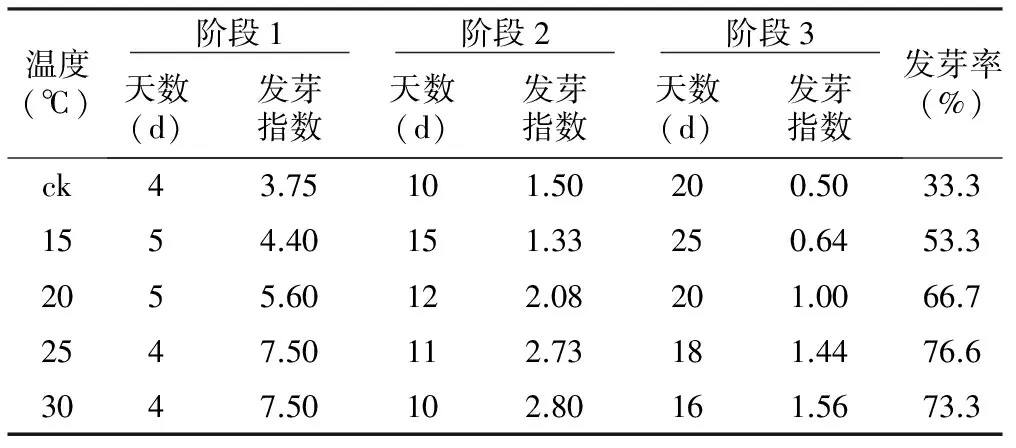
温度(℃) 阶段1 阶段2 阶段3 天数(d)发芽指数天数(d)发芽指数天数(d)发芽指数发芽率(%)ck43.75101.50200.5033.31554.40151.33250.6453.32055.60122.08201.0066.72547.50112.73181.4476.63047.50102.80161.5673.3

注:A为桃仁萌发前的结构特征;B为桃仁吸胀过程的结构特征;(放大倍数依次为5×、10×、40×)SC为种皮;E为胚;CO为子叶;pb为蛋白体; s为淀粉粒。图2 不同萌发时期种子内部结构特征
在15~30 ℃范围内,不同温度条件下的桃种子均可发芽,发芽率为33.3%~76.6%,其中在25 ℃条件下的种子发芽率最高。从表1可看出,不同温度处理对种子开始吸胀(阶段1)的时间没有明显的影响,时间为4~5 d;但是对种子萌动(阶段2)、发芽(阶段3)时间存在一定的影响,分别10~15 d和16~25 d,温度越高各阶段间隔时间越短,其中吸胀、萌发和发芽时间最短的是30 ℃。在发芽过程中,在15 ℃条件下培养的种子发芽缓慢,胚根很短,表现不正常;30 ℃条件下发芽的幼苗生长虽然较快,但胚根在萌发后期易褐化,导致已处于阶段3的种子死亡。总体上,25 ℃条件下的种子萌发速度较快、种子发芽率高。
2.2 不同萌发时期桃仁形态结构特征
从萌发前桃仁的纵切面(图2 A-1)观察,可看到内种皮、胚、子叶3个部分。内种皮由两类细胞组成,一种细胞体积较小,细胞内出现大的空泡,细胞之间有黑色颗粒状物质,明显地构成了内种皮的内层,为1~2层细胞;另一种细胞体积较大,细胞中的内含物染色较深,由多层细胞构成。胚细胞呈现胚性细胞的典型特征,小而致密,细胞质浓厚,核大(图2 A-2)。子叶细胞发育完全,细胞排列规则,所贮藏的营养物质成分较多,有利于胚的发育,子叶中含量较多的物质结构是淀粉粒和蛋白体,淀粉粒多呈不规则型,通常每个细胞中含有1~4个淀粉颗粒;蛋白体多呈近圆球形,分布在淀粉颗粒之间的空隙内(图2 A-3)。
桃仁浸种后,种子处于吸胀过程,体内开始发生变化。从图2 B-1、图2 B-2可以明显看出,胚细胞迅速生长,胚芽形成;胚根开始伸长生长。种子内部储存淀粉粒和蛋白体等大分子开始被水解,分解成可溶性的小分子(图2 B-3)。
2.3 桃仁内含物中氨基酸含量变化
对萌发过程中的桃仁进行16种氨基酸含量测定(表2),在整个萌发过程中精氨酸含量最高,为0.10%~1.46%;其次为谷氨酸含量,为0.06%~0.74%;蛋氨酸,甘氨酸、苏氨酸、酪氨酸、胱氨酸、缬氨酸、异亮氨酸、亮氨酸等7种氨基酸含量较低,为0.01%~0.05%。
从氨基酸总含量和种类随着种子的萌发进程不断增加。萌发前的氨基酸总量最低,为0.26%,各氨基酸成分含量范围为0.00%~0.10%,并且只检测到9种氨基酸,其中精氨酸含量最高,为0.10%,其次为谷氨酸(0.06%)、苯丙氨酸(0.04%)、甘氨酸(0.02%),天门冬氨酸、丝氨酸、组氨酸、缬氨酸均为0.01%。萌发阶段1的氨基酸总量为1.86%,检测到除了酪氨酸、胱氨酸、蛋氨酸、异亮氨酸以外的12种氨基酸种类,其中谷氨酸含量最高,为0.74%。萌发阶段2的氨基酸总量为2.63%,同时检测到了所有16种氨基酸种类。萌发阶段3的氨基酸含量最高,为3.10%,检测到除蛋氨酸以外的15种氨基酸种类。
从同一氨基酸不同的萌发阶段来看,多数氨基酸含量随着桃仁种子的萌发进程不断增加,其高峰值处于萌发阶段3。而天门冬氨酸、谷氨酸含量的高峰值处于第1阶段,之后逐渐降低;丙氨酸含量高峰值处于第2阶段,第3阶段含量降低;赖氨酸的含量在第1阶段达到最高值,之后含量始终保持在0.17%;蛋氨酸含量在萌发前后差异较小,最高值是第2阶段,为0.01%。
表2不同发芽阶段桃仁内含物中氨基酸含量(%)

编号氨基酸萌发前阶段1阶段2阶段31天门冬氨酸0.010.250.210.202谷氨酸0.060.740.590.363丝氨酸0.010.070.160.204组氨酸0.010.040.080.165甘氨酸0.020.020.050.046苏氨酸0.000.010.030.047精氨酸0.100.300.931.468丙氨酸0.020.100.150.129酪氨酸0.000.000.020.0410胱氨酸0.000.000.020.0211缬氨酸0.010.040.040.0512蛋氨酸0.000.000.010.0013苯丙氨酸0.040.090.120.1314异亮氨酸0.000.000.030.0415亮氨酸0.000.020.040.0516赖氨酸0.000.170.170.17总和0.261.862.633.10
3 讨 论
桃种子有休眠现象,加上存在坚硬的内果皮,常出现烂种或隔年发芽现象,田间播种发芽率往往很低[9]。为了充分利用桃仁中的天然有效成分,同时便于后期的提取利用,本研究在播种前去掉核壳,利用可控的人工智能气候箱对桃仁进行不同温度条件下的发芽试验。经水浸泡处理的桃仁4 d后开始膨大萌动,之后胚轴伸长,胚根生长,陆续发芽,整个萌发过程可分为吸胀、萌动、发芽3个阶段,并以25 ℃条件下的种子萌发速度较快、种子发芽率高,为76.6%,与张桂兵等[10]用层积法、开水烫种法处理毛桃种子得到的出苗率差异不大。
从显微结构来看,桃仁的经过前期浸种处理后,最明显的变化就是胚细胞迅速生长,胚芽形成,胚根开始伸长生长;细胞内大量的淀粉粒和蛋白体等物质被降解。种子在萌发的过程中,种胚从生命活动相对静止状态,恢复到生理代谢旺盛的生长发育阶段,体内的储藏物质被转化和利用[11]。这与油松(Pinustabuliformis)[12]、银杏(Ginkgobiloba)[13]、番茄(Lycopersiconesculentum)[14]种子在萌发过程中表现出相似的情况,物质的降解与幼胚的生长同步进行,两者具有密切的联系。
另外,氨基酸及其衍生物易被皮肤吸收,使老化和硬化的表皮恢复弹性,延缓皮肤衰老[15]。在桃仁萌发过程中,贮藏蛋白质在蛋白酶的作用下逐渐分解为氨基酸,氨基酸含量和种类随着种子的萌发进程不断增加。从氨基酸含量来看,精氨酸含量最高,为0.10%~1.46%,其次为谷氨酸含量,为0.06%~0.74%,蛋氨酸,甘氨酸、苏氨酸、酪氨酸、胱氨酸、缬氨酸、异亮氨酸、亮氨酸等7种氨基酸含量较低,为0.01%~0.05%,这些对于后期桃仁中氨基酸含量的提取和利用提供了理论依据。
参考文献:
[1]修春,李铭源,宓穗卿,等.桃仁的主要化学成分及药理研究进展[J].中国药房,2007,18(24):1 903-1 904.
[2]颜永刚,雷国莲,刘静,等.中药桃仁的研究概况[J].时珍国医国药,2011,22(9):2 262-2 264.
[3]吕健,毕金峰,赵晓燕,等.国内外桃加工技术研究进展[J].食品与机械,2012,28(1):268-274.
[4]万春雁,糜林,韩明玉,等.桃胚培养及子叶再生的研究进展[J].江西农业学报,2010,22(10):49-51.
[5]王富荣,赵剑波,佟兆国,等.桃种质资源亲缘关系的研究进展[J].植物遗传资源学报,2006,7(1):118-122.
[6]张立莎,王召元,陈湖.我国设施桃果实品质研究进展[J].北方园艺,2011(22):175-177.
[7]何惠霞.高海燕,曹玉明.桃采后保鲜技术研究进展[J].食品与发酵工业,2009,35(2):130-133.
[8]王贵章,王贵禧木,梁丽松.桃果实芳香挥发物及其生物合成研究进展[J].食品科学,2014,35(17):278-284.
[9]张义.桃种子休眠原因及解除休眠方法研究概述[J].湖北农学院学报,2001,21(4):382.
[10]张桂兵,王合理,罗琳.低温层积法与开水烫种法处理桃、杏种子育苗试验[J].北方园艺,2008(10):53.
[11]张红生,胡晋主编.种子学[M].北京:科学出版社,2015.
[12]陈丽培.油松种子萌发初始阶段生理生化特性研究[D].南京林业大学硕士论文,2009.
[13]李生平.银杏种子萌发过程中贮藏物质代谢机理的研究[D].南京林业大学硕士论文,2004.
[14]孟祥红,王建波,韩笑冰,等.番茄种子及萌发过程中蛋白体超微结构的研究[J].西北植物学报,1999,19(1):89-94.
[15]陈燕珠.氨基酸的应用与发展趋势[J].化工时刊,2001,15(7):4-7.
(本栏目责任编辑:周介雄、戴燚)
