PRKAα1基因多态性与东亚人群胃癌易感性研究的meta分析
2018-04-09杨美娟樊文静尤崇革
杨美娟,张 东,樊文静,张 敏,尤崇革*
(兰州大学第二医院检验科,甘肃 兰州 730030)
据统计,2012年全球胃癌新发病例约95.1万,占全球癌症发病总数的6.8%,其中约70%的病例发生于发展中国家,而50%发生在东亚地区。据全球范围调查结果显示,东亚地区胃癌患者死亡率明显高于西非地区[1]。而胃癌的发生是环境因素、遗传因素等共同作用的结果。PRKAα1基因是腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)的α1亚基[2],该基因编码的蛋白是所有真核生物代谢中枢的调节物质之一,此蛋白有控制和调节机体物质、能量代谢的作用[3]。相关研究表明被PRKAα1基因激活的AMPK与正常的细胞周期和凋亡、肿瘤细胞的生长增殖及侵袭转移等密切相关[4-7]。
全基因组关联分析显示PRKAα1是胃癌患者的遗传易感基因,但针对该位点基因在胃癌高发区(东亚)进行的相关性实验研究结果并不完全一致,需综合相关资料进行meta分析,以明确PRKAα1基因多态性与胃癌易感性的相关性。
1 资料和方法
1.1 文献检索
以 “ PRKAα1” 、 “ gene polymorphism” 、“gastric cancer”、“stomach cancer”、“stomach neoplasms”等作为关键词在英文数据库PubMed、Web of Science中进行检索,同时以“PRKAα1基因多态性”和“胃癌”等作为主题词在中国知网、万方、维普等数据库检索。检索年限至2017年10月。
1.2 文献的选择标准
1.2.1文献的纳入标准 纳入标准包括:①已公开发表涉及PRKAα1基因多态性与胃癌易感性关系研究的中英文文献;②研究类型为病例-对照研究;③各文
献能提供原始基因型频率数据或者相对危险度(odds ratio,OR)等统计学综合指标。
1.2.2文献的排除标准 排除标准包括:①病例报告、会议论文以及综述类文章;②数据重复的文献;③报道人群为非东亚人群;④文章中基因型分布不符合Hardy-Weinberg遗传平衡定律。
1.2.3文献的质量评价 根据纽卡斯尔-渥太华量表(Newcastle-Ottawa scale,NOS)对上述病例-对照研究进行质量评估。NOS量表通过研究人群选择(共4分)、组间可比性(共2分)和暴露因素或结局(共3分)这3个方面对纳入文献进行评分。评分在0~4分时归为低质量研究,5~9分归为高质量研究。
1.3 数据提取
由两位研究者独立提取数据,并对数据的信息判断达成一致。本研究主要针对东亚胃癌群体的PRKAα1基因多态性进行分析。根据研究的纳入和排除标准提取数据,提取的数据内容主要包括:作者、发表时间、研究样本地区、种族、基因分型的方法、对照来源以及病例和对照组中各个基因型频数。根据人群的种族差异将研究对象分为中国和韩国人群;如研究包含多种人群,即对不同人群的数据分别抽提分类后再进行分析。
1.4 统计学分析
采用STATA 12.0软件进行meta分析。PRKAα1基因多态性与胃癌风险的相关性通过计算比值比(odds ratio,OR)和95%可信区间(confidence interval,CI)来衡量,合并OR值采用Z检验评估。采用Q检验分析评估纳入研究之间的异质性:P≤0.10且I2≥50%时认为存在显著异质性,采用随机效应模型计算每项研究的合并效应量OR值;P>0.10且I2<50%时认为不存在显著异质性,则采用固定效应模型进行分析。根据Begg’s检验绘制漏斗图,评估纳入研究的发表偏倚。通过剔除单项研究的方法评估该研究对合并效应量的影响,进行敏感性分析,以p<0.05为差异有统计学意义。
2 结果
2.1 文献检索流程及纳入文献的基本特征
按照关键词检索,共有16篇报道初步纳入分析。根据纳入和排除标准,排除7篇报道文献,其中2篇综述类、3篇无法提供基因型数据的研究、1篇重复研究和1篇不符合Hardy-Weinberg定律。最终有9项研究符合要求,包含9 840例患者和10 402例健康对照。纳入研究均为病例-对照研究,包括6项基于中国人群的研究和3项基于韩国人群的研究;其中有8项研究的对照人群来源于医院和体检中心,其余1项来源于社区志愿者。胃癌诊断主要依据组织病理学标准。纳入研究的基本特征见表1。
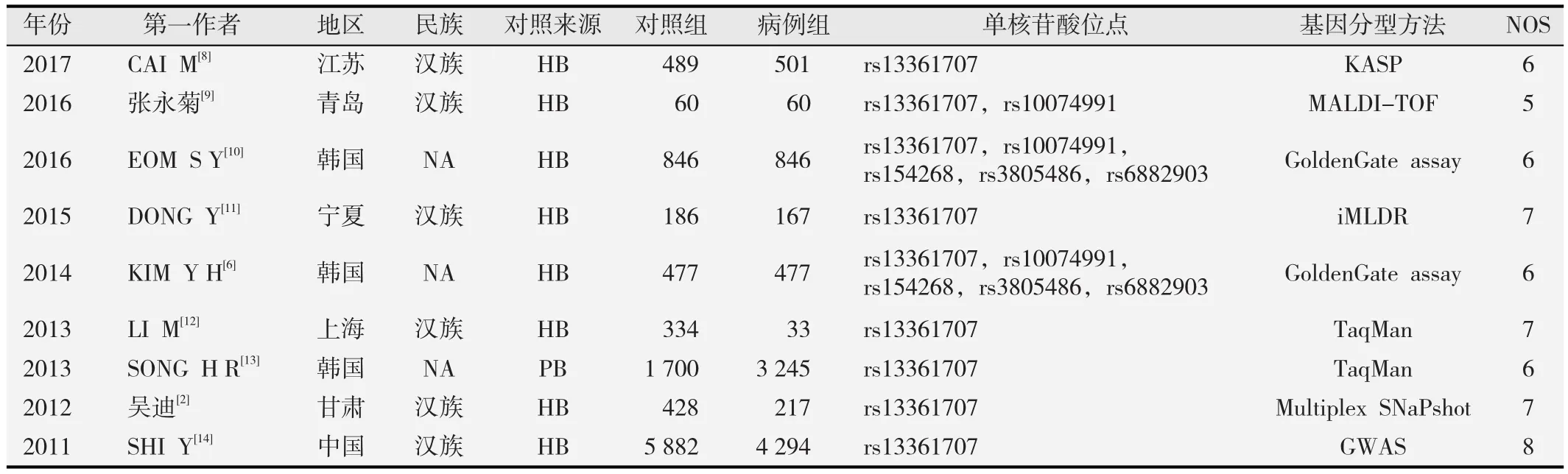
表1 纳入研究的基本特征
2.2 Meta分析结果
2.2.1rs13361707C>T多态性与胃癌易感性的关联最终纳入9项研究,其中8项研究与胃癌易感性相关,病例组9 840例,对照组10 402例,其多态性与东亚人群胃癌易感性无统计学相关性。按国家进行亚组分析显示,显性模型的合并OR=0.687,95%CI(0.614~0.769),P=0.000;隐性模型的合并OR=0.662,95%CI(0.594~0.737),P=0.000;加性模型的合并OR=0.553,95%CI(0.484~0.632), P=0.000; 共 显 性 模 型 的 合 并OR=0.766,95%CI(0.682~0.859),P=0.000;该结果显示在4种模型下韩国人群患胃癌风险降低。而该位点基因多态性与中国人群以及中国南北方人群易感性均无统计学相关性,结果见表2,图1。
2.2.2rs10074991G>A多态性与胃癌易感性的关联最初纳入4项研究,其中1项研究无法获得具体数据,最终纳入3项研究。3项研究均与胃癌易感性相关,病例组1 381例,对组照1 380例。Meta分析结果显示:显性模型的合并OR=0.590,95%CI(0.490~0.700),P=0.000;隐性模型的合并OR=0.637,95%CI(0.535~0.759),P=0.000;加性模型的合并OR=0.478,95%CI(0.385~0.593), P=0.000; 共 显 性 模 型 的 合 并OR=0.651,95%CI(0.541~0.784),P=0.000;该结果提示在4种模型下东亚人群患胃癌风险降低。地域亚组分析显示,显性模型的合并OR=0.610,95%CI(0.510~0.730),P=0.000;隐性模型的合并OR=0.638,95%CI(0.534~0.762),P=0.000;加性模型的合并OR= 0.489,95%CI(0.392~0.609), P=0.000共 显 性 模 型 的 合 并OR=0.675,95%CI(0.558~0.816),P=0.000;该结果提示在4种模型下韩国人群患胃癌风险降低;除隐性模型外,中国人群患胃癌风险降低。结果见表3,图2。

表2 rs13361707C>T基因多态性与胃癌易感性的meta分析结果
2.2.3rs154268T>C多态性与胃癌易感性的关联最终纳入2项研究,且2项研究均与胃癌易感性相关,病例组1 323例,对照组1 321例。Meta分析结果显示,显性模型的合并OR=1.480,95%CI(1.270~1.730),P=0.000; 加 性 模 型 的 合 并 OR=1.599, 95%CI(1.079~2.368),P=0.019;共显性模型的合并OR=1.469,95%CI(1.249~1.727),P=0.000;该结果提示:除隐性模型外,韩国人群患胃癌风险增加。结果见表4。

表3 rs10074991基因多态性与胃癌易感性的meta分析结果

图2 rs10074991基因多态性显性模型东亚地区(中国和韩国)亚组meta分析森林图
2.2.4rs3805486T>C多态性与胃癌易感性的关联最终纳入2项研究,只有1项研究与胃癌易感性相关,病例组1 320例,对照组1 318例。Meta分析结果显示,显性 模 型 的 合 并 OR=0.730, 95%CI(0.630~0.860), P=0.000; 隐 性 模 型 的 合 并 OR=0.600, 95%CI(0.433~0.832),P=0.002;加性模型的合并OR=0.770,95%CI(0.657~0.903), P=0.001; 共 显 性 模 型 的 合 并 OR=0.537,95%CI(0.385~0.749),P=0.000;该结果提示在4种模型下韩国人群患胃癌风险降低。结果见表4。
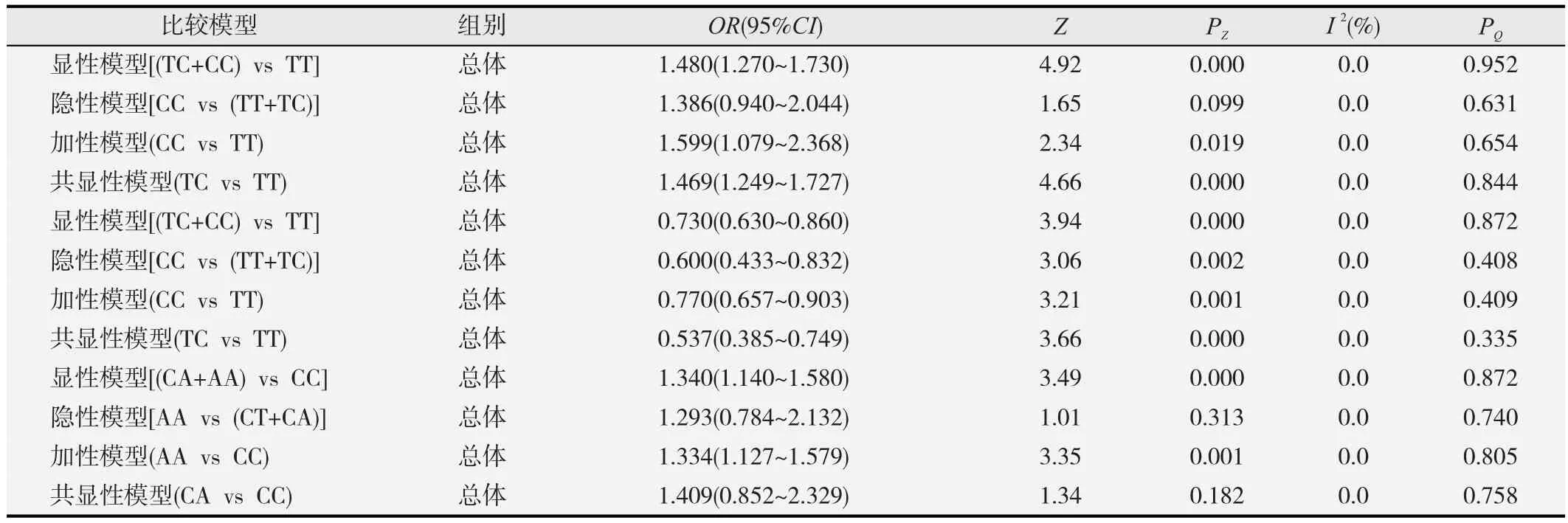
表4 rs154268、rs3805486、rs6882903基因多态性与胃癌易感性的meta分析结果(n=2)
2.2.5rs6882903C>A多态性与胃癌易感性的关联最终纳入2项研究,且2项研究均与胃癌易感性相关,病例组1 322例,对照组1 321例。Meta分析结果显示,显 性 模 型 的 合 并 OR=1.340, 95%CI(1.14~1.58), P=0.000; 加 性 模 型 的 合 并 OR=1.334, 95%CI(1.127~1.579),P=0.001;该结果显示,在显性和加性模型下,韩国人群患胃癌风险增加。结果见表4。
2.3 敏感性分析和发表偏倚分析
逐一剔除单项研究并计算各个位点在4种模型下单项研究对合并效应量的影响,结果显示该影响无明显变化,OR值稳定,提示本研究合并的结果基本可靠;对各位点的4种基因模型meta分析进行Begg’s检验和Egger’s检验,结果提示无发表偏倚存在(P>0.05);见表5、图3和图4。
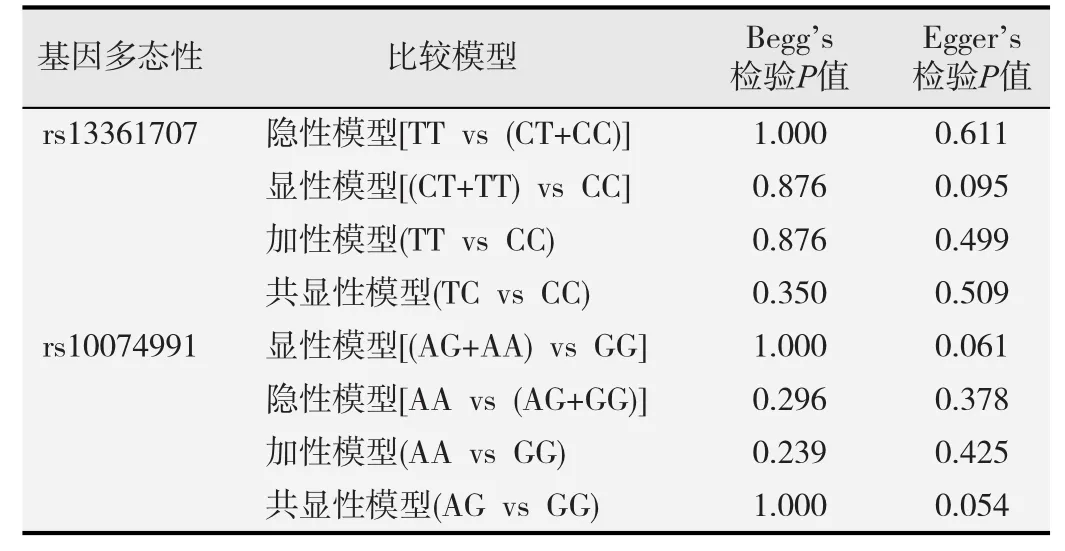
表5 PRKAα1基因多态性4种模型发表偏倚分析结果

图3 rs13361707位点显性模型与胃癌易感相关性研究的发表偏倚Begg’s漏斗图
3 讨论

图4 rs10074991位点显性模型与胃癌易感相关性研究的发表偏倚Begg’s漏斗图
PRKAα1基因位于5号染色体p13.1,全长38 817 bp,由10个外显子和9个内含子组成,该基因是AMPKα1亚基的编码基因[2]。AMPK是由α、β和γ 3个亚基组成的异源三聚体复合物[15],α亚基由α1和α2两个基因编码,α亚基起催化作用,β和γ亚基起调节作用。PRKAα1激活的AMPK与细胞周期、细胞凋亡、肿瘤细胞的生长增殖、侵袭转移等密切相关[4-7]。rs13361707位 于 PRKAα1 基 因 的 第 1个 内 含 子 上 ,rs10074991、rs154268、rs3805486、rs6882903位于该基因的其他内含子中,而这5个位点对胃癌发病的影响机制尚待进一步研究,但研究发现内含子中的碱基变异会激活剪切位点从而影响剪切,可能导致疾病的发生;有些内含子中间的碱基变异虽不影响剪切,也可能与疾病相关[16],可能是某些内含子中有编码与相关疾病发生有关的蛋白质的基因[17]。
rs13361707位点多态性与胃癌易感性的meta分析结果显示,该位点多态性与东亚人群胃癌的易感性无统计学相关性,结果存在显著异质性。亚组分析结果显示,该位点多态性与中国人群胃癌的易感性也无统计学相关性,且结果有异质性。由Tian等[18]研究表明,rs13361707位点T基因频率在不同地区、不同种族有所差异。可推测东亚、中国地区存在显著的异质性可能是不同种族、环境和饮食习惯导致不同的遗传背景所致。而其多态性与韩国人群胃癌的易感性有明显相关性,提示该位点携带T等位基因(TT/TC)可降低患胃癌风险,结果无异质性。rs10074991位点在4种模型下均与东亚人群胃癌的易感性有关,其携带A等位基因(AA/AG)可使患胃癌风险降低。亚组分析结果显示,在4种模型下韩国人群患胃癌风险降低;除隐性模型外,其余3种模型下中国人群患胃癌风险降低。且该位点在4种模型下分析结果均无异质性。rs154268位点meta 分析结果显示,除隐性模型外,韩国人群患胃癌风险增加,提示CC基因型可增加韩国人群患胃癌的风险且结果无异质性。rs3805486位点meta分析结果显示,在4种模型下韩国人群患胃癌风险降低,提示该位点携带C等位基因可降低患胃癌风险,且其在4种模型下结果均无异质性。rs6882903位点meta分析结果显示,在显性和加性模型下韩国人群胃癌风险增加,提示AA基因型可增加韩国人群患胃癌风险,结果无异质性。
PRKAα1 基因5个位点敏感性分析结果显示,单项研究剔除后对总体(4种模型)分析结果无明显影响,OR值稳定,提示研究合并稳定性好;rs13361707、rs10074991两位点在4种基因模型下进行Begg’s检验和Egger’s检验,结果提示无发表偏倚存在,说明结论可靠。rs154268、rs3805486、rs6882903该3个位点的4种基因模型进行Begg’s检验结果提示无发表偏倚存在,说明结论可靠。这3个位点纳入研究较少,故未做Egger’s检验(纳入研究太少时,做漏斗图无意义,检验效力不足)。
本meta分析还存在一定的局限性:①本meta分析纳入的文献较少,需要更多,更高质量的研究去证实;②中国组异质性显著,须进一步分析异质性来源;③研究人群仅为东亚人群,结果不一定适合其他人群;④对照组来源的纳入标准不统一,大多数来自医院对照,由于研究数量的限制,未进行对照组来源的亚组分析;⑤大部分有关位点与胃癌的研究主要集中在东亚范围内的中国和韩国地区,未收集到日本地区关于该位点与胃癌的研究。虽然本研究纳入9 840例患者和10 402例健康对照,样本数据不够多,但具有一定的参考价值,期待有更多相关的研究发表,以纳入和更新meta分析结果。
[1] FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5):359-386.
[2] 吴迪. PSCA、PLCE1、PRKAα1基因多态性及幽门螺旋杆菌感染与胃癌易感性的关系[D]. 兰州:兰州大学,2014.
[3] GLEASON C E,LU D,WITTERS L A,et al. The role of AMPK and mTOR in nutrient sensing in pancreatic beta-cells[J].J Biol Chem,2007,2(82):10341-10351.
[4] HOU L,LI Y,SONG H,et al. Protective macroautophagy is involved in vitamin E succinate effects on human gastric carcinoma cell line SGC-7901 by Inhibiting mTOR axis phosphorylation[J]. PLoS One,2015,10:0132829.
[5] LI S,ZHOU T,LI C,et al. High metastaticgastric and breast cancer cells consume oleic acid in an AMPK dependent manner[J]. PLoS One,2014,9:97330.
[6] KIM Y H,LIANG H,LIU X,et al. AMPKalpha modulation in cancer progression:multilayer integrative analysis of the whole transcriptome in Asian gastric cancer[J]. Cancer Res,2012,72:2512-2521.
[7] OBBA S,HIZIR Z,BOYER L,et al. The PRKAα 1/AMPKalpha1 pathway triggers autophagy during CSF1-induced human monocyte differentiation and is apotential target in CMML[J]. Autophagy,2015,11:1114-1129.
[8] CAI M,DAI S,CHEN W,et al. Environmental factors,seven GWAS-identified susceptibility loci,and risk of gastric cancer and its precursors in a Chinese population[J]. Cancer Med, 2017,6(3):708-720.
[9] 张永菊,张春艳,于新娟,等. PRKAα1和UNC5CL基因多态性与胃癌易感性的关系[J]. 中国临床医生杂志,2016,10:21-25.
[10] EOM S Y,HONG S M,YIM D H,et al. Additive interactions between PRKAA1 polymorphisms and Helicobacter pylori CagA infection associated with gastric cancer risk in Koreans[J].Cancer Med,2016,5(11):3326-3335.
[11] DONG Y,CHEN J,CHEN Z,et al. Evaluating the association of eight polymorphisms with cancer susceptibility in a Han Chinese population[J]. PLoS One,2015,10(7):0132797.
[12] LI M,HUANG L,QIU H,et al. Helicobacter pylori infection synergizes with three inflammation-related genetic variants in the GWASs to increase risk of gastric cancer in a Chinese population[J]. PLoS One,2013,8(9):74976.
[13] SONG H R,KIM H N,KWEON S S,et al. Genetic variations in the PRKAα1 and ZBTB20 genes and gastric cancer susceptibility in a Korean population[J]. Mol Carcinog,2013,52(1):155-160.
[14] SHI Y,HU Z,WU C,et al. A genome-wide association study identifies new susceptibility loci for non-cardia gastric cancer at 3q13.31 and 5p13.1[J]. Nat Genet,2011,43:1215-1218.
[15] MATTHEW F C ,FRANCIS R ,MELISSA S H ,et a l. S tructural basis for AMPK activation:natural and synthetic ligands regulate kinase activity from opposite poles by different molecular mechanisms[J]. S tructure,2014,22(8):1161-1172.
[16] 王晓斌,刘国仰. 有关内含子功能研究的新进展[J]. 中华医学遗传学杂志,2000,17(3):211-212.
[17] MOUNT S,HENIKOFF S. Gene organization:nested genes take flight[J]. Curr Biol,1993,3(6):372-374.
[18] TIAN C,CHEN Z,MA X,et al. Comparison of genetic variants in cancer-related genes between Chinese Hui and Han populations[J]. PLoS One,2015,10(12):0145170.
