碳离子全身辐照致小鼠造血系统的损伤
2018-04-09王转子巍李文建党秉荣
刘 芳 王转子 * 魏 巍李文建党秉荣
(1. 中国科学院近代物理研究所,甘肃 兰州 730000;2. 中国科学院大学,北京 100049)
高传能线密度(linear energy transfer,LET)重离子射线具有常规射线(低LET射线)不可比拟的物理学和生物学优势,在癌症放射治疗领域受到越来越多的关注[1-3]。但与低LET射线放疗一样,高LET射线在杀死癌细胞的同时也会对周围正常组织造成损伤。同时,随着载人航天技术的不断发展,空间辐射尤其是空间重离子辐射对宇航员健康安全的影响日益受到重视[4]。
骨髓是造血的主要部位和外周血细胞分化的主要场所,对电离辐射高度敏感。仅0.1 Gy的X射线辐照就会造成BALB/c和C57BL/6小鼠的网织红细胞产生明显的微核[5]。骨髓抑制是放疗过程中最常见的副作用,也是中/高剂量全身辐射后机体死亡和发病的主要原因[6]。研究发现,小鼠受γ射线或铁离子辐照后患急性髓系白血病的机率显著增加[7]。电离辐射还会导致小鼠造血干/祖细胞急性和长期损伤,严重影响造血功能[8]。造血系统的辐射损伤不仅会影响机体造血功能的正常进行,降低机体的辐射耐受性,并增加二次癌症的患病几率以及其他健康风险,而且严重时更会影响到其他重要器官的功能,甚至会威胁生命。因此深入研究电离辐射对造血系统的损伤具有十分重要的意义。低LET射线辐射对骨髓造血影响的研究较多,但由于受实验装置的限制,重离子辐射对骨髓造血损伤的相关研究相对缺乏。本研究拟利用兰州重离子加速器(HIRFL)提供的碳离子束对小鼠进行全身辐照,探讨碳离子辐射对小鼠造血系统的损伤及其损伤后随时间的恢复情况,为重离子辐射在医学上的应用以及研究空间重离子辐射的防护奠定实验基础。
1 材料与方法
1.1 实验动物
BALB/c雌鼠120只,SPF级,8~10周龄,体质量(18±2) g,购自中国农业科学院兰州兽医研究所实验动物中心,动物许可证号为:SCXK(甘)2015-001。
1.2 实验方法
1.2.1分组与辐照 将小鼠适应性饲养一周后,随机分为对照组和不同剂量(0.5、1、4、6 Gy)辐照组,每组24只。除对照组外,其余各组均在室温下进行12C6+重离子一次性全身照射,不同剂量组每只小鼠的辐照时间分别为0.5、1、4、6 min。碳离子束由兰州重离子加速器(heavy iron research facility in Lanzhou,HIRFL)装置提供,能量为80 MeV/u,传能线密度为31.6 KeV/μm,剂量率为1 G y/min。
1.2.2骨髓单核细胞DNA损伤检测 辐照后第1、3、8天,每组各取8只小鼠,收集双侧股骨,用PBS缓冲液(含0.1%肝素钠)冲洗骨髓以获取骨髓细胞,骨髓细胞经红细胞裂解液裂红得到骨髓单核细胞。再用碱性彗星电泳方法检测小鼠骨髓单核细胞DNA损伤情况[9]。 取上述单核细胞约1×104个,加入37 ℃温浴的1%低熔点琼脂糖120 μL,迅速混匀后滴加于预先涂布过1%正常熔点琼脂糖的载玻片上,盖上盖玻片使其固化。移去盖玻片后放入碱性裂解液(2.225 mol/L NaCl、89 mmol/L EDTA·2Na、8.9 mmol/L Tris、10% DMSO、1% Triton X-100、1%十二烷基肌氨酸钠,用NaOH调节pH至10),4 ℃下裂解2 h后,在碱性电泳缓冲液(0.3 mol/L NaOH、1 mmol/L EDTA·2Na)中解旋25 min,换新鲜电泳缓冲液,在1 V/cm、300 mA条件下电泳25 min。电泳结束后将载玻片放入PBS中清洗,然后用中性缓冲液(0.4 mol/L Tris-HCl,pH=7.5)中和5 min后取出,溴化乙锭染色,荧光显微镜(BX-53,Olympus,日本)观察拍照。所得图像用CASP1.2.2软件进行分析,并用彗星图像的尾矩(tail moment)和Olive尾矩(Olive tail moment)作为定量细胞DNA损伤程度的参数。
1.2.3骨髓单核细胞周期分布 按1.2.2收集骨髓单核细胞后,取骨髓单核细胞约105个,离心去除上清,用-20 ℃预冷的75%冷乙醇约1.5 mL重悬细胞,混匀后置于- 20 ℃固定细胞48 h以上。离心去除乙醇,并用PBS冲洗两次,去除上清后用细胞周期分析试剂盒(杭州联科生物技术有限公司)进行染色,室温下避光染色30 min后用流式细胞仪(LSRFortessa,BD公司,美国)进行周期测定。流式数据采用FlowJo7.6.1进行分析。
1.2.4辐照后小鼠的造血系统恢复情况评估 为了评估碳离子全身辐照后小鼠造血系统恢复情况,我们检测了小鼠的外周血细胞数和脾脏指数。辐照后第1、3、8天,每组各取8只小鼠,称体质量后眼眶采血20 μ L,用全自动血细胞分析仪(URIT-3000)分析外周血中各种细胞的含量。脱颈椎处死小鼠,解剖分离脾脏并称质量,计算脾脏指数:脾脏指数=脾脏质量/体质量×100%。
1.3 统计学分析
2 结果
2.1 碳离子全身辐照对骨髓单核细胞DNA的损伤
不同剂量碳离子辐射后第1天小鼠骨髓细胞碱性彗星试验结果见图1和图2。与对照组比较,不同剂量的碳离子辐射造成了骨髓单核细胞DNA的严重损伤,且损伤程度与剂量成正相关关系(第1天,r=0.99,P=0.001;第3天,r=0.96,P=0.007;第8天,r=0.97,P=0.006)。不同剂量碳离子辐射诱导的DNA损伤在辐照后第3天最严重(P均<0.01),在辐照后第8天,DNA损伤有所下降但仍很严重(P均<0.01)。

图1 不同剂量碳离子辐射后第1天小鼠骨髓单核细胞电泳图

图2 碳离子全身辐照对小鼠骨髓单核细胞DNA的损伤(n=8)
2.2 碳离子全身辐照对骨髓单核细胞周期分布的影响
如表1,从细胞周期分布的结果可以看出,碳离子辐射严重干扰了骨髓单核细胞的周期分布,在辐照后第3天,不同剂量的碳离子辐照造成了明显的S期和G2/M期阻滞,S期阻滞更明显,且辐照剂量越高,阻滞越严重。在辐照后第8天,各组S期阻滞基本解除,G2/M期阻滞仍然存在,但从整体上看,周期阻滞的程度有所缓解。
2.3 碳离子全身辐照后小鼠造血系统的恢复情况
外周血细胞数的统计结果见表2。在辐照后第1天,不同剂量的碳离子辐照导致小鼠外周血白细胞、淋巴细胞数明显下降,且辐照剂量越高,细胞数下降越多(p<0.01)。辐照后第3天,不同剂量组白细胞、淋巴细胞数仍持续下降(p<0.01),所有剂量组的单核细胞和除0.5 Gy剂量组外其余各剂量组的中性粒细胞数也显著下降(p<0.01)。在辐照后第8天,各组白细胞、淋巴细胞、单核细胞数均略有上升,但仍显著低于对照组(p<0.01);除6 Gy剂量组外其余各剂量组的中性粒细胞数恢复至正常水平。此外,不同剂量的碳离子全身辐射对外周血中成熟红细胞数的影响不大。

表1 碳离子全身辐照对小鼠骨髓单核细胞周期分布的影响(%,n=8)
脾脏指数分析结果见图3,在辐照后第1天,仅6Gy剂量组的脾脏指数明显降低(P=0.03);辐照后第3天,0.5 Gy剂量组脾脏指数略微上升,其余各剂量组的脾脏指数均显著下降(1 Gy,P=0.011;4和6 Gy,p<0.01),且剂量越大,下降越显著。辐照后第8天,0.5、1 Gy辐射剂量组的脾脏指数均有所恢复(0.5 Gy,P=0.719;1 Gy,P=0.088),但4 Gy与6 Gy剂量组的结果仍显著低于对照组(P=0.001)。
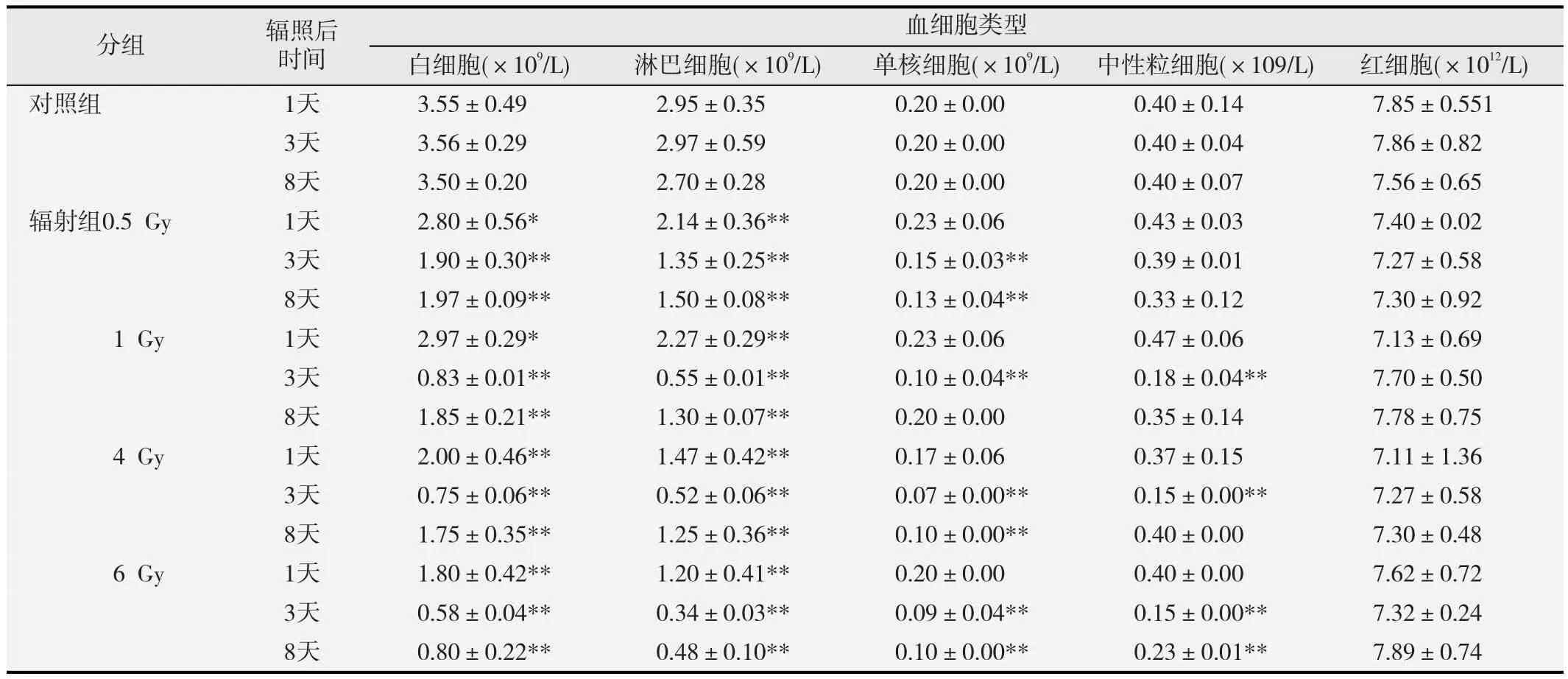
表2 碳离子全身辐照后小鼠外周血细胞的数量变化(n=8)
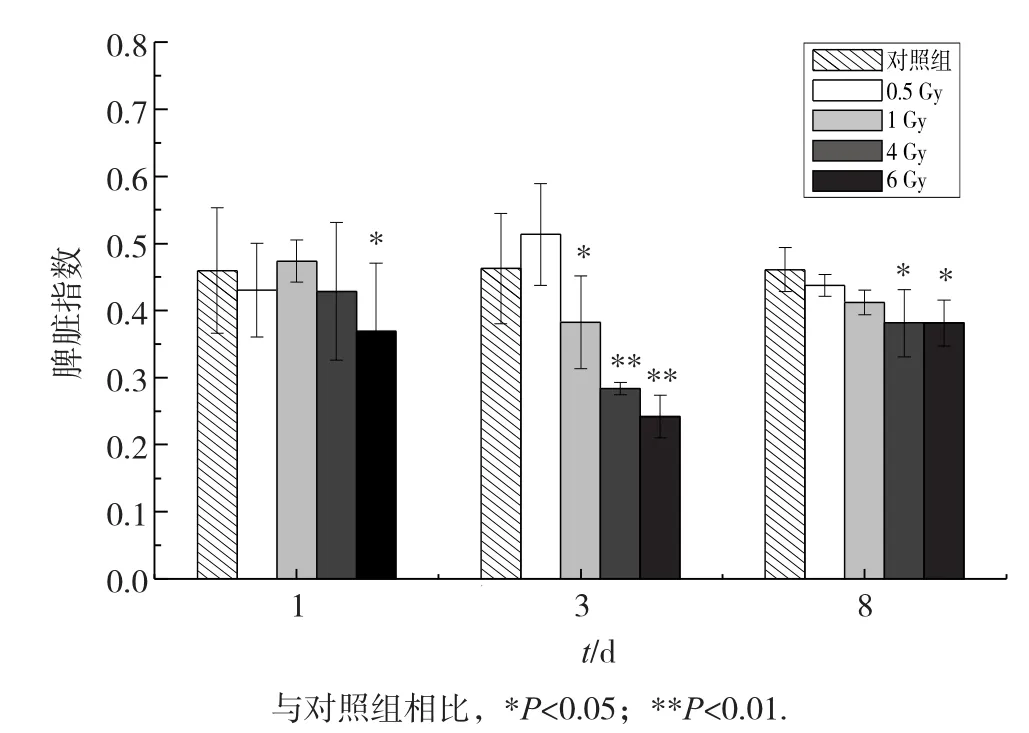
图3 碳离子全身辐照对小鼠脾脏指数的影响(n=8)
3 讨论
深入了解重离子辐射对健康组织的影响,对重离子辐射在医学上的应用以及空间重离子辐射防护都具有重要意义。本文以小鼠造血系统为研究对象,研究了不同剂量碳离子全身辐照对小鼠造血系统的损伤及其损伤后随时间的恢复情况。
DNA是电离辐射作用的主要靶分子,在细胞辐射损伤中起重要作用,因此我们首先对小鼠骨髓单核细胞的DNA损伤情况进行了检测。结果显示,碳离子辐射诱导的DNA损伤具有明显的剂量效应关系(r均≤0.96,P均<0.01),且在辐照后第3天最严重,在第8天仍显著下降。电离辐射通过直接作用和间接作用两种方式造成骨髓细胞DNA损伤,DNA损伤后会激活机体内的DNA损伤应答(DDR)通路以启动细胞内DNA损伤自修复过程。但骨髓细胞中DDR相关的许多蛋白(如ATM、ATR以及DNA-PKcs等)表达水平均很低,因此骨髓细胞的DNA损伤不能通过同源重组和非同源末端连接得到有效修复[10]。同时,电离辐射后细胞内不断产生的活性氧和活性氮等物质会进一步导致骨髓细胞的DNA损伤。这种氧化应激会在机体受到电离辐射后持续数天到数月[11],如6.5 Gy γ射线全身辐照小鼠导致其骨髓单核细胞内活性氧物质在辐照后4周内均显著高于对照,且峰值出现在辐照后第3天[12]。另外,碳离子辐射会诱导细胞产生DNA簇损伤,这类损伤会在碱基切除修复过程中产生新的DNA链断裂[13]。低修复效率、持续氧化应激与碱基切除修复过程中新产生的DNA损伤共同导致骨髓细胞DNA损伤在碳离子辐照后第3天最为严重(图2)。此后,新产生的DNA损伤逐渐减少,而原有的DNA损伤逐渐得以修复,但由于高LET碳离子辐射会产生较多难以修复的簇损伤[13-14],因此在辐照后第8天,DNA损伤虽有所减轻,但残余损伤与对照相比仍具有显著差异(图2)。与常规射线(X/γ射线)相比,高LET重离子辐射引起的DNA损伤更严重、且呈团簇状分布、空间结构复杂、难以修复[13-14],研究报道,暴露于同等剂量的X射线和碳离子射线24 h后,碳离子辐照造成的DNA残余损伤更加显著[15]。
DNA损伤能够激活细胞周期检验点[16],进而导致周期阻滞,为DNA损伤的修复提供时间[17]。骨髓单核细胞周期分布的检测结果表明,不同剂量的碳离子辐照造成了不同程度的S期和G2/M期阻滞,剂量越大,周期阻滞越明显(表1)。周期阻滞随辐照后时间的变化情况与DNA损伤程度基本一致(图2和表1)。研究表明,与常规射线相比,暴露于高LET射线后,小鼠成骨细胞因更严重的DNA损伤导致了更明显的周期阻滞[18]。2 Gy的碳离子照射会造成结肠癌细胞Caco-2产生永久的G2/M期阻滞(辐照后72 h未恢复),而5 Gy的X射线辐照造成的该种细胞G2/M期阻滞在辐照后48 h即已恢复[15]。
碳离子全身辐照还引起小鼠外周血有核细胞(白细胞、淋巴细胞、单核细胞和中性粒细胞)数量发生变化,外周血中不同细胞的辐射敏感性不同,其中淋巴细胞对碳离子辐射最敏感(表2),小鼠外周血淋巴细胞对γ射线的辐射敏感性也高于单核细胞和中性粒细胞[19]。而碳离子辐射对红细胞影响不大组(表2)。这可能是由于DNA是电离辐射损伤的重要靶标,碳离子辐射严重损伤外周血中的有核细胞,而成熟红细胞受到的损伤相对较弱。此外,碳离子辐射诱导的骨髓单核细胞DNA损伤(图2)和周期阻滞(表1)也会使外周血细胞来源匮乏[20]。随着骨髓细胞DNA损伤的修复、周期阻滞的缓解以及造血干细胞的自我更新,外周血细胞数有所回升,但在碳离子辐照后第8天,除中性粒细胞外,其余有核细胞数仍显著低于对照(表2)。碳离子全身辐照还剂量依赖性地引起小鼠脾脏指数下降(图3),刘丽等[21]也报道小鼠受到4 Gy γ射线辐射后脾脏明显萎缩。外周血细胞含量和脾脏指数可以反映小鼠造血系统恢复情况,从图3和表2结果来看,在碳离子辐照后第8天小鼠的造血系统并没有得以明显恢复。
综上,不同剂量的碳离子全身辐射会造成小鼠骨髓单核细胞产生严重的DNA损伤和明显的周期阻滞,DNA损伤和周期阻滞程度与剂量呈正比,并具有明显的时间-效应关系。碳离子辐射后小鼠脾脏指数下降以及外周血有核细胞数锐减,即碳离子辐射导致明显的骨髓抑制。在实验结束(辐照后第8天)时,骨髓细胞DNA损伤仍很严重,小鼠脾脏指数和外周血有核细胞数并未明显恢复,表明骨髓细胞DNA严重损伤使外周血细胞来源匮乏,小鼠造血系统未得到明显恢复。
[1] HAMADA N,IMAOKA T,MASUNAGA S,et al. Recent advances in the biology of heavy-ion cancer therapy[J]. J Radiat Res,2010,51(4):365-383.
[2] DURANTE M,YAMADA S,ANDO K,et al. X-rays vs.carbon-ion tumor therapy:cytogenetic damage in lymphocytes[J].Int J Radiat Oncol,2000,47(3):793-798.
[3] LOEFFLER J S,DURANTE M. Charged particle therapy—optimization,challenges and future directions[J]. Nat Rev Clin Oncol,2013,10(7):411-424.
[4] DURANTE M,CUCINOTTA F A. Heavy ion carcinogenesis and human space exploration[J]. Nat Rev Cancer,2008,8(6):465-472.
[5] HAMASAKI K,IMAI K,HAYASHI T,et al. Radiation sensitivity and genomic instability in the hematopoietic system:Frequencies of micronucleated reticulocytes in whole-body X-irradiated BALB/c and C57BL/6 mice[J]. Cancer Sci,2007,98(12):1840-1844.
[6] WANG Y,SCHULTE B A,LARUE A C,et al. Total body irradiation selectively induces murine hematopoietic stem cell senescence[J]. Blood,2006,107(1):358-366.
[7] WEIL M M,BEDFORD J S,BIELEFELDTOHMANN H,et al. Incidence of acute myeloid leukemia and hepatocellular carcinoma in mice irradiated with 1 GeV/nucleon56Fe ions[J].Radiat Res,2009,172(2):213-219.
[8] SHAO L,FENG W,LI H,et al. Total body irradiation causes long-term mouse BM injury via induction of HSC premature senescence in an Ink4a- and Arf-independent manner[J].Blood,2014,123(20):3105-3115.
[9] SPEIT G, ROTHFUSS A. The comet assay: a sensitive genotoxicity test for the detection of DNA damage and repair[J].DNA Repair Protocols,2012:79-90.
[10] SO E Y,OUCHI T. Decreased DNA repair activity in bone marrow due to low expression of DNA damage repair proteins[J].Cancer Biol Ther,2014,15(7):906-910.
[11] AZZAM E I,JAY-GERIN J P,PAIN D. Ionizing radiationinduced metabolic oxidative stress and prolonged cell injury[J].Cancer Lett,2012,327(1/2):48-60.
[12] WANG Y,LIU L,PAZHANISAMY S K,et al. Total body irradiation causes residual bone marrow injury by induction of persistent oxidative stress in murine hematopoietic stem cells[J].Free Radical Bio Med,2010,48(2):348-356.
[13] YUKA T,YOSHIYA F,HIROSHI I,et al. Role of isolated and clustered DNA damage and the post-irradiating repair process in the effects of heavy ion beam irradiation[J]. J Radiat Res,2015,56(3):446-455.
[14] WARD J F. The complexity of DNA damage:relevance to biological consequences[J]. Int J Radiat Biol,1994,66(5):427-432.
[15] SUETENS A,KONINGS K,MOREELS M,et al. Higher initial DNA damage and persistent cell cycle arrest after carbon ion irradiation compared to X-irradiation in prostate and colon cancer cells[J]. Front Oncol,2016,6(Sup):1-10.
[16] BRANZEI D,FOIANI M. Regulation of DNA repair throughout the cell cycle[J]. Nat Rev Mol Cell Biol,2008,9(4):297-308.
[17] PIWNICA-WORMS H. Cell cycle:fools rush in[J]. Nature,1999,401(6753):535-536.
[18] HU Y,HELLWEG C E,BAUMSTARK-KHAN C,et al. Cell cycle delay in murine pre-osteoblasts is more pronounced after exposure to high-LET compared to low-LET radiation[J]. Radiat Environ Bioph,2014,53(1):73-81.
[19] HEYLMANN D,RÖDEL F,KINDLER T,et al. Radiation sensitivity of human and murine peripheral blood lymphocytes,stem and progenitor cells[J]. Biochim Bioph Acta,2014,1846(1):121-129.
[20] FLIEDNER T M,GRAESSLE D,PAULSEN C,et al.Structure and function of bone marrow hemopoiesis:mechanisms of response to ionizing radiation exposure[J]. Cancer Biother Radio,2002,17(4):405-426.
[21] 刘丽,金宏,王先远,等. 大豆异黄酮对电离辐射小鼠脾脏细胞周期、凋亡与增殖的影响[J]. 中国应用生理学杂志,2006,22(4):497-500.
