169份辣椒种质资源的遗传多样性分析
2018-04-08赵红星孟祥锋魏小春李金玲驻马店市农业科学院驻马店市蔬菜遗传育种工程技术研究中心河南驻马店46000河南省农业科学院园艺研究所河南郑州45000南阳市农业科学院河南南阳47000
李 艳,赵红星,王 勇,姜 俊*,孟祥锋,魏小春,李金玲(.驻马店市农业科学院 驻马店市蔬菜遗传育种工程技术研究中心,河南 驻马店 46000; .河南省农业科学院 园艺研究所,河南 郑州 45000; .南阳市农业科学院,河南 南阳 47000)
辣椒属(Capsicum)起源于中美洲和南美洲地区,有着悠久的栽培历史,其野生种质资源极为丰富。目前,辣椒是我国栽培面积最大的三大蔬菜之一。辣椒种质资源指携带有不同基因型的辣椒野生种、近缘种和栽培种,是开展辣椒育种和基础研究的基础。由于我国地域广阔,土壤、气候类型复杂,是重要的辣椒次生起源中心,所以我国野生种和栽培种种质资源十分丰富。利用其资源优势可研究鉴别种质资源中特异种质、筛选核心亲本,避免育种的盲目性,提高育种效率。
1975年,Sambrook等[1]发明了限制性片段长度多态性(RFLP)技术,随后,随着分子生物学的发展和模式植物全基因组序列测序的完成,相应地开发出了AFLP、RAPD、ISSR、SSR等一系列分子标记。Tam等[2]利用SSAP、AFLP和SSR 3种DNA分子标记比较分析了辣椒和西红柿的遗传多样性。李晴等[3]采用11个随机RAPD标记对37份辣椒资源材料进行扩增分析,聚类分析将37份辣椒资源材料分为5个类群,每个类群内的资源材料亲缘关系较近,但其遗传关系与地域、距离并无明显相关性。周晶等[4]利用52对SSR多态性引物分析了89份辣椒资源材料的遗传关系,聚类结果表明,利用SSR标记进行辣椒遗传多样性分析是可行的。贾豪等[5]首次用不同地理来源的24份辣椒种质资源,对基于辣椒全基因组编码区序列设计的152对SSR引物进行筛选,获得条带清晰、稳定性好的41对SSR多态性引物,并将24份辣椒聚为7类,结果基本与辣椒种类来源相符。SSR标记属于共显性类分子标记,与其他几种分子标记相比,具有多态性信息丰富、扩增结果稳定性好、费用低等优点,是研究群体遗传多样性和亲缘关系远近较理想的标记[6]。
由于辣椒种质资源的遗传变异性大,种质间的交流不仅丰富了辣椒资源材料的遗传信息,也为辣椒品种的改良和新品种的选育提供了基础。(本研究以基于辣椒全基因组编码区序列开发设计覆盖12条染色体的152对SSR引物为基础,经过前期试验筛选出17对多态性较好的SSR引物),对169份辣椒种质资源进行了遗传多样性分析,为辣椒资源材料的收集、鉴定、保存和新品种的选育提供理论指导。
1 材料和方法
1.1 试验材料
试验材料为驻马店市农业科学院园艺所多年来收集的来源于不同地区且性状存在差异的169份辣椒资源材料,材料信息见表1。所有资源材料均种植在驻马店市农业科学院试验基地。
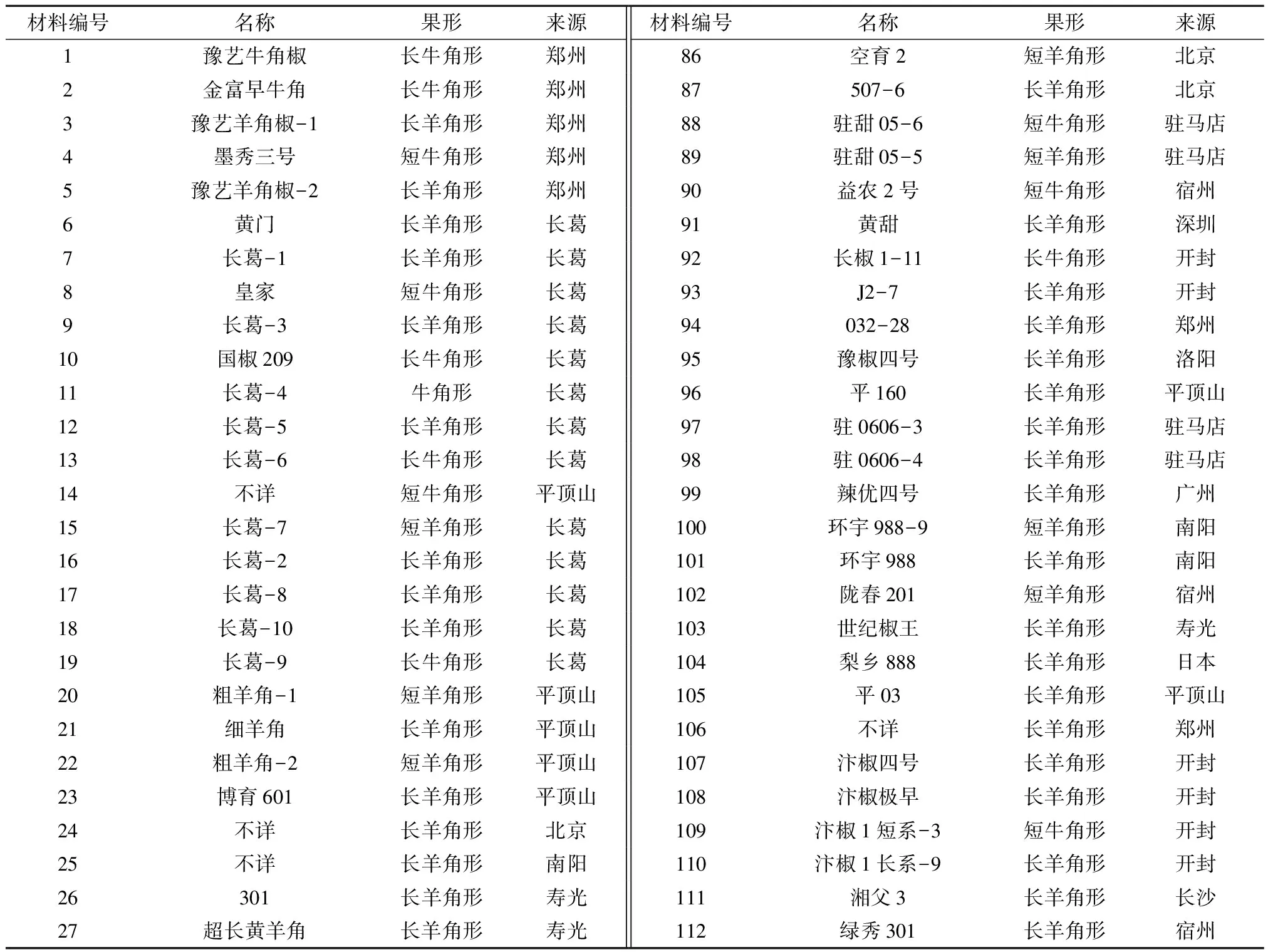
表1 辣椒种质资源的名称和来源

续表1 辣椒种质资源的名称和来源
1.2 方法
1.2.1辣椒总DNA提取采取辣椒幼嫩叶片为试验材料,利用改良过的CTAB法提取辣椒总DNA[5],用1.0%琼脂糖凝胶电泳检测提取的辣椒样品总DNA的质量,测定样品DNA的质量浓度,并稀释至50 ng/μL,用于后续PCR扩增。
1.2.2引物的筛选根据已经测序的CM334和遵辣1号基因组数据库[7-8],参照黄瓜中开发SSR引物的方法进行辣椒全基因组编码区序列SSR引物的开发[9-10],以随机挑选覆盖辣椒12条染色体的152对SSR引物为基础,筛选出17对多态性好的引物用于全部试验材料的检测(表2),分析其遗传多样性。
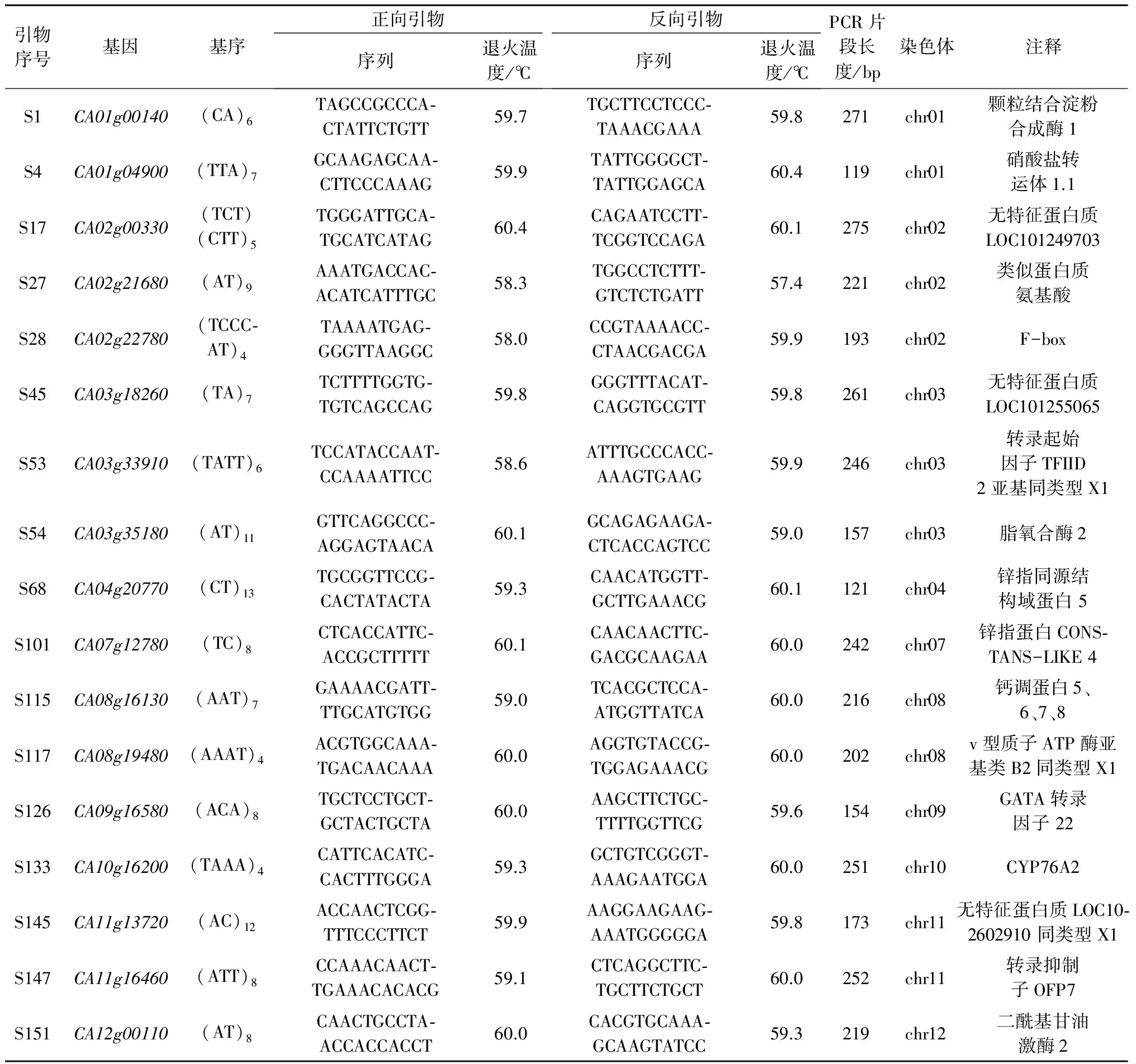
表2 17对多态性SSR引物信息
1.2.3PCR扩增及检测PCR反应体系为20 μL:10×TaqBuffer (Mg2+plus) 2 μL,TaqDNA Polymerase(5 U/μL) 0.1 μL,dNTP Mix (10 mmol/L each) 0.4 μL,ddH2O 13.9 μL,正、反向引物各0.8 μL,模板DNA 2 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性45 s,57 ℃退火40 s,72 ℃延伸60 s,35个循环;72 ℃延伸10 min;4 ℃低温保存。PCR扩增结束后使用9%聚丙烯酰胺凝胶对PCR扩增产物进行电泳检测。
1.2.4数据分析根据二元数据的统计原则,对试验结果中多态性条带进行统计,有条带的记为1,无条带的记为0,模糊条带不统计。利用Phylip软件进行统计结果的分析,并用UPGMA法对169份试验材料进行聚类分析,生成聚类分析图,明确辣椒种质资源材料间的亲缘关系。
1.2.5遗传多样性分析根据统计的扩增结果,利用POPGENE32软件计算试验材料的等位基因数(Na)、有效等位基因数(Ne)、期望杂合度(He)、观测杂合度(Ho)和香浓指数(I)[11];采用PIC1.06并根据Nei遗传距离计算引物的多态性信息含量(PIC)[12]。
2 结果与分析
2.1 SSR引物多态性分析
利用已合成的152对SSR引物,用4种不同类型的辣椒资源材料筛选出17对多态性较好的引物,利用其对不同来源的169份辣椒材料进行PCR扩增及聚丙烯酰氨凝胶电泳检测(图1)。据统计,17对SSR引物共扩增出46个多态性位点,平均每对引物扩增出2.71个位点,其中扩增出2个等位基因的引物有14对,而产生3个等位基因的引物有3对,分别为S1、S147、S151(表3)。
2.2 遗传多样性分析
利用POPGENE32软件对试验获得的扩增结果进行计算 (表3)。辣椒资源材料的等位基因数为2~3,平均值为2.176 5;有效等位基因数为1.113 9~2.587 9,平均值为1.629 1;期望杂合度为0.103 7~0.622 0,平均值为0.360 2;观测杂合度为0~1,平均值为0.834 7;香农指数为0.210 3~1.013 0,平均值为0.549 6;多态信息含量为0.166 2~0.568 1,平均值为0.310 6。表明筛选出的引物多态性信息丰富,参试辣椒资源材料的遗传多样性高。
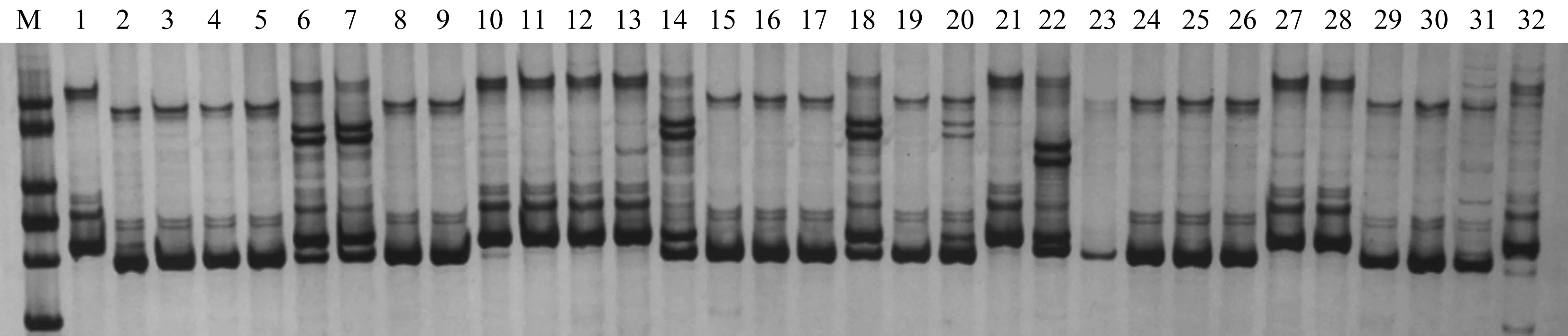
M为Maker;1—32为样品图1 引物S115对部分辣椒材料SSR扩增结果
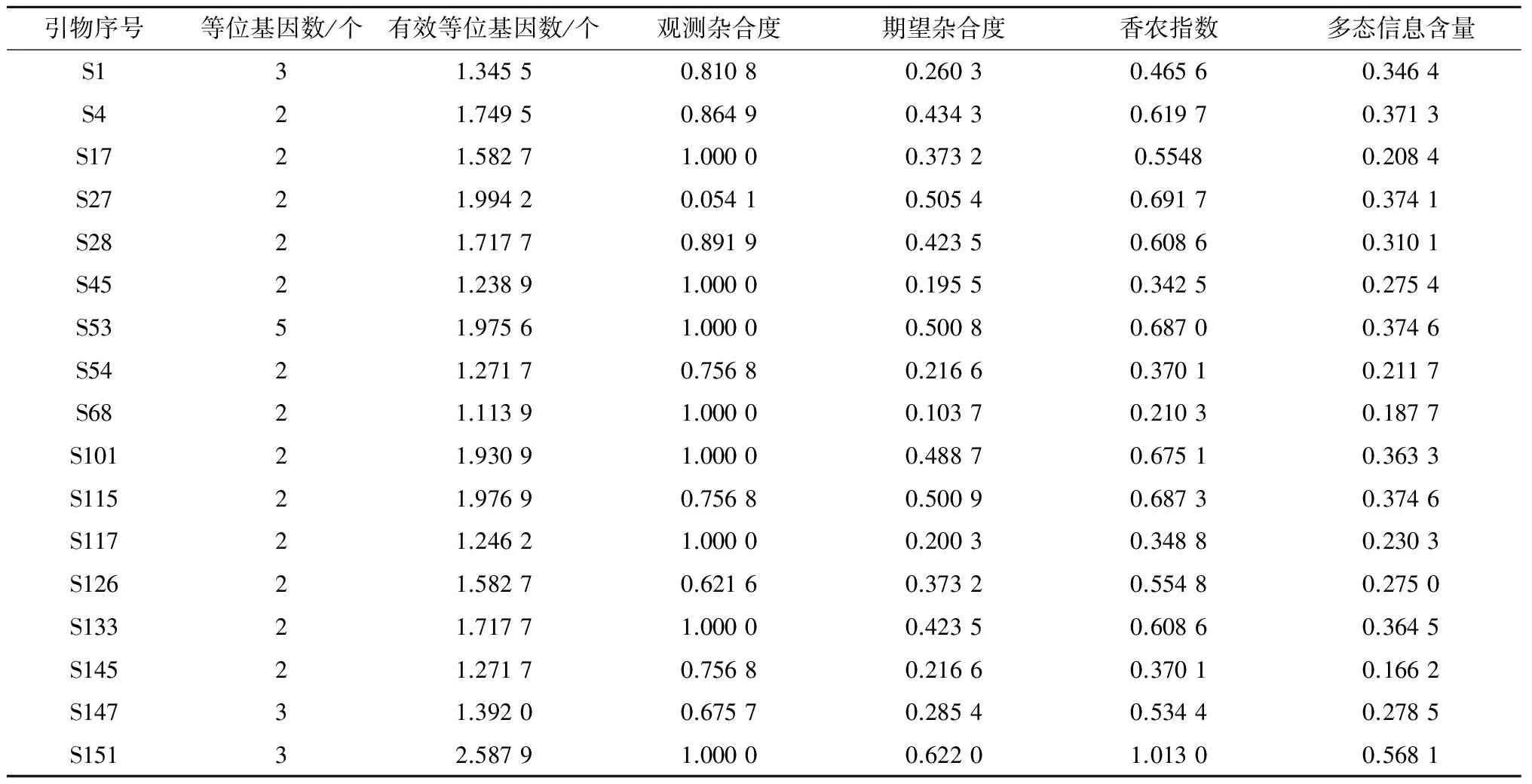
表3 辣椒种质资源遗传多样性相关指标
2.3 聚类结果分析
将垂直电泳结果转化为0-1矩阵,利用Phylip软件对PCR扩增结果进行分析,采用UPGMA方法进行聚类和亲缘关系远近分析(图2)。结果表明,将169份资源材料分为7类。第1类为材料D10,与其他辣椒资源材料的亲缘关系最远;第2类为材料D8,除D10外,与其他辣椒资源材料的亲缘关系最远;第3类为材料D4,与大部分辣椒资源材料的亲缘关系较远;第4类为材料D62和D106,这2份材料亲缘关系最近;第5类为材料D47;第6类为材料D58和D141,这2份材料亲缘关系也最近;第7类为其他的大部分资源材料。

图2 169份辣椒资源遗传多样性聚类分析
3 结论与讨论
SSR分子标记一般是由1~6个碱基对串联组成的核苷酸重复序列,是通过PCR特异性扩增的共显性类型的遗传标记[13]。全基因组水平上的基因编码区的SSR标记在基因组中的位置是确定的,能够检测出转录区的多态性,较适合用于群体遗传关系的评价。本研究基于辣椒全基因组编码区序列设计152对SSR引物,前期试验筛选出17对多态性好的SSR引物,利用这些引物对来源不同的169份辣椒资源材料进行扩增,并统计扩增结果。试验结果表明,共扩增出46个多态性位点,平均每对引物扩增出2.71个等位基因,平均多态性信息含量为0.310 6。罗玉娣等[14]利用21对SSR引物对33份辣椒种质进行遗传多样性分析,结果表明,每对SSR引物平均检测出2.6个等位基因,且聚类分析时把同种的辣椒材料基本聚为一类,说明SSR分子标记是研究辣椒材料遗传关系的有效手段。周晶等[4]利用109对SSR引物对不同来源的89份辣椒资源材料进行了PCR扩增,每对SSR引物平均扩增出2.66个等位基因,且聚类分析结果表明,SSR分子标记用来分析辣椒资源材料的遗传多样性是可行的。陈文超等[15]利用33对SSR分子标记对31份辣椒材料进行了遗传多样性分析,结果表明,每对SSR标记平均扩增出2.76个等位基因。本试验检测出的平均等位基因数均比罗玉娣等[14]、周晶等[4]的结果高,与陈文超等[15]检测出的平均等位基因数最接近,表明本研究所筛选的SSR引物具有较丰富的多态性,可以真实地反映出种质之间的遗传多样性。
在辣椒资源材料聚类分析中,本研究将169份辣椒资源材料聚为7类,遗传聚类分析结果清晰地表明了辣椒种质的遗传多样性和种质间亲缘关系的远近,可有效提高辣椒的育种效率,减少育种目标的盲目性,并为今后的辣椒新品种的选育提供理论指导。
参考文献:
[1]Sambrook J,Williams J,Sharp P A,etal.Physical mapping of temperature-sensitive mutations of adenoviruses [J].J Mol Biol,1975,97(3):369-390.
[2]Tam S M,Mhiri C,Vogelaar A,etal.Comparative analyses of genetic diversities within tomato and pepper collections detected by retrotransposon-based SSAP,AFLP and SSR[J].Theor Appl Genet,2005,110(5):819-831.
[3]李晴,张学时,张广臣,等.辣椒种质遗传多样性的RAPD分析[J].北方园艺,2010(22):118-122.
[4]周晶,沈火林,杨文才,等.辣椒遗传多样性的SSR分析[J].华北农学报,2009,24(S1):62-67.
[5]贾豪,魏小春,姚秋菊,等.辣椒SSR标记种质资源遗传多样性的分析[J].分子植物育种,2017(1):353-363.
[6]Zhebentyayeva T N,Reighard G L,Gorina V M,etal.Simple sequence repeat(SSR) analysis for assessment of genetic variability in apricot germplasm[J].Theor Appl Genet,2003,106(3):435-444.
[7]Kim S,Park M,Yeom S,etal.Genome sequence of the hot pepper provides insights into the evolution of pungency inCapsicumspecies[J].Nat Genet,2014,46(3):270-278.
[8]Qin C,Yu C S,Shen Y,etal.Whole-genome sequencing of cultivated and wild peppers provides insights intoCapsicumdomestication and specialization[J].Proc Natl Acad Sci USA,2014,11(14):5135-5140.
[9]Lu J,Qi J J,Shi Q X,etal.Genetic diversity and population structure of cucumber(CucumissativusL.) [J].PLoS One,2012,7(10):e46919.
[10]Ren Y,Zhang Z H,Liu J H,etal.An integrated genetic and cytogenetic map of the cucumber genome[J].PLoS One,2009,4(6):e5795.
[11]Kumar S,Tamura K,Nei M.MEGA3:Integrated software for molecular evolutionary genetics analysis and sequence alignment[J].Brief Bioinform,2004,5(2):150-163.
[12]Nei M.Estimation of average heterozygosity and genetic distance from a small number of individuals [J].Genetics,1978,89(3):583-590.
[13]Powell W,Machray G C,Provan J.Polymorphism revealed by simple sequence repeats [J].Trends Plant Sci,1996,1(7):215-222.
[14]罗玉娣,李建国,李明芳.用SSR标记分析辣椒属种质资源的遗传多样性[J].生物技术通报,2006 (S1):337-341.
[15]陈文超,张竹青,邹学校.辣椒种质遗传多样性的EST-SSR分析[J].植物遗传资源学报,2013,14(6):1137-1141.
