盐胁迫环境下接种根际促生细菌对白蜡树根际生物学特征及其生长的影响
2018-03-29井大炜马海林刘方春杜振宇马丙尧昝林生贾海慧郭英华丁洪星
井大炜, 马海林, 刘方春, 杜振宇, 马丙尧, 昝林生, 贾海慧, 郭英华, 丁洪星
(1.德州学院 资源环境与规划学院, 山东 德州 253023; 2.山东省林业科学研究院, 山东 济南 250014; 3.德州学院生态与园林建筑学院, 山东 德州 253023; 4.济南市国有苗圃, 山东 济南 250100; 5.济南花木联合开发公司, 山东 济南 250100)
土壤盐渍化是造成当今世界土地退化的重要原因之一,盐渍化土壤在全球分布的面积非常广泛,已有超过1.00×109hm2的盐渍化土地急需有效、可持续地管理[1-2]。由于灌溉方式不当、滥砍乱伐、破坏草原及盲目施肥等原因,全球每年的盐渍化土地面积仍在快速增长[3]。中国现有盐渍化土地面积约3.63×107hm2,占全国可利用土地面积的4.88%[3]。解决这一问题的根本途径在于恢复植被,改善土壤结构,这是关系到国民经济可持续发展与和谐社会构建的重大课题。多年来,人们围绕盐碱地改良开展了大量的探索研究工作,也积累了许多盐碱地改良技术,比如土工排水体排水技术、隔盐层技术、集雨洗盐技术与表面覆盖技术等[4]。
植物根际促生细菌(plant growth-promoting rhizobacteria, PGPR)是指生存在植物根圈范围内,对植物生长有促进或对病原菌有拮抗作用的有益细菌的统称,对植物生长与病害防治有极其重要的作用[5]。PGPR对土壤中非寄生性根际有害微生物与有害病原微生物能起到生防作用,并产生利于植物生长的代谢产物,进而促进植物的生长发育[6]。PGPR还具有降解土壤中污染物的作用,并减少生产中使用化肥、农药带来的环境污染与土壤板结等问题[7]。有研究表明[8],接种产ACC脱氨酶或产生长素的PGPR,可显著促进作物生长。也有研究认为[5],接种PGPR对植物根际生态环境的改善,尤其是植物根系生长有显著促进作用。同时,也有关于在干旱生境下接种产细胞分裂素的PGPR,并能显著增强林木干旱耐受性的研究报道[9]。可见,PGPR的开发研究正逐渐成为现代林农领域的研究热点,但有关PGPR在盐胁迫环境中对根际生物学特征影响的研究甚少。
根际是距离根系表面0—4 mm的土壤区域[10]。林木根际是由树木细根—土壤—微生物—酶组成的一个特殊微生态系统,也是各种养分、水分及各种物质进入根系参与物质循环和能量转化的重要场所之一,是与原土体差异较大的特殊土壤微区[5]。土壤微生物作为土壤生态系统的重要组成部分,推动着土壤的碳、氮循环[11]。土壤微生物种类、数量在很大程度上影响着微生物的活性。土壤盐渍化不仅可以直接影响微生物的活性,还能通过改变土壤的理化性状影响微生物的生存环境,进而影响微生物的种类与数量[3]。土壤酶也是土壤有机成分中极其活跃的部分,参与了土壤中大部分的生物化学过程,对物质循环与养分形成、积累有抑制或促进作用[10,12]。因此,近年来许多学者认为,积极改善土壤微生态环境,充分协调根际中微生物与酶,有利于提高作物在逆境下的耐受能力。白蜡树(Fraxinuschinensis)具有较强的抗逆性能,在盐碱地区土壤改良与生态体系构建中发挥着重要作用[3]。为此,本文选取具有促生功能的阴沟肠杆菌为供试菌株,以白蜡树为试材,开展不同盐胁迫梯度下接种PGPR对白蜡树根际生物学特征的影响研究,旨在明确PGPR对白蜡树耐盐性的改善效果,为盐胁迫环境下PGPR的推广应用提供理论依据。
1 材料与方法
1.1 试验地点与供试材料
试验地点设在山东省德州市农业科学研究院试验大棚,供试土壤为潮土,土壤速效氮含量32.87 mg/kg,速效磷含量28.06 mg/kg,速效钾含量86.50 mg/kg,有机质11.93 g/kg,可溶性盐分为0.069 5%,pH值8.06。供试白蜡树为1年生实生苗,株高(8.72±3.46)cm,地径(0.19±0.02)cm。
利用梯度稀释法与三区划线法从白蜡树的根际中分离、纯化出细菌分离物,然后参考Liu等[9]的生物法(小麦叶片保绿和萝卜子叶增重)筛选出1株促生效果较好的植物根际促生细菌,综合其生理生化特征与16 S rRNA基因序列分析,鉴定为:阴沟肠杆菌(Enterobactercloacae)TIA062。将该菌株接入牛肉膏蛋白胨培养基(牛肉膏0.3%,蛋白胨1%,氯化钠0.5%,琼脂2%,pH值7.0~7.2,质量百分比)中,于37 ℃,180 r/min条件下振荡培养2~3 d。然后,接种到液体培养基中(乳糖2%,蛋白胨2%,K2HPO40.15%, MgSO4·7 H2O 0.02%,CaCl20.01%,pH值6.2~6.8),接种量10%,于30~35 ℃摇床培养,转速180 r/min,培养12 h,利用平板计数法测定每毫升含菌量,计算菌液浓度,统一稀释至2.00×108cfu/ml。
1.2 试验设计
于2016年6月4日选取长势基本一致的苗木进行盆栽,盆高20 cm,宽30 cm。每盆称土9.8 kg。
试验共设7个处理,分别为: ①CK:对照,不加NaCl和PGPR; ②LS:轻度盐胁迫,盐分质量分数0.2%; ③MS:中度盐胁迫,盐分质量分数0.4%; ④SS:重度盐胁迫,盐分质量分数0.6%; ⑤LS+P:在处理2的基础上加入PGPR菌液; ⑥MS+P:在处理3的基础上加入PGPR菌液; ⑦SS+P:在处理4的基础上加入PGPR菌液。重复5次。处理5,6,7是分别取PGPR菌液10 ml,稀释至150 ml,均匀浇灌于白蜡树苗根系周围;然后浇水至田间持水量的75%,每天定时浇水,维持土壤含水量为田间持水量的65%~70%。
1.3 测定项目与方法
2016年9月29日首先用游标卡尺和卷尺测量白蜡树苗的地径、株高,然后采用剥落分离法[12]采集根际土,并将所取根际土样混匀后分为2份:一份鲜样迅速用于土壤微生物数量与微生物量碳、氮的测定;另一份自然风干,过1 mm筛后用于土壤酶活性的测定。
土壤微生物数量采用稀释平板计数法,其中细菌数、放线菌数与真菌数的测定分别采用牛肉膏蛋白胨琼脂培养基、改良高氏1号培养基+重铬酸钾与马丁培养基+孟加拉红+硫酸链霉素[5]。微生物量碳、氮采用氯仿熏蒸K2SO4浸提法测定[5]。土壤脲酶、多酚氧化酶、过氧化氢酶和蔗糖酶活性的测定分别采用苯酚钠—次氯酸钠比色法、邻苯三酚比色法、高锰酸钾滴定法和Na2S2O3滴定法[13]。根系体积采用排水法测定;根系总吸收面积、活跃吸收面积采用甲烯蓝吸附法[14]测定。
1.4 数据处理
采用SPSS 19.0软件进行数据统计分析,采用双因素方差分析(two-way ANOVA)与最小显著差异法(LSD)比较不同处理组间的差异,显著性水平设定为α=0.05。
2 结果与分析
2.1 根际微生物数量与微生物量碳、氮
由表1可见,白蜡树根际微生物以细菌为主,放线菌次之,真菌最少,其所占微生物总量的比例分别为70.78%~79.17%,20.23%~28.78%和0.44%~0.60%。在盐胁迫生境中,白蜡树根际的微生物数量显著降低,且微生物数量随土壤盐分的增加降幅增大。与CK相比,LS,MS和SS处理的细菌数分别下降7.49%,19.81%和38.93%。当接种PGPR后,各处理对应的细菌和放线菌数量显著增加,而真菌数变化较小。LS+P处理的细菌数、放线菌数和微生物总量均达最高值,并显著高于其他处理,分别较CK提高14.64%,24.01%和17.04%。土壤微生物总量的变化趋势与细菌数一致。从表1还可知,不同处理的微生物量碳、氮含量呈现出基本一致的变化规律,加菌液处理均高于对应的不加菌液处理。以上分析可知,土壤盐胁迫会导致白蜡树根际微生物数量与微生物量碳、氮含量显著下降,而接种根际促生细菌可减弱盐分胁迫的影响。

表1 不同处理对白蜡树根际微生物数量与微生物量碳、氮含量的影响
注:CK:对照,不加NaCl和PGPR; LS:轻度盐胁迫,盐分质量分数0.2%; MS:中度盐胁迫,盐分质量分数0.4%; SS:重度盐胁迫,盐分质量分数0.6%; LS+P:在SS的基础上加入PGPR菌液; MS+P:在LS+P的基础上加入PGPR菌液; SS+P:在MS+P的基础上加入PGPR菌液。数据为平均值±标准误; 同列数据后不同小写字母表示处理间差异显著(p<0.05)。下同。
2.2 根际酶活性
从表2可见,不同盐胁迫梯度均显著降低了白蜡树根际的脲酶、多酚氧化酶、过氧化氢酶和蔗糖酶活性;当接种PGPR后,对应的脲酶、多酚氧化酶和蔗糖酶活性显著升高,而过氧化氢酶活性的增幅较小。以LS+P处理的脲酶、多酚氧化酶和蔗糖酶活性为最高,与CK差异不显著,但显著高于其他处理,其中脲酶活性分别较LS,MS,SS,MS+P和SS+P处理均提高16%以上。MS+P处理的脲酶、蔗糖酶活性与LS处理无显著性差异,而多酚氧化酶、过氧化氢酶活性明显低于LS处理。SS+P处理的蔗糖酶活性与MS处理差异未达显著水平,而脲酶、多酚氧化酶活性显著低于MS处理。由此可见,随土壤盐分梯度的增加,白蜡树根际酶活性表现出递减的变化趋势,而接种PGPR能使对应的脲酶、多酚氧化酶和蔗糖酶活性显著升高。
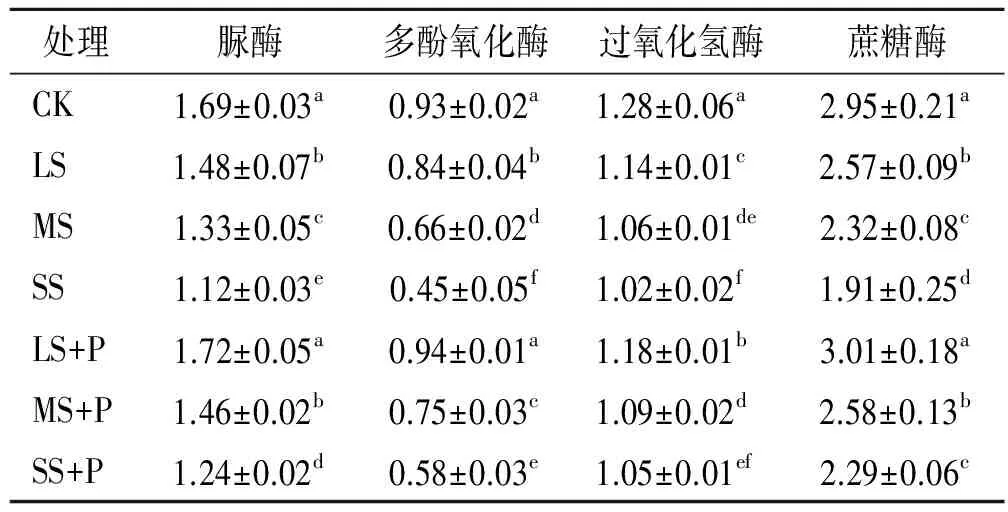
表2 不同处理对白蜡树根际酶活性的影响 ml/(g·h)
2.3 根系吸收面积
从表3可知,土壤盐分对白蜡树根系产生了较大影响。随着土壤盐分的增加,白蜡树的根体积、总吸收面积和活跃吸收面积呈逐渐降低的趋势,且下降幅度越来越大。当接种PGPR后,加菌液处理的根体积、总吸收面积和活跃吸收面积均高于对应的不加菌液处理,其中LS+P处理的根体积、总吸收面积与CK差异不显著,而活跃吸收面积显著高于CK 15.97%;同时,LS+P,MS+P和SS+P处理的根系指标呈递减的变化趋势。从表3还可见,盐胁迫使活跃吸收面积/总吸收面积的比值较对照有上升趋势;接种PGPR后,对应的比值继续升高,以LS+P处理为最高,并与其他处理差异达显著水平。数据分析表明,在不同梯度的盐胁迫环境下接种根际促生细菌能不同程度地提高白蜡树根系的总吸收面积与活跃吸收面积,其中在轻度盐胁迫下接种的效果最显著,这能更利于促进根系对水分、养分的吸收。
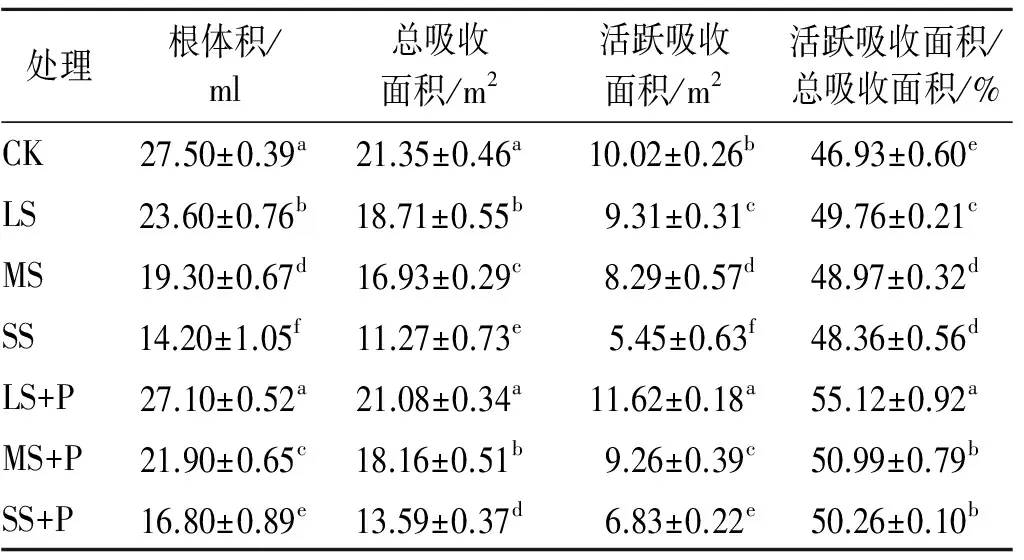
表3 不同处理对白蜡树根系总吸收面积与活跃吸收面积的影响
2.4 地径、株高
从图1可见,与对照相比,轻度、中度和重度盐胁迫使白蜡树的地径、株高显著降低,且胁迫程度越高,下降幅度也越大。而接种PGPR使白蜡树的地径、株高呈明显升高趋势,其中LS+P处理的地径、株高与CK无显著性差异,但显著高于其他处理,地径分别较LS,MS,SS,MS+P和SS+P处理高出13.80%,30.01%,95.64%,15.58%和69.57%,株高分别高出19.08%,41.41%,124.84%,24.11%和71.84%。同时,MS+P处理的地径、株高显著高于SS+P处理。综上所述,土壤盐胁迫可明显抑制白蜡树地径、株高的生长,而接种根际促生细菌能显著促进白蜡树的生长,其中在轻度盐胁迫生境下接种根际促生细菌的促长效应最明显。

图1 不同处理对白蜡树地径与株高生长的影响
3 讨 论
根际是植物—土壤—微生物—酶相互作用的特殊生态环境,根际微生物数量和种类是表征土壤肥力的主要生物学指标[15]。本试验研究表明,盐胁迫环境下白蜡树根际细菌数占微生物总量的比例为70.78%~79.17%,放线菌为20.23%~28.78%,而真菌仅占0.44%~0.60%。盐胁迫下接种根际促生细菌并没有大幅度改变土壤中三大功能微生物的总体比例。盐胁迫导致根际微生物数量显著下降,且随着盐胁迫程度的加剧,降幅呈增加趋势,这与莫俊杰等[16]对盐胁迫下甘蔗根际微生物量的研究结论相似。这说明白蜡树根际中的微生物种群对盐分浓度变化十分敏感,土壤盐胁迫改变了土壤微生物的生长繁殖环境,从而使其种群数量受到了影响[17]。本试验还得出,接种PGPR能使对应的微生物数量显著提高,其原因可能是由于接种阴沟肠杆菌可分泌生长素,促进白蜡树根系的生长,并刺激根系活性,促使其根系分泌物的增多,从而为微生物的生长繁殖提供了营养物质。其中在轻度胁迫下接种的效果最显著,其次为中度或重度胁迫下接种,表明低盐环境可能更利于根际促生细菌的定植与繁殖生长,也说明根际促生细菌的影响作用与土壤盐分梯度有一定内部关联。
土壤酶主要来自微生物和植物根系的分泌。土壤中盐分的增加不仅影响到植物的生长发育,而且对土壤自身的物理化学性状也产生不良效应[18]。土壤酶活性的变化可从一个侧面反映土壤性状的改变[19]。本研究表明,在盐胁迫生境中,白蜡树根际的脲酶、多酚氧化酶、过氧化氢酶和蔗糖酶活性显著降低,且随着盐胁迫程度的加剧,下降幅度越来越大。这与周德平等[17]关于盐胁迫对蔬菜地土壤酶活性的研究结果相一致。其原因可能在于盐分改变了土壤环境,盐分产生的渗透胁迫与离子毒害均会抑制土壤酶的活性。当接种PGPR后,对应的脲酶、多酚氧化酶和蔗糖酶活性显著升高。究其原因在于: ①PGPR能显著提高白蜡树根际的微生物数量,这可能会增加微生物向土壤中分泌的土壤酶量[19]; ②该种促生菌可产生长素,能刺激白蜡树根系分泌物的增多。
当植物受到盐胁迫时,根系首先感应到根际的变化。植物根系是活跃的吸收器官与合成器官,根系吸收面积可反映根系吸收水分与养分的能力,而根系活跃吸收面积则能在一定程度上反映根系活力的情况[14]。有研究发现[20-21],作物通过某种机制感知根际养分变化,然后通过启动体内特定基因的表达和相应的生理生态反应,最终引起根系的形态与生理特性变化,来增加养分的吸收。因此,植物对养分的吸收与产量的形成是根系形态特征与生理特性共同影响的结果。本试验得出,盐胁迫导致白蜡树根系的总吸收面积与活跃吸收面积显著降低,但接种PGPR能使根系总吸收面积与活跃吸收面积明显升高。这可能是由于该促生细菌能分泌生长素,明显增强了白蜡树的根系活性,同时还能显著改善土壤微生态环境条件,进而为根系创造了优越的生长环境。
本研究还得出,盐胁迫明显抑制了白蜡树地径、株高的生长,而接种阴沟肠杆菌TIA062则可显著促进其生长。这可能与PGPR能显著提高白蜡树根际微生物数量和酶活性,并增加白蜡树根系总吸收面积与活跃吸收面积有密切关联。这进一步验证了根际促生细菌可通过改善根系生长的微域环境条件,进而促进苗木的生长。
4 结 论
盐胁迫显著降低了白蜡树根际的微生物数量、微生物量碳、氮含量和脲酶、多酚氧化酶、过氧化氢酶、蔗糖酶活性,且其降幅随着盐胁迫梯度的增加而增大;当接种PGPR后,对应的指标均呈上升趋势,其中轻度盐胁迫接种PGPR处理的细菌数、放线菌数和微生物总量达最高。同时,白蜡树的根体积、根系总吸收面积与活跃吸收面积随着盐胁迫程度的加剧呈递减趋势,但接种PGPR后,对应的根系指标均有增加,其中轻度盐胁迫接种PGPR处理的活跃吸收面积显著高于对照15.97%。此外,同对照相比,不同程度盐胁迫均显著降低了白蜡树的地径、株高,而接种PGPR则显著提高了地径、株高,其中轻度盐胁迫接种PGPR处理的地径、株高与对照差异不显著,但显著高于其他处理。综上,轻度盐胁迫下(盐分含量0.2%)接种阴沟肠杆菌能显著改善白蜡树根际生物学特征,并促进白蜡树生长,其作用效果显著优于中度、重度盐胁迫下接种阴沟肠杆菌。
[1] Huo Long, Pang Huancheng, Zhao Yonggan, et al. Buried straw layer plus plastic mulching improves soil organic carbon fractions in an arid saline soil from Northwest China[J]. Soil and Tillage Research, 2017,165:286-293.
[2] 王佳丽,黄贤金,钟太洋,等.盐碱地可持续利用研究综述[J].地理学报,2011,66(5):673-684.
[3] 马海林,刘方春,马丙尧,等.白蜡树容器苗和裸根苗对盐分胁迫的生长响应[J].东北林业大学学报,2016,44(6):13-16.
[4] 王弯弯,诸葛玉平,王慧桥,等.外源NO对盐胁迫下小麦幼苗生长及生理特性的影响[J].土壤学报,2017,54(2):516-524.
[5] 刘方春,邢尚军,马海林,等.干旱生境中接种根际促生细菌对核桃根际土壤生物学特征的影响[J].应用生态学报,2014,25(5):1475-1482.
[6] 刘方春,马海林,杜振宇,等.金银花容器苗对干旱胁迫下接种根际促生细菌的生理响应[J].生态学报,2015,35(21):7003-7010.
[7] 丁新景,黄雅丽,马风云,等.根际促生菌对景天科多肉植物雪莲的促生作用[J].东北林业大学学报,2016,44(12):26-30.
[8] 康贻军,程洁,梅丽娟,等.植物根际促生菌作用机制研究进展[J].应用生态学报,2010,21(1):232-238.
[9] Liu Fangchun, Xing Shangjun, Ma Hailin, et al. Cytokinin-producing, plant growth-promoting rhizobacteria that confer resistance to drought stress in Platycladus orientalis container seedlings[J]. Applied Microbiology and Biotechnology, 2013,97(20):9155-9164.
[10] 井大炜,邢尚军,刘方春,等.保水剂施用方式对侧柏根际微生态环境的影响[J].农业机械学报,2016,47(5):146-154.
[11] 沈仁芳,赵学强.土壤微生物在植物获得养分中的作用[J].生态学报,2015,35(20):6584-6591.
[12] 井大炜,王明友,张红,等.蚯蚓粪配施尿素对豇豆根系特征与根际土腐殖质的影响[J].农业机械学报,2017,48(1):212-219.
[13] 关松荫.土壤酶及其研究方法[M].北京:中国农业出版社,1986:274-332.
[14] 井大炜,邢尚军,刘方春,等.保水剂—尿素凝胶对侧柏裸根苗细根生长和氮素利用率的影响[J].应用生态学报,2016,27(4):1046-1052.
[15] 刘磊,李彩凤,郭广昊,等. NaCl+Na2SO4胁迫对甜菜根际土壤微生物数量及酶活性的影响[J].核农学报,2016,30(10):2033-2040.
[16] 莫俊杰,彭诗春,叶昌辉,等.盐胁迫下甘蔗根际土壤微生物量及其酶活性的效应分析[J].广东农业科学,2016,43(6):103-108.
[17] 周德平,吴淑杭,褚长彬,等.盐胁迫对蔬菜地土壤微生物及土壤酶活的毒害效应[J].农业环境科学学报,2011,30(8):1602-1607.
[18] 张雪,贺康宁,史常青,等.盐胁迫对柽柳和白刺幼苗生长与生理特性的影响[J].西北农林科技大学学报:自然科学版,2017,45(1):105-111.
[19] 吴林坤,林向民,林文雄.根系分泌物介导下植物—土壤—微生物互作关系研究进展与展望[J].植物生态学报,2014,38(3):298-310.
[20] Bankaji I, Cacador I, Sleimi N. Assessing of tolerance to metallic and saline stresses in the halophyteSuaedafruticosa: The indicator role of antioxidative enzymes [J]. Ecological Indicators, 2016,64:297-308.
[21] Chaum S, Kirdmanee C. Effect of inland salt-affected soil on physiological and growth characters of Eucalypt tree (EucalyptuscamaldulensisDehnh.)[J]. Emirates Journal of Food and Agriculture, 2010,22(6):466-474.
