黄土高原植被恢复对不同粒径土壤团聚体中酶活性的影响
2018-03-29姬秀云李玉华
姬秀云,李玉华
(宁夏云雾山国家级自然保护区管理局, 宁夏 固原 756000)
土壤酶是土壤系统中的生物催化剂,促进土壤中元素循环,也是土壤有机质分解的重要驱动力和植物营养元素吸收的活性库,能够为植物和微生物的生长提供养分[1-3]。土壤酶活性能够反映土壤物质循环与能量流动的强度和方向,也能够敏感地反映外界环境的变化,常常被用来当做评价土壤质量的重要指标之一[4]。与此同时,土壤酶活性可作为土壤生物功能多样性的指标[5],也是反映土壤生产力和微生物活性潜力的指标[6],能够敏感地反映土地利用/变化的变化[7]。因此,研究土壤酶活性的变化,将有助于了解土壤肥力状况及其演变特征[8]。在黄土高原,大量的研究表明植被恢复显著提高了土壤质量,相应地,植被恢复有效地促进土壤酶活性的增加,从而改善了土壤质量[9-10],因此土壤酶活性能够有效地评价黄土高原植被恢复对土壤质量的效益。
宁南山区位于黄土高原的西部,随着近年来的植被恢复等生态工程的构建,植被恢复得到了较大的提高,形成了林地、草地、农地等多样的恢复方式。大量的研究表明该区植被恢复明显改善土壤团聚体结构,进而提高了土壤质量,而关于该区植被恢复下土壤团聚体中酶活性的研究还尚不多见。有鉴于此,本文拟通过对宁南山区不同植被恢复方式下不同粒径团聚体中土壤酶活性(土壤脲酶、蔗糖酶、碱性磷酸酶)进行研究,明晰土壤酶活性在反映土壤质量变化中的指示作用及不同植被恢复方式对土壤质量的改善作用,以期为黄土高原植被恢复和管理提供理论依据。
1 材料和方法
1.1 研究区概况及样地设置
研究区位于宁夏固原市东部的河川乡上黄村,属泾河水系支流小川河的中游。地理位置35°59′—36°3′ N,106°26′—106°30′ E,海拔1534~1822 m,年均降水量420 mm,大部分降雨主要集中在7—9月,年均气温7 ℃,干燥度1.5~2.0,属半干旱中温带向暖温带过渡季风气候。该区域90%地形为沟坡地,平缓台地仅占8%,坡度在15°~20°之间,总土地面积7.6 km2[11]。研究区由小川河分为两部分,东部为梁状丘陵,地形起伏较大,西部自东向西依次为台、坪、梁地形,较为开阔。研究区的土壤类型主要是黄土母质上发育的淡黑垆土和黄绵土。根据研究区不同的植被恢复情况,选取4种植被恢复方式:天然草地(naturalgrassland, NaG),主要优势植物为长芒草(Stipabungeana),伴生铁杆蒿(Artemisiagmelinii)、百里香(Thymusmongolicus)、糙隐子草(Cleistogenessquarrosa)等;栽植15 a柠条(Caraganakorshinskii)、栽植25 a柠条以及坡耕地,坡耕地主要种植玉米。
1.2 土壤样品的采集和分析
2015年6月,在每种植被恢复方式下,沿等高线在上坡、中坡、下坡建立3个10 m×10 m的样地,在每个样地内,分别采集0—20 cm和20—40 cm两个土层的土壤样品。每种植被恢复方式设置野外重复3次。在每个样地内,用硬质塑料饭盒采集原状土壤样品,在无扰动的情况下带回实验室进行常温风干,用于土壤团聚体的分析。原状风干土利用传统的湿筛法测定不同粒径的土壤团聚体含量(>5,5~2,2~1,1~0.25,<0.25 mm)。土壤平均质量直径(MWD)计算公式为[12]:
土壤酶活性按照《土壤酶及其研究法》书中的标准方法进行测定[13]。土壤蔗糖酶活性采用Na2S2O3滴定法进行测定,土壤蔗糖酶活性用24 h后1g土壤葡萄糖的毫克数表示;土壤脲酶活性采用靛酚比色法进行测定,以24 h后1 g土中氨态氮(NH3-N)的毫克数表示;土壤碱性磷酸酶活性采用磷酸苯二钠比色法,以2 h后100 g土壤P2O5的毫克数表示。
1.3 数据处理
数据分析采用SPSS 16.0软件对数据进行方差分析,比较不同植被恢复方式下土壤团聚体的平均质量直径。图形制作采用Excel 2013。
2 结果与分析
2.1 不同植被恢复方式下土壤团聚体变化
如表1所示,不同植被恢复方式下,土壤团聚体粒径分布依然呈现中间低两边高的趋势,>5 mm和<0.25 mm为主要粒径,二者之和占总体的65 %以上;5~2 mm和1~0.25 mm居中;2~1 mm这一粒径的团聚体含量最少,为9%以下。植被恢复后,天然草地、柠条25 a,柠条15 a在0—20 cm土层中>5 mm团聚体百分含量分别是坡耕地的2.6,2.2,2.3倍,20—40cm土层的分别是坡耕地的2.9,2.8,2.4倍。这说明灌木林地和天然草地对大团聚体的含量有很好的改善作用,且天然草地更为有利。
坡耕地的MWD约为1.4,其他植被恢复方式下土壤的MWD在1.9~3.1之间,其中,在0—20 cm土层MWD值依次为:天然草地>柠条25 a>柠条15 a>坡耕地,天然草地、柠条地显著高于坡耕地(p<0.05);20—40 cm土层表现为与0—20 cm相似的变化趋势:柠条25 a>天然草地>柠条15 a>坡耕地,天然草地、柠条地明显高于坡耕地,由此表明坡耕地的土壤团聚体稳定性较差,不利于土壤团聚体的形成。
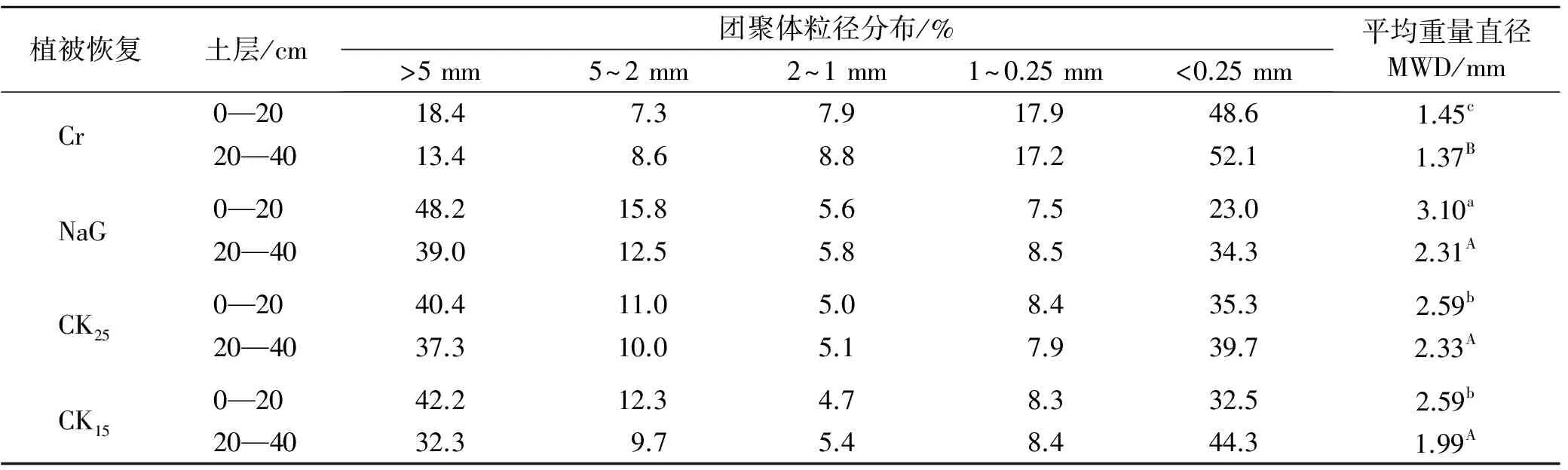
表1 黄土高原人工植被恢复下土壤团聚体粒径分布
注:Cr为坡耕地;NaG为天然草地;CK25为柠条25年; CK15为柠条15年; 不同小写字母表示0—20 cm土层不同植被恢复方式之间差异显著(p<0.05); 不同大写字母表示20—40 cm土层不同植被恢复方式之间差异显著(p<0.05)。下同。
2.2 不同植被恢复方式下土壤蔗糖酶活性随粒径变化特征
从图1可以看出,不同的植被恢复方式土壤中,农地在2个土层的蔗糖酶活性均最低,天然草地及15和25 a柠条林地活性相当。在不同粒径土壤团聚体中,2个土层的15和25 a柠条林地土壤蔗糖酶活性表现出相似的变化趋势,即活性随粒径的增大而增大,在1~2 mm,2~3 mm和3~5 mm土壤团聚体中逐渐达到最大,之后又随土壤团聚体粒径的增大而减小。天然草地的0—20 cm土层除2~3 mm蔗糖酶活性偏低之外,其他也有类似的变化趋势。另外,从柠条林地的植被恢复年限来看,蔗糖酶活性随着植被恢复年限的增加在0—20 cm土层没有明显的增大。20—40 cm土层有较为微弱的增大。
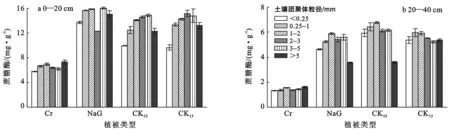
图1 黄土高原不同植被恢复方式下各层土壤蔗糖酶活性随粒径变化特征
2.3 不同植被恢复方式下土壤碱性磷酸酶活性随粒径变化特征
碱性磷酸酶活性在不同植被恢复方式中的变化可通过图2看出,同蔗糖酶一样,其含量在农地中最低,且在不同粒径的土壤团聚体中也没有明显的变化趋势。在0—20 cm土层中,天然草地的碱性磷酸酶活性要较15和25 a柠条林地土壤的高。不同粒径土壤团聚体中,天然草地、15和25 a柠条林地表现出了明显的活性随粒径的增大而增大,并在1~2,2~3和3~5 mm土壤团聚体中逐渐达到最大,之后又随土壤团聚体粒径的增大而减小的变化趋势。25 a柠条林地20—40 cm土层中的不同粒径土壤团聚体碱性磷酸酶活性表现出和0—20 cm土层相似的变化趋势,15 a柠条林地土壤的磷酸酶活性基本随土壤团聚体粒径的增大而提高。天然草地在0.25~1和1~2 mm土壤团聚体中明显偏高,而在其他土壤团聚体中基本随土壤团聚体粒径的增大而减小。从柠条林地的恢复年限来看,随着恢复年限的增加,0—20 cm土层没有明显的变化,20~40 cm土层则表现出了微弱的增大。

图2 黄土高原不同植被恢复方式下各层土壤的碱性磷酸酶活性随粒径变化特征
2.4 不同植被恢复方式下土壤脲酶活性随粒径变化特征
从图3可以看出,不同的植被恢复方式土壤中,农地土壤的脲酶活性在2个土层中均最低。在0~20 cm土层中,农地土壤的脲酶活性在不同粒径土壤团聚体中表现出随土壤团聚体粒径的增大而增大的趋势,天然草地土壤除1~2 mm土壤团聚体中的脲酶活性偏低之外,其他粒径土壤团聚体中的脲酶活性基本随土壤团聚体粒径的增大而减小,25 a柠条林地土壤表现出和天然草地相似的变化趋势。15 a柠条林地土壤的脲酶活性除在0.25~1 mm土壤团聚体中较高之外,其他粒径土壤团聚体中的脲酶活性随土壤团聚体粒径的增大而增大。20—40 cm土层中,天然草地土壤的脲酶活性表现出了明显的随其粒径的增大而增大,并在1~2,2~3和3~5 mm土壤团聚体中逐渐达到最大,之后又随土壤团聚体粒径的增大而减小的变化趋势。
农地也有相似的较为微弱的变化趋势。15和25 a柠条林地则表现出随粒径的增大而减小的趋势,其中,25 a柠条林地要比15 a柠条林地的变化趋势较为明显。从柠条林地的恢复年限来看,0—20 cm土层中,脲酶活性表现出随恢复年限的增大而呈现一定的负增长,20—40 cm土层则表现出随恢复年限的增大而增大的变化趋势。

图3 黄土高原不同植被恢复方式下各层土壤的脲酶活性随粒径变化特征
3 讨 论
土壤酶主要来源于植物根系分泌物和微生物的残留物,影响着土壤生态系统中物质循环,其活性的高低不仅可以反映土壤生物化学过程的强度和方向,而且还能指示土壤营养元素等的动态变化,是土壤中生物催化剂[14]。由于影响土壤酶活性的因素多种多样,主要包括土壤母质、水热条件、植被覆盖类型等。此外人为因素如土地利用类型、土壤耕作制度和管理方式等都将影响土壤酶活性[15]。自然环境中,土地利用变化是影响影响土壤酶活性的主要因素,合理的土地利用可改善土壤结构,增强土壤对外界环境变化的抵抗力,而不合理的土地利用会导致土壤肥力退化,造成土壤质量下降,增强土壤侵蚀,降低生物多样性。在本研究的不同植被恢复方式中,农地土壤的蔗糖酶、脲酶和碱性磷酸酶活性均表现最低,而天然草地、15和25 a柠条林地则较高。农地由于其人为的翻耕等活动较为频繁,破坏了土壤结构及作物根系,不利于土壤酶的积累及转化,而天然草地和柠条林地的相反,除了枯枝落叶等回归土壤补充了土壤微生物的碳氮源,根系分泌物也是土壤酶的重要来源。自然植被恢复则有利于土壤磷酸酶活性增加[16]。
土壤团聚体是影响土壤酶活性分布的重要影响因素[17-19]。有研究[18]表明,大团聚体不利于土壤酶活性的累积,这与本研究一致。本研究中不同植物恢复措施下,土壤酶活性先随着土壤团聚体的粒径的增大而增大,然后再随着土壤团聚体粒径的增大而减小的趋势。团聚体中酶活性的分布特征与土壤碳氮含量有关。Lagomarsino等[20]研究表明,高有机质含量的土壤团聚体中土壤酶活性较大。此外,Qin等[21]研究也发现在农业生态系统中,土壤酶活性与土壤有机碳含量呈显著的正相关。从柠条林地的恢复年限来看,0—20 cm土层中,土壤酶活性表现出随恢复年限的增大有所增加,主要是随着恢复年限的增加土壤有机质含量的增加导致土壤酶活性的累积[22]。土壤有机质是影响土壤酶活性分布的主要因素,随着有机质的增加,土壤酶活性也逐渐增加[23]。因此通过植被恢复提高土壤有机质含量是促进土壤酶活性提高的主要措施。
4 结 论
(1) 在本研究中天然草地、15 a柠条和25 a柠条林地土壤酶活性较高,而农地中较低,表明农地不利于土壤酶的累积。植被恢复有助于土壤酶活性的提高,能够有效地改善土壤质量。
(2) 在不同粒径土壤团聚体中,土壤酶活性随其粒径的增大而增大,主要集中在1~2,2~3和3~5 mm土壤团聚体中。大团聚体(>5 mm)以及小团聚体(<0.25,0.25~1 mm)中土壤酶活性较低。
[1] 周礼恺.土壤酶学[M].北京:科学出版社,1987.
[2] Shi Wei. Agricultural and Ecological Significance of Soil Enzymes: Soil Carbon Sequestration and Nutrient Cycling[M]. Berlin Heidelberg: Springer, 2010:43-60.
[3] Badiane N N Y, Chotte J L, Pate E, et al. Use of soil enzyme activities to monitor soil quality in natural and improved fallows in semi-arid tropical regions[J]. Applied Soil Ecology, 2001,18(3):229-238.
[4] Dick R P. Soil enzyme activities as indicators of soil quality[J]. Soil Science Society of America Journal, 1994,58:107-124.
[5] Bending G D, Turner M K, Jones J E. Interactions between crop residue and soil organic matter quality and the functional diversity of soil microbial communities[J]. Soil Biology & Biochemistry, 2002,34(8):1073-1082.
[6] Sicardi M, Garciaprechac F, Frioni L. Soil microbial indicators sensitive to land use conversion from pastures to commercialEucalyptusgrandis(Hill ex Maiden) plantations in Uruguay[J]. Applied Soil Ecology, 2004,27(2):125-133.
[7] Bandick A K, Dick R P. Field management effects on soil enzyme activities[J]. Soil Biology & Biochemistry, 1999,31(11):1471-1479.
[8] 沈慧,姜凤岐,杜晓军,等.水土保持林土壤肥力及其评价指标[J].水土保持学报,2000,14(2):60-65.
[9] Yin Rui, Deng Hua, Wang Huili, et al. Vegetation type affects soil enzyme activities and microbial functional diversity following re-vegetation of a severely eroded red soil in sub-tropical China[J]. Catena, 2014,115(3):96-103.
[10] Li Junjian, Zhou Xiaomei, Yan Junxia, et al. Effects of regenerating vegetation on soil enzyme activity and microbial structure in reclaimed soils on a surface coal mine site[J]. Applied Soil Ecology, 2015,3(87):56-62.
[11] 李鑫,李娅芸,安韶山,等.宁南山区典型草本植物茎叶分解对土壤酶活性及微生物多样性的影响[J].应用生态学报,2016,27(10):3182-3188.
[12] 李娅芸,刘雷,安韶山,等.应用LeBissonnais法研究黄土丘陵区不同植被区及坡向对土壤团聚体稳定性和可蚀性的影响[J].自然资源学报,2016,31(2):287-298.
[13] 关松荫.土壤酶及其研究法[M],北京:1986,农业出版社.
[14] 徐华勤,肖润林,向佐湘,等.稻草覆盖、间作三叶草茶园土壤酶活性与养分的关系[J].生态学杂志,2009,28(8):1537-1543.
[15] Paul, E.A. Soil microbiology, ecology and biochemistry[M]: Newyork: Academic Press, 2014.
[16] Elfstrand S, Hedlund K, Mrtensson A. Soil enzyme activities, microbial community composition and function after 47 years of continuous green manuring[J]. Applied Soil Ecology, 2007,35(3):610-621.
[17] Cheng Xiaoli, Luo Yiqi, Xu Xia, et al. Soil organic matter dynamics in a North America tallgrass prairie after 9 years of experimental warming[J]. Biogeosciences Discussions, 2010,7(6):1487-1498.
[18] Nie Ming, Pendall E, Bell C, et al. Soil aggregate size distribution mediates microbial climate change feedbacks[J]. Soil Biology & Biochemistry, 2014,68:357-365.
[19] 李鑫,马瑞萍,安韶山,等.黄土高原不同植被带土壤团聚体有机碳和酶活性的粒径分布特征[J].应用生态学报,2015,26(8):2282-2290.
[20] Lagomarsino A, Grego S, Kandeler E. Soil organic carbon distribution drives microbial activity and functional diversity in particle and aggregate-size fractions[J]. Pedobiologia, 2012,55(2):101-110.
[21] Qin Shuping, Hu Chunsheng, He Xinhua, et al. Soil organic carbon, nutrients and relevant enzyme activities in particle-size fractions under conservational versus traditional agricultural management[J]. Applied Soil Ecology, 2010,45(3):152-159.
[22] Knelman J E, Graham E B, Trahan N A, et al. Fire severity shapes plant colonization effects on bacterial community structure, microbial biomass, and soil enzyme activity in secondary succession of a burned forest[J]. Soil Biology & Biochemistry, 2015,90:161-168.
[23] Tejada M, Benítez C. Effects of crushed maize straw residues on soil biological properties and soil restoration. [J]. Land Degradation & Development, 2015,25(5):501-509.
