重组慢病毒携带酪氨酸羟化酶对大鼠帕金森病模型的干预研究
2018-03-22董小林战丽萍邬刚李青芸魏欢李建辉李妍平
董小林,战丽萍,邬刚,李青芸,魏欢,李建辉,李妍平
本研究背景和创新点:
帕金森病是一种常见的神经退行性疾病,病因是中脑黑质多巴胺能神经元凋亡缺失,多巴胺合成减少是导致其震颤和运动障碍的主要原因,酪氨酸羟化酶(TH)是多巴胺能神经元的主要分子标记和功能分子。机体利用左旋酪氨酸(L-tyrosine),在TH的催化下生成左旋多巴,左旋多巴在芳香族脱羧酶的催化下脱去羧基最后生成左旋多巴胺。本研究分离、培养胎鼠原代神经元,采过反转录聚合酶链式反应(RT-PCR)从多巴胺能神经元中克隆大鼠TH(rTH) cDNA,将该片段包装到重组慢病毒中。将Lv-rTH重组慢病毒感染大鼠成纤维细胞REF,体外检测表明Lv-rTH重组慢病毒能在体外成功和高效地表达rTH。通过脑内立体定位注射6羟多巴胺(6-OHDA)的方法建立了大鼠帕金森病模型,建模后进行基因治疗,给予Lv-rTH重组慢病毒脑内注射,通过阿扑吗啡诱发旋转实验进行行为学评分,免疫组化进行神经元恢复评分,结果发现:Lv-rTH重组慢病毒能显著减少由阿扑吗啡诱导的自体旋转且能上调大鼠帕金森病模型TH表达阳性细胞所占比例。
帕金森病(Parkinson's disease,PD)是一种常见的神经系统变性病,患者的主要临床表现为:运动迟缓、肌强直、静止性震颤、姿势步态异常等[1-2]。已有研究发现遗传因素和多种杀虫剂是PD的重要危险因素[3]。PD的病理特征主要是中脑黑质多巴胺能神经元减少和坏死。多巴胺能神经元主要是一类能产生多巴胺的神经元,能将神经冲动信号传递至纹状体,而纹状体主要控制骨骼肌的运动,因此多巴胺合成的减少导致了机体的运动障碍。基于该病理基础,PD患者的治疗主要通过维持纹状体内多巴胺和乙酰胆碱两种递质的平衡,使临床症状得以改善。左旋多巴最早用于治疗PD,该药物在治疗早期病情缓解效果较好,但是随着治疗“蜜月期”的结束,左旋多巴会导致多种运动并发症[4]。而多巴胺激动剂类药物虽能一定程度缓解症状,但长期使用会导致消化道反应和精神症状等不良反应[5]。手术治疗虽能改善症状,但不能根治疾病,术后仍需应用药物治疗,也可能带来相关并发症,如舌头和手的麻痹、辨距不清和意识不清等症状[6],也存在一定局限性。
基因治疗主要是将相关基因通过载体导入病灶部位,对靶点区域的细胞进行修复、补偿和校正,以恢复相关区域正常生理功能,基因治疗主要适用于病灶区域单一和明确的疾病。国外有研究报道利用神经营养因子对PD进行基因治疗,主要是通过导入神经营养因子〔包括胶质细胞源性神经营养因子(GDNF)、Neurturin和脑源性神经营养因子(BDNF)〕促进和保护相关神经元的存活[7]。但是,多数PD患者发病时大量的多巴胺神经元丢失,因此,提升患者相关神经核团对多巴胺的合成可能是治疗该疾病的关键。酪氨酸羟化酶(tyrosine hydroxylase,TH)表达于多巴胺能神经元,是该类神经元分子标志物。TH是催化左旋多巴产生的加氧酶,是多巴胺合成中的关键限速酶[8]。慢病毒载体是一种广泛应用于基因表达和基因治疗的缺陷型载体,相比于其他载体,慢病毒载体具有能在机体内持续稳定表达、较低的免疫性和外源基因容量大的特点,已广泛应用于心血管疾病、肿瘤和自身免疫疾病的治疗[9]。为了探索和评估利用TH作为PD基因治疗的评价效果,本研究克隆了大鼠TH基因(rTH基因),构建了携带rTH的慢病毒载体,并利用该载体对大鼠PD模型进行基因治疗,为PD基因治疗提供新思路,为临床研究奠定理论基础。
1 材料与方法
1.1 材料 慢病毒载体LvX、pHelper和大肠埃希菌DH5α由本研究室保存,大鼠成纤维细胞REF和293T细胞由本研究室保存。限制性内切酶NotI、BamHI、PrimeStar HS DNA Polymerase 和 T4 DNA Ligase购自宝生物工程(大连)有限公司,质粒大提试剂盒购自Qiagen公司。上游引物P1:5'-GCGGCCGC ACCATGCCCACCCCCAGCGCC-3'和 下 游 引 物 P2:5'-GGGGATCCTTAGCTAATGGCACTCAG-3'由北京六合华大基因科技有限公司合成。Anti-TH antibody(AF7566)和BDNF购自R&D Systems。Western Chemiluminescent HRP底物和HRP标记二抗购自Merck Millipore公司。Opti-MEM、Lipofectamine 2000、DMEM 高 糖、Neural Basal培 养 基、B27 Serum Free Supplement和 胎 牛 血清(FBS)等购自ThermoFisher公司。成年Sprague-Dawley大鼠购自北京华阜康生物科技股份有限公司。6羟多巴胺(6-OHDA)和阿扑吗啡(apomorphine)购自Sigma Aldrich。
1.2 方法
1.2.1 胎鼠原代神经元的分离、培养和鉴定 2014年11月—2015年12月,取雌性和雄性Sprague-Dawley大鼠各10只,按照2∶1进行合笼过夜饲养。第2天分笼饲养,记录时间,动态检测雌性大鼠体质量以确定雌性大鼠妊娠天数。准确选取妊娠14 d雌性大鼠1只,处死后取出子宫。在预冷的Hank's平衡盐溶液(HBSS)无菌培养皿中分离胎鼠大脑,从中脑腹侧处取神经组织,剪碎。将神经组织平铺于多聚赖氨酸包被的6孔板中,37 ℃,5% CO2孵育30 min。加入B27培养液〔Neural Basal,2% B27 Serum Free Supplement,1% 双 抗,5%FBS和10 ng/ml BDNF〕,37 ℃,5% CO2培养,每3 d半量换液,于14 d得到大鼠原代神经元,对神经元进行鉴定。采用免疫组化法将大鼠原代神经元用磷酸盐缓冲液(PBS)洗涤3次,加入固定和透化液(2%多聚甲醛,0.2% Triton X-100,PBS pH=7.4)处理15 min;加入丙酮和甲醇混合物(7∶3),-20 ℃处理10 min。细胞固定和破膜后,用PBS洗涤3次。加入封闭液〔5%牛血清清蛋白(BSA)/0.05% Tween-20,PBS pH=7.4〕封闭30 min。封闭结束后加入封闭液稀释的一抗,工作浓度为1 μg/ml,结合2 h,PBST洗涤3次,加入二抗(1∶1 000)孵育60 min,PBST洗涤3次后加入二氨基联苯胺(DAB)显色。
1.2.2 rTH基因的克隆 取1×106个胎鼠原代神经元,利用Qiagen RNeasy Mini Kit提取细胞总RNA。检测RNA纯度和浓度后进行cDNA的反转录。取500 ng细胞总RNA,利用RevertAid First Strand cDNA Synthesis Kit合成cDNA。取模板cDNA,以rTH扩增上下游引物,利用PrimeStar HS DNA Polymerase扩增rTH基因。反应体系为:5×PrimeSTAR Buffer 10 μl,dNTP Mixture(2.5 mmol/L)4 μl,上、下游引物各10 pmol,cDNA 1 μl,Polymerase 0.5 μl,总体积 50 μl。反应条件:98 ℃预变性 2 min;98 ℃变性 10 s,55 ℃复性 15 s,72℃延伸2 min,35个循环;最终72 ℃延伸10 min,16℃保存。使用1%琼脂糖凝胶电泳检测扩增产物,扩增产物送生工生物工程(上海)股份有限公司测序。
1.2.3 Lv-rTH重组慢病毒的包装 将rTH PCR产物进行胶回收纯化,纯化产物和LvX载体进行NotI和BamHI双酶切。酶切产物经过胶回收纯化后用T4 DNA Ligase 16 ℃连接过夜。连接产物转化DH5α感受态细胞。Lv-rTH重组质粒通过酶切进行鉴定。对Lv-rTH和pHelper质粒进行大量扩增。使用Qiagen去内毒素质粒大提试剂盒提取质粒,测浓度后备用。复苏293T细胞,取对数生长期293T细胞,调整细胞密度至0.5×106cells/ml,接种于100 mm细胞培养皿。37 ℃ 5% CO2培养12 h。次日细胞密度达到70%融合度进行转染。使用Opti-MEM培养液对293T细胞洗涤3次。取15 ml离心管,加入40 μg Lv-rTH和30 μg pHelper载体混合。加入Opti-MEM培养液至2.5 ml,孵育5 min。取200 μl Lipofectamine 2000,加入2.3 ml Opti-MEM培养液进行稀释。将载体混合液与脂质体稀释液进行混合,室温孵育20 min。将DNA与Lipofectamine 2000混合液均匀滴加至293T细胞的培养液中,十字混匀后放置37 ℃ 5%CO2细胞培养箱中继续培养过夜后换新鲜完全培养基培养48 h。收集上清液,4 ℃,4 000×g离心10 min。上清液使用0.45 μm滤器过滤,过滤上清液进行浓缩和纯化,最后测定滴度进行保存。
1.2.4 实时荧光定量反转录聚合酶链式反应(RTPCR)、免疫荧光实验和Western blotting法检测大鼠成纤维细胞REF中rTH基因表达 取对数生长期大鼠成纤维细胞REF,以5×106/ml密度接种至6孔板,37 ℃5% CO2过夜培养。次日,以MOI=100的感染复数接种Lv-rTH重组慢病毒,以未携带基因的慢病毒Lv-NC为对照。加入终浓度5 μg/ml Polybrene增强感染,感染24 h后更换新鲜培养基。继续培养72 h后进行实时荧光定量RT-PCR、免疫荧光实验和Western blotting检测。RT-PCR反应体系及反应条件参见1.2.2。免疫荧光实验二抗采用异硫氰酸荧光素(FITC)标记,采用封闭液稀释(1∶250),37 ℃孵育60 min。PBST洗涤4次后荧光显微镜下观察。Western blotting法检测选取大鼠原代神经元、接种Lv-rTH重组慢病毒、Lv-NC大鼠成纤维细胞REF,每种细胞取5×106个,加入含有蛋白酶抑制剂的RIPA裂解液,冰上裂解。利用BCA法测定细胞裂解物蛋白浓度,调整蛋白浓度一致。10%十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶电泳分离蛋白,将蛋白电转至甲醇激活的聚偏二氟乙烯膜(PVDF膜)。转膜后将膜用PBS洗涤3次,5%脱脂奶4 ℃封闭过夜。加入anti-TH一抗,同时以anti β-actin抗体为内参对照,浓度分别为0.5 μg/ml和0.1 μg/ml,PBST洗涤3次后加入二抗进行孵育(1∶5 000)。PBST洗涤4次后加入Chemiluminescent HRP底物,暗室曝光显影。
1.2.5 PD建模和基因治疗 PD建模和基因治疗分为对照组、Lv-NC治疗组和Lv-rTH治疗组,每组入选7只成年雌性Sprague-Dawley大鼠。采用腹腔注射戊巴比妥钠50 mg/kg进行麻醉,麻醉后,将大鼠固定于立体定位注射仪,双耳固定耳杆并调节至相同刻度,固定鼻托。头部备皮,消毒后切开暴露颅骨。Lv-NC治疗组和Lv-rTH治疗组大鼠右侧纹状体注射6-OHDA 20 μg,损毁多巴胺能神经元,完成PD建模,注射坐标:前囟=-1.0 mm,右侧水平偏移=3.5 mm,深度=5.5 mm,缓慢注射、缓慢退针,注射后缝合大鼠头皮;对照组大鼠注射等量0.9%氯化钠溶液。造模14 d后评估和再次注射病毒进行基因治疗。每只大鼠注射损毁侧纹状体和黑质2个点。纹状体注射坐标:前囟=0.8 mm,右侧水平偏移=3.5 mm,深度=5.5 mm;黑质核团注射坐标:前囟=5.5 mm,右侧水平偏移=2.4 mm,深度=7.5 mm(见图1)。每只大鼠每个点注射病毒1×109TU/ml,共注射 5 μl。
1.2.6 阿扑吗啡诱发旋转实验和免疫组化实验 LvrTH重组慢病毒对大鼠基因治疗的疗效主要通过行为学和组织学进行评估。注射Lv-rTH重组慢病毒前1周开始对大鼠进行PD症状的行为学评估,主要通过肌肉注射阿扑吗啡2.5 mg/kg进行。肌肉注射后观察每只大鼠60 min内自发旋转圈数,计算每分钟自发旋转圈数进行评估。行为学观察进行11周后处死大鼠。取出脑组织,采用10%甲醛溶液固定,固定后进行脱水、透明和石蜡包埋,切片后进行免疫组化,脱蜡、脱二甲苯,Tris-EDTA缓冲液抗原煮沸修复,修复后采用3%过氧化氢处理、封闭和一抗孵育。孵育结束后洗片4~5次,加入酶标二抗进行孵育,最后洗涤5~6次后加入DAB显色。采用Image J图形分析软件计算大鼠中脑黑质TH阳性神经元所占比例。
1.3 统计学方法 采用SPSS 17.0统计学软件进行数据处理,计量资料以(x±s)表示,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 胎鼠原代神经元的培养和鉴定 选取胎鼠中脑原代神经元(见图2、3),免疫组化法检测显示,所获得神经元能表达TH(见图4)。
2.2 rTH基因的克隆和Lv-rTH重组慢病毒的包装RT-PCR检测显示得到分子量约为1 500 bp的特异扩增基因片段(见图5)。基因测序结果与GeneBank中NM_012740.3所公布序列完全一致(见图6)。
2.3 Lv-rTH重组慢病毒体外表达检测 RT-PCR检测显示rTH基因在大鼠成纤维细胞REF的转录(见图7)。免疫荧光检测显示接种Lv-rTH重组慢病毒的大鼠成纤维细胞REF中有rTH基因表达,未携带基因的慢病毒Lv-NC的大鼠成纤维细胞REF中无荧光信号(见图8)。Western blotting法检测显示接种Lv-rTH重组慢病毒的大鼠成纤维细胞REF中表达分子量约为60 kD的蛋白(见图9)。
2.4 3组大鼠不同时间自发旋转速率比较 3组大鼠治疗前1周自发旋转速率比较,差异无统计学意义(P>0.05);3 组大鼠治疗 0、1、2、3、4、5、6、7、8、9、10周自发旋转速率比较,差异均有统计学意义(P<0.05);其中治疗 0、1、2、3、4、5、6、7、8、9、10周,Lv-NC治疗组和Lv-rTH治疗组大鼠自发旋转速率较对照组增快,差异均有统计学意义(P<0.05);治疗2、3、5、6、8、9、10周,Lv-rTH治疗组大鼠自发旋转速率较Lv-NC治疗组减慢,差异均有统计学意义(P<0.05,见表1)。
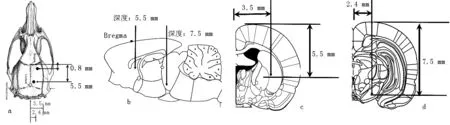
图1 大鼠纹状体和黑质脑内立体定位注射坐标Figure 1 Stereotactic coordinates of rat striatum and substantial nigra
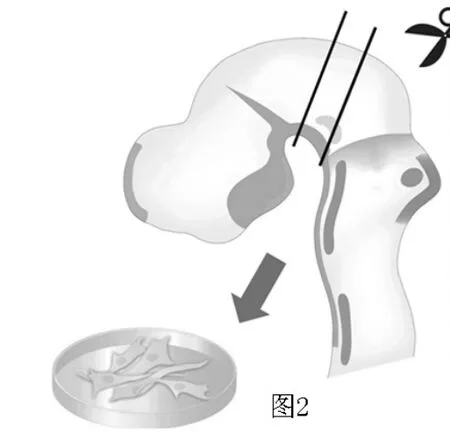
图2 分离胎鼠中脑原代神经元Figure 2 Isolation of primary fetal rat neurons
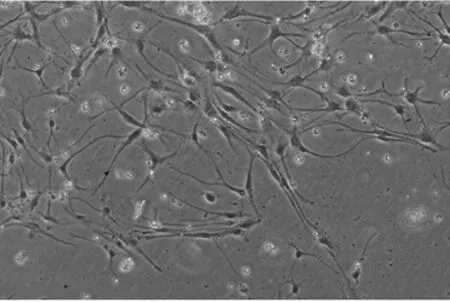
图3 胎鼠中脑原代神经元细胞形态(×200)Figure 3 Morphology of primary rat neurons
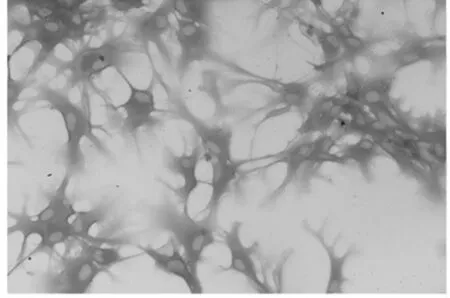
图4 免疫组化法检测胎鼠中脑原代神经元TH表达(×400)Figure 4 Detection of TH expression in primary rat neurons by immunohistochemistry
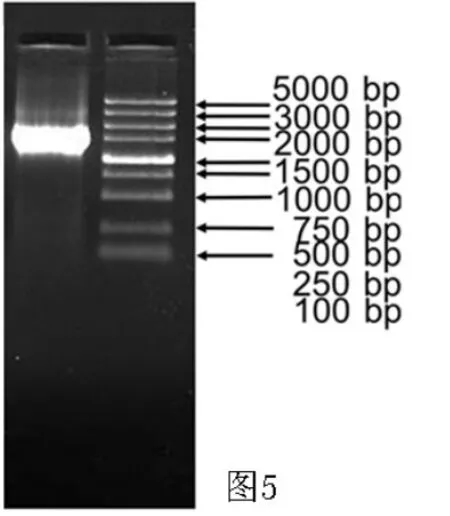
图5 RT-PCR检测rTH基因Figure 5 Detection of rTH gene by RT-PCR
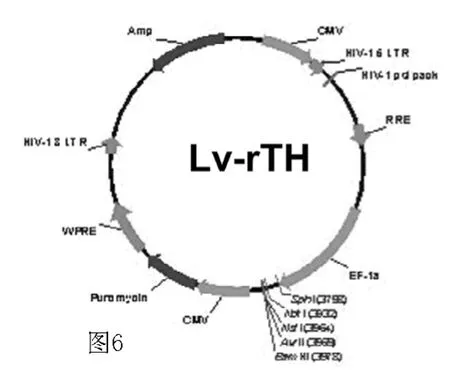
图6 Lv-rTH重组慢病毒包装图Figure 6 Lv-rTH recombinant lentivirus vector packaging
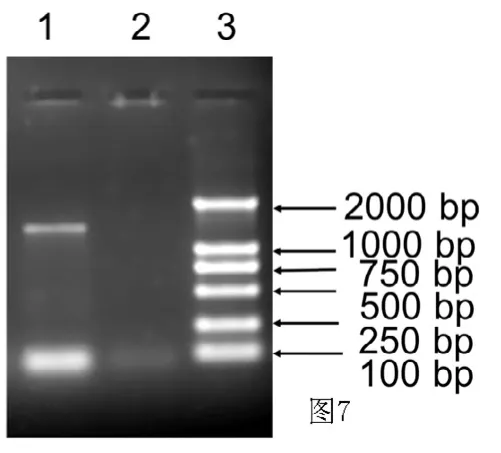
图7 RT-PCR检测rTH基因在大鼠成纤维细胞REF中的表达Figure 7 Expression of rTH gene in rat fibroblasts REF detected by RT-PCR
2.5 3组大鼠中脑黑质TH阳性神经元所占比例 免疫组化实验显示与Lv-NC治疗组大鼠中脑黑质相比,LvrTH治疗组大鼠经过治疗后向正常大鼠中脑恢复(见图10)。3组大鼠中脑黑质TH阳性神经元所占比例比较,差异有统计学意义(P<0.05);其中Lv-NC治疗组和Lv-rTH治疗组大鼠中脑黑质TH阳性神经元所占比例较对照组降低,差异有统计学意义(P<0.05);Lv-rTH治疗组大鼠中脑黑质TH阳性神经元所占比例较Lv-NC治疗组升高,差异有统计学意义(P<0.05,见表2)。
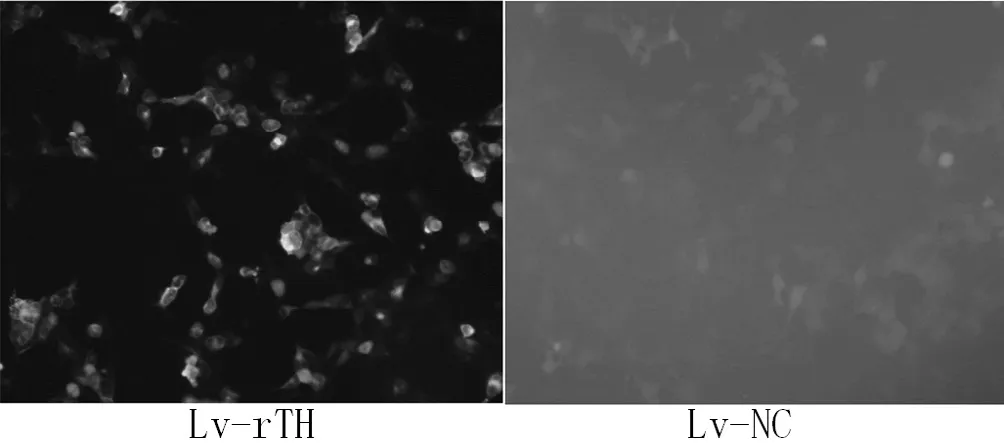
图8 免疫组化检测rTH基因在大鼠成纤维细胞REF中的表达(×200)Figure 8 Expression of rTH gene in REF detected by immunohistochemistry
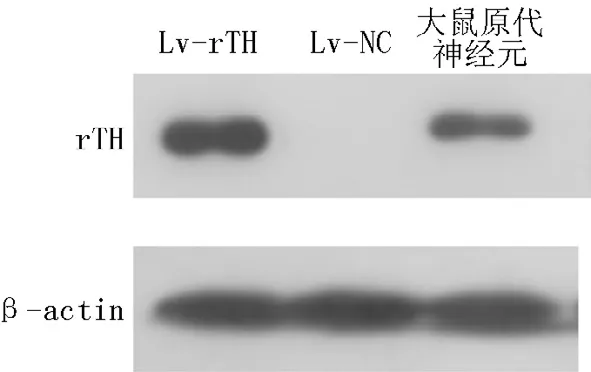
图9 Western blotting检测rTH基因在大鼠成纤维细胞REF中的表达Figure 9 Expression of rTH gene in REF detected by Western blotting
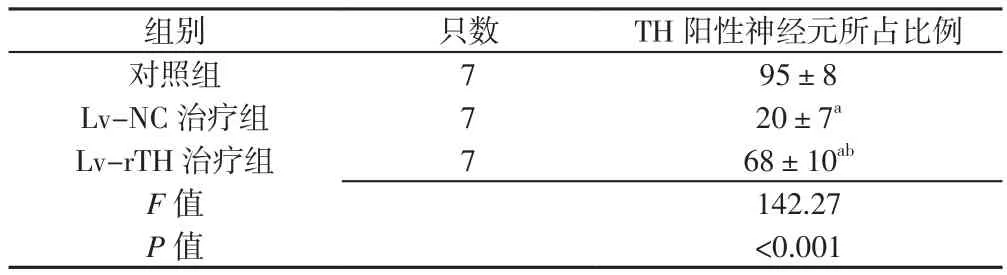
表2 3组大鼠中脑黑质TH阳性神经元所占比例比较(x±s,%)Table 2 Comparitson of the proportions of TH-positive neurons in the substantial nigra between the three groups
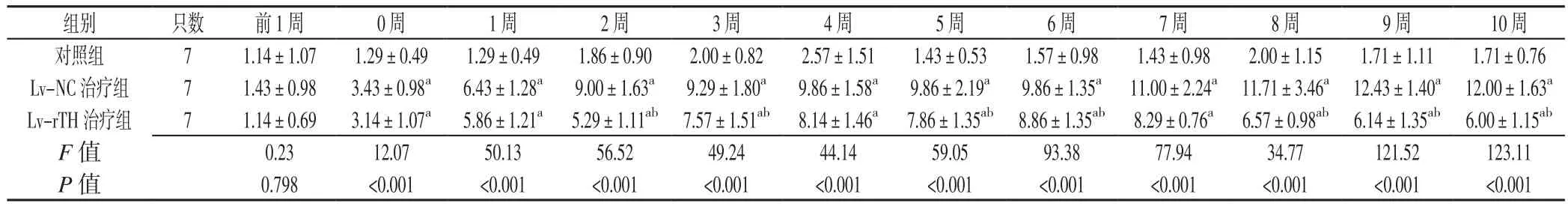
表1 3组大鼠不同时间自发旋转速率比较(x±s,r/min)Table 1 Comparison of the spontaneous rotation rates of the rats in three groups at different time points

图10 免疫组化检测大鼠中脑黑质TH阳性神经元(×200)Figure 10 TH-positive neurons in the substantial nigra detected by immunohistochemistry
3 讨论
本研究体外分离、培养了胎鼠中脑多巴胺能神经元,免疫组化染色发现TH呈阳性表达,证明实验所分离和培养的神经元为多巴胺能神经元,通过RT-PCR从多巴胺能神经元中成功克隆了约为1 500 bp的cDNA片段,经测序确认,该片段与理论片段序列完全一致,证明所获得的基因为rTH。将该rTH cDNA片段包装到慢病毒中,并感染大鼠成纤维细胞REF,体外通过实时荧光定量RT-PCR、免疫荧光实验和Western blotting法证明所包装的rTH重组慢病毒能在体外成功和高效地表达rTH。通过脑内立体定位注射6-OHDA的方法建立了大鼠PD模型,建模2周后,给予大鼠脑内注射Lv-rTH重组慢病毒、未携带基因的慢病毒Lv-NC及0.9%氯化钠溶液。通过阿扑吗啡诱发旋转实验进行行为学评分,免疫组化进行神经元恢复评分,结果发现:Lv-rTH重组慢病毒能显著减少由阿扑吗啡诱导的自发旋转速率,免疫组化检测发现,Lv-rTH能上调大鼠PD模型中脑黑质TH表达阳性神经元所占比例。
目前国内对PD的基因治疗主要使用神经营养因子(GDNF、Neurturin和BDNF)。研究报道通过基因载体或者重组蛋白递送至模型后相关核团能保护多巴胺能神经元,抵抗造模药物6-OHDA和MTPT的神经损伤作用[9-11]。美国Ceregen公司研发了携带Neurturin基因的重组腺相关病毒,并对其临床疗效进行了测试,表明患者在接受基因治疗后,PD症状确实有明显改善,但是正电子发射计算机断层显像(PET-CT)扫描表明患者的纹状体核团对左旋多巴的利用没有明显上升[10,12]。
通过慢病毒作为载体递送TH对PD进行基因治疗的机制是:TH是催化多巴胺合成的关键酶[13]。TH是一种单加氧酶,其是催化生物体自身合成左旋多巴胺系列反应的第一步反应的限速酶,机体利用左旋酪氨酸(L-tyrosine),在TH的催化下生成左旋多巴,左旋多巴在芳香族脱羧酶的催化下脱去羧基最后生成左旋多巴胺。本研究在动物模型上证实了通过重组慢病毒在与多巴胺合成相关的神经核团中过表达rTH基因,促进核团多巴胺的合成,能改善动物模型的PD症状,降低了阿扑吗啡诱导的自发旋转。同时,免疫组化证实多巴胺合成相关核团TH的表达增强。
流行病学调查报道:全球PD在65~69岁中患病率为0.6%,80岁及以上患病率为4%;中国65岁及以上PD的患病率为2.06%,男性高于女性[14]。据估算我国大约有200万PD患者,每年新发病例约10万人。我国已进入人口老龄化社会,PD已成为仅次于糖尿病和心血管疾病的影响我国人口健康的重大疾病。口服左旋多巴是早期治疗PD的理想药物,能显著缓解PD症状,但是长期使用左旋多巴可能带来症状波动和异动症,这种症状波动和异动症有可能对患者造成更为严重的损伤。外科手术治疗法主要分为神经核团损毁术、脑深部电刺激术和神经组织移植术3种,丘脑损毁术会导致舌与手的麻木、辨距不良和意识混乱,苍白球损毁术术后会导致视野缺损和偏瘫[15-16]。脑深部电刺激有导致颅内出血的风险,与刺激有关的不良反应有对侧肢体抽搐、麻木、眼球凝视等症状[17]。神经组织移植治疗由于使用人类胚胎组织,存在伦理学方面的问题。
慢病毒载体已经发展到产业化阶段,国内已有专业开展慢病毒制备的公司和成熟的病毒制备、浓缩和纯化工艺,制备成本较低;慢病毒已被广泛应用于抗肿瘤CAR-T细胞的制备等,具有一定的安全性[18]。因此使用慢病毒作为基因治疗载体具有较好的产业化基础。其次,慢病毒系统较好地满足了人类疾病基因治疗的要求:能感染大部分哺乳动物细胞;可插入较大的外源基因;能够整合,且持续和稳定的表达。其他病毒载体主要包括:腺病毒系统和腺相关病毒系统。腺病毒系统由于属于瞬时表达载体,且免疫原性加大,通常不适宜用于基因治疗。腺相关病毒具有较低的免疫原性,且能持续表达,但是由于其基因组限制,只能容纳3 kb的外源基因片段。
综上所述,本研究通过重组慢病毒载体在目标核团过表达rTH基因,该方案能快速增强多巴胺的合成,缓解模型动物PD症状,同时上调大脑黑质TH表达阳性神经元所占比例。尽管如此,该方法不能再生多巴胺能神经元。因此,利用胚胎干细胞或间充质干细胞多向分化潜能,同时通过慢病毒载体递送相关诱导基因的表达,促进目标核团的神经元再生可能是今后PD基因治疗努力的方向。
作者贡献:战丽萍进行文章的构思与设计,论文的修订;董小林进行研究的实施与可行性分析,撰写论文;邬刚进行数据收集;魏欢进行数据整理;李青芸进行统计学处理;李建辉进行结果的分析与解释;李妍平负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
[1]BAIZABAL-CARVALLO J F,JANKOVIC J.Parkinsonism,movement disorders and genetics in frontotemporal dementia[J].Nat Rev Neurol,2016,12(3):175-185.DOI:10.1038/nrneurol.2016.14.
[2]PARKINSON J.An essay on the shaking palsy.1817[J].J Neuropsychiatry Clin Neurosci,2002,14(2):223-236,discussion 222.DOI:10.1176/jnp.14.2.223.
[3]ALLAM M F,DEL CASTILLO A S,NAVAJAS R F.Parkinson's disease risk factors:genetic,environmental,or both?[J].Neurol Res,2005,27(2):206-208.DOI:10.1179/016164105X22057.
[4]FOSTER H D,HOFFER A.The two faces of L-DOPA:benefits and adverse side effects in the treatment of Encephalitis lethargica,Parkinson's disease,multiple sclerosis and amyotrophic lateral sclerosis[J].Med Hypotheses,2004,62(2):177-181.DOI:10.1016/S0306-9877(03)00318-9.
[5]MURATA M.Levodopa in the early treatment of Parkinson's disease[J].Parkinsonism Relat Disord,2009,15(Suppl 1):S17-20.DOI:10.1016/S1353-8020(09)70006-9.
[6]BROOKS D J.Dopamine agonists:their role in the treatment of Parkinson's disease[J].J Neurol Neurosurg Psychiatry,2000,68(6):685-689.
[7]OBESO J A,RODRIQUEZ M C,GOROSPE A,et al.Surgical treatment of Parkinson's disease[J].Bailliere Clin Neurol,1997,6(1):125-145.
[8]QUDRAT A,UNNI N.Theoretical approaches to lentiviral mediated neurotrophin delivery in potential treatments of Parkinson's disease[J].Yale J Biol Med,2016,89(2):215-225.
[9]FJORD-LARSEN L,JOHANSEN J L,KUSK P,et al.Efficient in vivo protection of nigral dopaminergic neurons by lentiviral gene transfer of a modified Neurturin construct[J].Exp Neurol,2005,195(1):49-60.DOI:10.1016/j.expneurol.2005.03.006.
[10]HICKEY P,STACY M.AAV2-neurturin (CERE-120) for Parkinson's disease[J].Expert Opin Biol Ther,2013,13(1):137-145.DOI:10.1517/14712598.2013.754420.
[11]BARTUS R T,BAUMANN T L,BROWN L,et al.Advancing neurotrophic factors as treatments for age-related neurodegenerative diseases:developing and demonstrating "clinical proof-of-concept"for AAV-neurturin (CERE-120) in Parkinson's disease[J].Neurobiol Aging,2013,34(1):35-61.DOI:10.1016/j.neurobiolaging.2012.07.018.
[12]HERZOG C D,BROWN L,KRUEGEL B R,et al.Enhanced neurotrophic distribution,cell signaling and neuroprotection following substantia nigral versus striatal delivery of AAV2-NRTN(CERE-120)[J].Neurobiol Dis,2013,58(1):38-48.DOI:10.1016/j.nbd.2013.04.011.
[13]DAUBNER S C,LE T,WANG S.Tyrosine hydroxylase and regulation of dopamine synthesis[J].Arch Biochem Biophys,2011,508(1):1-12.DOI:10.1016/j.abb.2010.12.017.
[14]DE LAU L M,BRETELER M M.Epidemiology of Parkinson's disease[J].Lancet Neurol,2006,5(6):525-535.DOI:10.1016/S1474-4422(06)70471-9.
[15]BORAUD T,BEZARD E,BIOULAC B,et al.High frequency stimulation of the internal Globus Pallidus (GPi) simultaneously improves parkinsonian symptoms and reduces the firing frequency of GPi neurons in the MPTP-treated monkey[J].Neurosci Lett,1996,215(1):17-20.
[16]GHIKA J,VILLEMURE J G,FANKHAUSER H,et al.Efficiency and safety of bilateral contemporaneous pallidal stimulation (deep brain stimulation) in levodopa-responsive patients with Parkinson's disease with severe motor fluctuations:a 2-year follow-up review[J].J Neurosurg,1998,89(5):713-718.DOI:10.3171/jns.1998.89.5.0713.
[17]Deep-Brain Stimulation for Parkinson's Disease Study Group,OBESO J A,OLANOW C W,et al.Deep-brain stimulation of the subthalamic nucleus or the pars interna of the globus pallidus in Parkinson's disease[J].N Engl J Med,2001,345(13):956-963.DOI:10.1056/NEJMoa000827.
[18]ESCORS D,BRECKPOT K.Lentiviral vectors in gene therapy:their current status and future potential[J].Arch Immunol Ther Exp(Warsz),2010,58(2):107-119.DOI:10.1007/s00005-010-0063-4.
