Sb(Ⅲ)和Sb(Ⅴ)在不同吸附剂上的吸附特征①
2018-03-22张莹雪胥思勤李佳霜
张莹雪,胥思勤,李佳霜
Sb(Ⅲ)和Sb(Ⅴ)在不同吸附剂上的吸附特征①
张莹雪,胥思勤*,李佳霜
(贵州大学喀斯特环境与地质灾害防治重点实验室,贵阳 550025)
以氢氧化铁、氢氧化铝、高岭土和蛭石4种材料为吸附剂,探究Sb(Ⅲ)和Sb(Ⅴ) 的吸附效果,以类比土壤中主要矿物对Sb的吸附作用并进行对比。研究内容包括吸附动力学试验、等温吸附试验及不同背景溶液pH变化下的吸附解吸效应。结果表明:4种吸附对Sb(Ⅲ) 和Sb(Ⅴ) 的吸附在振荡24 h后逐渐趋于平稳,蛭石和氢氧化铁对Sb(Ⅲ)的吸附量在 6 h达到峰值后出现下降,如氢氧化铁在6 h时对Sb(Ⅲ) 的吸附量为23.19 μg/g,72 h后降为19.75 μg/g,并测定出该悬浮液中Sb(Ⅴ) 浓度上升。用Langmuir和Freundlich吸附模型对两种价态Sb的等温吸附曲线进行拟合,两种模型拟合优度均在0.7以上。蛭石和氢氧化铁对Sb(Ⅲ) 的吸附效果好于另两种吸附剂,而蛭石对Sb(Ⅴ) 的吸附能力较弱;氢氧化铁和氢氧化铝对Sb(Ⅴ) 的吸附效果较好,而氢氧化铝对Sb(Ⅲ) 吸附效果不理想。随着pH的增加,Sb(Ⅲ) 和Sb(Ⅴ) 的吸附出现明显下降,并且解吸率增加,表现出pH对吸附的显著影响,如高岭土对Sb(Ⅲ) 的吸附量由平衡液pH为4.82时的10.12 μg/g增加到pH为2.12时的37.89 μg/g。
Sb(Ⅲ);Sb(Ⅴ);吸附;土壤矿物;铁/铝氢氧化物
目前锑(Sb)在环境中的危害逐渐受到重视,Sb虽不是植物必需元素,但植物仍可从土壤中吸收并积累Sb,一方面对植物生长带来不利影响,另一方面其可随食物链富集。不同植物对Sb的积累部位不同,许多植物根部对Sb积累量高于地上部分,某些蔬菜可食用部分含Sb量达2.05 mg/kg[1]。Sb在自然环境中分为无机Sb与有机Sb,无机Sb存在形式主要为Sb(Ⅲ) 和Sb(Ⅴ),虽然对Sb的毒性作用等方面认识还不充分,但普遍认为无机Sb毒性大于有机Sb,而Sb(Ⅲ) 毒性远大于Sb(Ⅴ)[2-3]。
由于价态差异,两者配位数不同,与Sb(Ⅲ) 相邻链接着3个氧原子,形成三角锥型结构;而与Sb(Ⅴ)则链接着6个氧原子,形成八面体结构[4-5]。土壤中Sb的主要存在形态为Sb(Ⅴ),Sb(Ⅲ) 即便在弱还原条件下都较易氧化为Sb(Ⅴ)[6-7]。Sb(Ⅲ) 在矿物表面吸附过程中,如在针铁矿表面、锰氧化物表面吸附时会发生氧化反应,生成Sb(Ⅴ)[8-10]。Sb(Ⅴ) 在酸性红壤中的吸附量大于棕色石灰土[11],且Sb(Ⅴ) 在两种土壤土柱出流试验中显示在石灰土中迁移的穿透峰值大于红壤,试验结束后土壤中Sb主要以铁铝结合态为主[12]。Sb在土壤中很大程度上会与铁、铝和锰等氧化物结合[13],特别是铁、铝水合氧化物,且性质与砷(As)类似,铁氧化物同样能强烈吸附五价砷[14],As、Sb主要与氧化物表面的氧原子结合[4,9,15-16]。Sb(Ⅲ) 和Sb(Ⅴ)在高岭石和绿脱石等黏土矿物上的吸附过程,主要在矿物边缘与铁/铝氧八面体形成内源配合物,形成共用角的单齿或双齿配合物[4]。关于Sb的吸附过程仍在探索中。有文献报道,Sb在土壤腐殖酸上吸附时,用X射线吸收精细结构(XAFS)光谱分析发现,腐殖酸(HA)开链上羧基和羟基上的质子信号在结合Sb时消失了[17]。Sb在磁铁矿上的吸附可能结合在磁铁矿络合的表面羟基的氧原子上[18]。另外,Mason等[19]用密度泛函理论(DFT)对Sb(Ⅲ) 和Sb(Ⅴ) 在铁/铝水合氧化物上的吸附反应进行了计算和分析,模拟吸附反应为Sb(Ⅲ) 和Sb(Ⅴ) 氧化物失去3个Sb结合的羟基(Sb-OH),与铁/铝水合氧化物表面羟基(M(OH)3)失去的3个质子生成水,而Sb与铁/铝水合氧化物表面氧原子结合形成配合物。
目前,对Sb在土壤中的吸附已有一定研究,但对Sb(Ⅲ) 和Sb(Ⅴ) 吸附效应和吸附机理差异性的比较和介绍较少,本文论述了高岭土、蛭石、氢氧化铁、氢氧化铝4种吸附剂对Sb(Ⅲ) 和Sb(Ⅴ) 的吸附情况,旨在比较两个价态Sb在不同类型的吸附剂上的吸附效应和差异,为研究不同价态Sb的吸附特征做基础,为Sb在土壤复合环境下的吸附和迁移研究做铺垫。
1 材料与方法
1.1 吸附剂
选用4种吸附剂:氢氧化铁(Fe(OH)3)、高岭土、蛭石、氢氧化铝(Al(OH)3)。氢氧化铁为红棕色粉末,高岭土和氢氧化铝为白色粉末,以上3种试剂均为分析纯;蛭石为3 ~ 5 mm颗粒,过2 mm筛后使用。选用这4种吸附剂的原因在于该4种物质为土壤中的重要组成物质,特别是在贵州地区主要发育的黄壤,其主要的特征就是富含水合氧化铁(针铁矿)。另外,在黄壤中黏土矿物以蛭石为主,高岭石、伊利石次之,亦有三水铝石出现。
蛭石与蒙脱石相似,同为2︰1型的层状硅酸盐矿物,具有膨胀性能和较大的表面积及空隙。而高岭土则为1︰1型黏土矿物,无膨胀性能且表面积较小。三水铝石是铝的氢氧化物矿物,也可视为氧化铝的水合氧化物,晶体结构由 (OH)-Al-(OH) 配位八面体层平行叠置而成,通过用苛性钠对三水铝石矿物加温溶解出氧化铝是工业制备氢氧化铝的重要过程(拜耳法)。因此选用氢氧化铝作为类比,比较铝的氢氧化物对Sb的吸附情况。针铁矿和纤铁矿可能是氢氧化铁的结晶变形体,故选用氢氧化铁来类比铁的水合氧化物对Sb的吸附情况。
对上述4种吸附剂进行阳离子交换量(CEC)及比表面积测定,阳离子交换量测定方法依据《中性土壤阳离子交换量和交换性盐基的测定》(NY/T295- 1995),比表面积采用BET-N2吸附法通过全自动比表面微空隙分析仪(美国麦克仪器公司,ASAP2020 (M))进行测定,具体测量结果如表1所示。
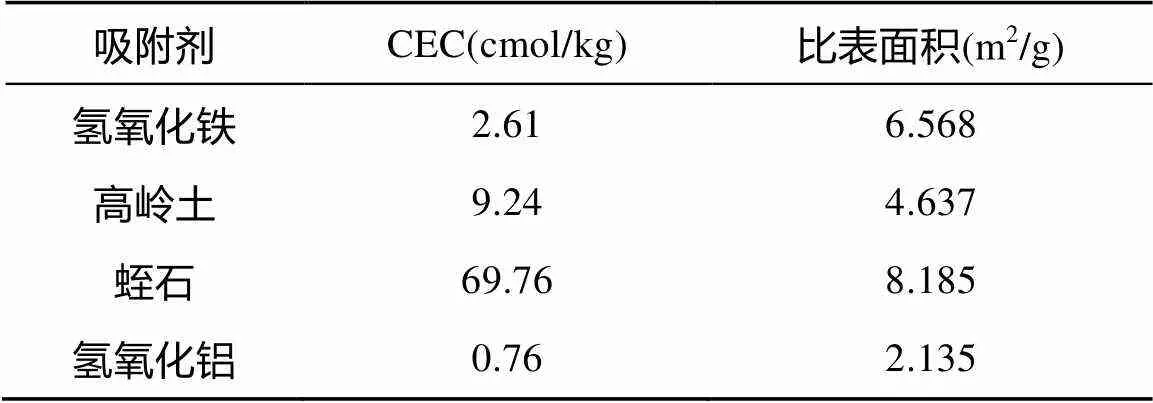
表1 4种吸附剂CEC及比表面积测定值
1.2 试验方案
1.2.1 吸附动力学试验 分别取0.50 g氢氧化铁、高岭土、氢氧化铝、蛭石(过2 mm筛)于50 ml离心管中;用酒石酸锑钾和焦锑酸钾分别配置1 000 mg/L的Sb Sb(Ⅲ) 和Sb(Ⅴ) 储备液,用0.01 mol/L NaCl溶液(控制离子强度)配置1 mg/L Sb(Ⅲ) 和Sb(Ⅴ) 溶液,取20 ml于离心管中;25℃下恒温振荡72 h,于一定时间:0.5、1、2、4、6、8、10、24、30、48、72 h取出离心管,离心,取上清液测定其中Sb(Ⅲ) 和总量Sb的浓度。
1.2.2 等温吸附试验 分别取0.50 g氢氧化铁、高岭土、氢氧化铝、蛭石(过2 mm筛)于一系列50 ml离心管中;向各组离心管中分别加入浓度梯度为0.5、1.0、2.0、4.0、8.0、15.0、20.0 mg/L的Sb(Ⅲ) 、Sb(Ⅴ) 溶液20 ml,25℃下振荡24 h,3 000 r/min下离心15 min,取上清液测定Sb(Ⅲ) 和总量Sb浓度。
1.2.3 不同背景溶液pH下 Sb的吸附解吸 用0.1 mol/L的NaOH溶液和HCl溶液调节0.01 mol/L NaCl背景溶液的pH为2.00、4.00、5.00、8.00,另以0.01 mol/L NaCl溶液即作为中性条件下背景溶液,pH为6.15;用上述不同pH的NaCl溶液分别配置1 mg/L的Sb(Ⅲ)和Sb(Ⅴ) 溶液,取20 ml不同pH溶液分别加入装有0.50 g吸附剂的离心管中,25℃下恒温振荡24 h;振荡结束后取出离心管,离心,取上清液测定其中Sb(Ⅲ) 和总量Sb浓度。另进行解吸试验:取上述吸附完成的离心管,倾倒去上清液,加入20 ml 0.01 mol/L NaCl溶液,25℃下恒温振荡24 h,离心,取上清液测定,观察解吸效果。
1.2.4 Sb价态的测定 Sb价态的测定方法采用差值法,利用柠檬酸钠对Sb(Ⅴ) 有较好的掩蔽作用[20]。分别取两份1 ml上清液于比色管,其中一支加入1 ml 100 g/L硫脲-抗坏血酸溶液,1 ml 1︰1盐酸,定容至10 ml刻度,还原30 min后测定总量Sb浓度;另一支中加入3 ml 20 g/L 柠檬酸钠溶液,对Sb(Ⅴ) 进行掩蔽,再加入1 ml 1︰1 盐酸,定容至10 ml刻度,测量Sb(Ⅲ) 浓度,利用总量和Sb(Ⅲ) 的浓度差得到Sb(Ⅴ) 浓度。
1.3 数据处理
Sb吸附量计算公式:
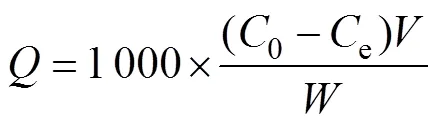
式中:为Sb吸附量(μg/g);0和e分别为溶液初始Sb浓度和吸附平衡时Sb浓度(mg/L);为加入的溶液体积(L);为土壤质量(g)。
Sb动力学吸附量计算公式:

式中:Q为某时刻的Sb吸附量(μg/g),Q–1为上一时刻的Sb吸附量(μg/g),C–1为上一时刻悬浮液中Sb浓度(mg/L),C为提取时刻悬浮液Sb浓度(mg/L);为加入的溶液体积(L);为土壤质量(g)。
2 结果与讨论
2.1 锑的吸附动力学过程
图1、图2为Sb(Ⅲ) 、Sb(Ⅴ) 吸附动力学过程吸附量变化。由图1、图2可知,Sb(Ⅲ) 和Sb(Ⅴ) 吸附量均在8 h之前有较快的上升,24 h之后趋于平稳。蛭石对Sb(Ⅲ) 的吸附量上升很快,在6 h时达到峰值,而高岭土和氢氧化铝对Sb(Ⅲ) 的吸附速率则不如蛭石和氢氧化铁显著。氢氧化铁相比于其他3种吸附剂,对Sb(Ⅲ) 和Sb(Ⅴ) 均有较好的吸附能力。4种吸附剂对Sb(Ⅲ) 和Sb(Ⅴ) 的吸附速率存在一定差异。其速率的限制因素与吸附质分子在界面上的扩散,受吸附剂表面静电吸引/排斥作用,以及与吸附剂表面吸附电位结合能力、表面化学反应的控制等等有关。
在图1所示的Sb(Ⅲ) 吸附动力学过程中,蛭石和氢氧化铁的吸附量在达到峰值后出现下降趋势,如氢氧化铁在6 h时吸附量为23.19 μg/g,72 h后降为19.75 μg/g,且Sb(Ⅴ) 浓度上升至0.548 mg/L。这与一些文献报道的情况类似,出现解吸的原因可能是Sb(Ⅲ) 吸附过程中发生氧化反应所致,氧化生成Sb(Ⅴ) 而从吸附剂上解吸。图3为以氢氧化铁为例,吸附动力学过程中Sb(Ⅲ) 、Sb(Ⅴ) 浓度的变化情况。如图3所示,Sb(Ⅲ) 浓度在不断下降,Sb(Ⅴ) 浓度逐渐升高,说明一直有Sb(Ⅲ) 进行转化,但不清楚是液相中的物质转化过程,还是固液相间的转化过程导致的Sb(Ⅴ)增加。对比其他吸附剂的情况,如高岭土和氢氧化铝上清液中Sb(Ⅴ) 浓度变化并不如氢氧化铁和蛭石反应中的显著,显示溶液中Sb(Ⅲ) 的转化应当是十分缓慢的,推测吸附过程对Sb(Ⅲ) 向Sb(Ⅴ) 的转化具有一定的影响。有文献提出,Sb(Ⅲ) 在矿物上的吸附可能催化氧化反应的发生;另外,有文献就Sb(Ⅲ) 、Sb(Ⅴ) 在铁铝氧化物表面上的相互反应过程和能量进行模拟和计算,推算其反应和吸附趋势,发现Sb(Ⅲ) 和Sb(Ⅴ) 更倾向于与铁的水合氧化物发生吸附反应,且Sb(Ⅲ) 吸附于吸附剂上后具有显著的氧化为Sb(Ⅴ) 形态的趋势[19]。推测这种Sb(Ⅲ) 向Sb(Ⅴ) 转化的结果与多相催化过程或氧化物表面的氧化还原反应有关,如Sb(Ⅲ) 在锰氧化物表面的氧化同时存在四价锰的还原[10,21]。而化学吸附是多相催化的先决条件,此外,多相催化的表面多为多孔物质中的特征吸附点位,蛭石相对于其他3种吸附剂具有更加丰富的空隙结构,因而具有更大的比表面积,且其对Sb(Ⅲ) 的吸附效果较其他3种吸附剂更好,则具有更多的吸附结合点位,促进多相催化反应的发生。
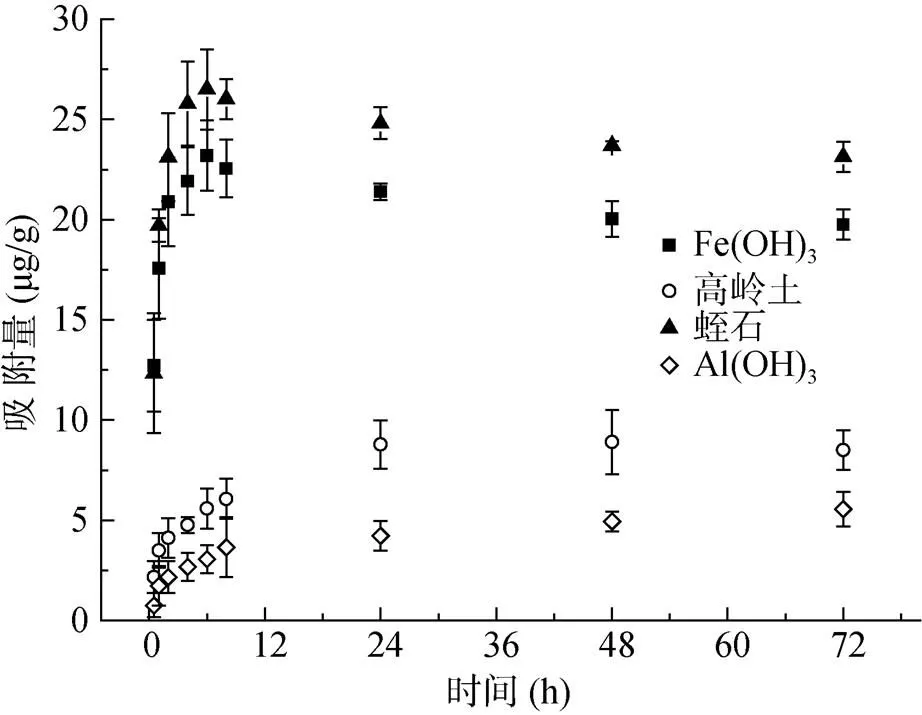
图1 Sb(Ⅲ) 吸附动力学过程

图2 Sb(Ⅴ)吸附动力学过程

图3 氢氧化铁吸附Sb(Ⅲ)动力学过程浓度变化
Fig 3 Changes of antimony concentrations during adsorption kinetics of Sb(Ⅲ) on ferric hydroxide
对Sb(Ⅲ) 和Sb(Ⅴ) 的吸附动力学过程进行了拟合,拟合方程为拟一级动力学方程、拟二级动力学方程、Elovich方程和双常数方程。拟合公式如表2所示。表3、表4分别为Sb(Ⅲ) 和Sb(Ⅴ) 动力学参数拟合结果。对Sb(Ⅲ) 而言,由于氢氧化铁和蛭石在吸附过程中伴随着解吸过程,其两者的拟合效果不及高岭土和氢氧化铝理想。总体而言,拟一级和拟二级动力学方程对Sb(Ⅲ) 均有较好的拟合效果,4种吸附剂的拟合优度均分别在0.8和0.7以上。Elovich方程和双常数方程对高岭土和氢氧化铝Sb(Ⅲ) 吸附有很好的拟合效果,两种方程对氢氧化铝的拟合优度分别为0.988和0.949,而对氢氧化铁和蛭石,这两种方程的拟合效果则不理想,拟合优度均在0.3以下。对Sb(Ⅴ) 来说,总体以拟二级方程拟合效果最好,拟合优度均在0.9以上。氢氧化铁和蛭石的拟二级动力学方程和Elovich方程拟合优度均在0.9以上,明显好于拟一级动力学方程和双常数方程。而对高岭土和氢氧化铝而言,拟一级和拟二级动力学方程则能更好地描述Sb(Ⅴ) 的吸附动力学过程,其拟合优度均为0.93以上,其次是Elovich方程。
2.2 锑的等温吸附过程
等温吸附用Langmuir和Freundlich两种模型进行拟合,Langmuir等温吸附模型为:

式中:m是最大吸附量(μg/g);是吸附平衡常数(L/g);e和e分别为吸附平衡时固相上的吸附量(μg/g)和悬浮液中的平衡浓度(μg/L)。
Freundlich等温吸附模型为:

式中:为Freundlich亲和系数((μg/g)/(μg/L)1/n),与吸附容量有关;n为常数,1/n被认为是吸附群强度的指标;e和e意义同上所述。

表2 动力学模型方程

表3 Sb(Ⅲ) 动力学吸附拟合参数
注:2为拟合优度(0<2<1);下同。

表4 Sb(Ⅴ)吸附动力学拟合参数
Langmuir模型所描述的等温线是一种随着浓度增加,逐渐趋于平缓的渐进线,其吸附面假设为光滑的理想表面,且假定仅发生单层吸附,该模型对化学吸附能很好地描述。与Langmuir模型不同,Freundlich模型描述的等温线呈无限上升的趋势,并假设吸附剂表面异质化、活性吸附点位分布不均的多层吸附。图4、图5分别为Sb(Ⅲ)和Sb(Ⅴ)的Langmuir吸附等温线、Freundlich吸附等温线;表5、表6所示为Sb(Ⅲ) 、Sb(Ⅴ) 吸附等温拟合参数。两种模型对两个价态Sb均有较好的拟合效果,拟合优度均在0.7以上。Sb(Ⅲ) 的等温吸附拟合中,除蛭石为Freundlich模型拟合效果好于Langmuir模型外,其余3种吸附剂的Langmuir模型拟合效果都好于Freundlich模型。而Langmuir模型对Sb(Ⅴ) 的拟合效果总体较Freundlich模型更好。
Langmuir模型拟合参数m为最大吸附量,若浓度无法满足吸附剂达到饱和程度的要求,则该拟合得出的最大吸附量并不准确。其中参数为吸附平衡常数,可视为与吸附质和吸附剂间的亲和力有关,其值越大则说明吸附效果越好。Sb(Ⅲ) 吸附中,蛭石的值最大,为0.000 66,其次为氢氧化铁,氢氧化铝的值最小。这与试验得出的直观数据相符,蛭石和氢氧化铁对Sb(Ⅲ) 的吸附能力好于其他两种吸附剂。而蛭石对Sb(Ⅴ)的吸附能力则明显下降,蛭石和高岭土两种黏土矿物对Sb(Ⅴ) 的吸附效果均低于氢氧化铁和氢氧化铝,其值拟合结果明显小于两种水合氧化物。此外值得注意的是,试验结果显示在低浓度下,蛭石对Sb(Ⅲ) 的吸附效果好于氢氧化铁,如在初始浓度为0.5 mg/L时,氢氧化铁的吸附量为9.70 μg/g,蛭石吸附量为17.16 μg/g,而从初始浓度为2 mg/L之后,氢氧化铁的吸附量开始高于蛭石。说明蛭石对Sb(Ⅲ) 具有较好的亲和力,而吸附容量不及氢氧化铁,可能由于氢氧化铁表面具有更多的羟基配体。

图4 Sb(Ⅲ) (A)和Sb(Ⅴ)(B)Langmuir吸附等温线比较

图5 Sb(Ⅲ) (A)和Sb(Ⅴ)(B)Freundlich吸附等温线比较

表5 Sb(Ⅲ) 和Sb(Ⅴ) Langmuir等温吸附拟合参数比较
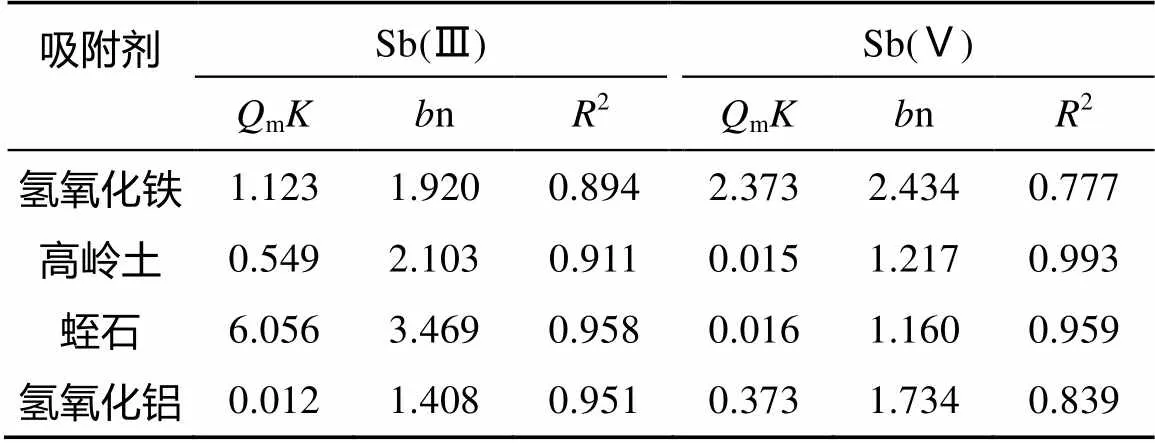
表6 Sb(Ⅲ) 和Sb(Ⅴ) Freundlich等温吸附拟合参数比较
Freundlich模型中的值与吸附亲和力有关,即值越大,吸附效果越显著。Sb(Ⅲ) 等温吸附中,蛭石的值最大,达到6.056,其次是氢氧化铁,为1.123。Sb(Ⅴ) 等温吸附中,氢氧化铁的值最大,为2.373,其对Sb(Ⅴ) 的吸附效果在4种吸附剂中最好,其次为氢氧化铝。1/n通常是在0 ~ 1范围内的值,有文献指出,n值越大,则吸附剂对重金属离子吸附作用力越大[22],若1/n在0.1 ~ 0.5,则表示吸附容易进行。与前述相符,Sb(Ⅲ) 在Freundlich等温吸附中,蛭石的n值最大;Sb(Ⅴ) 在Freundlich等温吸附中,氢氧化铁的n值最大,吸附效果最好。
综上,4种吸附剂中,蛭石和氢氧化铁对Sb(Ⅲ) 有较好的吸附效果,且氢氧化铁对Sb(Ⅴ) 的吸附效果最好。4种吸附剂对Sb(Ⅲ) 和Sb(Ⅴ) 的吸附效果均存在明显差异,总体来说对Sb(Ⅲ) 吸附效果好于Sb(Ⅴ),有文献提到这种差异可能跟Sb(Ⅲ) 和Sb(Ⅴ) 在溶液中的类型和性质不同有关。此外,Mason等[19]对Sb(Ⅲ) 、Sb(Ⅴ) 在铁/铝水合氧化物上的吸附反应能量分析计算得出,Sb(Ⅲ) 和Sb(Ⅴ) 更倾向于与铁氧化物结合。在本次试验结果中,氢氧化铁对Sb的吸附效果也明显好于氢氧化铝。
许多文献报道Sb(Ⅲ) 和Sb(Ⅴ) 在矿物胶体表面的吸附与表面羟基有关,其与氧结合形成内球面络合物[10,18-19]。高岭土和蛭石的阳离子交换量均大于两种水合氧化物,且蛭石这类2∶1型硅酸盐矿物含有更多的表面负电荷。由于表面羟基和负电荷数量可能导致黏土矿物和水合氧化物间对Sb(Ⅴ) 吸附的差异。然而蛭石和氢氧化铝对Sb(Ⅲ) 吸附间的差别,可能引出Sb(Ⅲ) 和Sb(Ⅴ) 吸附机理上的差异性。Freundlich模型对蛭石对Sb(Ⅲ) 的吸附拟合优度高于Langmuir模型,这个结果与绿脱石对Sb(Ⅲ) 、Sb(Ⅴ) 吸附的规律相似[5],而其对Sb(Ⅴ) 吸附中Langmuir模型拟合优度更好。且蛭石对Sb(Ⅲ) 吸附显著好于Sb(Ⅴ),并对Sb(Ⅲ) 不易解吸(下文将介绍)。推测其因具有较多的内部空隙而对Sb(Ⅲ) 的吸附体现了表面异质性的影响,而蛭石的大比表面特性并未在吸附Sb(Ⅴ) 时起到关键作用。可能由于Sb(Ⅲ) 、Sb(Ⅴ) 在溶液中的存在形式、分子形态以及在吸附剂表面的结合点位和分布差异等,引起吸附效果的不同。并且有文献通过吸附反应热力学分析得出Sb(Ⅴ) 吸附需克服一个小的活化势垒。
2.3 pH对锑吸附解吸的影响
土壤中的电荷有永久电荷和可变电荷,黏土矿物中大部分含有永久电荷,是由于硅氧四面体和铝氧八面体中阳离子被低价的阳离子同晶置换而形成,因而多数带负电荷。如蛭石的负电荷来源于硅氧四面体中的硅被铝置换。土壤可变电荷的来源是土壤胶体表面羟基的两性解离,主要来源于铁铝水合氧化物,另外黏土矿物边面上的破键水合形成的羟基表面也是可变电荷的来源。对于2︰1层型黏土矿物,如蒙脱石和蛭石,为两层硅氧片夹一层铝氧八面体片,因而其上下两面都是惰性疏水的硅氧烷面,因而与其带有的大量永久电荷相比,在一般的pH变化下,其可变电荷性质表现不明显。而高岭土的永久电荷量较少,蛭石的永久电荷为100 ~ 150 cmol/kg,而高岭土的永久电荷仅为3 ~ 10 cmol/kg[23]。高岭土为1︰1层型黏土矿物,即一层硅氧片和一层铝氧片为结构单元,其表面仅有一面为硅氧烷面,另一面的铝氧片中含有与氢结合的氧,且其电荷不饱和,在pH变化下产生可变电荷,因而高岭土具有明显的可变电荷。如与铝连接的电荷不饱和的氧,在酸性条件下,这个带负电荷的氧接受一个质子而带正电荷,而在强碱条件下,由于氢离子的解离而带负电荷。零点电荷可以指示在不同pH条件下吸附剂表面带电荷情况,氢氧化铁零点电荷pH在8.3 ~ 8.7[24],氢氧化铝为8.5 ~ 9.4[24],高岭土为3.5 ~ 4.6[25],蛭石在2.5 ~ 3.3。
如图6、图7所示,随着pH的升高,4种吸附剂对Sb(Ⅲ) 和Sb(Ⅴ)的吸附量逐渐降低。吸附平衡后,除背景液pH为2的条件下,4种吸附剂吸附平衡后悬浮液pH维持在2.10 ~ 3.24,背景溶液pH为4 ~ 8的其余4种条件下,吸附平衡的pH均有显著上升。高岭土吸附平衡pH为4.80 ~ 6.97,蛭石为2.20 ~ 7.20,氢氧化铁为7.85 ~ 8.45,氢氧化铝为7.45 ~9.05。高岭土在悬浮液pH为2.12的情况下对Sb(Ⅲ) 吸附量显著提高,为37.89 μg/g,与蛭石的38.59 μg/g接近,而平衡液pH升高为4.82时,高岭土对Sb(Ⅲ) 吸附量降为10.12 μg/g,表现出在强酸性条件下表面带正电荷对阴离子吸附效果增强。而氢氧化铝在强酸性条件下对Sb(Ⅲ) 的吸附量略有上升,仅从pH为7.74条件下的3.75 μg/g上升为7.05 μg/g,吸附效果不如预期,或许与Sb(Ⅲ) 的酸根离子与氢氧化铝的亲和力有关。高岭土、蛭石和氢氧化铝在强酸条件下对Sb(Ⅴ) 的吸附效果均有显著增加,如蛭石在吸附平衡pH为6.35条件下吸附量为8.45 μg/g,而pH为2.29时吸附量升至34.73 μg/g。氢氧化铝由pH为7.45的14.48 μg/g上升到pH为2.07的36.15 μg/g。而氢氧化铁的变化则较为平缓,5种pH条件下对Sb(Ⅴ) 的吸附量为10.35 ~ 17.51 μg/g,一方面与吸附反应容量有关,另一方面也许在强酸条件下,与氢氧化铁溶解有关。
如图8、图9所示,随着吸附平衡pH的升高,Sb(Ⅲ)、Sb(Ⅴ)的解吸率显著增加。在吸附平衡液pH为2.10 ~ 3.24条件下,除氢氧化铝外,其他3种吸附剂对Sb(Ⅲ) 的解吸率均在13% 以下,氢氧化铝对Sb(Ⅲ) 的解吸率一直在60% 以上。4种吸附剂在该pH条件下,对Sb(Ⅴ) 的解吸率均在14% 以下。蛭石对Sb(Ⅲ) 在pH变化范围内均有较好的吸附效果,且解吸率一直维持在10% 以下。通常吸附剂在吸附反应后,吸附质的脱附会出现滞后环,由于吸附剂表面的异质性,特别对于内部多孔物质,吸附质进入后很难脱出,其脱附需要一定的过程。蛭石对Sb(Ⅲ) 吸附解吸过程中,随着背景溶液pH的增加,解吸率变化不如其对Sb(Ⅴ)解吸过程显著,再次显示出蛭石对Sb(Ⅲ) 和Sb(Ⅴ) 吸附的差异,Sb(Ⅲ) 吸附过程中可能进入蛭石内部孔隙结构,结合能力较强从而不易解吸,体现出蛭石表面异质性对Sb(Ⅲ) 吸附的作用。

图6 Sb(Ⅲ) 在不同背景pH下的吸附情况

图7 Sb(Ⅴ) 在不同背景pH下的吸附情况
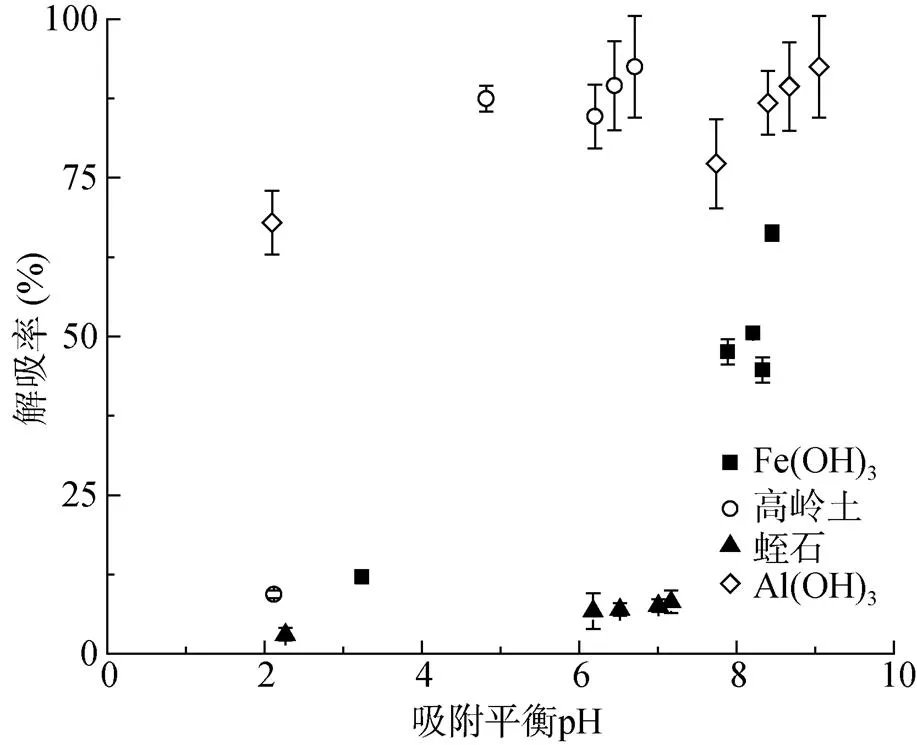
图8 Sb(Ⅲ) 在不同背景pH下吸附后的解吸

图9 Sb(Ⅴ) 在不同背景pH下吸附后的解吸
3 结论
1) 4种吸附剂对Sb(Ⅲ) 和Sb(Ⅴ)的吸附在反应24 h后均趋于平缓。蛭石和氢氧化铁对Sb(Ⅲ) 的吸附在前8 h内呈现快速的增长,在8 h后吸附量出现下降,溶液中Sb(Ⅴ) 浓度增加。如氢氧化铁在吸附反应6 h时吸附Sb(Ⅲ) 量为23.19 μg/g,72 h后降为19.75 μg/g,Sb(Ⅴ) 浓度上升到0.548 mg/L。
2) 4种吸附剂中,蛭石和氢氧化铁对Sb(Ⅲ) 的吸附能力较好;氢氧化铁对Sb(Ⅴ) 的吸附效果最好,其次为氢氧化铝。用Langmuir和Freundlich两个模型进行等温吸附线拟合,两种模型对Sb(Ⅲ) 和Sb(Ⅴ)吸附拟合优度2均在0.7以上,Freundlich模型对蛭石吸附Sb(Ⅲ) 的拟合优度大于Langmuir模型,而对其他吸附剂及对Sb(Ⅴ) 等温吸附情形下,Langmuir模型则更适宜。
3)随着背景溶液pH的升高,4种吸附剂对Sb(Ⅲ) 和Sb(Ⅴ) 的吸附量明显下降,并且解吸量同时显著上升。如高岭土对Sb(Ⅲ) 的吸附,在平衡液pH为2.12时吸附量为37.89 μg/g,当pH升高为4.82时,高岭土对Sb(Ⅲ) 吸附量降为10.12 μg/g。
[1] 袁程, 张红振, 池婷, 等. 中南某锑矿及其周边农田土壤与植物重金属污染研究[J]. 土壤, 2015, 47(5): 960–964
[2] Lintschinger J, Michalke B, Schulte-Hostede S. Studies on speciation of antimony in soil contaminated by industrial activity[J]. International Journal of Environmental Analytical Chemistry, 1998, 72(1): 11–25
[3] 何孟常, 万红艳. 环境中锑的分布、存在形态及毒性和生物有效性[J]. 化学进展, 2004,16(1): 131–135
[4] Buschmann J, Sigg L. Antimony(Ⅲ) binding to humic substances: influence of pH and type of humic acid[J]. Environmental Science & Technology, 2004, 38(17): 4535–4541
[5] Ilgen A G, Trainor T P. Sb(III) and Sb(V) sorption onto Al-rich phases: Hydrous Al oxide and the clay minerals Kaolinite KGa-1b and oxidized and reduced nontronite NAu-1[J]. Environmental Science & Technology, 2012, 46(2): 843–851
[6] Masaki T, Satoshi F, Takashi Y. Determination of chemical form of antimony in contaminated soil around a smelter using X-ray absorption fine structure[J]. Analytical Sciences the International Journal of the Japan Society for Analytical Chemistry, 2005, 21(7): 769–773
[7] Mitsunobu S, Harada T, Takahashi Y. Comparison of antimony behavior with arsenic under various soil redox conditions[J]. Environmental Science & Technology, 2006, 40: 7270–7276
[8] Xi J H, He M C, Lin C. Adsorption of antimony(III) and antimony(V) on bentonite: Kinetics, thermodynamics and anion competition[J]. Microchemical Journal, 2011, 97(1): 85–91
[9] Xi J H, He M C, Wang K P, et al. Adsorption of antimony (III) on goethite in the presence of competitive anions[J].Journal of Geochemical Exploration, 2013, 132(3): 201–208
[10] Liu R, Xu W, He Z, et al. Adsorption of antimony(V) onto Mn(II)-enriched surfaces of manganese-oxide and FeMn binary oxide[J]. Chemosphere, 2015, 138: 616–624
[11] 李璐璐, 张华, 周世伟, 等.中国南方两类典型土壤对五价锑的吸附行为研究[J]. 土壤学报, 2014, 51(2): 279–285
[12] 李璐璐, 张华, 周世伟, 等. 五价锑在中国南方两类典型土壤中的迁移特征[J]. 土壤学报, 2015, 52(2): 321–328
[13] Scheinost A C, Rossberg A, Vantelon D, et al. Quantitative antimony speciation in shooting-range soils by EXAFS spectroscopy[J]. Geochimica Et Cosmochimica Acta, 2006, 70(13): 3299–3312
[14] 钟松雄, 尹光彩, 陈志良, 等. 水稻土中砷的环境化学行为及铁对砷形态影响研究进展[J]. 土壤, 2016, 48(5): 854–862
[15] Mccomb K A, Craw D, Mcquillan A J. ATR- IR spectroscopic study of antimonite adsorption to iron oxide[J]. Langmuir., 2007, 23(24): 12125–12130
[16] Liu T, Wu K, Xue W, Ma C. Characteristics and Mechanisms of Arsenate Adsorption onto Manganese Oxide-Doped Aluminum Oxide[J]. Environmental Progress & Sustainable Energy, 2015, 34(4): 1009–1018
[17] Sh T, Liu C Q, Wang L H. Antimony coordination to humic acid: Nuclear magnetic resonance and X-ray absorption fine structure spectroscopy study[J]. Microchemical Journal, 2012, 103(103): 68–73
[18] Mittal V K, Bera S, Narasimhan S V, et al. Adsorption behavior of antimony(III) oxyanions on magnetite surface in aqueous organic acid environment[J]. Applied Surface Science, 2013, 266(2): 272– 279
[19] MasonS E, Trainor T P, Goffinet C J. DFT study of Sb(III) and Sb(V) adsorption and heterogeneous oxidation on hydrated oxide surfaces[J]. Computational and Theoretical Chemistry, 2012,987(5): 103–114
[20] Jr1 S M, Leao D J, Oliveira O M, et al. Speciation analysis of inorganic antimony in sediment samples from São Paulo Estuary, Bahia State, Brazil[J]. Environmental Science and Pollution Research, 2015, 22(11): 8386–8391
[21] 徐伟. 铁锰复合氧化物表面砷解吸及锑吸附行为研究[D]. 北京: 中国科学院研究生院, 2011
[22] 关连珠, 周景景, 张昀, 等. 不同来源生物炭对砷在土壤中吸附与解吸的影响[J]. 应用生态学报, 2013, 24(10): 2941–2946
[23] 于天仁, 季国亮, 丁昌璞.可变电荷土壤的电化学[M]. 北京: 科学出版社, 1996: 1–36
[24] 安德森M A, 鲁宾 A J(美).水溶液吸附化学——无机物在固-液界面上的吸附作用[M]. 北京: 科学出版社, 1989: 87–103
[25] 赵杏媛,张有瑜. 粘土矿物与粘土矿物分析[M]. 北京: 海洋出版社, 1990: 37–40
Adsorption Characteristics of Trivalent and Pentavalent Antimony on Different Adsorbents
ZHANG Yingxue, XU Siqin*, LI Jiashuang
(Key Laboratory of Environment and Geologic Hazard Prevention of Karst, Guizhou University, Guiyang 550025, China)
This study reports on the adsorption reactions of trivalent antimony (Sb(Ⅲ)) and pentavalent antimony (Sb(Ⅴ)) on four adsorbents: ferric hydroxide, aluminum hydroxide, kaolin and vermiculite, which were used to simulate the main minerals in the soil. The results showed that the adsorptions of both Sb(Ⅲ) and Sb(Ⅴ) on the four adsorbents gradually become stable after 24 h. In addition, the adsorption of Sb(Ⅲ) on vermiculite andferric hydroxide reached to peak value at 6 h and then decreased. For example, the adsorption of Sb(Ⅲ) on ferric hydroxide was 23.19 μg/g at 6 h, and decreased to 19.75 μg/g at 72 h. The decline of adsorption and the increase concentration of Sb(Ⅴ) determined in supernatant indicated the oxidation of Sb(Ⅲ) during the adsorption process. The isothermal adsorption curves of two valence antimony were fitted well by Langmuir and Freundlich adsorption models, and the goodness of fit (2) of both models were above 0.7. Comparing the fitting curve and the parameters obtained, the best adsorption of Sb(Ⅲ) were shown on vermiculite and ferric hydroxide, while the absorbability of vermiculite to Sb(Ⅴ) was weak. Sb(Ⅴ) were adsorbed better by ferric hydroxide and aluminum hydroxide, but aluminum hydroxide showed poor adsorption effect of Sb(Ⅲ). Both valence antimony had anion adsorption characteristics, for the adsorption decreased while the desorption increased with the increase of equilibrium solution pH. For instance, the adsorption of Sb(Ⅲ) on kaolin increased from 10.12 μg/g to 37.89 μg/g when the equilibrium solution pH decreased from 4.82 to 2.12.
Sb(Ⅲ); Sb(V); Adsorption effect; Soil mineral; Iron/aluminum hydroxide
国家自然科学基金项目(41062007)、贵州省重点学科建设项目(黔学位合字ZDXK[2016]11号)、贵州省高校喀斯特环境生态工程研究中心建设项目(黔教合KY字[2016]011)和贵州省水利科技经费项目(KT201403)资助。
(sqxu1@gzu.edu.cn)
张莹雪(1992—),女,贵州贵阳人,硕士研究生,主要研究方向为岩溶环境污染与控制。E-mail: nazhangive@126.com
10.13758/j.cnki.tr.2018.01.019
X131.3
A
