阿尔山国家森林公园自然保护区杨树根际土壤固氮菌多样性及特性研究
2018-03-20牛艳芳陈立红内蒙古农业大学林学院内蒙古呼和浩特0009内蒙古师范大学生命科学与技术学院内蒙古呼和浩特000
牛艳芳,闫 伟,陈立红,峥 嵘(内蒙古农业大学 林学院,内蒙古 呼和浩特0009;内蒙古师范大学 生命科学与技术学院,内蒙古 呼和浩特 000)
生物固氮是指微生物通过固氮酶的催化将大气中的分子氮还原为氨的过程,在生物固氮中,固氮量的60%由陆生固氮生物完成,40%由海洋固氮生物完成[1-2]。到目前为止,所发现的生物固氮作用只存在于细菌域和古生菌域中,在分类地位上主要隶属于固氮菌科(Azotobacteraceae)、根瘤菌科(Rhizobiaceae)、红螺菌目(Rhodospirillales)、甲基球菌科(Methylococcacese)、蓝细菌(Cyanobacteria)以及芽孢杆菌属(Bacillus)和梭菌属(Clostridium)中的部分菌种。自1886年人们首次分离出共生固氮的根瘤菌起,至2006年已发现的固氮微生物多达200余属[3-6]。
近年来,很多学者热衷于研究农业作物及固氮树种的固氮作用[7-13],而对于非固氮树种的固氮研究相对较少,仅限于杨树、杉木、茶树、马尾松、桉树等的初步研究,且集中在联合固氮菌的回接对这些树木的促生效应方面[14-21]。杨树具有适应性强、生长速度快、轮伐期短等特点,已成为主要的造林树种,广泛地应用于森林保护、农田防风固沙和道路两边的绿化等领域,其氮素来源于土壤和人工施用的氮肥,对土地消耗巨大[22-23]。杨树作为非固氮树种的典型代表,其固氮机制研究相对较少。因此,本研究对阿尔山国家森林公园自然保护区杨树根际土壤固氮菌进行了筛选,并对其特性进行分析,旨在探明杨树的固氮机制,为以非固氮树种为主的森林生态系统的可持续发展提供理论依据。
1 研究区概况
研究区位于内蒙古自治区东部兴安盟的西北端,地处大兴安岭中段,被呼伦贝尔、锡林郭勒、科尔沁、蒙古四大草原所环抱,东邻扎兰屯市,西与锡林郭勒盟及蒙古国接壤,北与呼伦贝尔新巴尔虎左旗、鄂温克旗毗邻,南与兴安盟科右前旗相接,地理坐标为北纬46°39′-47°39′,东经119°28′-121°23′。年均温度为-3.1 ℃,年平均湿度为70%,每年7-8月份湿度最大,约为80%,春季湿度在50%左右,冬季湿度为76%~79%。阿尔山森林资源丰富,森林面积46.4万hm2,人工林10.53万hm2,森林覆盖率为79.2%,活立木蓄积量28 261 387.1 m3。林相以寒温带针阔叶混交林为主,树种以兴安落叶松、油松、山杨、白桦为主,均为非固氮树种[24-25]。
2 研究方法
2.1 主要试剂
细菌基因组提取试剂盒,天根生化科技有限公司生产;TaqMaster Mix(2×),购于南京博尔迪生物科技有限公司。试验所用引物由生工生物工程(上海)有限公司合成。
阿须贝无氮培养基:葡萄糖10 g,KH2PO40.2 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g,CaSO40.2 g,CaCO35 g,琼脂18 g,蒸馏水1 000 mL,pH为7.0~7.2。
无机磷培养基:Ca3(PO4)25 g,葡萄糖10 g,(NH4)2SO40.5 g,NaCl 0.3 g,MgSO4·7H2O 0.3 g,KCl 0.3 g,MnSO40.03 g,FeSO4·7H2O 0.03 g,蒸馏水1 000 mL,pH 7.0。
2.2 土样的采集
2015年8,在阿尔山国家森林公园自然保护区杨树分布区内选取一块样地,设置5个不同的采样点(4个顶点加1个中心点),每个采样点选取一棵杨树,去除地表的腐殖质,用无菌的铁锹挖取30 cm深的土壤,找到杨树根系,将带有根系的土壤装入灭菌的密封袋,带回实验室于4 ℃冰箱保存备用。
2.3 根际土壤固氮菌的分离与纯化
[26-27],采用阿须贝无氮培养基分离纯化土壤样品中的固氮菌。称取土样10 g,放入装有90 mL无菌水的加玻璃珠的三角瓶中,在摇床上于150 r/min振荡20 min,依次制成稀释度分别为10-3,10-4,10-5的土壤悬液,分别接种到培养皿中,用无菌玻璃棒涂布均匀,28 ℃下培养6~7 d。将培养出来的固氮菌菌落利用划线法进行分离,培养分离到的纯种固氮菌4~5 d,之后再转接3次,保证分离纯化的固氮菌仍具有固氮作用。将纯化后的固氮菌保存于试管中,置4 ℃冰箱中保存备用。
2.4 根际土壤固氮菌的形态观察及生理生化特性测定
依照《微生物学实验》[28]及周国英等[29]的方法,对分离出的固氮菌进行菌体形态及生理生化鉴定,以不接菌的培养基作为空白对照(CK)。
2.5 根际土壤固氮菌系统发育树的构建
利用细菌基因组提取试剂盒提取固氮菌基因组DNA,具体操作方法详见试剂盒说明书。以细菌基因组DNA为模板,采用细菌通用引物27f(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492r(5′-GGTTACCTTGTTACGACTT-3′)扩增16S rDNA。PCR反应体系为25 μL:DaeamTaqGreen PCR Master Mix(2×)12.5 μL,10 μmol/L引物27f 1.0 μL,10 μmol/L引物1492r 1.0 μL,模板DNA 1.0 μL,ddH2O 9.5 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,43 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 15 min。PCR产物送上海生物工程有限公司进行16S rDNA测序。
将测定的固氮菌16S rDNA序列经软件DNAMAN6.0校正后引入EzTaxon(http://www.ezbiocloud.net/eztaxon),进行菌株分类地位的初步确定,寻找相似性最高的模式种序列作为系统发育分析的参比序列,利用DNAMAN6.0进行多序列比对,然后采用MEGA 4中的邻接法(NJ)构建系统发育树,自展值(Bootstrap)为1 000,分析根际土壤固氮菌的系统发育地位[30-33]。
2.6 不同pH和温度对根际土壤固氮菌生长的影响
2.6.1 pH 将筛选出的固氮菌制成菌悬液,使其在600 nm处的吸光值(D600 nm)为0.05,吸取不同固氮菌的菌悬液0.1 mL,分别接种于pH为 3,4,5,6,7,8,9,10和11的阿须贝无氮培养基中,每处理3个重复,28 ℃培养5 d,观察菌落生长情况。
2.6.2 温 度 吸取上述菌悬液0.1 mL接种于阿须贝无氮培养基中(pH 7.0),每个处理3次重复,分别于4,15,28,37,45 ℃培养5 d,观察不同温度下菌落的生长情况。
2.7 根际土壤固氮菌解磷能力的测定
将不同固氮菌进行活化处理后,采用溶磷圈法[34]接种到无机磷培养基中,28 ℃培养10 d,观察菌落周围是否有透明圈出现,如果出现,测定透明圈直径(D)和菌落的直径(d),用D/d表示菌株解磷能力的强弱,其值越大,表明菌株解磷能力越强。
3 结果与分析
3.1 杨树根际土壤固氮微生物的分离与纯化
根据菌落大小、颜色、透明度、边缘是否整齐等特征,最终从杨树根际土壤中分离得到8株能在阿须贝无氮培养基上生长的细菌,分别命名为XY1、XY2、XY5、XY7、XY8、XY9、XY14和XY15。
3.2 杨树根际土壤典型固氮菌菌落的形态及生理生化特性
从图1可以看出,8株固氮菌的菌落形态各不相同,菌株XY1菌落较大,淡黄色,不透明,表面较湿润、光滑,边缘整齐,扁平;菌株XY2菌落大小中等,乳白色,不透明,表面较湿润、光滑,边缘整齐,扁平;菌株XY5菌落较小,乳白色,不透明,表面湿润、光滑,边缘整齐,突起;菌株XY7菌落较大,中间淡黄色,边缘乳白色,不透明,表面湿润、光滑,边缘整齐,突起;菌株XY8菌落较大,乳白色,不透明,表面湿润、光滑,边缘整齐,突起;菌株XY14菌落大小中等,乳白色,不透明,表面较湿润,边缘不整齐,扁平;菌株XY15菌落较小,乳白色,不透明,表面较湿润,边缘不整齐,扁平;菌株XY9菌落大小中等,乳白色,不透明,干燥,边缘不整齐,扁平。
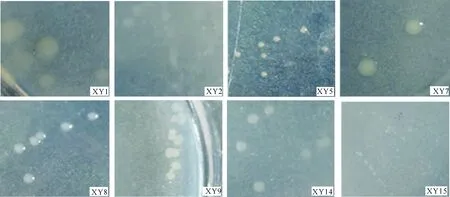
图1 阿尔山国家森林公园自然保护区杨树根际8株土壤固氮菌的菌落形态Fig.1 Colony morphology of 8 tested nitrogen-fixing strains in Populus L.rhizosphere in Arxan National Forest Park
由表1可知,8株典型固氮菌的生理生化特征具有明显的差异。菌株XY1的葡萄糖、乳糖、甘露醇、蔗糖、尿素水解、过氧化氢酶反应均为阳性;菌株XY2的葡萄糖、乳糖、甘露醇、蔗糖、吲哚试验、淀粉水解、油脂水解、过氧化氢酶反应均为阳性;菌株XY5的葡萄糖、甘露醇、蔗糖、尿素水解、过氧化氢酶反应均为阳性;菌株XY7的葡萄糖、甘露醇、甲基红试验、VP试验、尿素水解、过氧化氢酶反应均为阳性;菌株XY8的葡萄糖、乳糖、甘露醇、蔗糖、尿素水解、过氧化氢酶反应均为阳性;菌株XY14的葡萄糖、乳糖、甘露醇、蔗糖、吲哚试验、淀粉水解、油脂水解、尿素水解、过氧化氢酶、明胶液化反应为均为阳性;菌株XY15的葡萄糖、甘露醇、吲哚试验、VP试验、油脂水解、过氧化氢酶、明胶液化均为阳性;菌株XY9的葡萄糖、甘露醇、蔗糖、VP试验、油脂水解、过氧化氢酶、明胶液化、革兰氏染色反应均为阳性。
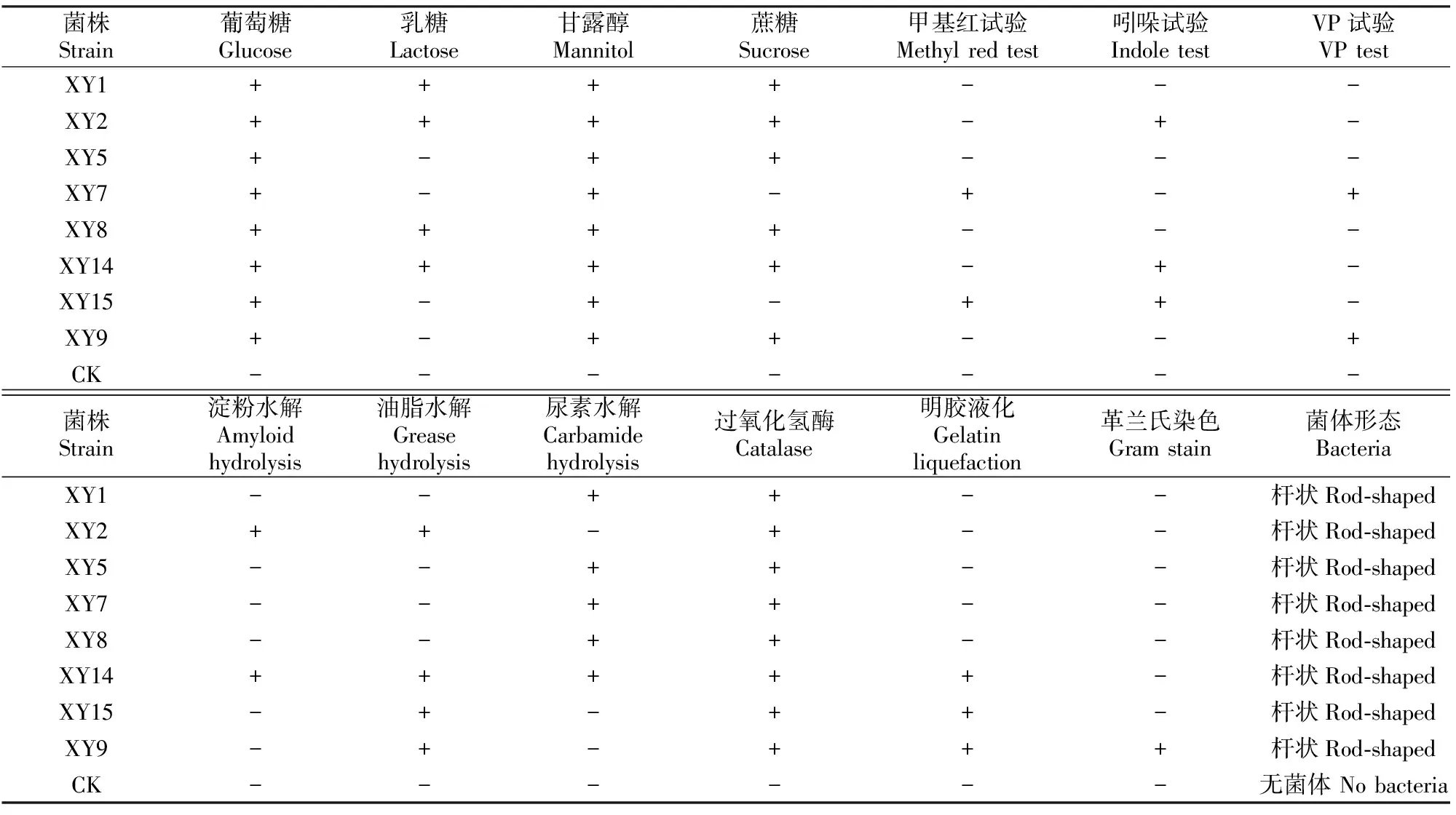
表1 阿尔山国家森林公园自然保护区杨树根际8株固氮菌的生理生化特征Table 1 Physiological and biochemical features of 8 tested nitrogen-fixing strains in Populus L.rhizosphere in Arxan National Forest Park
注:“+”表示反应呈阳性,“-”表示反应呈阴性,“CK”表示空白对照。
Note:“+”.Positive,“-”.Negative,“CK”.Blank control
3.3 杨树根际8株土壤固氮菌16S rDNA基因序列测定及系统发育分析
用细菌通用引物27f和1492r,对阿尔山杨树根际土壤中分离出的8株固氮菌的16S rDNA基因片段进行扩增,所得片段长度均约为1.5 kb(图2),符合细菌16S rDNA的大小。
将测定的固氮菌16S rDNA序列引入EzTaxon进行序列比对,结果表明,从杨树根际土壤分离出的8株固氮菌的16S rDNA与相关标准菌株的相似性为96.85%~99.8%。根据16S rDNA鉴定标准,同源性大于等于97%的属于同一种,同源性大于85%而小于97%的认定为同一个属不同的种[35-36]。从系统发育树(图3)可以看出,分离出的8株固氮菌分属于8个不同的属。
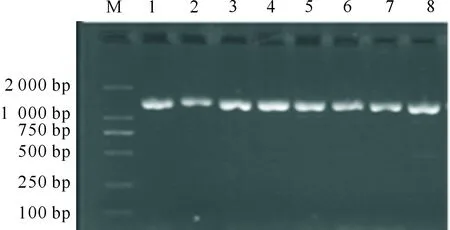
M.DNA Marker;1~8分别为菌株XY1、XY2、XY5、XY7、XY8、XY9、XY14、XY15扩增产物M.DNA Marker;1-8.Represent amplification products of XY1,XY2,XY5,XY7,XY8,XY9,XY14,and XY15,respectively图2 阿尔山国家森林公园自然保护区杨树根际8株固氮菌16S rDNA电泳图谱Fig.2 Amplification products of 16S rDNA gene from nitrogen-fixing bacteria strains in Populus L.rhizosphere in Arxan National Forest Park
根据《伯杰氏鉴定细菌学手册》[37]和《常见细菌系统鉴定手册》[38],结合16S rDNA序列分析,最终确定,分离自阿尔山杨树根际土壤的固氮菌XY1、XY2、XY5、XY7、XY8、XY14、 XY15 和XY9分别属于柄杆菌属(Caulobacter)、叶杆菌属(Phyllobacterium)、红球菌属(Rhodococcus)、假单胞菌属(Pseudomonas)、根瘤菌属(Rhizobium)、类芽孢杆菌属(Paenibacillus)、沙雷氏菌属(Serratia)、芽孢杆菌属(Bacillus)等。
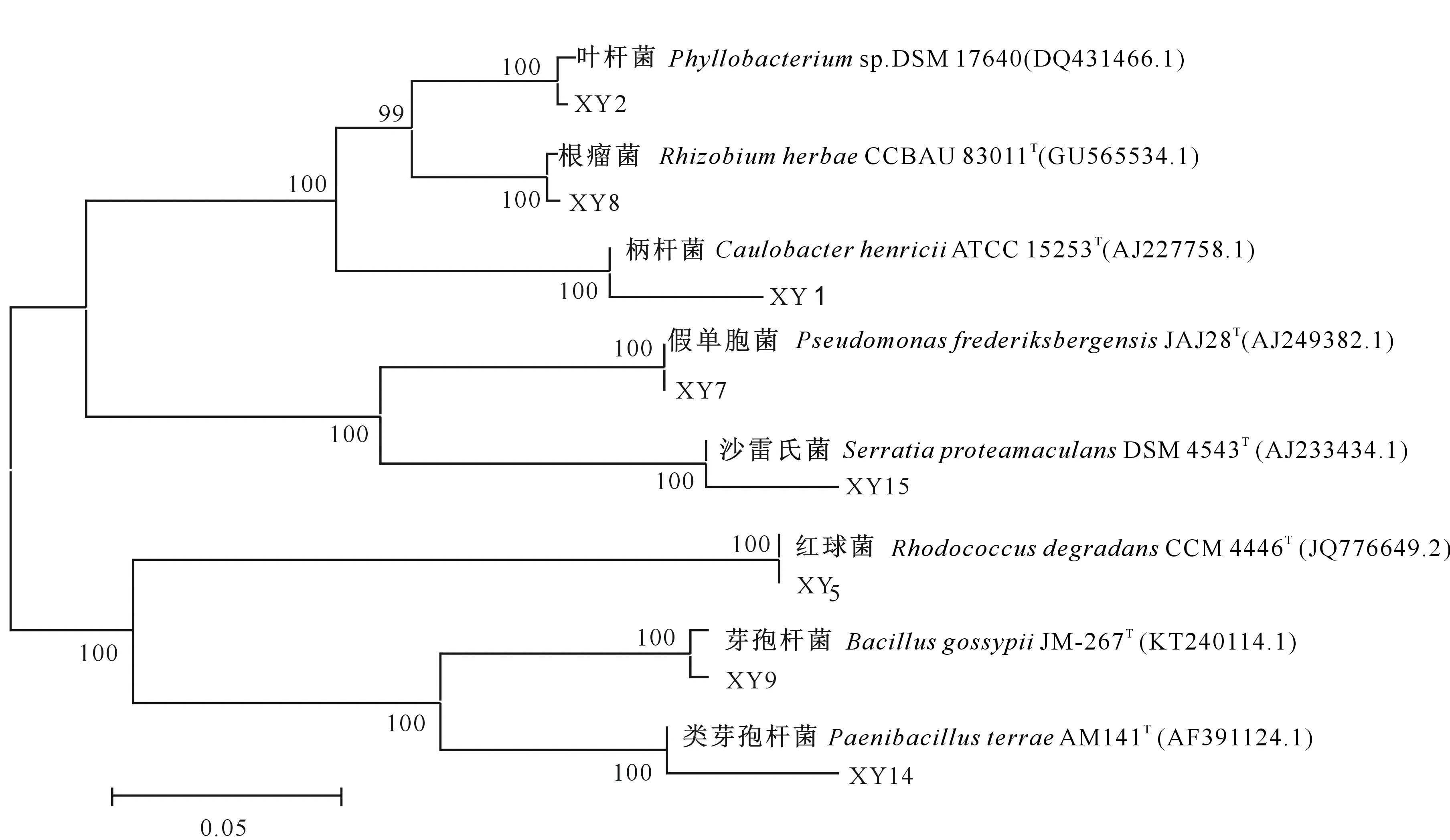
图3 基于16S rDNA序列的阿尔山国家森林公园自然保护区杨树根际固氮菌的系统发育树Fig.3 Phylogenetic tree based on 16S rDNA sequences from nitrogen-fixing bacteria strains in Populus L.rhizosphere in Arxan National Forest Park
3.4 pH和温度对杨树根际8株土壤典型固氮菌生长的影响
3.4.1 pH 从表2可以看出,不同固氮菌生长的pH范围有差异,菌株XY1、XY2、 XY5 生长pH为3~9,其中XY1和XY2的最适pH为6~8,XY5的最适pH为6~7;菌株XY7的生长pH为4~10,最适pH为6~8;菌株XY8的生长pH为3~10,最适pH为7;菌株XY 14生长的pH为3~11,最适pH为7;菌株XY15生长的pH为5~9,最适pH为6~7;菌株XY9生长的pH为4~10,最适pH为7。
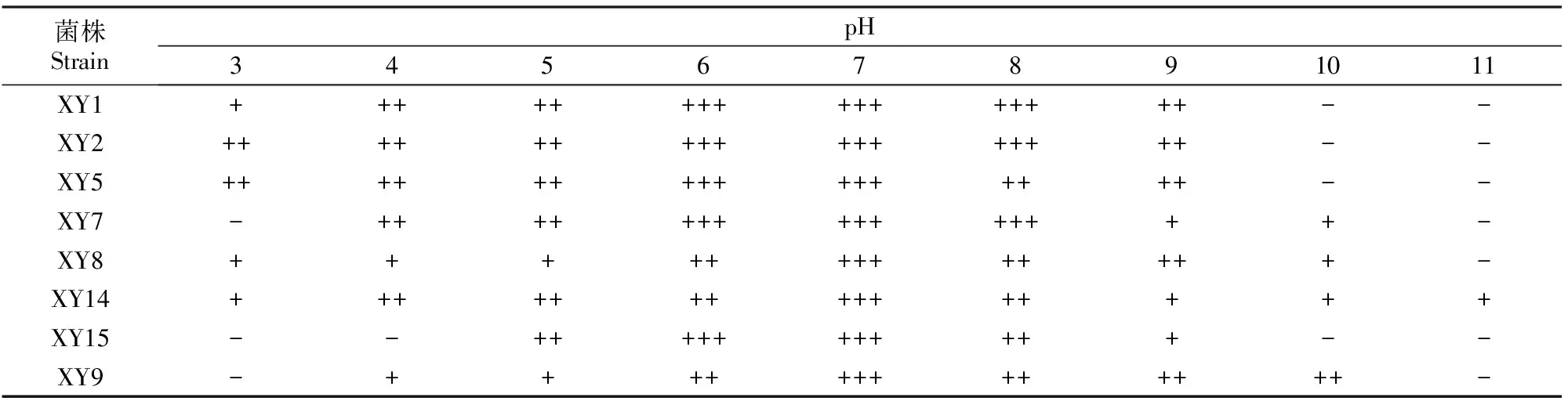
表2 阿尔山国家森林公园自然保护区杨树根际8株固氮菌在不同pH下的生长情况Table 2 Effect of different pH on growth of strains from Populus L.in Arxan National Forest Park
注:“-”表示不生长,“+”表示生长,“++”表示生长较好,“+++”表示生长旺盛。下表同。
Note:“-” Represents no growth,“+” Represents growth,“++” Represents good growth,“+++” Represents lush growth.The same below.
3.4.2 温 度 从表3可以看出,不同固氮菌生长温度不同,菌株XY2、XY5、XY8、XY9的生长温度范围比较广,在4~45 ℃都能生长;菌株XY1和XY7生长温度为15~28 ℃;菌株XY14生长温度为15~37 ℃;菌株XY15生长温度为4~37 ℃。
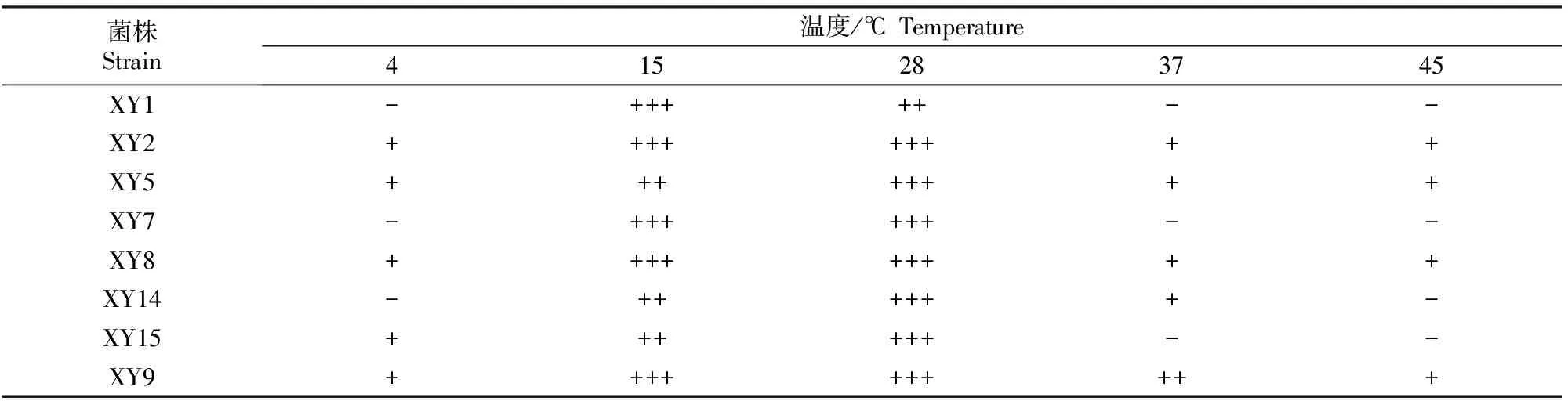
表3 阿尔山国家森林公园自然保护区杨树根际8株固氮菌在不同温度下的生长情况Table 3 Effect of different temperature on growth of strain in Populus L.rhizosphere in Arxan National Forest Park
3.5 杨树根际8株固氮菌的解磷能力
固氮菌除了具有固氮能力外,张晓勇等[39]和Malik等[40]还发现,有些固氮菌具有解磷作用。本试验对筛选出的8株固氮菌的解磷能力进行了测定,结果发现,只有菌株XY2、XY7在培养基上出现了透明圈,其他菌株在培养基上未出现透明圈,其中菌株XY2的透明圈直径(D)为1.35 cm,菌落直径(d)为1.12 cm,其D/d值为1.21;菌株XY7的D为1.2 cm,d为0.9 cm,其D/d值为1.33。结果表明,只有XY2、XY7具有解磷能力,其他菌株无解磷能力。
4 讨 论
植物根际土壤固氮菌具有丰富的多样性,对一种植物而言,其根际土壤中能分离出几种甚至十几种不同类型的固氮菌[41]。本研究利用阿须贝无氮培养基从阿尔山国家森林公园自然保护区杨树根际土壤中分离得到8株固氮菌,经菌落形态、生理生化特性及分子生物学鉴定,分别属于柄杆菌属、叶柄菌属、红球菌属、假单胞菌属、根瘤菌属、类芽孢杆菌属、沙雷氏菌属、芽孢杆菌属等8个不同的属,表明该地区杨树根际土壤固氮菌资源丰富。
本研究中,不同固氮菌的生长pH和温度有差异,其中有的固氮菌pH生长范围比较宽,既可以在碱性条件下生长,也可以在酸性条件下生长,如菌株XY14;有的菌株具有较宽的温度生长范围,在4~45 ℃都能生长,如菌株XY2、XY5、XY8和XY9;有的固氮菌除了具有固氮能力之外,还具有解磷能力,为树木的生长提供氮素营养的同时又提供磷素营养,如菌株XY2和XY7。综上所述可知,不同类型固氮菌的生物特性不同,这为森林生态系统非固氮树种的固氮研究提供了理论依据。在后续的研究中,将分离鉴定出的不同固氮菌回接到杨树根际,结合杨树生长的特殊生境,筛选出可促进杨树生长的优良菌株,为研制适合杨树生长的专用微生物肥料提供理论依据。
[参考文献]
[1] 张 武,杨 琳,王紫娟.生物固氮的研究进展及发展趋势 [J].云南农业大学学报,2015,30(5):810-821.
Zhang W,Yang L,Wang Z J.Advance and development trend of biological nitrogen fixation esearch [J].Journal of Yunnan Agricultural University,2015,30(5):810-821.
[2] 冯晓敏,杨 永,任长忠,等.燕麦/大豆和燕麦/花生间作对根际土壤固氮细菌多样性与群落结构的影响 [J].中国农业大学学报,2016,21(1):22-32.
Feng X M,Yang Y ,Ren C Z,et al.Effects ofoat-soybean andoat-groundnu intercropping on the diversity and community composition of soil nitrogen-fixing bateral in rhizosp here soil [J].Journal of China Agriculturl University,2016,21(1):22-32.
[3] 周德庆.微生物学教程 [M].北京:高等教育出版社,2011:136-141.
Zhou D Q. Microbiology tutorial [M].Beijing:Higher Education Press,2011:136-141.
[4] 沈 萍,陈向东.微生物学 [M].北京:高等教育出版社,2006,119-120.
Shen P,Chen X D.Microbiology [M].Beijing:Higher Education Press,2006:119-120.
[5] 孙建光,徐 晶,胡海燕,等.中国十三省市土壤中非共生固氮微生物菌种资源研究[J].植物营养与肥料学报,2009,15(6):1450-1465.
Sun J G ,Xu J ,Hu H Y,et al.Collection and investigation on asymbiotic nitrogen-fixing microbial resources from 13 provinces over China[J].Plant Nutrition and Fertilizer Science,2009,15(6):1450-1465.
[6] Navarro-Noya,Yendi E, Hernandez-Mendoza,et al.Isolation and characterization of nitrogen fixing heterotrophic bacteria from the rhizosphere of pioneer plants growing on mine tailings [J].Applied Soil Ecology,2012,62:52-60.
[7] Katherine E F,Andrzej T,Lindsay A,et al.Conversion of grassland to arable decreases microbial diversity and alters community composition [J].Applied Soil Ecology,2017,1:43-52.
[8] Bauer J T, Kleczewski N M, Bever J D , et al.Nitrogen-fixing bacteria and arbuscular mycorrhizal fungi in Piptadenia gonoacantha (Mart.) Macbr [J].Brazilian Journal of Microbiology,2016,481(1):95-100.
[9] 樊俊华,张晓波,赵 艳.地毯草根际固氮菌的分离及鉴定 [J].东北农业大学学报,2012,43(8):105-109.
Fan J H,Zhang X B,Zhao Y.Isolation and identification of associative nitrogen-fixing bacteria in the rhizosphere ofAxonopuscompressus[J].Journal of Northeast Agricultural University,2012,43(8):105-109.
[10] Verma J P,Yadav J,Tiwari K N,et al.Impact of plant growth promoting rhizobacteria on crop producti[J].International Journal of Agricultural Research,2010,5(11):954-983.
[11] Fernando I,Luis W,Adriana F.Starting points in plant-bacteria nitrogen-fixing symbioses:intercellular invasion of the roots [J].Journal of Experimental Botany,2016,2:1-10.
[12] 陈胜男,谷 洁,付青霞,等.接种自生固氮菌对玉米根际土壤酶活性和细菌群落功能多样性的影响 [J].植物营养与肥料学报,2012,18(2):444-450.
Chen S N,Gu J,Fu Q X,et al.Effects of inoculating azotobacter on soil enzyme activities and bacterial community functional diversity in the rhizosphere of maize (ZeamaysL.)[J].Plant Nutrition and Fertilizer Science,2012,18(2):444-450.
[13] Zhang G X, Peng G X,Wang E T,et al.Diverse endophytic nitrogen-fixing bacteria isolated from wild riceOryzarufipogon and description ofPhytobacterdiazotrophicusgen.nov.sp.Nov [J]Archieve Microbiology,2008,189:431-439.
[14] Zhu R F,Tang F L,Liu J L.Co-inoculation of arbusculr mycorrhizae and nitrogen fixing bacteria enhanceAlfalfayield under saline conditions [J].Pakistan Journal of Botany,2016,28(2):763-769.
[15] Wurzburger,Nina.Old-growth temperate forests harbor hidden nitrogen-fixing bacteria [J].New Phytologist,2016,210(2):374-376.
[16] Liu J Y,Peng M J,Li Y G.Phylogenetic diversity of nitrogen-fixing bacteria and thenifHgene from mangrove rhizosphere soil [J].Canadian Journal of Microbiology,2012,58(4):531-539.
[17] 王劲松,吕成群,覃林海,等.两个桉树无性系接种固氮菌造林试验效果初探 [J].中南林业科技大学学报,2010,30(12):56-61.
Wang J S,Lü C Q,Qin L H,et al.Effect of inoculating nitrogen fixation bacteria on afforestation experiment for twoEucalyptusclones[J].Journal of Central South University of Forestry &Technology,2010,30(12):56-61.
[18] 马海宾,康丽华,江业根,等.接种固氮菌对尾叶桉抗青枯病的作用及相关酶活性变化 [J].浙江林业科技,2009,29(4):7-10.
Ma H B,Kang L H,Jiang Y G,et al.Effect of nitrogen-fixation bacteria on resistance ofEucalyptusurophyllato bacteria wilt disease and changes of defense enzymes activity[J].Jour of Zhejiang for Sci & Tech,2009,29(4):7-10.
[19] Boddey R M,Dobereiner J.Nitrogen fixation associated with grasses and cereals:recent results and perspectives for future research [J].Plant Soil,1988(108):53-65.
[20] 何雪香,李 玫,廖宝文.红树林固氮菌和解磷菌的分离及对秋茄苗的促生效果 [J].华南农业大学学报,2012,33(1):64-68.
He X X,Li M,Liao B W.Isolation of nitrogen-fixing bacteria and phosphate-solubilizing bacteria from the rhizosphere of mangrove plants and their enhancement to the growth of kandelia candel seedlings [J].Journal of South China Agricultural University,2012,33(1):64-68.
[21] 赵秀云,韩素芬.固氮细菌与杨树的联合固氮作用 [J].南京林业大学学报,2001,25(4):17-20.
Zhao X Y,Han S F.Nitrogen fixing bacteria andPoplar’s associative nitrogen fixation [J].Journal of Nanjing Forestry University,2001,25(4):17-20.
[22] 刘文国,张旭东,黄玲玲,等.我国杨树生理生态研究进展 [J].世界林业研究,2010,23(1):50-54.
Liu W G,Zhang X D,Huang L L, et al.Research progress on physiologic and ecologic characteristics of popular [J].World Forestry Research,2010,23(1):50-54.
[23] Kaur K,Goyal S,Kapoor K K.Impact of organic fertilizers with and without chemical fertilizers on soil chemical properties and the establishment of nitrogen-fixing bacteria in the rhizosphere [J].Microbes and Environments,2008,23(4):313-316.
[24] 李 菁.内蒙古阿尔山林区植物、节肢动物生物多样性与森林健康评价[D].北京:北京林业大学,2012.
Li J.Plant, arthropod diversity and forest health evaluation in aershan forestry area,Inner Mongolia[D].Beijing:Beijing Forestry University,2012.
[25] 李 菁,骆有庆,石 娟.基于生物多样性保护的兴安落叶松与白桦最佳混交比例 [J].生态学报,2012,32(16):4943-4949.
Li J,Luo Y Q,Shi J.The optimum mixture ratio of larch and birch in terms of biodiversity conservation:a case study in Aershan forest area [J].Acta Ecologica Sinica,2012,32(16):4943-4949.
[26] 杨鸿儒,袁 博,赵 霞,等.三种荒漠灌木根际可培养固氮细菌类群及其固氮和产铁载体能力 [J].微生物学通报,2016,43(11):2366-2373.
Yang H R,Yuan B,Zhao X,et al.Cultivable diazotrophic community in the rhizosphere of three desert shrubs and their nitrogen-fixation and siderophore-producing capabilities[J].Microbiology China,2016,43(11):2366-2373.
[27] Teixeira,Helena,Rodriguez-Echeverria,et al.Identification of symbiotic nitrogen-fixing bacteria from three African leguminous trees in Gorongosa National Park [J].Systematic and Applied Microbiology,2016,39(5):350-358.
[28] 沈 萍,陈向东.微生物学实验 [M].北京:高等教育出版社,2007:111-129.
Sheng P,Chen X D.Microbiology experiment [M].Beijing:Higher Education Press,2007:111-129.
[29] 周国英,唐大武,陈晓艳,等.几种木本植物联合固氮细菌的研究:联合固氮细菌的分离鉴定及固氮活性 [J].中南林学院学报,2002,22(1):23-26.
Zhou G Y,Tang D W,Chen X Y,et al.Studies of the associative diazotrophs from woody plants:segregation identification of associative nitrogen-fixing bacteria and theirs activity [J].Journal of Central South Forestry University,2002,22(1):23-26.
[30] 李 雯,阎爱华,黄秋娴.尾矿区不同植被恢复模式下高效固氮菌的筛选及Biolog 鉴定 [J].生态学报,2014,34(9):2329-2337.
Li W,Yan A H,Huang Q X,et al.Isolation and biolog identification of the high-efficiency azotobacter from iron tailing under different vegetation restoration modes [J].Acta Ecologica Sinica,2014,34(9):2329-2337.
[31] 田国杰,王 晗,陈立红.内蒙古赤峰地区主要树种根际固氮菌的分离和鉴定 [J].内蒙古林业科技,2016,42(1):21-26.
Tian G J,Wang H,Chen L H.Isolation and determination of nitrogen-fixing bacteria in rhizosphere of main tree species in chifeng,Inner Mongolia [J].Journal of Inner Mongolia Forestry Science & Technology,2016,42(1):21-26.
[32] 牛艳芳,陈立红,闫 伟.贺兰山地区油松根际固氮菌的多样性研究 [J].湖南林业科技,2016,43(5):17-21.
Niu Y F,Chen L H,Yan W.Diversity of nitrogen-fixing bacteria isolated fromPinustabulaeformis in Helan mountains[J].Hunan Forestry Science & Technology,2016,43(5):17-21.
[33] 郑红丽,庞保平,靳润岁,等.内蒙古锡林郭勒天然草原禾本科牧草根际18株固氮细菌的初步分类鉴定 [J].干旱区资源与环境,2011,25(9):106-109.
Zheng H L,Pang B P,Jin R S,et al.Primary dentification of nitrogen fixation bacteria isolated from rhizosphere of 18 species of grasses in Xilingol Grassland of Inner Mongolia[J].Journal of Arid Iand Resources and Environment,2011,25(9):106-109.
[34] 余贤美,王 义,沈奇宾,等.解磷细菌PSB3 的筛选及拮抗作用的研究 [J].微生物学通报,2008,35(9):1398-1403.
Yu X M,Wang Y,Shen Q B,et al.The screening of phosphorus solubilizing bacteria PSB3 and the study of its antagonism [J].Microbiology,2008,35(9):1398-1403.
[35] 裘娟萍,汪 琨,邱乐泉,等.微生物学教程多媒体课件 [CD].北京:高等教育出版社,高等教育电子音像出版社,2008.
Qiu J P,Wang K,Qiu L Q,et al.Microbiology tutorial multimedia courseware [CD].Beijing:Higher Education Press,Higher Education Electronic Audio Video Press,2008.
[36] 周贤轩,杨 波,陈新华.几种分子生物学方法在菌种鉴定中的应用[J].生物技术,2014,14(6):35-38.
Zhou X X,Yang B,Chen X H.Application of several molecular biological methods in microbe characterization[J].Biotechnology,2014,14(6):35-38.
[37] 布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].北京:科学出版社,1984.
Buchanan R E,Gibbons N E,et al.Bergey’s manual of determinative bacteriology [M].Beijing:Science Press,1984.
[38] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
Dong X Z,Cai M Y.Handbook of common bacterial system identification [M].Beijing:Science Press,2001.
[39] 张晓勇,刘平义.玉米联合固氮菌的溶磷作用 [J].新疆农业科学,1992(6):264-265.
Zhang X Y,Liu P Y.Phosphate solubilization of associative nitrogen fixation bacteria in maize [J].Xinjiang Agricultural Sciences,1992(6):264-265.
[40] Malik R D S,Kavimandan S K,Tilak K V B R.Growth promoting bacteria associated with sunflow [J].Indian Journal of Experimental Biology,1995,33(4):311-312.
[41] 蔡 苗,彭方任,陈隆升,等.不同油茶林分联合固氮菌及固氮效能分析 [J].南京林业大学学报,2011,35(5):121-124.
Cai M,Peng F R,Chen L S,Isolation of associative-nitrogen-fixing bacterium from typicalCamelliaforestsand analysis of nitrogen efficiency [J].Journal of Nanjing Forestry University,2011,35(5):121-124.
