串联质谱法检测妊娠疾病的氨基酸与酰基肉碱结果分析
2018-03-19刘桂红邓伟楠陈耀勇孙筱放陈敦金余波澜
刘桂红,邓伟楠,陈耀勇,孙筱放,陈敦金,余波澜
(广东省产科重大疾病重点实验室,广东省普通高校生殖与遗传重点实验室,广州医科大学附属第三医院妇产科研究所,广州 510150)
代谢组学是研究生物体系代谢途径的一种技术,主要应用于疾病诊断、药物代谢、毒理代谢等方面,是继基因组学、转录组学和蛋白质组学之后,系统生物学的又一重要研究平台,并逐渐成为生命科学的研究热点[1-2]。串联质谱技术的临床应用越来越广泛,尤其在新生儿遗传代谢病检测方面,其检测结果的优势是准确性好、灵敏度高,特别是在小分子化合物代谢方面的检测,弥补了其他检测技术的短板,是目前具有独特优势的一种代谢产物检测技术。妊娠疾病不同于一般内外科疾病,因新陈代谢异常产生的不良代谢产物,可对母体和胎儿造成危害,导致不良妊娠结局。本文重点研究采用串联质谱技术分析妊娠期疾病患者体内氨基酸和酰基肉碱的表达水平,以期为后续研究代谢产物的作用机制提供思路。
资料与方法
一、一般资料
回顾性分析广州医科大学附属第三医院产科2015~2016年收治的孕妇78例,按照有无合并妊娠期疾病分为两组:正常对照组31例、妊娠疾病组47例,妊娠疾病组又根据妊娠期合并疾病的不同分为3个亚组:妊娠期糖尿病组(GDM组)16例、妊娠期高血压疾病组(HDP组)20例、GDM+HDP组11例。
上述血清样本采于患者,保存于广州医科大学附属第三医院生物样本库,巢式病例对照研究所需要的样本均来自于国家重点研发计划项目所建设的中国产科联盟妊娠队列(COACS队列)。本研究经广州医科大学附属第三医院伦理委员会审批通过,伦理批号为广医2016年(申0406)号,临床研究注册号为Clinical Trials NCT03038555。
病例纳入、《知情同意书》签署、样本采集和临床随访均由专职人员担任,并保存于广州医科大学附属第三医院生物样本库。所有患者均知情同意,并签署《知情同意书》。
妊娠疾病组纳入标准:(1)孕产妇年龄在20~45岁之间,单活胎,包括自然分娩和剖宫产;GDM组、HDP组、GDM+HDP组入选标准均按照《妇产科学》第8版诊断标准;(2)排除死胎与死婴、急慢性并发症(肾病、视网膜病变、心血管和消化道疾病等)。正常对照组的纳入标准为:(1)孕产妇年龄在20~45岁之间,无不良孕产史,单活胎,胎龄为37~41周,包括自然分娩和剖宫产;(2)排除产妇妊娠期并发症、原发性内外科疾病(但乙肝病毒携带者肝功能正常者可纳入);(3)产程顺利,排除胎儿、胎盘、胎膜、羊水异常或存在胎儿疾病者。
二、试剂与仪器
1.主要试剂:非衍生化多种氨基酸、酰基肉碱测定试剂盒(串联质谱法)购自广州丰华生物工程有限公司,检测18种氨基酸和31种酰基肉碱。检测项目包括:苯丙氨酸(Phe)、蛋氨酸(Met)、亮-异亮氨酸(Leu-Ile)、缬氨酸(Val)、精氨酸(Arg)、瓜氨酸(Cit)、组氨酸(His)、鸟氨酸(Orn)、酪氨酸(Tyr)、苏氨酸(Thr)、色氨酸(Trp)、甘氨酸(Gly)、丙氨酸(Ala)、丝氨酸(Ser)、天冬氨酸(Asp)、谷氨酸(Glu)、谷氨酰胺(Gln)、脯氨酸(Pro),游离肉碱(C0)、乙酰基肉碱(C2)、丙酰基肉碱(C3)、丁酰基肉碱(C4)、异戊酰基肉碱(C5)、己酰基肉碱(C6)、辛酰基肉碱(C8)、癸酰基肉碱(C10)、十二烷酰基肉碱(C12)、十四烷酰基肉碱(C14)、十六烷酰基肉碱(C16)、十八烷酰基肉碱(C18)、丙二酰基肉碱/3-羟基丁酰肉碱(C3DC/C4OH)、戊二酰基肉碱/3-羟基己酰基肉碱(C5DC/C6OH)、甲基丙二酰基肉碱/3-羟基异戊酰基肉碱(C4DC/C5OH)、异戊烯酰基肉碱(C5∶1)、己二酰基肉碱(C6DC)、辛烯酰基肉碱(C8∶1)、癸烯酰基肉碱(C10∶1)、癸二烯酰基肉碱(C10∶2)、二烯酰基肉碱(C12∶1)、十四烯酰基肉碱(C14∶1)、十四二烯酰基肉碱(C14∶2)、3-羟基十四烷酰基肉碱(C14OH)、十六烯酰基肉碱(C16∶1)、3-羟基十六烷酰基肉碱(C16OH)、3-羟基十六烯酰基肉碱(C16∶1OH)、十八烯酰基肉碱(C18∶1)、十八二烯酰基肉碱(C18∶2)、3-羟基十八烷酰基肉碱(C18OH)、3-羟基十八烯酰基肉碱(C18∶1OH)。
2.仪器:API3200MD型串联质谱仪购自美国生物应用系统公司(Applied Biosysterms);Shmazu DGU-20A3型高效液相仪购自日本岛津公司;96孔板加热振荡装置采用FWZ-II恒温微量振荡器,购自广州丰华生物工程有限公司。
三、液相色谱串联质谱检测方法
1.样品处理:抽取孕妇外周静脉血,采用血清标本。配置日常萃取工作液(氨基酸内标∶肉碱内标∶萃取液体积比为1∶1∶108)。样品经过沉降、干燥、溶解处理。96孔U型板中,样品60 μl与240 μl甲醇/乙腈(1∶1,V∶V)混合,-20℃静置10 min,14 000 r/m 4℃离心10 min。离心后取上清15 μl,真空干燥1 300 r/m,60℃,约15 min至溶剂完全蒸发,管内无任何液体。干燥后每孔加入日常萃取工作液100 μl,封片37℃ 750 r/m振荡30 min溶解萃取。揭膜转移:取75 μl至V型微孔板。铝膜覆盖,即可上样检测。
2.仪器设置:流动相采用试剂盒自配非衍生法流动相。四元泵流速设置为 30 μl/min,自动进样器设置为每次进样20 μl。每次测定同时采用中性粒子丢失、母离子扫描、多反应监测(MRM)3种扫描方式完成。
3.数据处理:采用软件ChemoView2.0版本(美国生物应用系统公司)定量处理。
4.质量控制:室内质控品购自广州丰华生物工程有限公司。1份血清标本做复孔,取两次检测结果的平均值。
四、统计学分析
应用SPSS 19.0 统计软件,非正态分布计量资料以平均秩(Z)表示,多组间比较采用非参数检验(Kruskal-Wallis H检验),P<0.05为差异具有统计学意义。
结 果
一、各组间氨基酸及酰基肉碱检测情况比较
各组检测的49种氨基酸及酰基肉碱浓度相比较,其中有12项指标(氨基酸3项、酰基肉碱9项)组间有显著性差异(P<0.05),具体如下:Gly、Gln、Trp、C3、C3DC/C4OH、C4、C5、C6、C6DC、C8∶1、C14、C16∶1OH;其中有8项指标(氨基酸2项、酰基肉碱6项)在正常对照组的表达水平(平均秩)显著低于妊娠疾病组(P<0.05),具体如下:Gly、Trp、C3、C3DC/C4OH、C4、C5、C6、C6DC。其余37项指标组间比较无显著性差异(P>0.05)。数据结果详见表1~2。
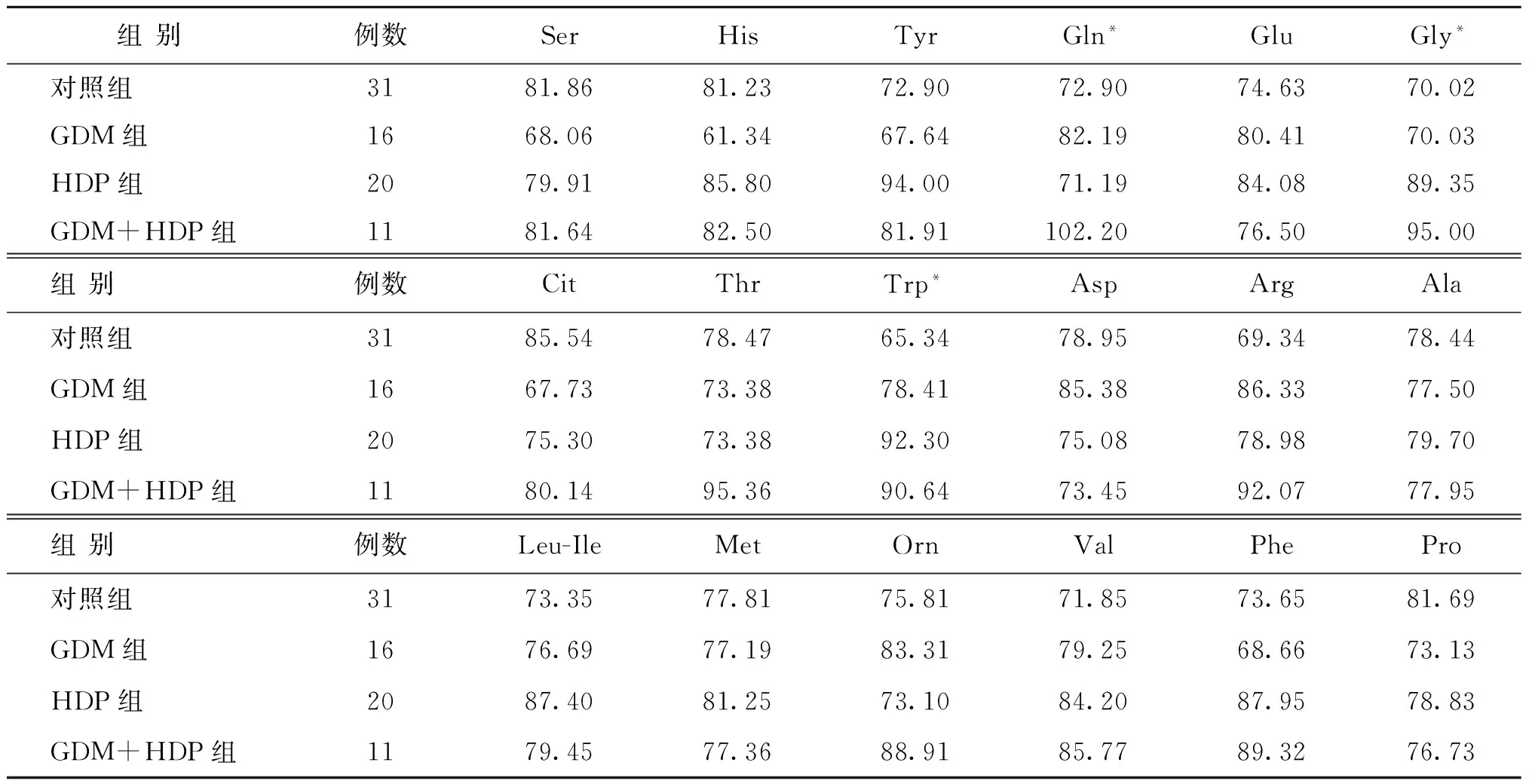
表1 18种氨基酸测定含量的组间比较(Z,单位:μmol/L)
注:组间比较,*P<0.05
注:组间比较,*P<0.05
二、GDM组与对照组中氨基酸及酰基肉碱检测情况比较
多组间Kruskal-Wallis H检验结果显示,12项有显著性差异的指标中,GDM组中表达水平显著高于对照组的有氨基酸3项和酰基肉碱6项,具体如下:Gly、Gln、Trp、C3、C3DC/C4OH、C4、C5、C6、C6DC。GDM组表达水平显著低于对照组的有酰基肉碱3项(C8∶1、C14、C16∶1OH)。
三、HDP组与对照组中氨基酸及酰基肉碱检测情况比较
根据多组间Kruskal-Wallis H检验,HDP组中表达水平显著高于对照组的有氨基酸2项和酰基肉碱8项,具体如下:Gly、Trp、C3、C3DC/C4OH、C4、C5、C6、C6DC、C8∶1、C14。HDP组中表达水平显著低于对照组的有2项(Gln、C16∶1OH)。
四、GDM+HDP组与对照组中氨基酸及酰基肉碱检测情况比较
多组间Kruskal-Wallis H检验结果显示,GDM+HDP组中表达水平显著高于对照组的有氨基酸3项和酰基肉碱7项,具体如下:Gly、Gln、Trp、C3、C3DC/C4OH、C4、C5、C6、C6DC、C8∶1。GDM+HDP组中表达水平显著低于对照组的有酰基肉碱2项(C14、C16∶1OH)。
五、GDM组与HDP组中氨基酸及酰基肉碱检测情况比较
HDP组中表达水平显著高于GDM组的指标有氨基酸2项和酰基肉碱7项,具体如下:Gly、Trp、C3、C4、C5、C6、C6DC、C8∶1、C14。HDP组中表达水平显著低于GDM组的指标有3项(Gln、C3DC/C4OH、C16∶1OH)。
六、GDM+HDP组、GDM组、HDP组中氨基酸及酰基肉碱检测情况比较
GDM+HDP组中表达水平显著高于GDM组和HDP组的指标有氨基酸2项和酰基肉碱3项(Gly、Gln、C3DC/C4OH、C5、C6),显著低于GDM组和HDP组的有氨基酸1项和酰基肉碱4项(Trp、C3、C4、C6DC、C8∶1)。GDM+HDP组中表达水平均显著低于GDM组和HDP组的有酰基肉碱2项(C14、C16∶1OH)。
讨 论
生命的新陈代谢是一个复杂的系统过程,正常人血中游离氨基酸、游离脂肪酸、有机酸的水平处于动态平衡中。为了满足胎儿和母体的营养需求,妊娠期间新陈代谢会发生复杂的变化。然而,妊娠期间的高血压疾病、糖尿病因涉及到复杂的病理生理过程,导致体内的新陈代谢发生异常变化,严重影响了母婴健康。近几年,已有研究报道游离氨基酸及脂肪酸的水平变化与高血压病、糖尿病之间的相关性[3],游离脂肪酸与代谢性疾病之间的关系[4],认为游离脂肪酸的代谢异常在胰岛素抵抗(IR)、高胰岛素血症、高血压病、2 型糖尿病等发病过程中具有非常重要的作用。尽管酰基肉碱是脂肪酸、有机酸代谢的中间产物,但较少学者研究妊娠疾病中孕妇外周血中氨基酸和酰基肉碱的表达水平。
国外Lindsay等[5]报道健康妊娠期间几种必需氨基酸和非必需氨基酸、长链多不饱和脂肪酸、游离肉碱、乙酰肉碱、磷脂酰胆碱和鞘磷脂的母体血浆浓度显著降低。本研究运用液相色谱串联质谱技术研究HDP组、GDM组、GDM+HDP组孕妇体内49种氨基酸及酰基肉碱的含量水平,与正常对照组比较,氨基酸或酰基肉碱浓度增加,提示HDP、GDM与氨基酸或酰基肉碱的代谢失衡关系密切。
有研究将原发性高血压患者与健康受试者的代谢状态进行比较,发现原发性高血压患者血浆中3-甲基组氨酸、甘氨酸、鞘氨醇等浓度显著升高,而门冬氨酸、亮氨酸、异亮氨酸等浓度显著下降[6]。结合本研究结果,我们分析表明原发性高血压和HDP中氨基酸代谢的种类变化不一致,推测妊娠因素决定了两者之间的氨基酸代谢发生变化的机制不一致,进而影响了氨基酸代谢水平的差异。董爱华[7]的硕士学位论文报道,HDP组血清游离脂肪酸水平升高,这为本研究HDP组的酰基肉碱水平比正常对照组呈现升高趋势的实验结果,提供了一定的“桥梁”价值。同时,Odibo等[8]研究表明妊娠期氨基酸和酰基肉碱代谢组学的测定筛选在先兆子痫中具有潜在的预警生物标志物的作用。
Weng等[9]研究表明在糖耐量受损并高血压病的白种人和非裔美国人中,氨基酸(缬氨酸、亮氨酸、异亮氨酸、酪氨酸和苯丙氨酸)的血浆水平与代谢综合征相关。Rahimi等[10]研究表明氨基酸(精氨酸、甘氨酸和甲硫氨酸)的水平与GDM风险相关,Chorell等[11]研究表明GDM的支链氨基酸(亮氨酸、异亮氨酸、缬氨酸)水平显著提高。国内汪思阳等[12]亦对2型糖尿病患者中血浆氨基酸变化特点进行了研究。结合本研究表明,无论是2型糖尿病,还是GDM,其氨基酸含量水平呈升高趋势;两者疾病之间是否存在共同代谢途径的异常机制尚不完全清楚。Nevalainen等[13]研究表明氨基酸或酰基肉碱的血清水平在孕早期GDM中存在显著差异,是重要的预测标志物。
本研究表明妊娠期间高血压疾病、糖尿病,在妊娠因素、不同疾病的影响下,机体内氨基酸或酰基肉碱的代谢水平有差异。同一疾病的氨基酸或酰基肉碱变化的种类报道不一,这可能与不同的人群种族特异性表型、代谢组学研究方案和检测方法不一致有关,需要流行病学方法进一步研究分析。氨基酸或酰基肉碱含量水平的升高是否作为妊娠期间的高血压疾病、糖尿病的危险因素和早期预警生物标志物,有待于进一步深入探讨研究。
目前氨基酸和酰基肉碱代谢途径的异常机制尚不完全清楚。Cooper-Dehoff等[14]报道评估了异亮氨酸、亮氨酸、缬氨酸、酪氨酸和苯丙氨酸的代谢水平与支链氨基酸转氨酶1(BCAT1)和苯丙氨酸羟化酶(PAH)的单核苷酸多态性、糖耐量受损发展的关系。Ho等[15]在口服葡萄糖耐量试验(OGTT)检测前后进行110种代谢物分析,证实氨基酸、糖异生和各种氧化还原反应等的代谢途径受胰岛素作用影响。Berti等[16]研究妊娠母体营养和后代健康有关的生物化学机制以及它们在胎盘中的转运和利用。基于之前研究报道,我们推测HDP或GDM的氨基酸或酰基肉碱水平的代谢变化机制与BCAT1和PAH的单核苷酸多态性、胰岛素作用、胎盘营养代谢和胎儿转移蛋白合成功能有关。
本实验的不足之处是样本量较小,可能会对结果造成一定的偏倚,后续应进一步扩大样本量和对基线资料分析,控制混杂因素,以进一步探讨和验证现有结论。
[1] Weckwerth W. Metabolomics in systems biology[J]. Annu Rev Plant Biol,2003,54:669-689.
[2] Kell DB. Metabolomics and systems biology:making sense of the soup[J]. Curr Opin Microbiol,2004,7:296-307.
[3] 王胜奎,周俊,丁慧. 高血压病患者与血清游离脂肪酸水平的相关性研究[J]. 中国卫生检验杂志,2015,25:4060-4062.
[4] McGarry JD. Banting lecture 2001:dysregulation of fatty acid metabolism in the etiology of type 2 diabetes[J]. Diabetes,2002,51:7-18.
[5] Lindsay KL,Hellmuth C,Uhl O,et al. Longitudinal metabolomic profiling of amino acids and lipids across healthy regnancy[J/OL]. PloS One,2015,10:e0145794.
[6] 邓淑芳. 基于液相色谱—质谱联用的针刺治疗原发性高血压的血浆代谢全谱分析[D]. 成都中医药大学,2016.
[7] 董爱华. 妊娠期高血压疾病与游离脂肪酸、血栓调节蛋白的相关性[D]. 河北医科大学,2012.
[8] Odibo AO,Goetzinger KR,Odibo L,et al. First-trimester prediction of preeclampsia using metabolomic biomarkers:a discovery phase study[J]. Prenat Diagn,2011,31:990-994.
[9] Weng L,Quinlivan E,Gong Y,et al. Association of branched and aromatic amino acids levels with metabolic syndrome and impaired fasting glucose in hypertensive patients[J]. Metab Syndr Relat Disord,2015,13:195-202.
[10] Rahimi N,Razi F,Nasli-Esfahani E,et al. Amino acid profiling in the gestational diabetes mellitus[J]. J Diabetes Metab Disord,2017,16:13.
[11] Chorell E,Hall UA,Gustavsson C,et al. Pregnancy to postpartum transition of serum metabolites in women with gestational diabetes[J]. Metabolism,2017,72:27-36.
[12] 汪思阳,徐蓉,沈展,等. 2型糖尿病患者中血浆氨基酸变化的意义[J]. 河北医药,2013,35:2585-2586.
[13] Nevalainen J,Sairanen M,Appelblom H,et al. First-trimester maternal serum amino acids and acylcarnitines are significant predictors of gestational diabetes[J]. Rev Diabet Stud,2016,13:236-245.
[14] Cooper-Dehoff RM,Hou W,Weng L,et al. Is diabetes mellitus-linked amino acid signature associated with beta-blocker-induced impaired fasting glucose?[J]. Circ Cardiovasc Genet,2014,7:199-205.
[15] Ho JE,Larson MG,Vasan RS,et al. Metabolite profiles during oral glucose challenge[J]. Diabetes,2013,62:2689-2698.
[16] Berti C,Cetin I,Agostoni C,et al. Pregnancy and infants’ outcome:nutritional and metabolic implications[J]. Crit Rev Food Sci Nutr,2016,56:82-91.
