卵母细胞激活技术在辅助生殖技术中的临床应用
2018-03-19陈兵兵贾洪响毕星宇武学清
陈兵兵,贾洪响,毕星宇,武学清
(山西省儿童医院妇幼保健院生殖医学中心,太原 030013)
辅助生殖技术(ART)中约有30%的卵母细胞发生受精失败[1]。卵母细胞的激活是受精的关键环节,卵母细胞的激活方法及激活机制的研究日益受到人们的关注。尽管应用ICSI可以取得较高的受精率和卵裂率,但是ICSI受精低下或失败在临床中仍反复发生,给患者带来了巨大的经济负担和身心伤害。而卵母细胞辅助激活技术联合ICSI应用于反复ICSI受精低下或失败的患者,已经有获得临床妊娠及健康新生儿的报道[2-3]。本研究回顾性分析了山西省妇幼保健院生殖医学中心12例既往ICSI受精低下或失败的患者的临床资料,评估卵母细胞激活技术的临床应用效果。
资料与方法
一、研究对象
选择2014年10月至2016年10月在山西省妇幼保健院生殖医学中心行ICSI助孕,至少有1次ICSI受精失败或受精低下(受精率<30%),再次行ICSI助孕时采用了卵母细胞激活处理的患者。排除因卵母细胞质量差或获得成熟的卵母细胞<3枚而导致的ICSI受精失败或低下患者。
获得的105枚成熟卵母细胞均行ICSI后钙离子载体A23187联合6-甲基氨基嘌呤(6-DMAP)激活。本研究经本院伦理学委员会批准,纳入本研究的患者均签署知情同意书。
二、助孕诊疗回顾
1.卵母细胞收集:采用长方案或短方案行控制性促排卵,当主导卵泡直径达18 mm时,肌注HCG(珠海丽珠医药)5 000~10 000 U,36 h后在阴道B超引导下穿刺取卵。在体外培养3~4 h后,将卵母细胞置于透明质酸酶溶液中,进行去卵丘处理,将成熟的卵母细胞移入含Hepes的胚胎培养液中等待ICSI。
2.卵母细胞激活:在ICSI 30 min后将卵母细胞置于含5 μmol/L的Ca2+载体A23187(Sigma,美国)的人类输卵管液(G-IVF,Vitrolife,瑞典)中避光处理5 min,经卵裂培养液(G1,Vitrolife,瑞典)洗涤5~6次,然后在含2 mmol/L 6-DMAP(Sigma,美国)的卵裂培养液中处理3 h,经卵裂培养液洗涤5~6次,移入卵裂培养液滴中培养。
激活结果判定:卵母细胞激活处理后18~20 h,倒置显微镜下观察,将出现原核(PN)或发生卵裂的卵母细胞判定为激活,包括:单原核(1PN)、双原核(2PN)、多PN(≥3PN)、卵裂。
3.激活后胚胎培养:将激活的胚胎分别置于培养液G1和G2(Vitrolife,瑞典)中,进行序贯培养,每24 h观察胚胎的发育情况。
4.卵裂期胚胎评级:卵裂期胚胎评级综合卵裂球数目、卵裂球大小是否均匀、细胞碎片多少、胞浆是否均质、有无空泡现象、有无胞质收缩等,分为4级[4]。I级:卵裂球大小均匀,形状规则,透明带完整;胞质均匀清晰,没有颗粒现象;碎片含量在0~5%;Ⅱ级:卵裂球大小稍不均匀,形状稍不规则;胞质有颗粒现象;碎片在6%~20%;Ⅲ级:卵裂球大小明显不均匀,形状明显不规则;胞质有粗大的颗粒;碎片在21%~50%;Ⅳ级:卵裂球大小严重不均匀;胞质有严重颗粒现象;碎片在>50%以上。
第3天卵裂期胚胎评级为I级、Ⅱ级、Ⅲ级的胚胎为可利用胚胎;第4天卵裂期胚胎评级为I级、Ⅱ级的胚胎为优质胚胎。
三、主要观察指标
受精率、卵裂率、可利用胚胎数和优质胚胎数。
四、统计学方法
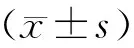
结 果
一、卵母细胞激活情况
既往ICSI受精低下或失败患者本次激活周期中共获得成熟卵母细胞105个,全部用钙离子载体A23187联合6-DMAP激活,激活率为63.81%(67/105)(表1)。
二、既往ICSI受精低下或失败周期与本次激活周期受精率、卵裂率和优质胚胎数比较
本次激活周期中优质胚胎及可利用胚胎数量较既往周期显著增加(P<0.05),卵裂率和受精率也显著高于既往周期(P<0.05)(表2)。
既往ICSI受精低下或失败的12例患者中,本次激活周期中有5例(41.67%)获得临床妊娠。
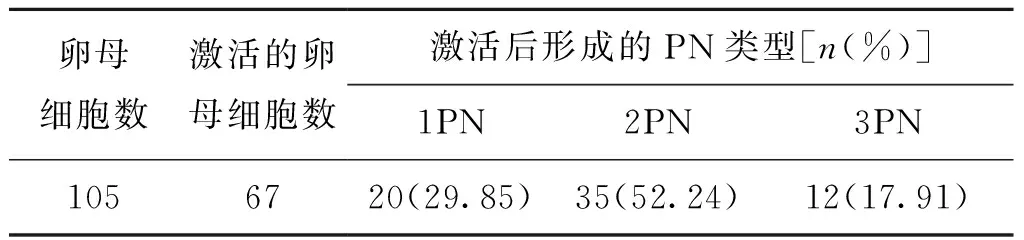
表1 既往ICSI受精低下或失败患者的本次卵母细胞激活情况

表2 既往周期与本次激活周期的受精率、胚胎发育情况比较[(-±s),%]
注:与既往周期比较,*P<0.05
讨 论
卵母细胞辅助激活主要是通过外界刺激使外源性Ca2+内流或内源性Ca2+释放,提高卵母细胞内Ca2+浓度,引发后续的一系列反应,使卵母细胞启动受精过程并脱离MⅡ期。在正常受精过程中是由精子释放磷脂酶Cζ(PLCζ)来启动该过程[5],但在卵母细胞受精失败的患者中,精子对卵母细胞的激活能力弱于常人[6],因此需要通过人为施加干预来激活卵母细胞,完成受精过程。卵母细胞辅助激活技术最早应用于体细胞核移植和卵母细胞孤雌激活[7-8],包括物理方法和化学方法,其中物理方法主要是电激活[9],化学方法主要有钙离子载体[10]、6-DMAP[11]和氯化锶(SrCl2)[12-13]等,其中有些方法如SrCl2在动物上的应用较为广泛,而在人卵母细胞的辅助激活中仅有个例报道。
本研究采用钙离子载体A23187联合6-DMAP进行卵母细胞激活,用于治疗既往ICSI受精低下或失败的患者,激活周期与既往周期相比,激活周期组的卵母细胞在受精率、卵裂率、可利用胚胎数及优质胚胎数方面均显著高于既往周期组(P<0.05),这与已有文献报道[14]相符,提示既往ICSI受精低下或失败的患者确实存在精子激活能力弱的问题,另一方面也证实钙离子载体A23187联合6-DMAP可以有效激活ICSI后的卵母细胞,而且能够在一定程度上改善卵母细胞的后续发育能力,增加可利用胚胎数和优质胚胎数,这也与Sfontouris等[15]的研究结果一致。
另外,对激活周期中卵母细胞的受精情况进行分析,发现已受精的卵母细胞中异常受精所占的比例很高,特别是1PN的比例高达29.85%,这与刘英等[16]的研究结果一致,这种情况的出现可能是精子染色体解聚异常导致雄性原核不能形成,造成孤雌激活的发生,也有可能是异常的钙离子浓度升高不能正常引发卵母细胞的激活所致。
总体来看,钙离子载体A23187联合6-DMAP激活虽然会导致异常受精的增多,但是可利用胚胎数和优质胚胎数也得到明显提高,这就大大增加了患者移植成功的希望。本研究纳入的12例患者既往周期均未成功,而激活周期中有5例最终获得临床妊娠,改善了妊娠结局。在目前尚未有更理想的治疗方法出现之前,卵母细胞辅助激活仍将是治疗既往ICSI受精低下或失败患者的有效措施之一。
[1] Rawe VY,Olmedo SB,Nodar FN,et al. Cytoskeletal organization defects and abortive activation in human oocytes after IVF and ICSI failure[J]. Mol Hum Reprod,2000,6:510-516.
[2] 孙海翔. 早期补救ICSI 的安全性和应用价值[J]. 生殖医学杂志,2009,18:195-197.
[3] 邱绮,贾佳,黄佳,等. 胚胎移植管血染对IVF /ICSI 助孕结局的影响[J]. 广东医学,2014,35:1185-1188.
[4] Lu Q,Zhao Y,Gao X,et al. Combination of calcium ionophore A23187 with puromycin salvages human unfertilized oocytes after ICSI[J]. Eur J Obstet Gynecol Reprod Biol,2006,126:72-76.
[5] Saunders CM,Larman MG,Parrington J,et al. PLC zeta:a sperm-specific trigger of Ca(2+)oscillations in eggs and embryo development[J].Development,2002,129:3533-3544.
[6] Araki Y,Yoshizawa M,Abe H,et al. Use of mouse oocytes to evaluate the ability of human sperm to activate oocytes after failure of activation by intracytoplasmic sperm injection[J]. Zygote,2004,12,111-116.
[7] Yu Y,Mai Q,Chen X,et al. Assessment of the developmental competence of human somatic cell nuclear transfer embryos by oocyte morphology classification[J]. Hum Reprod,2009,24:649-657.
[8] Brevini TA,Gandolfi F. Parthenotes as a source of embryonic stem cells[J]. Cell Prolif,2008,41(Suppl 1):20-30.
[9] Egashira A,Murakami M,Haigo K,et al. A successful pregnancy and live birth after intracytoplasmic sperm injection with globozoospermic sperm and electrical oocyte activation[J]. Fertil Steril,2009,92:2037.e5-9.
[10] Yanagida K,Fujikura Y,Katayose H. The present status of artificial oocyte activation in assisted reproductive technology[J]. Reprod Med Biol,2008,7:133-142.
[11] 徐小明,陆长富,周虹,等. 显微受精废弃的人类卵母细胞体外成熟及孤雌激活[J]. 生命科学研究,2011,15:250-253.
[12] 王二耀,于洋,李雪梅,等. 核移植方法和活化方法对小鼠体细胞克隆胚胎发育的影响[J].科学通报,2007,52:74-79.
[13] 史三宝,纪冬梅,陈蓓丽,等. 氯化锶不同浓度及作用时间对小鼠孤雌胚类原核数量的影响[J]. 生殖与避孕,2014,34:177-181.
[14] 鹿群,陈曦,沈浣,等. 卵母细胞激活技术在卵细胞质内单精子注射受精失败或低下患者中的应用[J]. 中国妇产科临床杂志,2014,15:109-113.
[15] Sfontouris IA,Nastri CO,Lima ML,et al. Artificial oocyte activation to improve reproductive outcomes in women with previous fertilization failure:a systematic review and meta-analysis of RCTs[J]. Hum Reprod,2015,30:1831-1841.
[16] 刘英,韩晓洁,王树玉,等. 两种激活方案对辅助生殖技术中未受精卵母细胞的激活效果比较[J]. 生殖与避孕,2010,9:588-591.
