药用植物大黄种子基因组DNA的提取方法研究
2018-03-19任海龙
任海龙
(西藏大学医学院,西藏拉萨 850000)
大黄(Rheum L.)是蓼科多年生高大草本植物[1]。大黄是一种很常见的中药材[2],其功效与作用是很突出的[3]。大黄具有很强的抗感染作用、泻下作用、保肝作用、退热作用、治疗慢性肾衰竭等用途[4-5]。大黄对根癌土壤杆菌[6]和青霉孢子[7]具有明显的抑制作用。近年来,对于大黄化学成分的研究相对较多,南海江等[8]对大黄属植物的有效化学成分进行总结,研究发现,大黄属植物中有将近200种化学成分;廖华卫等[9]对大黄含片中的大黄酚进行了提取、分离和纯化方法的研究;龚云麒等[10]通过各种色谱方法从拉萨大黄乙醇提取物中分离的化合物经现代波谱技术进行了分别鉴定。刘喜纲等[11]对购于北京同仁堂大黄的总蒽醌的提取精制工艺进行了研究,找到了一种相对适合提取大黄总蒽醌的提取工艺。目前在分子方面研究相对比较少,程小丽等[12]对重庆产大黄总RNA提取方法进行了研究,获得了质量较高的总RNA样品。而对于DNA提取方面的研究甚少,若要详细了解其分子机理,最佳DNA的提取方法是必不可少的。
本研究用5种方法对大黄种子基因组DNA进行提取,旨在筛选出最适宜的提取方法,即得到高浓度、高纯度的DNA样品。
1 材料和方法
1.1 材料
大黄种子采于西藏山南琼结县(E91°40′,N29°1′),将大黄种子用中草药粉碎机粉碎,于4℃条件下保存备用。
1.2 方法
将处理保存后的大黄种子样品分别通过以下5种方法进行基因组DNA的提取。
1.2.1 传统CTAB法[13]称取大黄种子粉末50 mg,装入1.5 mL离心管中,加入500 μL于65℃预热的缓冲液(0.015 mol/L EDTA(pH 值 8.0),0.075 mol/L Tris-HCl(pH值8.0),1.5%CTAB,1 mol/L NaCl),于65℃保温30 min,每隔3~5 min轻轻颠倒混匀,使得大黄样品与提取液充分接触,加入等体积的氯仿/异戊醇(24∶1),颠倒混匀,12 000 r/min离心10 min,取上清液,再加入等体积(由上清液体积决定)的氯仿/异戊醇(24∶1),重复离心至中间无白色物质。取上清液,加入2倍体积的无水乙醇,于-20℃放置30min;室温下14000r/min离心17min,去上清,沉淀用70%乙醇洗涤2次,干燥后溶于50 μLTE。
1.2.2 改良CTAB法[14-15]称取大黄种子粉末50mg,装入1.5 mL离心管中,加500 μL 65℃预热的提取缓冲液(0.1 mol/L Tris-HCl pH值8.0,0.1 mol/L EDTA pH 值 8.0,0.5 mol/L NaCl,2%CTAB,3%PVP,2%DTT),65℃水浴 30 min,不时颠倒混匀;稍冷却后,4℃离心10 min,转速12 000 r/min;取上清,加 500 μL的氯仿 /异戊醇(24∶1),振荡混匀,转速12 000 r/min,4℃离心10 min;取上清,加等体积的异丙醇(-20℃预冷),轻轻颠倒混匀,-20℃静置 30 min;转速 14 000 r/min,4 ℃离心 30 min。去上清液,70%乙醇洗沉淀2次,干燥后溶于50 μLTE。
1.2.3 改良SDS法[16]称取大黄粉末约50 mg,装入1.5 mL离心管中,加500 μL零度预冷的提取液(50 mmol/L EDTA(pH值 8.0),50 mmol/L Tris-HCl(pH 值 8.0),3%可溶性 PVP,2%DTT),充分混匀后于0℃放置10 min,6 000 r/min离心10 min;去上清液,沉淀中加入500 μL预热(65℃)的裂解液,混匀后65℃水浴30 min,不时轻轻颠倒混匀;稍冷却后,加入 500 μL的氯仿 /异戊醇(24∶1),振荡至出现乳浊状(或近乳浊状),于4℃离心10 min,转速为10 000 r/min,重复2遍;取上清,加入0.25倍体积的无水乙醇和0.11倍体积5 mol/L NaAc溶液(pH值4.8),即刻10 000 r/min离心10 min;取上清,加入预冷的异丙醇(-20℃),-20℃放置30 min;4℃离心10 min,转速14 000 r/min;去上清液,70%乙醇洗涤2次,干燥后溶于50 μLTE。
1.2.4 高盐低pH法[17]称取大黄种子粉末约50mg,装入1.5 mL离心管中,加入800 μL于65℃水浴锅中预热的提取液[11](100 mmol/L NaAc,3%可溶性PVP,2%DTT,25 mmol/L EDTA (pH 值 8.0),2%SDS),混匀后65℃保温30 min,不时轻轻颠倒混匀;冷却后于4℃离心10 min,转速10 000 r/min;取上清液,加入2/3倍体积的2.5 mol/L NaAc溶液(pH值4.8),冰上放置15min;然后4℃离心10min,转速为10 000 r/min。取上清液,加入等体积的氯仿/异戊醇(24∶1),振荡混匀后4℃离心10 min,转速为10 000 r/min;取上清液,加等体积的异丙醇(-20℃预冷),充分混匀,-20℃静置30 min;4℃离心20 min,转速14 000 r/min,用70%乙醇洗涤,干燥后溶于50 μLTE。
1.2.5 试剂盒法 植物组DNA提取试剂盒购于上海生工生物工程有限公司。具体操作过程根据试剂盒提供的说明进行。
1.3 DNA提取液结果检测
1.3.1 紫外分光光度法检测 取2 μL DNA提取液稀释50倍,利用紫外分光光度计测定DNA样品的浓度,以及在波长260,280 nm处的吸光值,通过其比率可以判断DNA的纯度及提取效果。
1.3.2 琼脂糖凝胶电泳检测 配制0.8%的琼脂糖凝胶,110 V条件下进行电泳,并用凝胶成像系统进行拍照。
1.3.3 PCR扩增检测 25 μL体系:ddH2O 15.8 μL 10×Buffer(不含 Mg2+)2μL,MgCl22μL,dNTP2μL,ITS2 F(ATG CGA TAC TTG GTG TGA AT)1 μL,ITS2 R(GAC GCT TCT CCA GAC TAC AAT)1 μL,Taq 酶 0.2 μL,样品 DNA1 μL。
PCR反应程序设定:94℃预变性5 min;94℃变性30 s,56℃复性30 s,72℃延伸45 s,共35个循环;最后72℃延伸5 min。
扩增结果用1.5%的琼脂糖凝胶在110 V条件下进行电泳,并用凝胶成像系统进行拍照。
2 结果与分析
2.1 5种不同DNA提取方法紫外分光光度法检测结果
获得高质量的DNA提取液是对植物样品进行分子生物学研究的关键步骤。本研究采用常用的DNA提取方法(CTAB法、SDS法、高盐低pH值法和试剂盒法)提取大黄种子基因组DNA。5种不同提取方法均能提取出基因组DNA,但浓度和得率有些差别。经紫外分光光度法检测,结果列于表1。由表1可知,传统CTAB法所提取的质量浓度最大,为1 450 μg/mL,其次为改良CTAB法,质量浓度为980,960 μg/mL,高盐低 pH法居于中间,质量浓度为560,564 μg/mL,而改良SDS法和试剂盒法所提取的DNA质量浓度都比较少,都低于300 μg/mL。5种方法(除试剂盒法外)的A260/A230均小于2.0,说明有残存盐和小分子杂质污染。其中,传统CTAB法和改良CTAB法的A260/A230远小于2.0,说明小分子杂质特别多。高盐低pH值法、改良SDS法、试剂盒法的A260/A280均在1.7~1.9,其中,高盐低pH法为1.82和1.81,最接近1.8,说明只是略有杂质污染;而改良SDS法的A260/A280和A260/A230分别为1.76和1.74,试剂盒法的A260/A280和A260/A230分别为1.72和1.70,它们相对高盐低pH法杂质略多一点。

表1 5种方法所提取DNA的质量浓度和纯度
2.2 5种不同DNA提取方法琼脂糖凝胶电泳检测结果
从图1可以看出,改良SDS法、高盐低pH法、试剂盒法在20 000 bp左右均能看到明显条带,其中,高盐低pH法所提取的DNA条带最亮、最完整、亮度是改良SDS法的2倍,正好与前面浓度比相对应;试剂盒法有条带但不完整;而传统CTAB法和改良CTAB法均无明显条带,可能是由于CTAB法不适合大黄种子基因组DNA的提取。因此,从图中可以得出,DNA的量从大到小依次为高盐低pH法、改良SDS法、试剂盒法、改良CTAB法、传统CTAB法。

2.3 5种不同DNA提取方法PCR扩增检测结果
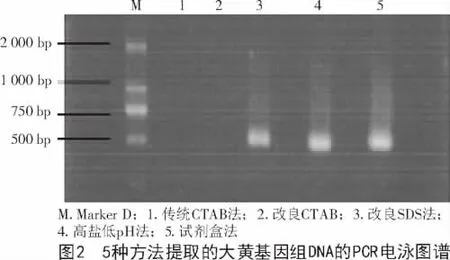
从图2可以看出,改良SDS法、高盐低pH法和试剂盒法的PCR检测效果都很好,条带在500 bp左右,都可以进行后续试验。CTAB法没有条带,充分证明CTAB法不适合大黄种子基因组DNA的提取。
3 讨论与结论
本研究结果表明,CTAB法不适合大黄种子基因组DNA的提取;改良SDS法、高盐低pH法和试剂盒法提取的大黄种子基因组DNA的纯度和完整性都较好,PCR检测结果也很好,都可以用来进行大黄种子基因组DNA的提取。但改良SDS法所提取的DNA含量太少,时间太长,试剂盒比较昂贵;高盐低pH法提取的DNA得率最好,时间较短,价格便宜,PCR扩增条带清晰,能满足分子标记的要求。另外,由于大黄中含酚类物质比较多,因此,在试验过程中加入PVP可以更有效地去除酚类物质,得到的DNA纯度更高[18]。
对于种子基因组DNA的提取,齐刚等[19]和庄蓉等[20]研究认为,SDS法更适合。而本研究中,在高盐低pH法基础上提高SDS含量进行尝试,取得了不错的效果。西藏大学生物分子实验室也进行过燕麦种子基因组的研究,结果发现,高盐低pH法适合种子基因组DNA的提取[21]。
因此,本研究认为,提取大黄种子基因组DNA的最佳方法是高盐低pH法。
[1]吴征镒.西藏植物志[M].北京:科学出版社,1983:638.
[2]国家药典委员会.中国药典(一部)[S].北京:中国医药科技出版社,2015:23-24.
[3]庄江能.大黄的主要成分及其临床药理研究进展[J].西南军医,2009,11(5):931-933.
[4]周金黄,王建华,刘干中.世纪之交:现代中药药理学的回顾与展望[J].中国药理学会通讯,1999,16(3):627.
[5]林秀珍,马德禄,翠荣芬.大黄素及番泻苷和大黄多糖对培鼠肝细胞内游离钙浓度的影响 [J].中国中西医结合杂志,1995,15(7):419.
[6]李莹莹,姜华,肖敏.27种中草药对根癌土壤杆菌的抑菌效果[J].山西农业科学,2008,36(5):35-38.
[7]张腾霄,王斌,魏雅冬.15种药材脂溶性提取物对青霉孢子的抑制效果[J].山西农业科学,2016,44(9):1351-1355.
[8]南海江,许旭东,陈士林,等.大黄属植物研究[J].天然产物研究与开发,2009,21(4):690-701.
[9]廖华卫,李瑞珍,陈飞苑.大黄中大黄酚的提取、分离和纯化方法研究[J].中国药房,2006,17(12):955-956.
[10]龚云麒,陈锦锌,方芳,等.拉萨大黄化学成分的研究[J].时珍国医国药,2015,26(3):601-602.
[11]刘喜纲,常金花,王汝行.大黄总蒽醌的提取精制工艺研究[J].中国医院药学杂志,2015,35(15):1366-1371.
[12]程小丽,魏胜利,刘春生,等.大黄总RNA提取方法研究[J].时珍国医国药,2014(5):1214-1216.
[13]郝豆豆,石梦菲,雷鸣,等.几种砂生槐叶片DNA提取方法的比较[J].科技展望,2016(1):81-83.
[14]张勇群,石梦菲,德吉,等.菊叶香藜DNA的提取及RAPD检测[J].西藏大学学报,2014,3(1):13-16.
[15]魏琦超,畅丽萍,周岩,等.利用改良CTAB法提取小麦干种子总 DNA[J].山西农业科学,2009,37(6):30-32.
[16]韩玉杰,贾炜珑,王自霞,等.几种提取植物DNA方法的比较[J].山西农业科学,2008,36(7):17-19.
[17]汤洁,刘连生,许娜娜,等.绞股蓝叶片DNA提取方法的比较研究[J].安徽农业大学学报,2008,35(3):445-448.
[18]李玉花,刘靖华,徐启江,等.现代分子生物学模块指南[M].北京:高等教育出版社,2007:5-10.
[19]齐刚,苏智先,阮期平,等.珙桐干种子总DNA提取方法的比较[J].绵阳师范学院学报,2008,27(8):75-77.
[20]庄蓉,邬琼霞,黄可辉,等.菟丝子属五个种的种子DNA微量提取方法比较[J].植物检疫,2008(4):216-219.
[21]郝豆豆,朱勇,雷鸣,等.燕麦种子基因组DNA不同提取方法的比较[J].黑龙江农业科学,2015(10):20-23.
