藏北高寒草甸温室气体排放对长期增温的响应*
2018-03-19王学霞高清竹干珠扎布胡国铮栗文瀚罗文蓉
王学霞,高清竹,干珠扎布**,胡国铮,栗文瀚,罗文蓉
藏北高寒草甸温室气体排放对长期增温的响应*
王学霞1,2,高清竹1,干珠扎布1**,胡国铮1,栗文瀚1,罗文蓉1
(1.中国农业科学院农业环境与可持续发展研究所/农业部农业环境重点实验室,北京 100081;2.北京市农林科学院植物营养与资源研究所,北京 100097)
为深入认识高寒草甸温室气体通量对长期气候变暖的响应,利用开顶式生长室(OTC,Open Top Chamber)模拟增温2a(2Y,2015-2016年)和6a(6Y,2011-2016年)对藏北高寒草甸生长季CO2、CH4和N2O通量的影响。结果表明:与对照相比,生长季(6-8月)增温6Y处理和增温2Y处理分别增加和降低高寒草甸土壤CO2排放通量,其中7月增温6Y处理CO2排放通量显著高于增温2Y处理;增温6Y和2Y处理增加了高寒草甸CH4吸收通量,但是处理间差异均不显著;高寒草甸N2O排放通量表现为增温6Y>2Y>CK,处理间无显著差异。环境因子与温室气体排放通量的相关分析表明,CO2、CH4和N2O排放通量与0~5cm土壤温度相关不显著;土壤湿度、植物地上生物量、微生物生物量碳和蔗糖酶是影响高寒草甸CO2排放通量的关键因子;NO3--N是影响CH4吸收通量的关键因素;脲酶和NO3--N是影响N2O排放通量的主要因子。因此,增温6Y处理通过增加植物地上部生物量、蔗糖酶活性,从而提高了土壤CO2排放通量,增温6Y和2Y处理通过增加土壤脲酶和NO3--N含量,从而促进了土壤N2O排放和CH4的吸收通量。
温室气体排放;OTC增温;高寒草甸;酶活性;土壤养分
气候变暖是全球气候变化的主要趋势,近年来,全球持续变暖对陆地生态系统产生的复杂生态效应已成为科学家广泛研究的热点[1-3]。草地是分布最广的陆地生态系统之一,占整个陆地生态系统面积的29%[4],是大气温室气体排放的重要排放源之一。目前有关模拟增温对温室气体排放影响的研究已在草地生态系统中广泛开展。研究表明模拟短期增温降低了内蒙古克氏针茅草原土壤呼吸[5],降低了泥炭草地CO2、CH4、N2O的排放通量[6];而增温对沼泽草地和泥炭草地[7]以及内蒙古荒漠草原[8]CO2、CH4、N2O的排放影响不明显,对内蒙古短花针茅荒漠草原CH4通量影响也不明显[9];模拟增温5a增加了半干旱草原CH4、N2O的排放[10]。由于受当地气候、增温强度、土壤养分、植被组成、土壤生物组成和活性的影响[11-12],温室气体排放对增温的响应趋势不同。研究证实气候变暖通过影响生物和环境因子直接或间接影响草地土壤CO2、N2O和CH4等温室气体的排放[13-15]。
相较于其它地区,极地和高海拔地区生态系统极其脆弱,且其适应长期低温环境,对气候变暖最为敏感[16]。作为对气候变暖高敏感的地区,藏北高原地区气温上升趋势明显高于全球和全国平均水平,据预测,到2100年,该地区平均温度将上升2.6~5.2℃[17]。高寒草甸亦是该地区面积最大、最为重要的生态系统,在全球温室气体收支平衡中起着重要作用。前人关于模拟短期增温对高寒草甸温室气体排放的研究已取得初步进展。Chen等研究表明,增温4.5℃促进了高寒草甸的土壤呼吸、CH4吸收和N2O排放[18],而增温6.2℃增加了沼泽草甸的土壤呼吸和N2O排放,而对CH4排放影响不显著[19]。Deng等[13,20]研究表明,短期增温(1~2℃)分别增加了高寒草甸和草原CO2排放通量;而耿晓东等[21]认为连续3a梯度增温未能显著改变生长季高寒草甸CO2、N2O和CH4平均通量,Zhao等[22]研究表明,短期增温(1~2℃)对高寒草甸CO2、N2O和CH4排放影响不明显,而降低了高寒草原CO2排放通量;Zhu等[23]认为短期增温增加了高寒草甸CH4吸收;Wang等[24]认为短期增温降低了N2O排放。由此可见,由于增温时间和幅度的差异导致高寒草甸温室气体排放对增温的响应还存在较大不确定性, 并且气候变暖对高寒草甸生态系统的影响是一个长期的过程。以往研究结果多集中在短期增温,而关于长期(>5a)增温对高寒草甸温室气体排放影响的研究报道较少,温室气体排放对长期增温的响应趋势尚不明确。为了更好地认识气候变暖对高寒草甸温室气体通量的影响,在西藏那曲高寒草甸设置OTC模拟增温控制实验,研究短期增温(2a)和长期增温(6a)对高寒草甸温室气体排放的影响,比较短期增温与长期增温温室气体排放的差异,以期探究长期增温条件下藏北高寒草甸温室气体排放变化趋势及其关键影响因素。
1 材料与方法
1.1 研究区概况
实验区位于藏北地区那曲县那曲镇的农业部农业环境科学观测实验站内(31.441°N,92.017°E)。该地区年平均温度-1.2℃,年降水量431.7mm,年日照时数为2789.9h(1955-2011年)。雨热同季,月平均温度在5-9月高于0℃,90%以上的降水也集中在该时段。实验区主要以小嵩草()和青藏苔草()为建群种,早熟禾()为主要的禾本科植物,主要杂草包括钉柱委陵菜()、二裂委陵菜(Linn)、小叶棘豆()等。
1.2 实验设置与取样
增温实验:采用开顶式生长室(Open top chamber,OTC)模拟增温对藏北高寒草甸影响的相关实验。OTC以聚碳酸酯为主要原料,其规格为:底部直径1.2m,顶部直径0.6m,高度0.45m。实验设置对照处理(CK):露天草地;增温2a(2Y):2015-2016年连续增温处理;增温6a(6Y):2011-2016年连续增温处理。均为4个重复。增温2a和6a处理OTC中,土壤温度明显高于对照,2016年生长季(6−8月)分别增加了0.68℃和0.73℃,说明两个处理确实达到了增温效果。在相同条件下,观测时段两个增温处理的土壤湿度明显低于CK。增温处理6a的OTC中植物群落组成主要以青藏苔草、小嵩草、早熟禾、钉柱委陵菜、小叶棘豆为主;增温2a处理植物群落主要以小嵩草、早熟禾、火绒草()为主;对照样地以小嵩草、早熟禾、火绒草、钉柱委陵菜为主。由于不同处理植物组成的差异造成增温处理6Y植物盖度和高度高于CK和增温处理2Y。
植物取样:在高寒草地植物旺盛生长期(8月初),每个样方内选取0.5m×0.5m测定高寒草甸植被盖度、物种,然后用剪刀剪取地上植物,放入小信封,用于地上生物量分析。
土壤取样:植物取样后,用直径5cm土钻取0~15cm的土壤,每个样地取2钻混匀为一个样品。一部分土壤过2mm筛后低温保存用于微生物活性培养、微生物生物量分析。另一部分常温干燥,用于土壤养分分析。
1.3 测定方法
植物生物量测定:将取得地上部分植物量,75℃烘至恒重称量。
土壤理化性质测定:在每个实验样地都装有温度(型号DS18B20)和湿度(EC-5)探头,记录土壤温度和土壤湿度,记录周期为15min(长年监测)。2016年9月,用电感耦合等离子体光谱仪(Spectro Arcos Eop, Spectro,German)测定土壤总氮含量,用元素分析仪(Vario EI,Elementar, German)测定有机碳含量,用流动分析仪(AA3,Bran+Luebbe, German)测定土壤NH4+-N、NO3--N含量。
土壤酶活性分析方法:2016年9月,分别采用二硝基水杨酸比色法、苯酚钠比色法、茚三酮比色法测定土壤中纤维素酶、蔗糖酶、蛋白酶和脲酶活性。
土壤微生物生物量分析:2016年9月,采用氯仿熏蒸浸提法测定土壤微生物量,包括微生物碳(MBC)[25]、微生物氮(MBN)[26]。
温室气体测定:采用常规静态箱法。静态箱采用不透明的PVC板制作,规格为:直径318mm,高200mm。于2016年6−8月测定CO2、CH4和N2O排放通量,每10d测一次,观测时间均为11:00。测前24h将静态箱底座插入土壤中3cm,测试时将静态箱罩于底座上,同时在周围抽取空气,注入密封玻璃气瓶中;分别在0、5、15、30min后用密封气瓶收集箱内气体。将收集的气体样品带回室内,使用气相色谱仪(HP6890N,美国)测定其浓度,氢火焰离子检测器(FID)测定CO2和CH4浓度,测定温度为200℃,电子捕获检测器(ECD)测定N2O浓度,测定温度为330℃,色谱柱均为PorpakQ填充柱,柱温70℃。
1.4 排放通量的计算
气体通量的计算式为

式中,F为t时刻温室气体排放通量(mg·m-2·h-1),正值为排放,负值为吸收;A为取样箱的底面积(m2);V为取样箱体积(m3);m1、m2分别为测定箱关闭前和开启前箱内某温室气体的质量(g);t1、t2分别为测定箱关闭前和开启前的时间;C1、C2分别为测定箱关闭前和开启前箱内温室气体的体积百分比浓度;T1、T2分别为测定箱关闭前和开启前箱内温度(℃);M0表示某种气体的摩尔质量(g·mol-1)。
1.5 统计分析
所有原始数据经过对数转化保证方差齐性检验。分析过程运用 SPSS22.0软件,运用单因素方差分析(one-way analysis of variance),差异显著性水平为0.05水平,所有图表数据均为平均值±标准误。
2 结果与分析
2.1 增温条件下高寒草甸土壤理化性状和植物群落特征
由图1和表1可见,增温处理2Y和6Y中,土壤环境与CK有一定的差别。生长季,增温2Y和6Y处理OTC中土壤温度均显著高于CK处理(P<0.05),其中6月分别增加6.5%和5.56%,7月分别增加4.16%和3.50%,8月分别增加5.23%和4.97%。而2Y和6Y OTC中土壤湿度表现出与之相反的趋势,2Y和6Y OTC中土壤湿度均显著低于CK处理(P<0.05),其中6月分别降低2.26个百分点和2.11个百分点,7月分别降低1.97个百分点和1.15个百分点,8月分别降低了2.81个百分点和2.33个百分点。由此可见,OTC增温处理有效增加了土壤温度而降低了土壤湿度,且生长季各月增加幅度不同。与对照相比,2Y和6Y增温处理分别降低了土壤有机碳、全氮含量,增加了铵态氮和硝态氮含量,但是差异不显著(表1)。可见,增温处理2Y和6Y对高寒草甸土壤碳、氮含量影响甚小。
增温处理2Y和6Y改变了高寒草甸植物群落特征。处理间植物物种数之间差异不明显。植物盖度观测结果显示,与CK处理相比,增温处理6Y显著增加(P<0.05)了禾草类、杂草类以及植物总盖度,而增温处理2Y显著降低(P<0.05)了禾草类和植物总盖度。对高度而言,增温处理6Y显著增加了植物高度(P<0.05),增温处理2Y增加了植物高度,但与CK差异不显著。地上部生物量的观测结果显示,增温处理6Y单位面积地上生物量最高,增温处理2Y地上生物量最低,与CK处理差异均达到显著水平。可见,增温处理2Y和6Y对高寒草甸植物盖度、高度和地上生物量影响显著。
2.2 增温条件下草甸土壤微生物的变化特征
由表2可见,在生长季,高寒草甸微生物生物量碳、氮均为6Y>CK>2Y,各处理间无显著差异,说明增温对土壤微生物生物量影响不明显。不同时间增温处理对土壤酶活性的影响不尽相同,增温处理6Y和2Y显著降低了高寒草甸土壤纤维素酶活性(P<0.05),增温处理6Y显著增加蔗糖酶的活性(P<0.05),说明增温改变了与碳代谢相关的酶活性。增温处理6Y显著增加脲酶和蛋白酶活性(P<0.05),而增温处理2Y增加了脲酶和蛋白酶活性(表2)。因此增温可能增加与氮代谢相关的酶活性。
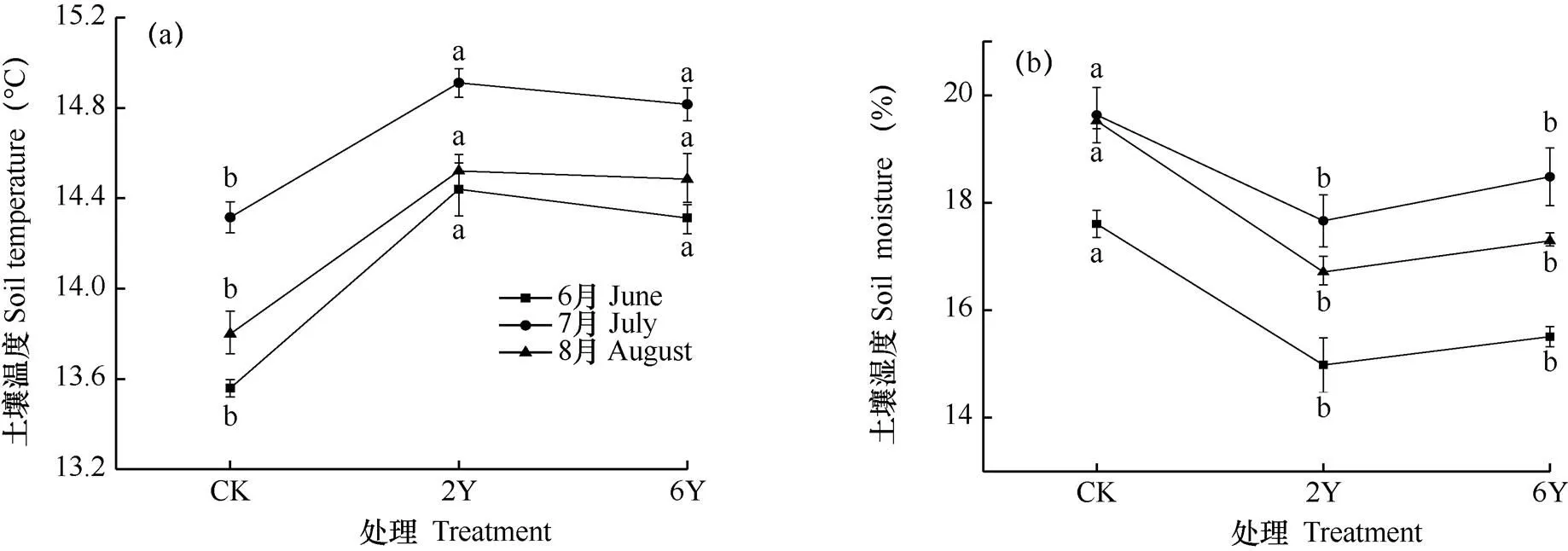
图1 高寒草甸生长季(6-8月)各处理土壤温度和湿度比较
注:2Y和6Y分别为连续2a(2015-2016年)和连续6a(2011-2016年)利用OTC进行增温处理,CK为露天草地。小写字母表示处理间在0.05水平上的差异显著性。数据为平均值±标准误。下同
Note: 2Y is the simulated warming from 2015 to 2016 (2 years), and 6Y is the simulated warming from 2011 to 2016 (6 years) in the open top chamber (OTC). CK is the open field.Lowercase indicates the difference significance among treatments at 0.05 level. The bar is standard error. The same as below

表1 各处理高寒草甸植被与土壤养分特征比较
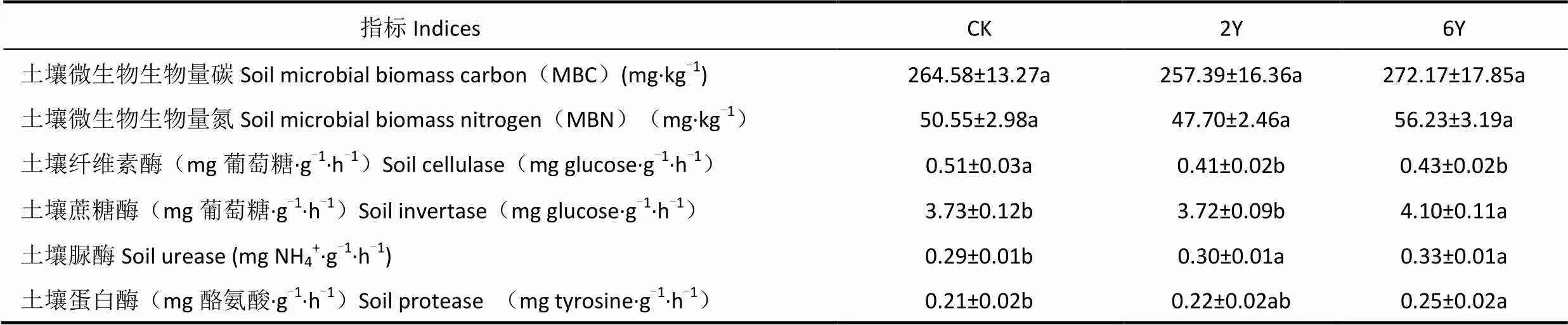
表2 各处理高寒草甸土壤微生物量和酶活性的比较
2.3 增温条件下草甸温室气体排放通量的变化特征
2.3.1 CO2排放通量
由图2可见,增温处理6Y和2Y对高寒草甸CO2排放通量影响不尽相同(图2)。在生长季(6、7、8月)CO2排放通量均表现为6Y>CK>2Y。6月和8月,与对照相比,增温处理6Y其CO2排放通量分别增加了7.78%和14.28%,而增温处理2Y分别降低了14.43%和10.07%,并且增温处理6Y、2Y与对照无显著差异。而7月增温处理6Y CO2排放通量分别增加了23.19%,增温处理2Y则降低11.89%,统计分析表明,6Y处理的CO2排放通量显著高于2Y处理(P<0.05)。

图2 生长季(6-8月)各处理CO2排放通量的比较
2.3.2 CH4排放通量
在生长季,高寒草甸各处理间CH4吸收通量差异均不显著(图3)。6月与8月趋势相一致,高寒草甸CH4吸收通量均为6Y>2Y>CK,与对照相比,增温处理6Y分别增加69.14%和84.61%,增温处理2Y分别增加33.33%和45.68%。而7月CH4吸收通量表现为2Y>6Y>CK,与对照相比,增温处理6Y和2Y分别增加94.68%和76.46%。由此可见,增温可能增加了土壤CH4的吸收通量。
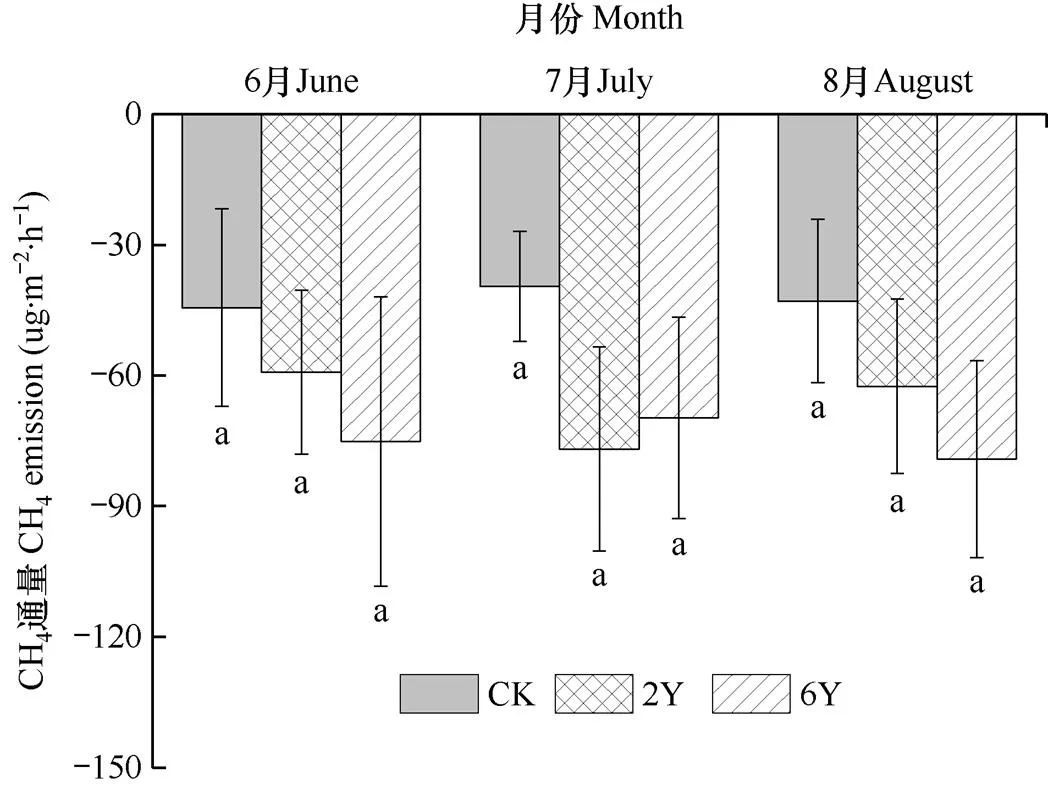
图3 生长季(6-8月)各处理CH4排放通量的比较
2.3.3 N2O排放通量
由图4可见,在生长季(6、7、8月)高寒草甸N2O排放通量均表现为6Y>2Y>CK,各处理间N2O排放通量差异均不显著。6月,与对照相比,增温处理6Y和2Y的N2O排放通量分别增加10.20%和50.34%;7月分别增加16.07%和48.21%;8月分别增加10.24%和40.36%。由此可见,增温可能增加了高寒草甸土壤N2O排放通量。
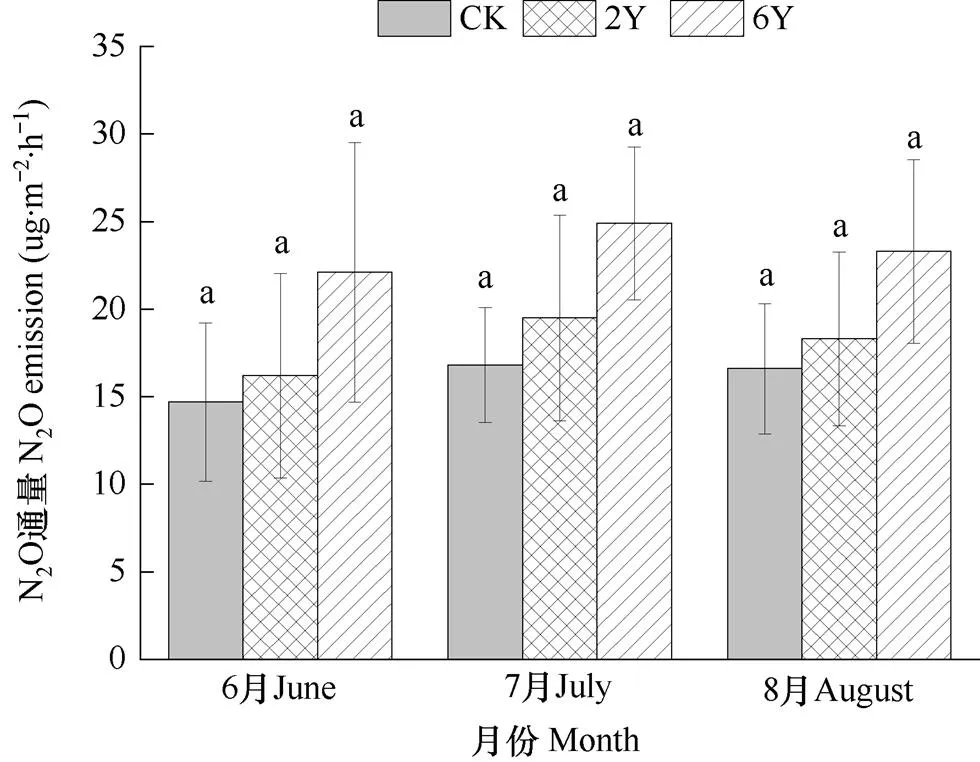
图4 生长季(6-8月)各处理N2O排放通量比较
2.4 温室气体排放的影响因素分析
环境因子与土壤温室气体排放的相关分析(8月)如表3。由表可见,CO2、CH4和N2O排放通量与土壤温度关系不密切;而CO2排放通量与土壤湿度呈显著正相关(P<0.05),CH4和N2O排放通量与土壤湿度无显著相关。CO2排放通量与地上植物生物量、土壤微生物生物量碳和蔗糖酶呈显著正相关(P<0.05),CO2排放通量与纤维素酶无显著相关。由此可见,土壤含水量、植物地上生物量、微生物数量、蔗糖酶活性是影响高寒草甸CO2排放的关键因子。CH4排放通量与NO3--N呈显著负相关(P<0.05),与脲酶、蛋白酶和纤维素酶活性均无显著相关。N2O排放通量与脲酶和NO3--N呈显著正相关(P<0.05),与蛋白酶、NH4+-N和微生物生物量碳无显著相关。由此可见,NO3--N是影响CH4排放通量的关键因子,脲酶和NO3--N是影响高寒草甸N2O排放的关键因子。
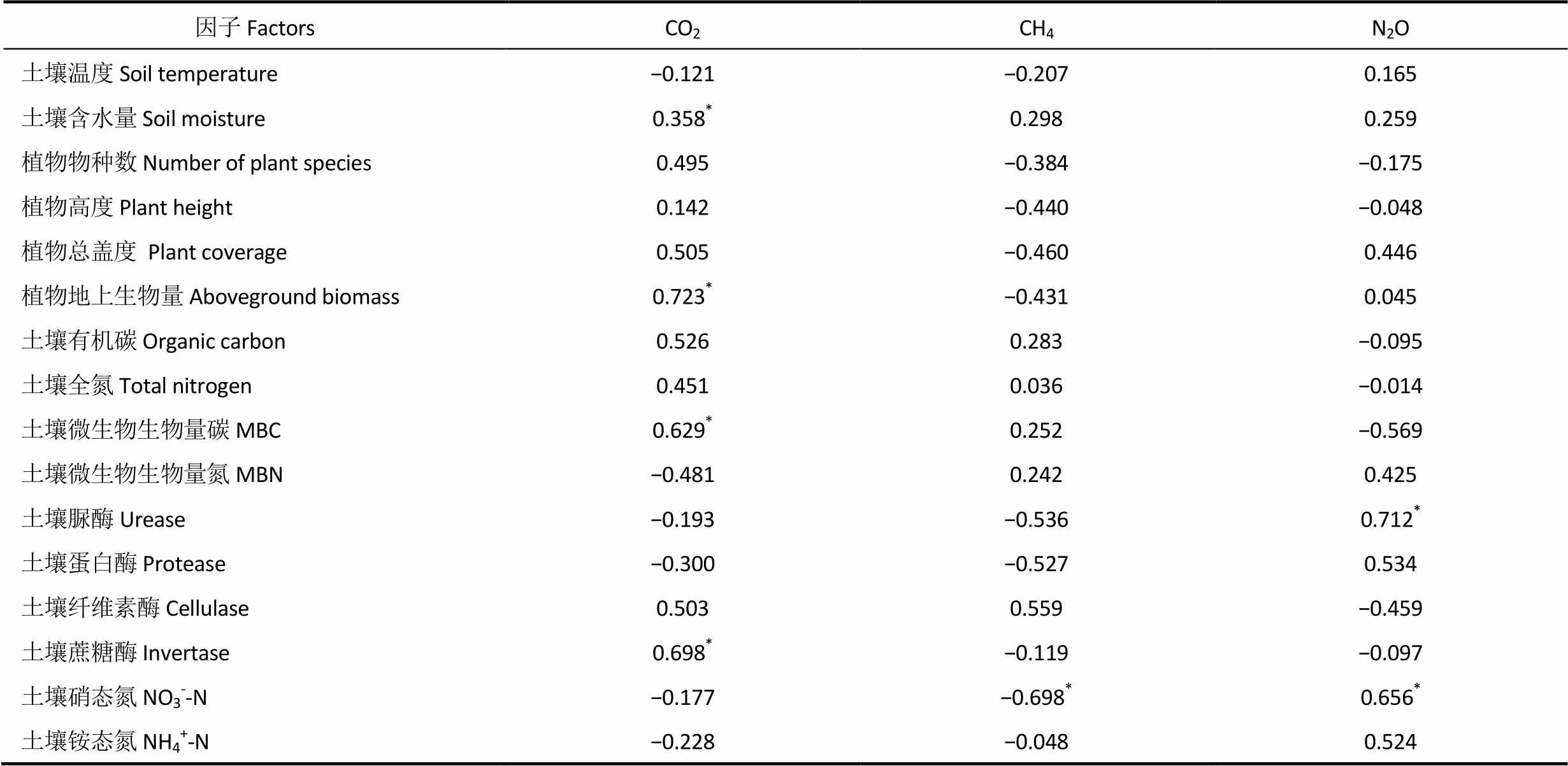
表3 环境因子与温室气体排放通量的相关分析(8月)
注*表示P<0.05,**表示P<0.01。
Note:*is P<0.05,**is P<0.01.
3 结论与讨论
3.1 讨论
3.1.1 土壤温度与土壤水分
采用OTC对高寒草甸模拟增温进行研究,发现高寒草甸温湿度均发生了明显的改变。在增温2Y和6Y处理下,高寒草甸土壤温度显著升高,而土壤含水量则显著降低。这与许多研究结果一致[27-28]。在生长季不同时期,OTC增温效应不尽相同。6月,由于土壤温度逐渐升高,但高寒草甸并未进入雨季,高寒草甸经历一段时期的干旱,此时增温效应被放大,并且对土壤含水量具有负面影响,因此导致干旱进一步加剧[27]。随着雨季来临,高寒草甸土壤含水量迅速升高,从而降低OTC对土壤的增温效应,进而导致7月和8月增温幅度低于生长季初[27]。
3.1.2 CO2排放
草地生态系统土壤CO2排放过程主要来源于土壤呼吸作用,包括自养呼吸和异养呼吸作用。其中自养呼吸主要取决于总初级生产力的变化[29],因此,增温在促进植物生长[30]的同时也加速其呼吸作用。异养呼吸作用主要受温度、水分和养分条件等环境因子以及微生物等的影响。增温处理导致植物生物量、土壤理化性质[31]、微生物数量以及活性[32]存在差异,影响生长季藏北高寒草甸CO2的排放。增温6Y处理促进生长季藏北高寒草甸CO2的排放,而增温2Y处理降低了CO2的排放但是影响不明显,主要原因为:(1)土壤温度、湿度的变化改变了植物群落的结构组成与生产力[27,31]。增温6Y处理显著增加生长季高寒草甸植物地上部生物量,而生产力与CO2排放呈现正相关关系[33],因此,长期增温促进CO2的排放。(2)土壤温度、湿度变化促使土壤生物生长环境发生变化,直接或间接影响微生物的组成、活性[34-35]和土壤酶活性[36],从而改变土壤有机质的分解和土壤呼吸作用,进而影响草地CO2的排放[20]。长期增温导致土壤蔗糖酶活性显著增加,促进地下有机质的分解[37];而短期增温对蔗糖酶活性影响不明显,对土壤有机质分解影响不显著。因而,长期增温增加了高寒草甸CO2的排放,而短期增温对土壤CO2排放影响不明显。不同月份间高寒草甸CO2排放的差异主要是由于生长季初期(6月)土壤温湿度、植物生产力和微生物活性较低,土壤呼吸弱,导致高寒草甸CO2排放通量低于7月和8月。
3.1.3 CH4的吸收
在高寒草甸生态系统中CH4表现为吸收作用[38],CH4吸收受多因素控制[38-40]。增温对CH4吸收通量的影响最终取决于甲烷产生菌和甲烷氧化菌对增温的响应。增温2Y和6Y处理后,0-5cm土壤温度与高寒草甸CH4的通量呈负相关,表明增温促进甲烷的吸收,这可能与增温直接促进甲烷氧化菌群活性或者增温导致土壤湿度下降,提高土壤透气性,促进甲烷氧化菌的活性有关[ 21]。增温2Y和6Y处理后,0-5cm土壤湿度与CH4通量呈正相关,这表明增温也对产甲烷菌群具有积极影响。高寒草甸土壤NO3--N含量增加,显著抑制CH4排放,主要原因为在匮乏有效氮的高寒草甸生态系统,NO3--N的输入将加速凋落物分解并增加甲烷氧化菌活性,进而促进CH4吸收[39],这应是本研究中得出的增温导致CH4吸收增加的另一个原因。
3.1.4 N2O排放
草地生态系统N2O排放主要取决于土壤中硝化与反硝化作用,而该过程受土壤温湿度、土壤中NH4+-N、NO3--N以及土壤微生物的影响[41-44]。本研究发现短期和长期增温分别增加和显著增加了高寒草甸土壤N2O的排放。可能有以下几个原因:(1)增温直接增加土壤的硝化和反硝化速率进而促进N2O的排放[45]。(2)增温样地土壤NH4+-N、NO3--N含量较高,高浓度的NH4+-N、NO3--N为参与硝化和反硝化过程微生物提供更多的底物,促进N2O生成和排放。研究表明硝化细菌产生的N2O比例也随着NH4+浓度的增加而提高,NH4+-N含量高时,土壤释放的N2O也高。硝化速率的增强为反硝化细菌提供了更多的NO3-,使硝化和反硝化过程都能产生更多的N2O[46]。(3)增温导致高寒草甸脲酶、蛋白酶等活性显著增加,这与Wang等[47]的研究结果相似,脲酶、蛋白酶活性的增加可能促进土壤含N有机物的分解,增加了土壤NH4+-N、NO3--N的含量,进而有助于N2O排放[48]。不同月份间高寒草甸N2O排放的差异主要是由于生长季初期(6月)土壤温湿度较低,而土壤温湿度与N2O排放通量呈现正相关[41, 45],导致高寒草甸N2O排放通量低于7月和8月。
3.2 结论
藏北高寒草甸对气候变暖较为敏感,CO2、N2O排放和CH4吸收通量受到植物、温度、湿度、微生物活性等多因素的影响,增温不仅直接影响温室气体的通量,也可对土壤湿度、植物地上生物量、酶活性等其它环境要素产生影响,从而对温室气体排放通量产生间接影响。短期(2Y)和长期增温(6Y)处理对高寒草甸CO2、N2O排放通量和CH4吸收通量的影响不尽相同,但是与对照相比,均没有导致温室气体通量发生显著改变。增温6Y处理增加了高寒草甸主要温室气体的排放通量,未来气候变暖可能对藏北高原草甸温室气体产生积极影响。
[1] Wu Z, Dijkstra P, Koch G W, et al. Responses of terrestrial ecosystems to temperature and precipitation change:a meta- analysis of experimental manipulation[J].Global Change Biology, 2011,17(2):927-942.
[2] Hansen J, Sato M, Ruedy R. Perception of climate change[J]. Proceedings of the National Academy of Sciences,2012, 109(37):2415-2423.
[3] Grimm N B, Chapin F S, Bierwagen B, et al. The impacts of climate change on ecosystem structure and function[J]. Frontiers in Ecology and the Environment,2013,11(9):474- 482.
[4] Saugier B, Roy J, Mooney H A.Estimations of global terrestrial productivity:converging toward a single number[M]. Terrestrial Global Productivity,2001:543-557.
[5] 张立欣,杨劼,高清竹,等.模拟增温增雨对克氏针茅草原土壤呼吸的影响[J].中国农业气象,2013,34(6):629-635.
Zhang L X, Yang J, Gao Q Z, et al. Effects of simulated warming and precipitation enhancement on soil respiration ofsteppe [J].Chinese Journal of Agrometeorology, 2013,34(6):629-635.(in Chinese)
[6] Ward S E, Ostle N J, Oakley S, et al. Warming effects on greenhouse gas fluxes in peatlands are modulated by vegetation composition[J].Ecology Letters,2013,16(10):1285- 1293.
[7] Dijkstra F A, Prior S A, Runion G B, et al. Effects of elevated carbon dioxide and increased temperature on methane and nitrous oxide fluxes: evidence from field experiments[J]. Frontiers in Ecology and the Environment,2012,10(10): 520-527.
[8] 徐冰鑫,胡宜刚,张志山,等.模拟增温对荒漠生物土壤结皮-土壤系统CO2、CH4和N2O通量的影响[J].植物生态学报,2014,38(8):809-820.
Xu B X, Hu Y G, Zhang Z S. Effects of experimental warming on CO2,CH4and N2O fluxes of biological soil crust and soil system in a desert region[J].Chinese Journal of Plant Ecology, 2014,38(8):809-820.(in Chinese)
[9] 潘占磊,王忠武,韩国栋,等.短花针茅荒漠草原甲烷通量对增温和施氮的响应[J].生态环境学报,2016,25(2):209-216.
Pan Z L, Wang Z W, Han G D, et al. Responses of methane fluxes on warming and nitrogen addition indesert steppe[J].Ecology and Environmental Sciences,2016, 25(2):209-216.(in Chinese)
[10]Dijkstra F A, Morgan J A, Follett R F, et al. Climate change reduces the net sink of CH4and N2O in a semiarid grassland[J].Glob Change Biology,2013,19(6):1816.
[11]Luo G J, Kiese R, Wolf B, et al. Effects of soil temperature and moisture on methane uptake and nitrous oxide emissions across three different ecosystem types[J].Biogeosciences, 2013,10(5):3205-3219.
[12]Tian H Q, Chen G S, Lu C Q, et al. Global methane and nitrous oxide emissions from terrestrial ecosystems due to multiple environmental changes[J].Ecosystem Health & Sustainability,2015,1(1):1-20.
[13]Deng B L, Li Z Z, Zhang L, et al. Increases in soil CO2and N2O emissions with warming depend on plant species in restored alpine meadows of Wugong Mountain, China[J]. Journal of Soils & Sediments,2016,16(3):777-784.
[14]Cui M M,Ma A Z,Qi H Y,et al.Warmer temperature accelerates methane emissions from the Zoige wetland on the Tibetan Plateau without changing methanogenic community composition[J].Scientific Reports,2015,5:11616.
[15]Oertel C, Matschullat J, Zurba K, et al. Greenhouse gas emissions from soils: a review[J].Chemie der Erde- Geochemistry,2016,76(3):327-352.
[16]Thomas C D,Cameron A,Green R E,et al.Extinction risk from climate change[J].Nature,2004,427:145-148.
[17]Yao T D, Pu J C, Lu A X, et al. Recent glacial retreat and its impact on hydrological processes on the Tibetan Plateau, China,and surrounding regions[J].Arctic, Antarctic, and Alpine Research,2007,39:642-650.
[18]Chen X P, Wang G X, Zhang T, et al. Effects of warming and nitrogen fertilization on GHG flux in an alpine meadow of permafrost region[J].Atmospheric Environment,2017,157: 111-124.
[19]Chen X P, Wang G X, Zhang T, et al. Effects of warming and nitrogen fertilization on GHG flux in an alpine swamp meadow of a permafrost region[J].Science of the Total Environment,2017,601-602:1389.
[20]Lu X Y, Fan J H, Yan Y, et al. Responses of soil CO2fluxes to short-term experimental warming in alpine steppe ecosystem, Northern Tibet[J]. PloS one,2013,8(3):e59054.
[21]耿晓东,旭日,魏达.多梯度增温对青藏高原高寒草甸温室气体通量的影响[J].生态环境学报,2017,26(3):445-452.
Geng X D, Xu R, Wei D. Response of greenhouse gases flux to multi-level warming in an alpine meadow of Tibetan Plateau[J].Ecology and Environmental Sciences,2017,26(3): 445-452.(in Chinese)
[22]Zhao Z Z, Dong S K, Jiang X M, et al. Effects of warming and nitrogen deposition on CH4,CO2and N2O emissions in alpine grassland ecosystems of the Qinghai-Tibetan Plateau[J].Science of the Total Environment,2017,592: 565-572.
[23]Zhu X X, Luo C Y, Wang S P, et al. Effects of warming, grazing/cutting and nitrogen fertilization on greenhouse gas fluxes during growing seasons in an alpine meadow on the Tibetan Plateau[J].Agricultural & Forest Meteorology,2015, 214-215:506-514.
[24]Wang J S, Quan Q, Sun J, et al. Effects of experimental warming and mowing on greenhouse gas fluxes in an alpine meadow on the Tibetan Plateau [A].EGU General Assembly Conference Abstracts[C]. Vienna, Austria: The EGU General Assembly,2017,19:5831.
[25]Lin Q M, Wu Y G, Liu H L. Modification of fumigation extraction method for measuring soil microbial biomass carbon[J].Chinese Journal of Ecology,1999,18:63-66.
[26]Brookes P C, Landman A, Pruden G, et al. Chloroform fumigation and the release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen in soil[J].Soil Biology & Biochemistry, 1985,17(6):837-842.
[27]Ganjurjav H,Gao Q Z,Schwartz M W,et al.Complex responses of spring vegetation growth to climate in a moisture-limited alpine meadow[J].Scientific Reports,2016, 6:23356.
[28]Peng F, You Q G, Xu M H, et al. Effects of warming and clipping on ecosystem carbon fluxes across two hydrologically contrasting years in an alpine meadow of the Qinghai-Tibet Plateau[J].Plos One,2014,9(10):e109319.
[29]Chen Z, Yu G R, Zhu X J, et al. Covariation between gross primary production and ecosystem respiration across space and the underlying mechanisms: a global synthesis[J]. Agricultural & Forest Meteorology,2015,203(203):180-190.
[30]Xue X, Peng F, You Q G, et al. Belowground carbon responses to experimental warming regulated by soil moisture change in an alpine ecosystem of the Qinghai-Tibet Plateau[J]. Ecology and Evolution,2015,5(18):4063-4078.
[31]Ganjurjav H, Gao Q, Gornish E S, et al. Differential response of alpine steppe and alpine meadow to climate warming in the central Qinghai-Tibetan Plateau[J].Agricultural and Forest Meteorology,2016,223:233-240.
[32]Andresen L C, Moser G Z, Seibert R, et al. Permanent managed grassland at future climate change :is there a connection between GHG emission and composition of plant and microbial communities[J]. Procedia Environmental Sciences,2015,29:156-157.
[33]梁艳,干珠扎布,曹旭娟,等.模拟氮沉降对藏北高寒草甸温室气体排放的影响[J].生态学报,2017,37(2):485-494.
Liang Y, Ganjurjav H, Cao X J, et al. Effects of simulated nitrogen deposition on greenhouse gas emissions from alpine meadows in northern Tibet[J].Acta Ecologica Sinica, 2017,37(2):485-494.(in Chinese)
[34]McHugh T A, Koch G W, Schwartz E. Minor changes in soil bacterial and fungal community composition occur in response to monsoon precipitation in a semiarid grassland[J]. Microbial Ecology, 2014,68(2):370-378.
[35]Li Y M, Lin Q Y, Wang S P, et al. Soil bacterial community responses to warming and grazing in a Tibetan alpine meadow[J].FEMS Microbiology Ecology,2016,92(1): fiv152.
[36]刘琳,朱霞,孙庚,等.模拟增温与施肥对高寒草甸土壤酶活性的影响[J].草业科学,2011,28(8):1405-1410.
Liu L, Zhu X, Sun G, et al. Effects of simulated warming and fertilization on activities of soil enzymes in alpine meadow [J]. Pratacultural Science,2011,28(8):1405-1410.(in Chinese)
[37]Lu M, Zhou X H, Yang Q, et al. Responses of ecosystem carbon cycle to experimental warming: a meta-analysis[J]. Ecology,2013,94(3):726-738.
[38]张裴雷,方华军,程淑兰,等.增氮对青藏高原东缘高寒草甸土壤甲烷吸收的早期影响[J].生态学报,2013,33(13):4101- 4110.
Zhang P L, Fang H J, Cheng S L, et al. The early effects of nitrogen addition on CH4uptake in an alpine meadow soil on the Eastern Qinghai-Tibetan Plateau[J].Acta Ecologica Sinica, 2013,33(13):4101-4110.(in Chinese)
[39]郭小伟,杜岩功,林丽,等.青藏高原北缘3种高寒草地的CH4、CO2和N2O通量特征的初步研究[J].草业科学, 2016,33(1):27-37.
Guo X W, Du Y G, Li L, et al.CH4,CO2and N2O flux among three types of alpine meadow in the north regions of Qinghai-Tibetan Plateau[J]. Pratacultural Science,2016, 33(1):27-37.(in Chinese)
[40]Wang S P, Yang X X, Lin X W, et al. Methane emission by plant communities in an alpine meadow on the Qinghai- Tibetan Plateau: a new experimental study of alpine meadows and oat pasture[J].Biology Letters,2009,5:535-538.
[41]魏达,旭日,王迎红,等.青藏高原纳木错高寒草原温室气体通量及与环境因子关系研究[J].草地学报,2011,19(3): 412-419.
Wei D, Xu R, Wang Y H, et al.CH4,N2O and CO2fluxes and correlation with environmental factors of alpine steppe grassland in Nam Co region of Tibetan Plateau[J].Acta Agrestia Sinica,2011,19(3):412-419.(in Chinese)
[42]Hu H W, Chen D, He J Z. Microbial regulation of terrestrial nitrous oxide formation:understanding the biological pathways for prediction of emission rates[J].FEMS Microbiology Reviews,2015,39(5):729-749.
[43]Barnard R, Le Roux X, Hungate B A, et al. Several components of global change alter nitrifying and denitrifying activities in an annual grassland [J].Functional Ecology,2006,20(4):557-564.
[44]岳泓宇,贾志斌,梅宝玲,等.内蒙古草原温室气体交换通量[J].生态学报,2016,36(24):7929-7941.
Yue H Y, Jia Z B, Mei B L, et al. Flux of greenhouse gases from grassland in Inner Mongolia[J].Acta Ecologica Sinica, 2016,36(24):7929-7941.(in Chinese)
[45]谢立勇,叶丹丹,张贺,等.旱地土壤温室气体排放影响因子及减排增汇措施分析[J].中国农业气象,2011,32(4): 481-487.
Xie L Y, Ye D D, Zhang H, et al. Review of influence factors on greenhouse gases emission from upland soils and relevant adjustment practices[J].Chinese Journal of Agrometeorology, 2011,32(4):481-487.(in Chinese)
[46]Avrahami S, Conrad R, Braker G. Effect of soil ammonium concentration on N2O release and on the community structure of ammonia oxidizers and denitrifiers[J].Applied and Environmental Microbiology, 2002,68(11):5685-5692.
[47]Wang X X, Dong S K, Gao Q Z, et al. Effects of short-term and long-term warming on soil nutrients, microbial biomass and enzyme activities in an alpine meadow on the Qinghai- Tibet Plateau of China[J].Soil Biology and Biochemistry, 2014,76:140-142.
[48]白红英,李春越,张一平.旱地土壤N2O排放与土壤脲酶活性关系的研究[J]. 西北农林科技大学学报(自然科学版),2003,31(1):29-33.
Bai H Y, Li C Y, Zhang Y P. Study on N2O emission and urease activity in dryland soil[J].Journal of Northwest Agriculture and Forestry University (Natural Science Edition),2003, 31(1):29-33.(in Chinese)
Response of Greenhouse Gases Emission Fluxes to Long-term Warming in Alpine Meadow of Northern Tibet
WANG Xue-xia1, 2, GAO Qing-zhu1, HASBAGAN Ganjurjav1, HU Guo-zheng1, LI Wen-han1, LUO Wen-rong1
(1. Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences/ Key Laboratory of Agricultural Environment, Ministry of Agriculture, Beijing 100081, China; 2. Institute of Plant Nutrition and Resources, Beijing Agricultural Forestry Academy, Beijing 100097)
To explore the effects of long-term climate warming on greenhouse gases(GHGs) flux in the alpine meadow, the simulated warming 2 years(2Y, 2015-2016) and 6 years(6Y, 2011-2016) experiments were conducted by the open top chamber(OTC) in an alpine meadow of Tibetan Plateau, then the dynamics of CO2, CH4and N2O fluxes were measured during growing season. The observations showed that the CO2flux during growing season was increased with 6Y and decreased with 2Y warming treatment, respectively, compared with the control. And the CO2flux with 6Y warming treatment was significantly higher than that of 2Y treatment in July. The CH4absorption flux was increased with 6Y and 2Y warming treatment, but the differences between treatments were not significant in the growing season. The N2O emission flux was showed 6Y>2Y>CK in the growing season, and the differences between treatments were not significant. The relationship between environmental factors and GHGs flux were analyzed by using of correlation analysis. The relationship between CO2, CH4and N2O fluxes and soil temperature(0-5cm) was not obvious. The soil moisture, aboveground biomass, microbial biomass carbon and invertase were key factors regulating the CO2fluxes, NO3--N was mainly factor affecting the CH4absorption flux, and NO3--N and soil urease were the main factors promoting N2O emission flux. Therefore, the CO2flux was promoted by increasing plant biomass and invertase activity with 6Y warming treatment, and the N2O emission and CH4absorption flux were improved by increasing the soil urease and NO3--N content with 6Y and 2Y warming treatment.
Greenhouse gases emission; OTC warming; Alpine meadow; Enzyme activity; Soil nutrients
10.3969/j.issn.1000-6362.2018.03.002
王学霞,高清竹,干珠扎布,等.藏北高寒草甸温室气体排放对长期增温的响应[J].中国农业气象,2018,39(3):152-161
收稿日期:2017-07-03
通讯作者。E-mail:ganjurjav@foxmail.com
博士后科学基金(157148);国家自然科学基金(青年)(31600366);国家重点研发计划课题(2016YFC0502003)
王学霞(1982-),女,博士,主要从事草地生态学研究。E-mail:wxx0427@163.com
