金葡菌的生长速度和凝固酶活性对巴马小型猪化脓性肝脓肿形成的影响
2018-03-12张汝钢张修礼杨云生
张汝钢, 张修礼, 杨云生
1.解放军总医院海南分院消化科,海南 三亚 572013; 2.解放军总医院消化科
金黄色葡萄球菌(S.aureus),简称金葡菌。它能够分泌多种外毒素,其中的凝固酶、葡萄球菌溶素(溶血酶)和耐热核酸酶是最重要的外毒素[1-3]。凝固酶(coagulase)耐热能使菌体包被纤维蛋白而抗拒调理作用和吞噬。溶血酶(staphylolysin)不耐热,其中溶血酶α(hla)最重要,对多种哺乳动物的红细胞有溶血作用。耐热核酸酶(thermostable nuclease),能较强地降解DNA和RNA,利于细菌扩散,目前临床上已将其作为测定葡萄球菌有无致病性的重要指标之一。金葡菌能够引起巴马小型猪化脓性肝脓肿[4-5],但哪种外毒素起关键作用目前还不明确,同时外毒素的活性表达是否存在时间上的差异目前也不明确。本研究旨是探讨在化脓性肝脓肿的形成过程中金葡菌分泌的哪一种外毒素起关键作用,同时也探讨外毒素的活性表达是否存在时间上的差异。
1 材料与方法
1.1材料RNAiso Plus(Total RNA提取试剂)和RNA PCR Kit(AMV)Ver.3.0试剂盒购自日本TaKaRa公司。凝固酶(coa)、溶血酶α(hla)、耐热核酸酶A(nucA)、附加基因调节基因A(agrA)和16S rRNA引物由华大基因公司合成。甲苯胺蓝DNA酶琼脂、凝固酶血桨和溶葡球菌酶分别购自英国Sigma-Aldrich公司、美国Remal公司和上海Sangon公司。日本大耳兔由解放军总医院动物中心提供。微孔滤膜(0.45 μm)、抗凝管(K2 EDTA 3.6 mg)和游标卡尺(1107型)分别购自美国Life Sciences公司、美国BD公司和哈尔滨量具刃具厂。
1.2方法
1.2.1 金葡菌生长曲线的描记:挑取生长良好的金葡菌单菌落接种于100 ml LB培养基,37 ℃、200 r/min振荡培养,间隔2 h取菌液测量OD450吸光度值,共测量9个点。以培养时间为横坐标,以菌液OD450吸光度值为纵坐标在平面直角坐标系中作图[6-7]。实验重复5次。
1.2.2 金葡菌毒力蛋白mRNA表达:(1)金葡菌总RNA提取:金葡菌于LB培养基内纯培养12 h(ATCC 29213)和16 h(ATCC 25923),取3 ml菌液于4 000×g离心10 min,收集细菌沉淀。加入100 μl溶葡球菌酶(1 U/μl),混匀,37 ℃水浴中消化15 min。加入1 ml RNAiso Plus,混匀,室温静置5 min。RNA提取按试剂盒说明书要求操作,最后用55 μl DEPC水溶解沉淀。取5 μl用紫外可见分光光度计定量。最后将总RNA用DEPC水定量为100 ng/μl,置于4 ℃冰箱备用。
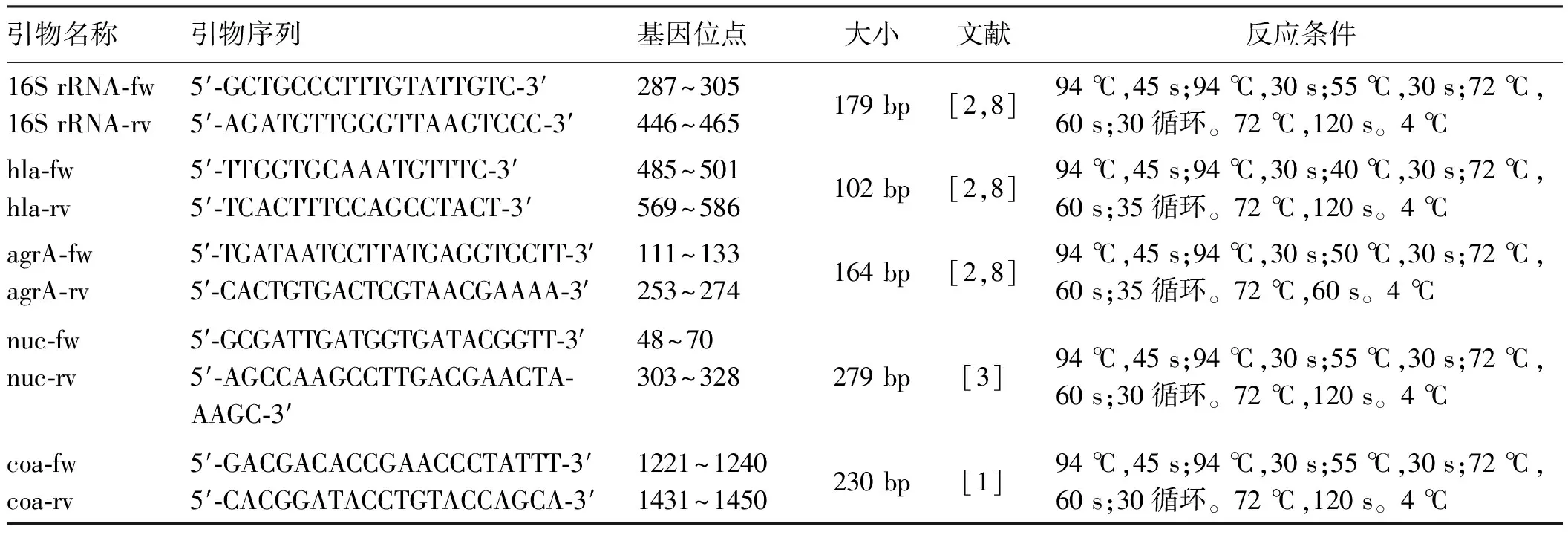
表1 RT-PCR引物序列、基因位点、产物大小、文献来源和反应条件
1.2.3 金葡菌毒力蛋白活性测定:(1)金葡菌培养液上清和兔红细胞的制备:挑取生长良好的金葡菌单菌落置于LB培养基内纯培养12 h、16 h和18 h,菌液4 000×g离心10 min,上清通过0.45 μm微孔滤膜过滤,过滤后的培养液上清置于-80 ℃冰箱保存。采集日本大耳兔空腹耳缘静脉血2 ml,注入内含EDTAK2 3.6 mg的抗凝管,混匀后室温下2 000 r/min离心10 min,去除血浆和白细胞;用3 ml PBS(0.01 M,pH 7.2~7.4)清洗红细胞,共清洗4次;红细胞沉淀用PBS定溶到2 ml,冰上保存。
(2)金葡菌游离耐热核酸酶活性测定:金葡菌培养液上清在微波炉上煮沸15 min备用。按试剂说明书要求配制甲苯胺蓝DNA酶琼脂(TB-DNA-agar,TDA)两块平板,用巴斯德吸管打孔(直径3 mm),取培养12 h、16 h和18 h的细菌培养液上清10 μl在一块平板上点样,取5 μl、10 μl和15 μl上清在另一块平板上点样(ATCC 29213培养12 h,ATCC 25923培养16 h),37 ℃静置孵育24 h测量粉红色晕环直径。LB培养基代替细菌培养液上清作阴性对照[9-10]。实验重复6次。
(3)金葡菌游离凝固酶活性测定:在1.5 ml EP管中加入0.5 ml经EDTA抗凝的兔血浆,再加入0.5 ml培养12 h、16 h和18 h的细菌培养液上清,混匀,37 ℃静置孵育8 h和24 h,倒置EP管观察血浆凝结情况。LB培养基代替细菌培养液上清作为阴性对照[11-12]。实验重复3次。
(4)金葡菌游离溶血酶活性测定:在1.5 ml EP管内混匀0.1 ml细菌培养液上清、0.9 ml PBS和25 μl兔红细胞;37 ℃静置孵育10 min;5 500×g室温离心1 min;在紫外可见分光光度仪上测量上清液OD543透过率值。金葡菌游离溶血酶活性为上清OD543透过率值,为相对活性,呈反变关系。LB培养基代替细菌培养液上清作阴性对照,质量浓度为10 g/L的SDS溶液代替细菌培养液上清液作为阳性对照[8,13]。实验重复6次。
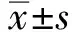
2 结果
2.1金葡菌生长曲线的描记金葡菌ATCC 29213生长曲线左移,到达指数生长期的时间为8 h、到达平台期的时间为10 h;ATCC 25923生长曲线右移,到达指数生长期的时间为12 h、到达平台期的时间为14 h;培养18 h两株细菌均达到平台期(见图1)。金葡菌ATCC 25923到达指数生长期的OD450吸光度值是ATCC 29213的3.778倍。金葡菌ATCC 29213的生长速度显著快于ATCC 25923(F=14.42,P=0.000)。
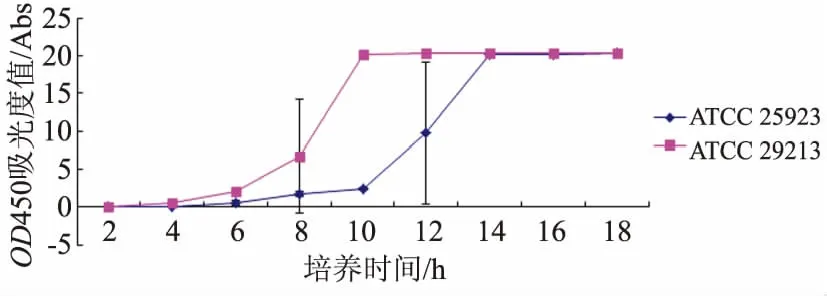
图1 金葡菌生长曲线Fig 1 Growth curves of S.aureus
2.2金葡菌毒力蛋白mRNA表达金葡菌在LB培养基内纯培养12 h(ATCC 29213)和16 h(ATCC 25923)。ATCC 29213凝固酶和耐热核酸酶A mRNA表达量显著高于ATCC 25923(F=63.5,P=0.000vsF=63.5,P=0.000),ATCC 29213溶血酶α和agrA mRNA表达量与ATCC 25923比较,差异无统计学意义(F=63.5,P=0.679vsF=63.5,P=0.452)(见图2)。
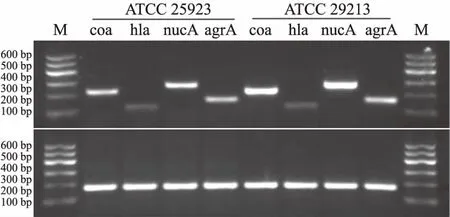
图2 金葡菌毒力蛋白mRNA表达 A:毒力蛋白(coa、hla、nucA)和agrA mRNA表达;B:内参照16S RNA mRNA表达Fig 2 Expressions of virulence protein mRNA of S.aureus A: expressions of coa, hla, nucA and agrA mRNA; B: expressions of 16S RNA mRNA
2.3金葡菌毒力因子活性测定
2.3.1 金葡菌游离耐热核酸酶活性测定:细菌培养液上清10 μl点样于TDA,37 ℃静置孵育24 h观察,ATCC 29213(12 h、16 h和18 h)的粉红色晕环直径显著小于对应时间的ATCC 25923(12 h、16 h和18 h)(F=68.2,P=0.000);ATCC 25923 12 h和16 h(P=0.043)、12 h和18 h(P=0.006)之间的粉红色晕环直径大小有显著性差异,而16 h和18 h之间的粉红色晕环直径大小无显著性差异(P=0.421)。细菌培养液上清5 μl、10 μl和15 μl(ATCC 29213培养12 h,ATCC 25923培养16 h)点样于TDA,37 ℃静置孵育24 h观察,ATCC 29213培养液上清的粉红色晕环直径显著小于对应体积的ATCC 25923(F=72.9,P=0.000)。
2.3.2 金葡菌游离凝固酶活性测定:细菌培养液上清和兔血浆混匀,37 ℃静置孵育。孵育8 h倒置观察,ATCC 29213(12 h、16 h和18 h)的血浆均凝结,而ATCC 25923(12 h、16 h和18 h)的血浆仍为水样;孵育24 h再倒置观察,ATCC 29213(12 h、16 h和18 h)和ATCC 25923(12 h)的血浆均凝结,而ATCC 25923(16 h和18 h)的血浆仍为水样(见图3)。
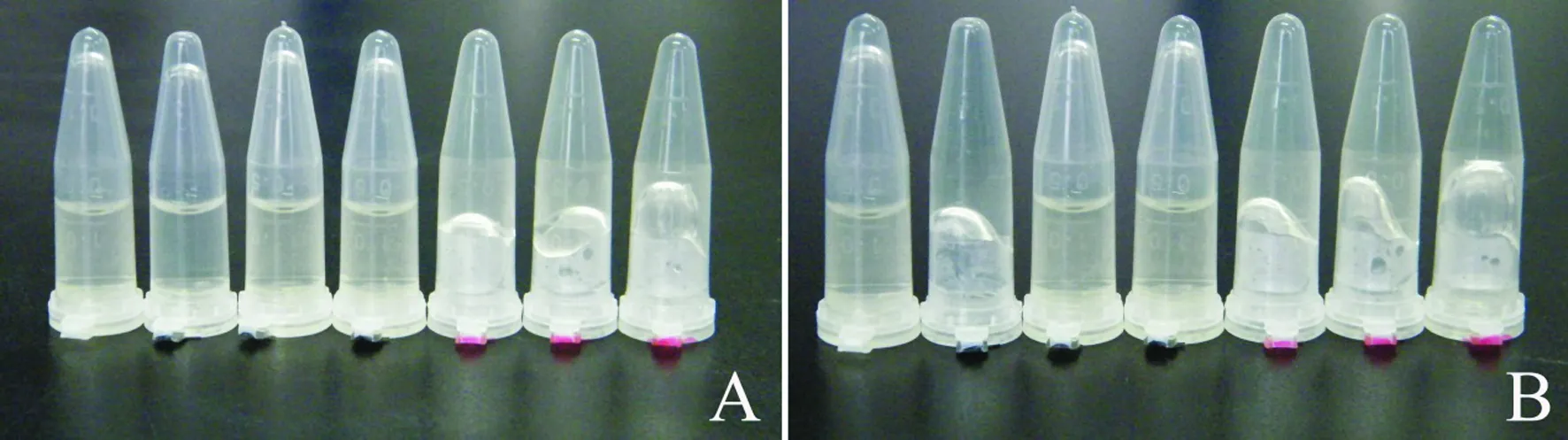
注:红色标记为ATCC 29213,蓝色标记为ATCC 25923,无标记为阴性对照。图3 金葡菌游离凝固酶活性测定 A:37 ℃静置孵育8 h后倒置观察;B:37 ℃静置孵育24 h后倒置观察Fig 3 Detection of free coagulase activity of S.aureus A: observation after incubation for 8 hours at 37 ℃; B: observation after incubation for 24 hours at 37 ℃
2.3.3 金葡菌游离溶血酶活性测定:细菌培养液上清和兔红细胞混匀,37 ℃静置孵育10 min,离心后测量上清液OD543透过率。ATCC 29213(12 h、16 h和18 h)和阴性对照LB透过率显著高于ATCC 25923(12 h、16 h和18 h)和阳性对照SDS(F=8383,P=0.000);ATCC 29213(12 h、16 h和18 h)透过率与阴性对照LB之间无显著性差异(P=0.997)。金葡菌ATCC 25923(12 h)培养液上清和兔红细胞混匀后未经孵育仅部分溶血,而ATCC 25923(16 h和18 h)培养液上清和兔红细胞混匀后未经孵育就能溶血。37 ℃静置孵育10 min离心后,ATCC 25923(12 h、16 h和18 h)均溶血。
3 讨论
前期的研究[4-5]结果显示,金葡菌ATCC 29213与自静脉血凝块混合后注射能够引起巴马小型猪化脓性肝脓肿,而ATCC 25923则不能。为探讨其机制,我们对其生长速度、毒力蛋白mRNA表达和活性高低进行了深入研究。金葡菌ATCC 29213到达指数生长期和平台期的时间均早于ATCC 25923,提示前者的生长速度显著快于后者。这与细菌纯培养时前者培养液的混浊时间早于后者相一致,进一步说明前者的生长速度显著快于后者。
金葡菌凝固酶mRNA表达量与其游离凝固酶活性表达相一致,但耐热核酸酶A和α溶血酶mRNA表达量与其活性表达不一致。两株细菌附加基因调节基因A(agrA)表达量无显著性差异,说明我们的RT-PCR结果是可信的。两种实验方法产生的结果不一致,可能的原因是,细菌毒力实验是从蛋白质水平检查,检查的是总的游离溶血酶活性或总的游离耐热核酸酶活性,而RT-PCR实验是从mRNA水平检查,检查的是溶血酶α或耐热核酸酶A单一成份的表达。溶血酶和耐热核酸酶亚型[8-10]的存在可能是这两种检查方法结果不一致的原因。
金葡菌ATCC 29213的游离凝固酶活性高于ATCC 25923。金葡菌ATCC 25923(12 h)的游离凝固酶活性高于ATCC 25923(16 h和18 h),然而其游离耐热核酸酶活性和游离溶血酶活性显著低于ATCC 25923(16 h和18 h)。提示,金葡菌ATCC 25923分泌的毒力蛋白活性表达存在时间上的先后顺序。
金葡菌ATCC 29213和自体静脉血凝块混合后注入肝实质能产生化脓性肝脓肿,而金葡菌ATCC 25923和自体静脉血凝块混合后注入肝实质不能产生化脓性肝脓肿[4-5]。说明金葡菌ATCC 29213是形成化脓性肝脓肿的关键因素,其原因可能与其生长速度快和分泌的游离凝固酶活性高有关,而与其分泌的耐热核酸酶和溶血酶活性表达无关。
金葡菌ATCC 29213引起巴马小型猪化脓性肝脓肿的机制与其生长速度快和产生的游离凝固酶活性高有关;金葡菌分泌的外毒素活性表达可能存在时间上的先后顺序。
[1] YANAGIHARA K, TASHIRO M, FUKUDA Y, et al. Effects of short interfering RNA against methicillin-resistant Staphylococcus aureus coagulase in vitro and in vivo [J]. J Antimicrob Chemother, 2006, 57(1): 122-126. DOI: 10.1093/jac/dki416.
[2] QIU J, WANG D, XIANG H, et al. Subinhibitory concentrations of thymol reduce enterotoxins A and B and alpha-hemolysin production in Staphylococcus aureus isolates [J]. PLoS One, 2010, 5(3): e9736. DOI: 10.1371/journal.pone.0009736.
[3] BRAKSTAD O G, AASBAKK K, MAELAND J A. Detection of Staphylococcus aureus by polymerase chain reaction amplification of the nuc gene [J]. J Clin Microbiol, 1992, 30(7): 1654-1660.
[4] 张汝钢, 张修礼, 杨云生. 巴马小型猪化脓性肝脓肿模型的建立和鉴定[J]. 胃肠病学和肝病学杂志, 2017, 26(1): 66-69. DOI: 10.3969/j.issn.1006-5709.2017.01.018.
ZHANG R G, ZHANG X L, YANG Y S. Establishment and identification of pyogenic hepatic abscess in Bama minipig [J]. Chin J Gastroenterol Hepatol, 2017, 26(1): 66-69. DOI: 10.3969/j.issn.1006-5709.2017.01.018.
[5] ZHANG R G, WANG X D, ZHANG X L, et al. An experimental model for Staphylococcus aureus hepatic abscess in Bama minipig [J]. Genet Mol Res, 2014, 13(3): 7113-7122. DOI: 10.4238/2014.February.21.12.
[7] 张汝钢, 杨云生. OD450值与金黄色葡萄球菌活菌数目的相关性研究[J]. 军医进修学院学报, 2011, 32(4): 343-344.
ZHANG R G, YANG Y S. Correlation between OD450 value and viable number of Staphylococcus aureus [J]. J Chinese PLA Postgrad Med Sch, 2011, 32(4): 343-344.
[8] QIU J, FENG H, LU J, et al. Eugenol reduces the expression of virulence-related exoproteins in Staphylococcus aureus [J]. Appl Environ Microbiol, 2010, 76(17): 5846-5851. DOI: 10.1128/AEM.00704-10.
[9] LACHICA R V, GENIGEORGIS C, HOEPRICH P D. Metachromatic agar-diffusion methods for detecting staphylococcal nuclease activity [J]. Appl Microbiol, 1971, 21(4): 585-587.doi:10.3969/j.issn.1006-5709.2018.02.014
[10] TANG J, ZHOU R, SHI X, et al. Two thermostable nucleases coexisted in Staphylococcus aureus: evidence from mutagenesis and in vitro expression [J]. FEMS Microbiol Lett, 2008, 284(2): 176-183.
[11] PHONIMDAENG P, O'REILLY M, O'TOOLE P W, et al. Molecular cloning and expression of the coagulase gene of Staphylococcus aureus 8325-4 [J]. J Gen Microbiol, 1988, 134(1): 75-83. DOI: 10.1099/00221287-134-1-75.
[12] ANDERSON J C, ADLAM C, KNIGHTS J M. The effect of staphylocoagulase in the mammary gland of the mouse [J]. Br J Exp Pathol, 1982, 63(3): 336-340.
[13] SCHMIDT K A, MANNA A C, GILL S, et al. SarT, a repressor of alpha-hemolysin in Staphylococcus aureus [J]. Infect Immun, 2001, 69(8): 4749-4758. DOI: 10.1128/IAI.69.8.4749-4758.2001.
