免疫分析技术在草甘膦残留检测中的应用①
2018-03-07李燕虹裴亚峰樊振江曹金博吴佳蓓
李燕虹 王 耀 裴亚峰 樊振江 曹金博 吴佳蓓
(河南科技大学食品与生物工程学院/食品加工与安全国家实验教学示范中心,洛阳 471023)
随着农作物种植中除草剂的使用越来越广泛,农药残留对环境、动植物及人体健康造成的威胁越来越凸显。草甘膦(Glyphosate)是美国孟山都公司在1971年开发的一种广谱灭生性水溶性除草剂,能够非选择性地有效抑制多种一年生或多年生杂草[1],目前已成为使用最广泛、用量最大的除草剂之一[2],并且其在全球的使用量正以每年20%的速度递增[3]。虽然草甘膦的毒性较低,但长期大量使用会在环境和生物体内不断富集,并通过食物链进入人体,对人体健康造成潜在威胁[4,5]。因此,很多国家和地区对于草甘膦残留提出了限量要求,针对草甘膦残留的检测研究也逐渐展开,目前较为成熟的检测方法包括气相色谱、液相色谱以及联用技术,但这些传统方法在样品处理、分析时间上都存在一些不足,不适宜于大批量筛查以及推广应用。近年来,随着免疫分析技术在草甘膦残留检测中的逐步应用,检测效率大大提高。本文将对这些免疫检测方法进行综述,以期为免疫分析技术在草甘膦残留检测中的深入应用提供一定的技术参考。
1 草甘膦概述
1.1性质及其作用机理 草甘膦是一种有机酸,化学名为N-膦羧甲基甘氨酸,商品名为镇草宁、农达等,化学式为C3H8NO5P,分子量为169,结构式图1所示。纯品为白色结晶,无臭,无挥发性,但草甘膦纯品易吸湿,不易保存。草甘膦主要存在形态为酸及以草甘膦异丙胺盐为主的盐类,在水中的溶解度为1.2%(25℃),难溶于无水乙醇、乙醚、苯等有机溶剂中,其异丙胺盐完全溶解于水。
草甘膦是一种内吸传导型除草剂,能被植物的茎叶吸收并向下传导,杀死多年生深根植物深埋地下的根茎;也可以在同一植株的不同分蘖间进行传导,杀死未接触到药剂的分蘖或分枝。草甘膦的除草作用是通过抑制莽草酸途径中的5-烯醇式丙酮莽草酸-3-膦酸合成酶(EPSPS)活性来实现的,因EPSPS在芳香氨基酸如苯丙氨酸、酪氨酸和色氨酸的生物合成中具有很重要的作用,而草甘膦抑制EPSPS的活性使莽草酸途径堵塞,使蛋白质合成受到抑制,从而导致高等植物消耗芳香族氨基酸,致使植物死亡,达到除草目的[6]。
1.2限量标准 由于草甘膦的使用量逐年增多,其引起的水体污染、土壤污染、食品残留等问题也在逐年增加。台湾地区食药署2016年燕麦产品抽检结果显示,总计抽检的市售36款燕麦片产品中有10款燕麦片检出草甘膦[7]。德国慕尼黑环境研究所2016年公布的一份实验室检测报告显示,德国最受欢迎的14种啤酒中被检测出含有不同程度的农药残留物草甘膦,这些啤酒中的草甘膦含量值介于0.46至29.74 μg/L[8]。吴晓刚等[9]和诸力等[10]利用高效液相色谱法对部分市售茶进行检测,部分样本也检出了草甘膦残留。

图1 草甘膦结构式Fig.1 Structure of glyphosate
已有研究证实草甘膦具有一定的动物毒性作用[11],Guilherme等[12]通过彗星实验和红细胞核异常实验验证了草甘膦对欧洲鳗鱼具有潜在的遗传毒性,能够引起血细胞DNA损伤。Prasad等[13]研究发现草甘膦会导致小鼠骨髓细胞染色体变异和微核增加。因此,很多国家和地区都将草甘膦的残留限量列入相关法规与标准中,我国以及美国的饮用水标准中都规定草甘膦的最大残留限量为0.7 mg/L,我国2014年修订的食品安全国家标准《食品中农药最大残留限量》(GB2763-2014)中对草甘膦在食品中的最大残留限量作出了更为详细的规定,如表1所示。
2 免疫分析技术
目前,对于环境及农产品中草甘膦残留的检测多以液相或气相色谱及其联用技术为主[14-17],色谱技术在灵敏度、准确度等方面具有优势,但其需要一定的前处理以及严苛的操作,不能很好地满足批量样品的快速筛查,不利于推广应用。近年来,免疫分析技术在食品安全检测领域发展迅速,以免疫学反应的特异性为基础,在满足检测灵敏度的需求下,大大提高了检测效率[18]。用于草甘膦残留检测的免疫分析方法较为有限,仍有较大的发展空间。
2.1荧光免疫法 荧光免疫法是标记免疫分析技术中发展较早的一种。该方法是将特定荧光素或荧光示踪物与已知抗体或抗原标记制成荧光标记物,再利用这种荧光标记物与抗原或抗体产生特异性反应,通过荧光强度对抗原或抗体进行定位与分析[19]。该方法具有较强的特异性和灵敏度,且无放射性污染。Biagini等[20]制备聚苯乙烯、二乙烯苯和甲基丙烯酸制备红色荧光微球,并将草甘膦与卵清蛋白偶联物链接至荧光微球,利用兔源抗体建立竞争模式的荧光微球免疫方法。该方法用于水质中草甘膦残留的检测,具有较高的灵敏度。但该类方法的建立过程较为复杂,且荧光物质易受样品基质的干扰,影响方法稳定性,因此相关报道较少。
表1GB2763-2014规定的食品中草甘膦的最大残留限量
Tab.1MaximumresiduelimitsofglyphosateinfoodsofGB2763-2014

FoodcategoryMaximumresiduelimit(mg/kg)FoodcategoryMaximumresiduelimit(mg/kg)CerealsUnhulledrico0 1FruitCitrusfruits(exceptcitrus)0 1Wheat5Citrus0 5Wheatflour0 5Kernelfruits(exceptapple)0 1Wholewheatflour5Apple0 5Corn1Drupafruits0 1OilandgreaseCottonseedoil0 05Berriesandothersmallfruits0 1SugarcropSngarcane2Tropicalandsubtropicalfruits0 1DrinkTea1Melonfruits0 1
2.2ELISA法 ELISA是将抗原和抗体的特异性反应与酶对底物的高效催化作用相结合的一种高敏感免疫分析方法。该方法首先将抗体或抗原固定于固相载体,检测时将样品和酶标抗原或抗体混合并与固相载体表面的抗体或抗原反应,然后洗涤除去游离成分,加入酶反应底物引发显色反应,最后终止反应根据显色程度进行分析。ELISA方法经过40多年的发展,已经成为食品分析领域主要的免疫分析方法之一,该方法具有成本低廉、简便快速、敏感特异且不需大型仪器设备等优点,对于样品纯度要求不高,非常适合批量样品的快速筛查[21]。Clegg等[22]最先利用草甘膦兔源多克隆抗体作为特异性识别抗体,建立了间接竞争ELISA方法检测水样中草甘膦残留,原理图如图2所示,该方法检测限为7.6 μg/ml。潘熙萍等[23]同样制备了草甘膦兔源多克隆抗体,所建立的间接竞争ELISA方法可有效地用于测定玉米粉和小麦粉中草甘膦的残留。Selvi等[24]则通过制备禽类抗体建立食品中草甘膦残留的间接竞争ELISA方法,获得了更高的检测灵敏度。由于ELISA方法操作简便,程序化强,目前国外已出现了一些商品化的ELISA试剂盒,其中Abraxis公司的ELISA试剂盒已被成功用于水质以及食品检测[25-28],将这种快速筛查方法与传统色谱方法相结合,能够有效提高检测效率。
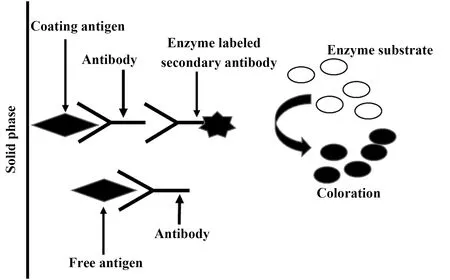
图2 间接竞争ELISA原理图Fig.2 Schematic diagram of indirect competitive ELISA
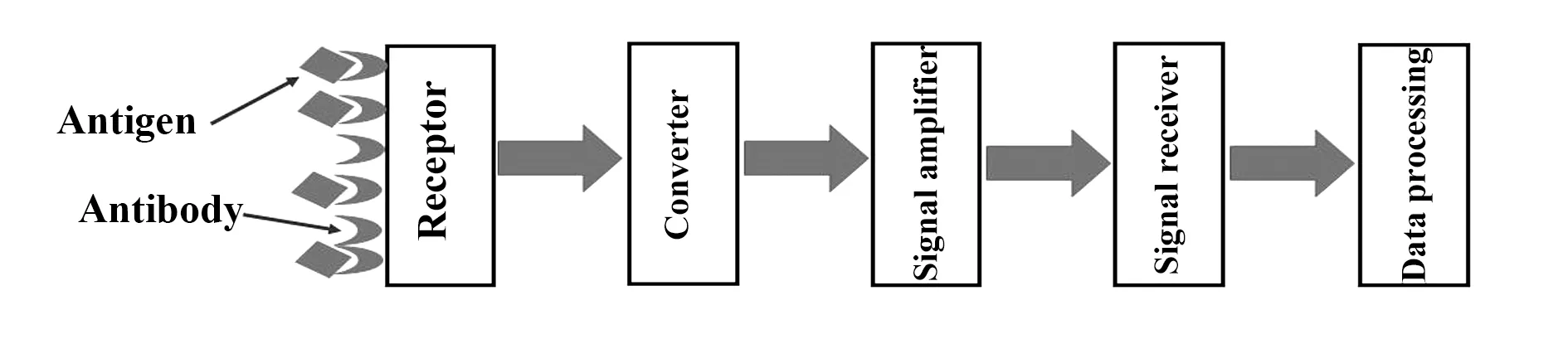
图3 免疫传感器原理图Fig.3 Schematic diagram of immune sensor
2.3免疫传感器法 免疫传感器是将高灵敏的传感技术(光、电、热等信号)与特异性免疫反应相结合,用以分析抗原抗体反应的一类生物传感器,其原理如图3所示。该方法具有特异性强、灵敏度高、操作简单及低成本等优点,其应用已涉及临床医学检验、食品分析、环境监测等领域[29-31]。González-Martínez等[32]利用草甘膦兔源多克隆抗体和草甘膦辣根过氧化物酶(Hores radish peroxidase,HRP)标记物建立了一种竞争型免疫传感器,用于分析水质及土壤中草甘膦残留。检测时样品中的草甘膦将与HRP标记物竞争结合抗体,然后通过加入底物引起显色反应,最终根据反应产物的荧光峰值对草甘膦残留进行间接分析,该方法的检测限可以达到0.021 μg/L。Lee等[33]制备了一种双探针DNA金纳米颗粒,并将草甘膦与DNA探针结合形成复合物,然后将草甘膦兔源多克隆抗体固定于修饰后的玻璃基板,建立夹心型免疫传感器,如图4所示,检测时复合物与待测草甘膦竞争结合抗体,洗脱金纳米颗粒后形成抗体-草甘膦-单探针DNA复合物,然后分析260 nm处单探针DNA的紫外吸收,从而间接测定样品中的草甘膦,该方法的检测范围为0.01~100 μg/ml。
微流控芯片具有集成化、微型化、高通量的特点,能够大大缩短分析时间、降低检测成本[34],将其与免疫传感相结合便形成了一种新型、快速、成本低廉的草甘膦残留免疫传感检测方法。程锴萍等[35]利用微流控芯片检测环境中的污染物,在此基础上建立了一种适合现场快速检测草甘膦的免疫传感器法,该方法基于竞争免疫吸附反应,如图4所示,首先将草甘膦与酶连接,形成酶结合物,检测时游离草甘膦与酶结合物竞争与抗体反应,然后与吸附在微珠表面的二抗结合,最后可以根据加入底物后的荧光反应强度来分析检测结果,该方法的检测范围为0.075~4 ppb。
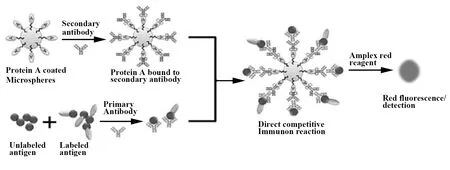
图4 竞争免疫吸附反应原理图Fig.4 Schematic diagram of competitive immunoso-rbent reaction
3 小结及展望
草甘膦既可直接残留于农作物,污染农产品,也可经雨水冲刷进入土壤、河流,扩大污染,进而经食物链对动物及人体产生潜在危害。随着人们对草甘膦残留的日益关注,草甘膦残留的检测技术研究就显得尤为重要。现有检测技术中,化学分析法的准确度和灵敏度较低;分光光度法虽操作简便,但易受其他离子的干扰;色谱及其联用技术灵敏度高,但操作过程繁琐,仪器昂贵且对实验人员要求较高,不适于大批量样品筛查。相比之下,免疫分析技术在准确性、特异性、稳定性、适用范围和分析容量、检测速度快及费用等方面都具有一定的优势,是草甘膦残留检测中最具发展前景的检测技术。
免疫分析技术虽已广泛应用于疾病诊断和控制、食品安全及环境检测领域。但该技术对抗体质量要求非常高,抗体的免疫学特性将直接影响检测方法的灵敏度、特异性、稳定性等指标,因此免疫分析技术研究的关键就在于抗体的制备,目前所开发的草甘膦残留免疫检测方法大都利用的是多克隆抗体,而单克隆抗体的亲和力和特异性都优于多克隆抗体,所以单克隆抗体的研制将是今后草甘膦免疫分析方法研究的一个主要内容。另外,ELISA方法仍是草甘膦残留免疫检测的主要方法,其他免疫检测方法报道相对较少。草甘膦作为一种使用量极大的农药,国内外对其残留量要求日益严格,对检测方法的要求也在不断提高,因此检测方法的创新尤为必要,而诸如免疫层析、时间分辨免疫检测、荧光偏振免疫检测等已在其他农药残留检测中成熟,应用方法仍未在草甘膦残留检测中得到应用,所以快速、灵敏和高效的新型免疫检测方法的研究也将是今后草甘膦免疫分析技术的主要研究方向。
[1] Guerrero Schimpf M,Milesi MM,Ingaramo PI,etal.Neonatal exposure to a glyphosate based herbicide alters the development of the rat uterus[J].Toxicology,2017,376:2-14.
[2] 周垂帆,李 莹,张晓勇,等.草甘膦毒性研究进展[J].生态环境学报,2013,22(10):1737-1743.
Zhou CF,Li Y,Zhang XY,etal.Research advance in ecotoxicity of glyphosate[J].Ecol Environmental Sci,2013,22(10): 1737-1743.
[3] Annett R,Habibi HR,Hontela A.Impact of glyphosate and glyphosate-based herbicides on the freshwater environment[J].J Appli Toxicol,2014,34(5):458-479.
[4] McDuffie HH,Pahwa P,McLaughlin JR,etal.Non-Hodgkin′s lymphoma and specific pesticide exposures in men:cross-Canada study of pesticides and health[J].Cancer Epidemiol Biomarkers Prev,2001,10(11):1155-1163.
[5] Richard S,Moslemi S,Sipahutar H,etal.Differential effects of glyphosate and roundup on human placental cells and aromatase[J].Environmental Health Perspectives,2005,113(6):716-720.
[6] Székács A,Darvas B.Forty years with glyphosate[M].Herbicides-Properties,Synthesis and Control of Weeds.Rijeka:InTech Open Access Publisher,2012:247-284.
[7] 萧 野,曲 径.有机燕麦成市场“香饽饽”[J].环境与生活,2017,11(1):24.
Xiao Y,Qu J.Organic oats as the market "hot property" [J].Environment Life,2017,11(1): 24.
[8] 刘少伟,阮赞林.啤酒与草甘膦残留[J].质量与标准化,2017,69:39-40.
Liu SW,Ruan ZL.Residue of glyphosate in beer[J].Quality Standardization,2017,69:39-40.
[9] 吴晓刚,陈孝权,肖海军,等.柱前衍生-超高效液相色谱-串联质谱法同时检测茶叶中草甘膦和草铵膦的残留量[J].色谱,2015,33(10):1090-1096.
Wu XG,Chen XQ,Xiao HJ,etal.Simultaneous determination of glyphosate and glufosinate-ammonium residues in tea by ultra performance liquid chromatography-tandem mass spectrometry coupled with pre-column derivatization[J].Chin J Chromatography,2015,33(10):1090-1096.
[10] 诸 力,陈红平,周苏娟,等.超高效液相色谱-串联质谱法测定不同茶叶中草甘膦,氨甲基膦酸及草铵膦的残留[J].分析化学,2015,43(2):271-276.
Zhu L,Chen HP,Zhou SJ,etal.Determination of Glyphosate,Aminomethyl Phosphonic Acid and Glufosinate in Different Teas by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry[J].Chin J Analytical Chemistry,2015,43(2): 271-276.
[11] Dai P,Hu P,Tang J,etal.Effect of glyphosate on reproductive organs in male rat[J].Acta Histochemica,2016,118(5):519-526.
[12] Guilherme S,Gaivão I,Santos MA,etal.European eel(Anguilla anguilla)genotoxic and pro-oxidant responses following short-term exposure to Roundup®-a glyphosate-based herbicide[J].Mutagenesis,2010,25(5):523-530.
[13] Prasad S,Srivastava S,Singh M,etal.Clastogenic effects of glyphosate in bone marrow cells of swiss albino mice[J].J Toxicol,2009:308985.
[14] Guo H,Riter LS,Wujcik CE,etal.Direct and sensitive determination of glyphosate and a minomethylphosphonic acid in environmental water samples by high performance liquid chromatography coupled to electrospray tandem mass spectrometry[J].J Chromato A,2016,1443:93-100.
[15] Chamkasem N,Harmon T.Direct determination of glyphosate,glufosinate,and AMPA in soybean and corn by liquid chromatography/tandem mass spectrometry[J].Analy Bioanalytical Chem,2016,408(18):4995-5004.
[16] Arkan T,Csampai A,Molnar-perl I.Alkylsilyl derivatization of glyphosate and a minomethylphosphonic acid followed by gas chromatography mass spectrometry[J].Microchemical J,2016,125:219-223.
[17] Steinborn A,Alder L,Michalski B,etal.Deter mination of glyphosate levels in breast milk samples from Germany by LC-MS/MS and GC-MS/MS[J].J Agri Food Chem,2016,64(6):1414-1421.
[18] 陈 曦,侯玉泽,蔡齐超,等.黄曲霉毒素M1免疫学检测方法研究进展[J].中国免疫学杂志,2015,31(3):413-416.
Chen X,Hou YZ,Cai QC,etal.Research progress on the immunology detection method of aflatoxin M1[J].Chin J Immunol,2015,31(3):413-416.
[19] 黄华伟,杜美菊.免疫荧光分析的研究进展[J].应用化工,2007,36(4):394-397.
Huang HW,Du MJ.Advances in immunofluorescence analysis[J].Applied Chemical Industry,2007,36(4): 394-397.
[20] Biagini RE,Smith JP,Sammons DL,etal.Development of a sensitivity enhanced multiplexed fluorescence covalent microbead immunosorbent assay(FCMIA)for the measurement of glyphosate,atrazine and metolachlor mercapturate in water and urine[J].Analy Bioanalyt Chem,2004,379(3):368-374.
[21] 王 耀,邓瑞广,张改平,等.大豆过敏原免疫学检测方法研究进展[J].中国粮油学报,2015,30(8):143-146.
Wang Y,Deng RG,Zhang GP,etal.Advance in the immunological detection of soybean allergens[J].J Chin Cereals Oils Association,2015,30(8): 143-146.
[22] Clegg BS,Stepheesoo GR,Hall JC.Development of an enzyme-linked immunosorbent assay for the detection of glyphosate[J].J Agri Food Chem,1999,47(12):5031-5037.
[23] 潘熙萍,楼佳俊,张高精,等.草甘膦残留的酶联免疫分析方法的建立[J].湖北农业科学,2012,51(5):1002-1005.
Pan XP,Lou JJ,Zhang GJ,etal.Establishment of the enzyme-linked immunosorbent assay for glyphosate residues[J].Hubei Agricultural Sci,2012,51(5): 1002-1005.
[24] Selvi AA,Sreenivasa MA,Manonmani HK.Enzyme-linked immunoassay for the detection of glyphosate in food samples using avian antibodies[J].Food Agri Immunol,2011,22(3):217-228.
[25] Byer Jonathan D,Struger J,Klawunn P,etal.Low cost monitoring of glyphosate in surface waters using the ELISA method:an evaluation[J].Environmental Sci Technol,2008,42(16):6052-6057.
[26] Mortl Maria,Nemeth Gyongyi,Juracsek J,etal.Determination of glyphosate residues in Hungarian water samples by immunoassay[J].Microchem J,2013,107:143-151.
[27] Ruiz-Toledo J,Castro R,Rivero-Pérez N,etal.Occurrence of glyphosate in water bodies derived from intensive agriculture in a tropical region of southern mexico[J].Bulletin Environmental Contamination Toxicol,2014,93(3):289-293.
[28] Emily Guo FR.Survey of glyphosate residues in honey,corn and soy products[J].J Environmental Analytical Toxicol,2014,5(1):249.
[29] 严 枫,胡效亚.免疫传感器在肿瘤标志物检测中的应用[J].分析测试学报,2006,25(2):132-136.
Yan F,Hu XY.Applications of immunosensors in determination of tumor markers[J].J Instrumental Analysis,2006,25(2): 132-136.
[30] 蒋雪松,许林云,卢利群,等.生物传感器在食品污染物检测中的应用研究进展[J].食品科学,2013,34(23):357-362.
Jiang XS,Xu LY,Lu LQ,etal.Development of biosensors for the detection of contaminants in foodstuffs[J].Food Sci,2013,34(23): 357-362.
[31] 邓 歌,李兆周,陈秀金,等.免疫分析技术在玉米赤霉烯酮检测中的应用和发展[J].中国免疫学杂志,2015,31(2):286-289.
Deng G,Li ZZ,Chen XJ,etal.The application and development of immunoassay of zearalenone[J].Chin J Immunol ,2015,31(2): 286-289.
[32] González-Martínez M,Brun EM,Puchades R,etal.Glyphosate immunosensor.application for water and soil analysis[J].Analytical Chem,2005,77(13):4219-4227.
[33] Lee HU,Shin HY,Lee JY,etal.Quantitative detection of glyphosate by simultaneous analysis of UV spectroscopy and fluorescence using DNA-labeled gold nanoparticles[J].J Agricultural Food Chem,2010,58(23):12096-12100.
[34] 董 亮,霍丹群,周 军,等.微流控芯片在食品安全分析中的应用进展[J].分析测试学报,2015,34(4):483-487.
Dong L,Huo DQ,Zhou J,etal.Progress on application of microfluidic chip in food safety analysis[J].J Instrumental Analysis,2015,34(4): 483-487.
[35] Cheng K,Zhao W,Liu S,etal.Microfluidic immunoassay for rapid detection of cotinine in saliva[J].Biomed Microdevices,2013,15(6):949-957.
