超声波辅助法提取野生玫瑰果种子油工艺的研究
2018-03-06李娜何雨董画薛桂新
李娜,何雨,董画,薛桂新
(延边大学农学院,吉林延吉133002)
野生玫瑰(Rose rugoseThunb)属于蔷薇科蔷薇属灌木植物[1],原产于中国北方沿海、朝鲜、日本及俄罗斯远东地区[2],目前,吉林省图们江下游地区是国内野生玫瑰种类数量保存完好的天然群落,己被列入国家二级、吉林省一级保护植物[3]。山东烟台、辽东半岛等地业残存一些野生玫瑰,但数量很少。野生玫瑰不仅是栽培玫瑰及蔷薇属花卉育种的重要种质资源[4],也是珍贵的中药材,还是食品工业和香料工业的重要原料。野生玫瑰果肉中含有丰富的还原型VC、多酚、番茄红素、β-胡萝卜素、果胶、黄酮类、矿物质、氨基酸和糖酸类,尤其是还原型Vc、多酚、果胶和Ca含量较高,分别达到了768~898 mg·100g-1、0.96%~1.03%、1.84%~3.25%和0.6%~1.1%[5]。野生玫瑰果中含有11.61%~12.20%种子[6],种子胚中含有丰富的油脂,且不饱和脂肪酸含量很高,具有降血脂、降胆固醇等功能,是营养和保健食品的重要原料[7]。刘小飞[8]等研究表明玫瑰(R.rugosa Rubra)种子油中不饱和脂肪酸含量为93.69%,其中亚油酸占50.42%、亚麻酸29.38%。但目前对野生玫瑰果种子油的研究在国内外鲜见报道。
提取植物油的方法主要为索氏提取法、冷榨法、微波提取法,超临界CO2萃取法及超声波提取法[9]。前两种方法能较好的保持油的品质,但提取时间太长,效率低,目前已较少应用。超临界萃取及微波提取方法提取率虽高,但对提取设备要求较高,且费用高,在医学方面应用得较多。超声波辅助提取方法是利用超声波对媒介所产生的机械振动及空化作用,增加细胞渗透性,破裂细胞壁,使细胞内含物浸出,既能提高油脂的提取率[10],还具有简单、快捷、高效、提取温度低、不破坏提取物结构等优点[11],被广泛用于油脂、黄酮类、酚类、色素、多糖、有机农药等的提取。
本试验采用超声波辅助法提取野生玫瑰种子油,研究了提取参数对油脂提取率的影响,通过正交试验设计优化提取工艺参数,为提高种子出油率提供参考依据。
1 材料与方法
1.1 实验材料
野生玫瑰果采自吉林省东部图门江下游的江畔和山地,采果后将种子与果肉分离并将种子放在50℃干燥箱中干燥,备用;正己烷(分析纯),氮气(超纯)。
1.2 仪器设备
BSA124S-CW电子分析天平(Sartorius)公司;KQ-500DE数控超声波清洗器昆山市超声仪器有限公司;TDZ5-WS离心机(湖南湘仪实验室仪器开发有限公司);SY-2000旋转蒸发仪(上海亚荣生化仪器厂);UGC-12MF流量可调氮吹仪(北京优晟联合科技有限公司);101-3AB型电热鼓风干燥箱(天津市泰斯特仪器有限公司)。
1.3 试验方法
1.3.1 野生玫瑰果种子油提取工艺[12]将干燥后的玫瑰果种子粉碎,过100目筛,放入密封袋中备用。称取5g种子粉放入250 mL三角瓶中,按料液比为1∶17加入正己烷,浸泡12h。将三角瓶放入超声清洗器中,在超声功率为250 W、超声温度为30℃、超声时间为50 min条件下提取玫瑰果种子油。然后在3500 r/min离心15 min,离心后将油脂和正己烷混合物用旋转蒸发仪进行浓缩,并过滤到接收瓶中,用氮气吹干溶剂,最后称重,按下列公式计算提取率。
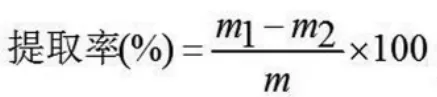
式中:m为野生玫瑰果种子质量,g;m1为接收瓶与玫瑰种子油的质量,g;m2为接收瓶的质量,g。
1.3.2 野生玫瑰果种子油单因素试验用上述提取工艺,分别对料液比(1∶8、1∶11、1∶14、1∶17、1∶20、1∶23)、超声功率(50 W、100 W、150 W、200 W、250 W、300 W、350 W)、超声温度(10℃、20℃、30℃、40℃、50℃、60℃)和超声时间(10 min、20 min、30 min、40 min、50 min、60 min、70 min、80 min、90 min)进行实验,计算油脂提取率。
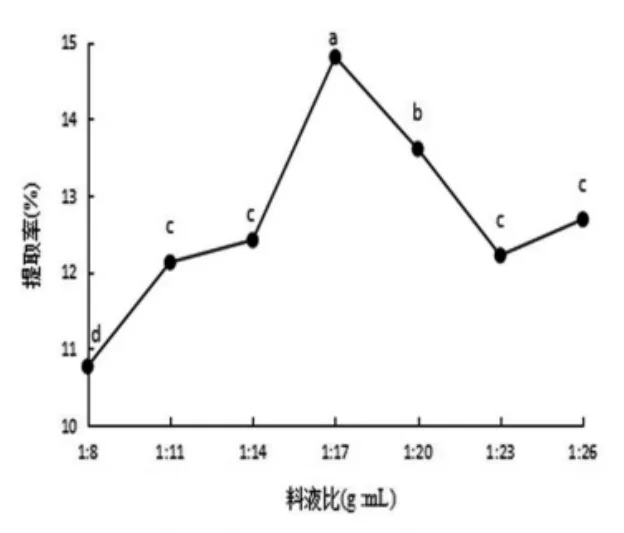
图1 玫瑰果种籽油料液化比对提取率的影响

图2 玫瑰果种籽油超声功率对提取率的影响
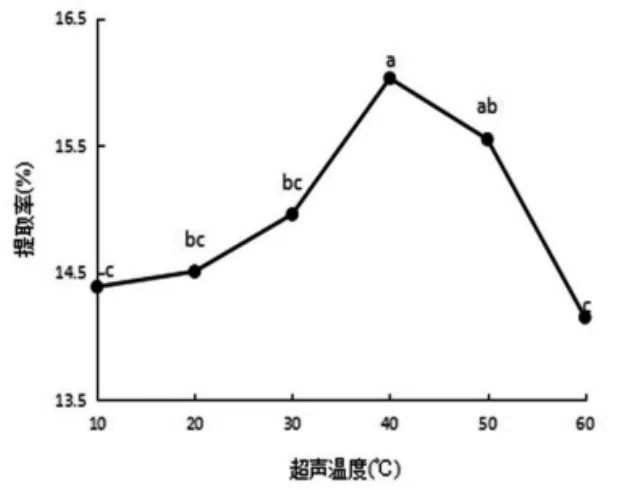
图3 玫瑰果种籽油超声温度对提取率的影响

图3 玫瑰果种籽油超声波时间对提取率的影响
1.3.3 正交实验设计根据单因素试验结果,选取液料比(A)、提取温度(B)和提取时间(C)为考察因子,提取率为考察指标,采用3因素3水平正交试验方法,因素水平表如表1。
1.4 数据处理
野生玫瑰种子油的提取条件的优化采用Excel软件和SPSS Statistics 17.0进行计算及方差分析。
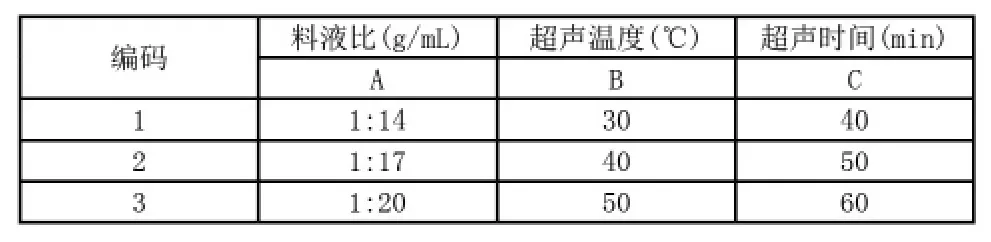
表1 正交试验因素水平表
2 结果与分析
2.1 野生玫瑰果种子油单因素试验
2.1.1 料液比对提取率的影响如图1所示,料液比对玫瑰果种子油提取率有较大影响,当料液比为1∶17时,油提取率达到最大为14.75%,该值与料液比为1∶8、1∶11、1∶14、1∶20、1∶23、1∶26的油脂提取率均具有显著性差异(P<0.05)。料液比从1∶8~1∶17随着料液比的增加,玫瑰果种子油提取率增大,尤其是1∶14~1∶17提取率上升速率极快,对提取率的影响作用最大,这是由于料液比增加,溶剂用量加大,油料间的粘度减小,渗透压增加,分子间扩散速度加大,油提取率增高[14]。当料液比为1∶17~1∶23时,提取率开始下降且下降速度很快,说明随着料液比增大油的提取率反而降低,这是由于当料液比继续增大时,溶剂用量也随之增多,体系内油脂含量相对降低,油脂提取率也相对降低,而且过大溶剂用量会造成浪费[15]。因此,最佳料液比为1∶17。
2.1.2 超声功率对提取率的影响如图2所示,超声功率对玫瑰果种子油提取率的影响较小,当超声功率为200W时其油脂提取率达到最大为12.96%,该值与超声功率为50W和350W时油脂提取率有显著性差异(P<0.05),与超声功率100W、150 W、250 W和300均无显著性的差异。这是因为当超声功率由50W增大到200W时,超声功率增大破坏种籽粉的细胞,油的浸出量增多,提取率增加。当超声功率由200W增大到350W时,油的提取率反而下降,这是由于超声波具有无选择破坏作用,在较高的超声功率作用下,产生了空化效应和湍动效应,不仅破坏了细胞壁,也破坏了待提取物的分子结构[16],使溶剂与待提取物间的极性发生改变,提取率反而降低。
2.1.3 超声温度对提取率的影响由图3可知,超声温度对油脂提取率具有较大的影响,当超声温度为40℃时提取率达到最高为16.03%,该值与10℃、20℃、30℃、60℃时油脂提取率有显著性差异(P<0.05)。这是由于温度升高促进油料分子剧烈运动,分子撞击颗粒时对颗粒的撞击力越大,分子的破坏率越高,油脂分子更容易溢出,从而使提取率增加[17]。当超声温度为40℃~60℃时,油脂提取率极速下降,这是因为过高的温度会使溶剂挥发,减少了物料与溶剂的接触面积;另外,高温会导致油料组分分解,大分子物质变性,导致提取率降低[18]。因此,最佳超声温度为40℃。
2.1.4 超声时间对提取率的影响如图4所示,超声时间对油脂提取率具有明显的影响,当超声时间为50min时,油脂提取率达到最高为13.44%,该值与10min、20min、30min、40min、60 min、70min、80min、90min油脂提取率均有显著性差异(P<0.05)。这是因为超声波处理时间越长,油料颗粒的有效撞击机率越大,油量浸出的机会越多,油脂的提取率越高[19]。当超声时间为50~60min时,油脂提取率极速下降,超声时间为60~90min时,油脂提取率下降较缓慢,这是因为超声时间过长,油脂发生分解反应,产生一定量杂质,并且长时间超声会导致体系升温,过高的温度减弱超声波的空化效应[20],使油脂提取率降低。因此,最佳超声时间为50min。
2.2 野生玫瑰果种子油正交试验
从表2可知,野生玫瑰果种子油在料液比为1∶17,超声温度为40℃,超声时间为60min的条件下,获得最高提取率为15.55%,即提取条件为A2B2C3时,提取率最大。通过极差分析可知,RA>RB>RC,说明3个因素对野生玫瑰果种子提取率的影响大小为料液比>超声温度>超声时间,在组合为A2B2C3时,油脂的提取率最高,这与试验结果一致。
如表3所示,经方差分析可知,FA>F0.01(2,2),说明料液比对油脂提取率具有极显著的影响;F0.05(2,2)<FB<F0.01(2,2),说明超声温度对油脂提取率有显著性影响;FC<F0.05(2,2),说明超声时间对油脂提取率无显著性影响。

表2 玫瑰果种子油试验L9(33)
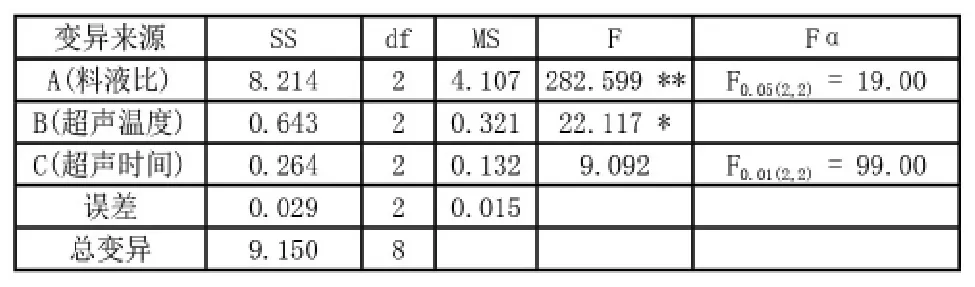
表3 正交试验方差分析表
3 结论
超声波辅助法提取野生玫瑰果种籽油时,3个因素影响野生玫瑰果种籽油脂提取率的大小顺序为料液比>超声温度>超声时间,且超声时间对油脂提取率无显著性影响,超声温度对油脂提取率有显著性影响(P<0.05),而料液比对油脂提取率具有极显著的影响(P<0.01),超声波辅助提取野生玫瑰果种子油的最佳提取条件为料液比为1∶17,超声温度为40℃,超声时间为50min,此提取条件下野生玫瑰果种子油提取率为15.55%。
[1] 林霜霜,珊莲,郑开斌,刘荣章.玫瑰种质资源多样性与育种研究进展[J].中国园艺文摘,2016(01):25-27.
[2] 姜楠南,张玉,房义福,等.玫瑰种质资源与综合利用研究进展[J].山东林业科技,2016(06):105-108.
[3] 张妮妮.玫瑰(Rosa rugosa Thunb.)种子特性的研究[D].山东农业大学,2009.
[4] 杨志莹,赵兰勇,徐宗大.野生玫瑰与栽培玫瑰对盐胁迫反应的比较研究[J].山东林业科技,2010(02):43-45.
[5] 周秀娟.野生玫瑰两个品系果实品质特性的比较分析与评价[D],延边大学.2017.
[6] 周秀娟,李娜,薛桂新.野生玫瑰果成熟期外观品质和果肉成分的分析与评价[J],延边大学农学学报.2017,39(01):42-48.
[7] 刘小飞,汪长钢,吴晗,等.玫瑰果籽油的成分分析及氧化性质研究[J].食品工业.2014,35(07):243-245.
[8] 刘小飞,汪长钢,吴晗,等.超临界CO2萃取玫瑰果籽油的研究[J].食品工业.2014,35(05):130-133.
[9] 王丽萍.不同品种石榴籽油的超声波辅助提取参数优化及其脂肪酸分析[D].西北农林科技大学,2012.
[10] 武瑜.葡萄籽油的超声波辅助提取及其理化性质的研究[D].2012.
[11] 麻成金,吴竹,黄伟,等.侧柏籽油的超声辅助提取及其脂肪酸组成分析[J].食品科学,2010,31(24):50-55.
[12] Fang Wei,Gui Zhen Gao,Xin Fa Wang,etal.Quantitative determination of oil content in small quantity of Oilseed rape by ult-rasound-assisted extraction combined with gas chromatography[J].Ultrasonics Sonochemistry.2008(15):938-942.
[13] 麻成金,黄伟,黄群,等.响应面法优化超声波辅助提取仿栗籽油工艺及其脂肪酸组成分析[J].食品科学,2012,33(16):24-29.
[14] Sue-Siang Teh,Gertrud E Morlock.Effect-directed analysis of cold-pressed hemp,flax and canola seed oils by planar chromat-ography linked with(Bio)assays and mass spectrometry[J].Food Chemistry.2015(187):460-468.
[15] Mohamed Koubaa,Houcine Mhemdi,Eugène Vorobiev,Seed oil polyphenols:Rapid and sensitive extraction method and high Resolution-mass spectrometry identification[J].Analytical Biochemistry.2015(476):91-93.
[16] 芳芳,孙晓洋,王兴国,等.超声波技术在油脂工业中的应用和研究进展[J].中国油脂,2012,37(10):76-80.
[17] 张鹰,刘锐浜,于新.超声辅助法提取山毛豆种子油的工艺优化[J].安徽农业科学,2011,39(27):16996-16998.
[18] 兴丽,赵凤敏,曹有福,等.超声波提取亚麻籽油工艺及其对亚麻籽微观结构的影响[J].中国粮油学报,2015,3(12):80-86.
[19] 瞿晓晶,彭芳芳,尹楹富,等.构树种子油的超声强化提取及其抗氧化性研究[J].天然产物研究与开发,2014,26:1685-1689.
[20] 张亚萍,陈彦,王萌萌,等.超声辅助提取西兰花种子油及其脂肪酸组成分析[J].中国油脂.2015,40(12):18-21.
