木质素模型化合物合成研究的现状与展望
2018-03-01赵新坤李赫龙孙润仓
赵新坤, 李赫龙, 佘 雕*, 孙润仓
(1. 西北农林科技大学 资源环境学院, 陕西 杨凌 712100; 2. 北京林业大学 材料科学与技术学院, 北京 100083)
化石燃料的日趋匮乏及其利用过程中产生的环境问题,使可再生资源受到越来越多的关注,其中生物质转化为化学品、燃料和材料方面的应用成为当今研究的热点[1]。植物体中一般含木质素15 %~36 %,全世界每年可产生木质素的量达6×1017kg,作为地球上产量仅次于纤维素的天然大分子有机物,木质素蕴藏着巨大的应用前景[2-4]。木质素是一种酚类多聚体,是维管植物细胞壁的重要组成成分,具有机械支持、水分运输和抵抗病菌侵袭等重要生物学功能[5-8]。在植物细胞壁中,纤维素与半纤维素聚集成纤丝束状,木质素填充其中,并结合多种结构蛋白与其他多糖形成坚固的聚合液晶结构[9]。在工农业生产过程中,木质素的分离降解成为最关键的技术难题[10],比如,木质素不容易被动物消化,其种类和含量很大程度上决定了作为饲料的农产品能否被高效利用[11];在制浆造纸过程中木质素很难与纤维素分离,不仅耗费能源,而且成本高,废弃物污染环境[1]。因此,木质素的高效分离和充分转化利用是当前木质纤维工业及生物质能源产业发展的客观要求,也是实现我国工业结构调整与升级的重要战略之一。木质素是一种异质聚合体,主要由对香豆醇、松柏醇和芥子醇3种单体的衍生物组成。植物中木质素的生物合成以苯丙烷为起始,经过一系列羧基化、甲基化、还原反应和醚键、碳-碳键连接最终生成上述3种不同甲基化程度的木质素单体。3种单体经氧化生成相应的木质素结构单元:对-羟基苯基单元(H)、紫丁香基单元(S)和愈创木基单元(G)。3种木质素结构单元之间再通过聚合作用生成高分子化的木质素[12]。随着对木质素合成途径的深入研究,研究人员发现除了以上3种基本结构单元以外,还有其他形式的单体也参与木质素的聚合过程[13],如有研究发现许多植物中存在相当比例的乙酰化的木质素单体[14],同时Ralph等[15]的研究还发现了自由基偶联反应生成的阿魏酸及其脱氢二聚体等。已有相关研究证明通过在转基因植物中减少木质素含量或者改变木质素结构组成可以明显提高制浆效率和生物乙醇的转化率[16-20]。这些生物质特性的改变可能与木质素组成和结构相关,也可能与木质素和半纤维素之间的相互作用有关[14]。木质化过程其实就是木质素单体或者低聚物之间自由基耦合的过程,这个过程通常发生在细胞壁中多糖生成之后[21]。尽管木质素的研究已有很长时间,然而其生物合成过程仍然存在很多未知领域,木质素的生物合成途径及机理至今仍是一个争议较多的研究领域。因此,深入了解木质素在植物体中的形成过程、机理、产物结构与性质等,并经人工合成木质素模型化合物,不仅是木质素研究理论上的重要突破,而且也会对有效分离、脱除木质素及其开发利用提供理论基础与技术指导。笔者以研究木质素合成为目的,简单介绍了木质素单体的合成途径和单体聚合的2种理论,重点介绍了木质素模型物合成研究的现状及发展趋势。
1 木质素生物合成
1.1木质素单体的生物合成途径
木质素的生物合成途径大致分为2步:1)木质素单体的合成,此过程是在细胞质中完成的;2)由细胞质转移到木质素沉积位点的木质素单体聚合成具有生物活性的木质素[17, 22-24]。目前,对于木质素单体的生物合成途径已达成广泛共识,普遍认为可分为3种主要途径:1)由植物光合作用初级产物葡萄糖生成苯丙氨酸、酪氨酸(禾本科植物)和色氨酸等的莽草酸途径;2)从苯丙氨酸到肉桂酸及其酰基辅酶A酯的苯丙烷类代谢途径;3)从肉桂酰辅酶A酯还原为木质素单体途径。其中,第三种合成途径生成的木质素单体经过聚合作用生成木质素的过程,称为木质素合成特异途径[17, 25-27]。木质素生物合成过程中起主要作用的是苯丙烷类代谢途径和木质素合成特异途径,同时这2种途径也是该领域的研究重点。木质素单体的合成过程极其复杂,存在多基团、多途径交互作用,有十几种酶参与了木质素单体合成的调控,其中多数酶的生理功能已被研究清楚并定位于合成途径中的相应位置上。目前的研究认为,被子植物中木质素单体合成的最优路径为:苯丙氨酸经过L-苯丙氨酸解氨酶(PAL)催化脱氨基生成苯丙烯酸,苯丙烯酸经过肉桂酸- 4-羟基化酶(C4H)催化苯羟基化生成对香豆酸,对香豆酸与辅酶A连接酶(4CL)生成中间产物对香豆酰基-辅酶A,之后经过多种酶催化发生苯羟基化反应,对香豆酰基-辅酶A的芳香环结构连接邻位双羟基,经过儿茶酚-O-甲基转移酶(COMT)和咖啡酰-辅酶A甲基转移酶基因(CCoAOMT)催化将羟基发生甲基化生成甲氧基,生成的阿魏酰-辅酶A经过肉桂酰辅酶A还原酶(CCR)催化脱去辅酶A生成松柏醛,而作为重要中间产物的松柏醛,一方面可以经过肉桂醇脱氢酶(CAD)和硬脂酰ACP去饱和酶(SAD)催化生成松柏醇(G型结构单体),另一方面可以经过阿魏酸-5-羟基化酶(F5H)催化发生苯羟基化反应生成5-羟基松柏醛,之后经过COMT催化发生羟基甲基化反应生成芥子醛,芥子醛在CAD和SAD催化作用下经过还原生成芥子醇(S型结构单体)。在不同的物种和环境下,对香豆酰基-辅酶A可以经过CCR催化生成对香豆醛,而后经过CAD和SAD催化发生还原反应生成对香豆醇(H型结构单体),该路径也偶有发生。而直接通过对香豆酸催化生成咖啡酸,后经过苯羟基化反应和羟基甲基化反应生成阿魏酸,生成阿魏酸与辅酶A结合生成中间产物再经过脱辅酶和还原生成松柏醇的路径很少发生[5]。
1.2木质素单体的聚合
植物细胞壁的木质化过程本质就是木质素单体通过聚合形成木质素大分子的过程。木质素聚合体的形成究竟是木质素单体的随机聚合还是受到严格调控,成为近年来争论的一个焦点[5, 17, 28-31]。目前,有关木质素聚合体的形成过程主要有2种理论学说:随机聚合学说和严格调控学说。
1.2.1随机聚合学说 早期的一些研究者认为木质素聚合体是游离分子偶联聚合的产物。Freudenberg于1965年首次提出了随机聚合理论的雏形,他认为木质化的起始阶段是由2个相同木质素单体经脱氢聚合开始的,所形成的二聚体进一步与木质素单体和低聚物经过交联偶合反应形成木质素大分子[32]。此理论认为该过程中没有生物化学因素的控制,而仅是木质素单体的自由基耦合过程,产生了一系列的无特定化学结构序列的外消旋聚合物,并采用松柏醇与虫漆酶在有氧条件下合成了木质素脱氢聚合物(DHP)。后来Freudenberg又发现过氧化物酶/H2O2也有脱氢作用,并且发现在植物中过氧化物酶是木质化作用的有效酶[28]。随后,Sarkanen和Ludwig的研究也证实了这一理论[33]。体外模拟的随机聚合方式可以大致模拟植物体内木质素的组装过程,这种体外木质素分子的形成取决于不同单体之间的比例、偶联反应机率、DHP中多糖的存在等[34-35]。目前,该学说的代表人物为John Ralph,他认为木质素单体聚合是一个酚类自由基在简单化学和物理控制条件下的交联过程,由于木质素单体及其聚合物产生的自由基会发生共振离域作用且可以在不同的化学部位交联,所以是自由基的一个“随机组合”过程。Ralph将该理论定名为“组合自由基交联理论”,其中最重要的反应是木质素单体的β-O-4直链末端和聚合体的酚基末端之间的交联反应[5]。他认为在细胞质中合成的木质素单体会转运到细胞壁产生脱氢作用而形成自由基,这些脱氢后的酚类自由基虽然由于电子离域作用而改变了芳环及其共轭侧链β位的电子密度使单体性质相对稳定,但是彼此之间可以相互耦合,通过氧化交联反应与已经形成的聚合体连接从而延伸木质素的三维网络结构。同时,Ralph还在理论上推算出了木质素单体交联聚合的过程及其主要产物,主要有5种。 第一种是松柏醇脱氢聚合,酚羟基自由基、苯环5位自由基与β位自由基随机发生聚合偶联反应。酚羟基自由基与β位自由基偶联生成β-O-4连接键的木质素二聚体模型化合物G-β-O-4-G,此类连接键在木质素中含量最多;β位自由基与苯环5位自由基发生随机聚合反应生成含有β-5的二聚体G-β-5-G;2个不同分子上的β位自由基发生偶合反应生成含有β-β连接键的二聚体G-β-β-G。需要特别注意的是,2个酚羟基自由基之间、2个苯环5位自由基之间、苯环5位自由基与酚羟基自由基之间无法发生聚合偶联反应。第二种是芥子醇脱氢聚合,不同于松柏醇在苯环3位上连接有1个甲氧基,芥子醇在苯环3、5位各含有1个甲氧基,所以在苯环5位上无自由基,芥子醇脱氢聚合只能发生在β位自由基和酚羟基自由基位置上。β位自由基之间发生偶合反应生成含有β-β连接键的二聚体S-β-β-S;β位自由基与羟基自由基发生随机聚合反应生成含有β-5的二聚体S-β-5-S。同样的,2个酚羟基自由基之间无法发生偶联反应。第三种是木质素单体与木质素大分子G型末端发生偶联反应。由于木质素大分子末端结构单元无β位自由基,所以只能发生单体β位自由基与大分子末端结构单元的酚羟基及苯环5位自由基之间的偶合反应。β位自由基与羟基自由基发生随机聚合反应生成含有β-O-4的多聚体G(S)-β-O-4-G;β位自由基与苯环5位自由基发生随机聚合反应生成含有β-5的多聚体G(S)-β-5-G。但是,单体与多聚体之间无法发生单体苯环5位自由基与大分子末端苯环5位自由基之间的偶合反应。第四种是木质素单体与木质素大分子S型末端发生偶联反应。木质素大分子末端结构单元无β位自由基和苯环5位自由基,所以只能发生单体β位自由基与大分子末端结构单元的酚羟基之间的偶合反应。单体β位自由基与大分子羟基自由基发生随机聚合反应生成含有β-O-4的多聚体G(S)-β-O-4-S。第五种是低聚体的交联。木质素单体结构单元之间不能发生苯环5位自由基的偶合反应及酚羟基自由基和苯环5位自由基之间的偶合反应。而木质素低聚物之间能通过酚羟基自由基和苯环5位自由基之间发生自由偶合反应。木质素中含有的5-5连接键和4-O-5连接键能且只能通过木质素低聚物之间的偶合反应得到,而不能通过单体与单体或者单体与低聚物反应得到[5]。
1.2.2严格调控学说 Davin和Lewis不赞成随机聚合学派关于木质素是自由基交联反应产物的理论,于1990年提出严格调控学说,该学说认为木质素主体结构在形成过程中受 “蛋白质排列点位的掩护阵列”控制并进行模板复制[29]。因为木质素单体的沉积表现出一定的时间顺序和空间格局:不同的细胞和相同细胞的不同细胞壁层都会呈现木质素种类和结构的差异[36]。他们从这种分布特征推断木质素的聚合是一个高度有序的过程,而非游离基偶联聚合的产物[29, 37]。他们研究认为,排列蛋白主要在一些可以木质化的细胞壁特定区域如次生壁外层(S1层)和胞间层(ML层)表达,这些区域与木质素沉积起始位点有关,据此推断排列蛋白与植物体内木质素单体聚合的调控机制有关。他们已从植物中分离出许多排列蛋白,并认为该类蛋白编码基因在植物中普遍存在[29]。然而该模型及理论存在一些不足,如还没有足够的证据说明排列蛋白在木质化过程中所起的作用,还需用反向遗传学方法对该类蛋白的生理功能加以验证;此模型不能解释木质素的外消旋性与受酶调控的生物合成机制间的矛盾;另外木质素分子空间排列紧凑,而酶蛋白分子体积大,故分散其中发挥其催化和调控功能的可能性较小。该学说提供的理论与实验支撑较少,很难用数据或者现象提供支撑,所以越来越多的研究人员开始寻找反对此学说的证据[38-39]。
1.2.3木质素单体聚合的研究现状 目前,由Freudenberg建立并由Ralph等深入发展的随机聚合理论逐渐得到普遍接受[3]。这一学派的研究目前已经获得了多达几十种自由基交联聚合物的模型物,可用于阐明不同木质素的结构特征[22, 40]。
目前为止,木质素单体合成的3种途径已经基本研究清楚,但从单体合成低聚体的机理仍是一个难点。国内关于木质素单体合成低聚体的途径、机理及其结构表征等方面的报道很少,仅有卢孟柱、谢益民、宋艳茹、孙润仓、马庆虎、杨传平等做了一些有益的探索[26-27, 41-43],但都未对木质素聚合机理进行深入探讨。近年来,Ralph在该领域取得了很好的研究成果,发现了松柏醇和阿魏酸酯的交联偶合二聚体松柏醇-(β-5)-阿魏酸,并建立了松柏醇与阿魏酸酯二聚体交联结构鉴定新方法,阐明了阿魏酸酯在木质化过程中的作用和机理。目前,关于另外2种木质素单体(芥子醇和对香豆醇)这方面的相关研究尚未见报道,但参照松柏醇单体交联二聚体的研究思路,相对应的另外2种单体聚合的研究在理论上的可行性较大。
2 木质素模型物合成
在木质素的研究和利用过程中面临的诸多问题,大部分与其结构方面的复杂性和多变性有关,而这些问题尚未能得到有效地解决。如果利用天然木质素的片段来研究木质素大分子,将使研究过程复杂化。因为天然木质素片段的结构是由多种因素共同影响的,其中包括木质素合成过程中可能受到控制蛋白的影响[30],多糖对木质素合成过程中空间位阻的影响,时空调控、分离提取过程中对天然木质素结构的破坏等[21-22]。因此,结构简单明确的木质素模型物可以在一定程度上代替天然木质素作为研究材料,受到科学界的广泛重视[44-50]。在木质素模型物开发过程中,一般以DHP代替天然木质素作为研究对象。DHP是在均匀混合的介质中生成的,所以可以人工控制反应条件以得到不同目标产物,如调节pH值、多糖含量、木质素单体的供应速率等,不同的单体供应速率得到的聚合物连接键比例不同[51-54]。木质素脱氢聚合物不仅可以由酶促反应得到,而且可以通过化学反应经无机催化剂催化得到,通过化学计量反应得到的模型物在木材木质素研究中比酶促反应得到的木质素更具有代表性[55]。总体来说,研究化学合成法得到的木质素模型物具有以下意义:模型物包含的化学键与木质素大分子中的化学键非常相似,所以其反应过程可以为木质素的降解和合成过程提供理论依据;由于木质素模型分子都可以在木质素大分子的降解产物中找到,所以对模型物的研究有利于为木质素解聚产物的高值化利用提供新思路;木质素模型物中只存在特定的化学键,不受其他更多且复杂的化学键影响,从而可以在根本上避免分析过程中来自于其他复杂聚合物的影响。
木质素模型物中最常用的是二聚体,其次是三聚体以及多聚体。由于大多数模型物之间的区别主要来源于功能团的种类和数量的不同,例如直接与芳香环相连的烷基或甲氧基,因此笔者仅选择具有代表性的几种木质素模型物进行简单介绍。
2.1二聚体的合成
木质素中存在最多的连接键是β-O-4键(约50%)[56],而且很容易断裂,在很大程度上影响了木质素的理化性质[57-59]。碱法制浆过程是解聚木质素的重要途径,因为碱溶液可以破坏木质素大分子中的醚键生成木质素碎片,醚键断裂生成的酚羟基使木质素水溶性大大增加,从而为木质素的利用提供了重要条件。因此,含有β-O-4连接键的模型物对木质素的化学结构、活性、生物降解等方面的研究具有重要的意义。1952年,Adler等[60]首次合成以醚键连接的愈创木基丙烷-β-愈创木基和藜芦基丙烷-β-愈创木基的二聚体,作为重要的木质素模型物,这2种物质被广泛地应用于木质素的研究中。之后,在此模型物基础上,又有多种不同木质素模型物被开发出来[61-62]。Shen等[63]在Adler的合成方法基础上经过改进合成多种β-O-4木质素模型物,如图1所示,乙酰藜芦酮经过溴化生成的α-溴-乙酰藜芦酮,溴作为高活性基团有利于其在无水、碱性条件下和香草醇发生取代反应,生成化合物1。在此反应过程中碱作为缚酸剂,消耗生成的氢溴酸,使反应向正向进行。由于化合物1中的羰基具有吸电子效应,使羰基邻位的碳活性提高,有利于发生甲醛的亲核加成反应。经过硼氢化钠还原,含有乙烷和丙烷基团的2种模型物分别可以生产对应的化合物3和4。

图 1 含有β-O-4键木质素模型物合成过程[63]
然而,当起始物质为香草乙酮时,由于酚羟基具有很强的活性,会阻止后续反应的发生,所以需要通过苄基化作用将酚羟基保护起来,后续经过溴化、取代、加成反应得到含有苄基的木质素模型物。作为保护基团,苄基可以在氢气环境下通过催化反应离去得到最终产物。此合成路线对实验条件要求较低,且操作简便易行,具有很强的可操作性,但是由于反应步骤多,导致总产率较低,药品浪费多。对于需求量小的研究,此方法不失为一种简单有效的合成途径。
Mostaghni等[64]在无水无氧条件下,将正丁基锂与六甲基二硅氮烷混合生成锂化试剂,然后加入2-甲氧基苯氧基乙酸[65],被活化的2-甲氧基苯氧基乙酸与苯(含取代基)甲醛发生取代反应生成二聚体。此反应过程中正丁基锂与六甲基二硅氮烷反应生成空间位阻极大的锂化试剂,2-甲氧基苯氧基乙酸中羰基邻碳上氢活性较高,与锂化试剂形成不稳定中间产物,有利于甲基化的丁香醛的取代。经过硼烷二甲基硫醚的还原作用和过氧化氢的氧化作用生成终产物。该方法用六甲基二硅氮烷代替之前研究中用到的二异丙基氨基锂[66],不仅可以抑制副产物的生成,还可以控制产物不同构型的比例。通过该方法可以合成不同的S型木质素模型物,但是对操作要求较高,实验条件要求苛刻,如超低温环境、无水无氧环境等,同时所用试剂活性非常高、使用过程中危险性较大等。因此,如果对于模型物中异构体无特殊要求,应尽量避免使用该方法。合成过程如图2所示。
Ralph等[67]利用过氧化氢和过氧化物酶合成了β-5二聚体,如图3所示,此合成方法利用了仿生系统,比传统的自由基耦合反应更快速得到最终产物,而且大大提高了反应得率。产物中虽然杂质种类较多,但是由于目标产物与杂质在硅胶中的洗脱速率有巨大差异,所以用层析色谱柱可以很容易将目标产物分离,并且总产率达50%以上。 虽然该方法对实验条件要求较低,实验简单易行,但是经由此方法得到的产物中的杂质较多,无法人为干预实验进程和方向,且产物需要过色谱柱分离,会浪费大量有机溶剂。同时,作为仿生合成过程,此方法不利于对合成机理的研究,只能作为一种较为快捷的合成木质素模型物的途径。
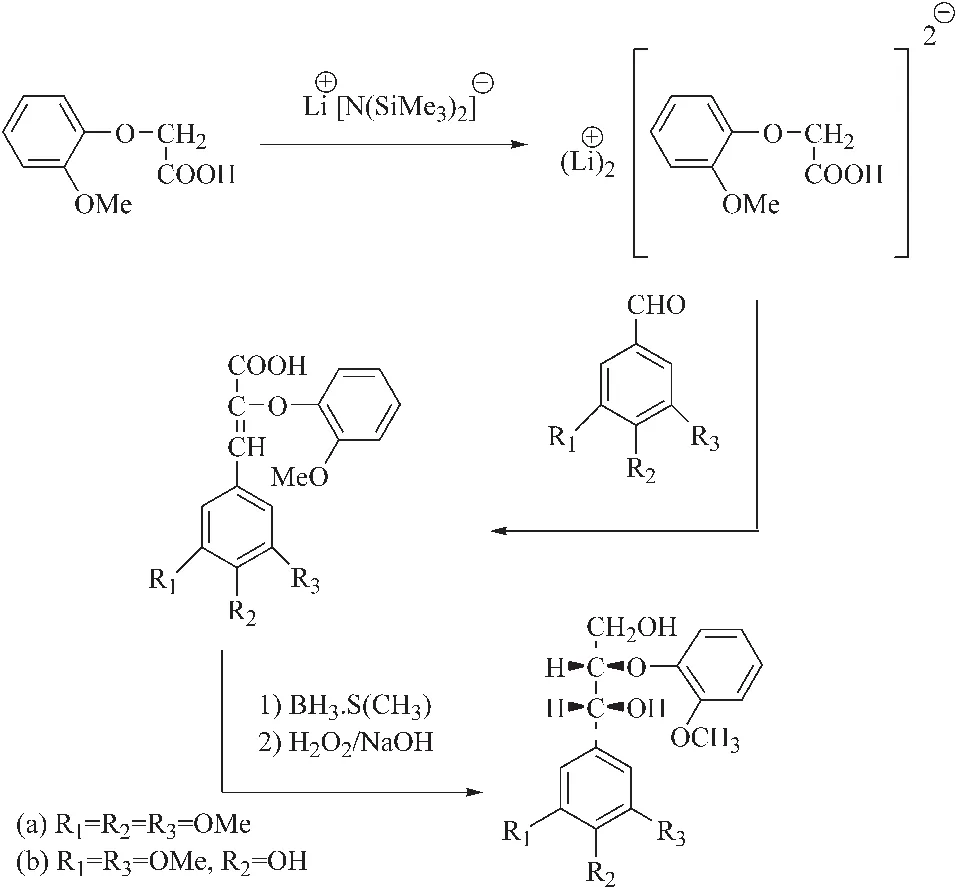
图 2 木质素模型物的立体选择性合成[64]
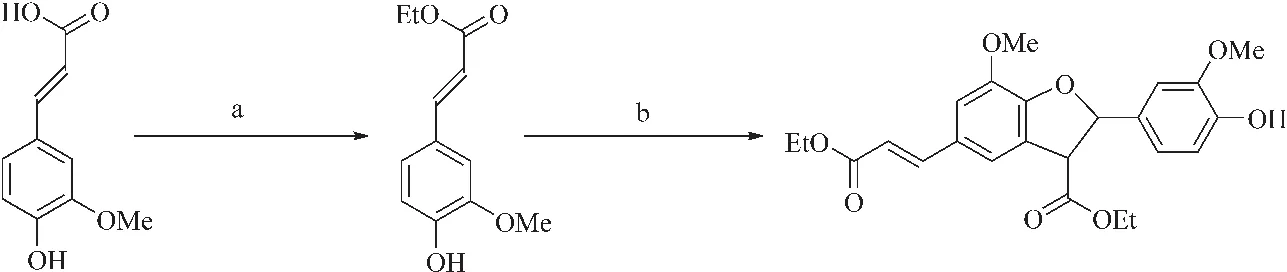
图 3 β-5连接的阿魏酸乙酯二聚体的仿生合成[67]
2.2三聚体的合成
Alves等[68]在无水环境中用乙酰基香草醛脱氢二聚体和α-溴-3-甲氧基-4-乙氧基苯乙酮在K2CO3作用下生成三聚体,然后以该三聚体为起始物,通过不同的反应过程生成多种衍生物,合成途径如图4所示。由图4可知,该4种化合物都含有β-O-4和5-5′键,而且4号位上的羟基被烷氧基取代,更接近于天然木质素的结构。该合成过程不是以简单的单体为起始物质,而是以乙酰基香草醛脱氢二聚体为原料,由于二聚体的合成过程产率很低,直接影响三聚体的产率;同时,另一种原料α-溴-3-甲氧基-4-乙氧基苯乙酮也需要经过连续两步反应得到,因而增加了反应步骤,使三聚体产率进一步受到限制。而且,生成的模型化合物中苯环含有一个碳作为侧链与天然木质素结构差别较大,不具有代表性,所以该方法合成的模型物应用范围较窄。
近来Ouyang等[69]通过微波辐射方法,以香草乙酮为底物通过三步反应合成含有β-O-4和α-O-4的三聚体。经过微波处理,产物得率可以从36%增加到95%以上。此合成方法所需步骤少、操作简单、对实验条件要求较低,而且所用反应底物为商品化的香草乙酮,不仅价格低廉,而且无毒无害。该方法在提高产率的同时,缩短了时间,降低了成本,可以应用于批量生产。但是,该合成过程中多次用到二甲基甲酰胺(DMF),虽然其溶解能力强,但是由于其沸点较高,对产物的利用带来很大影响。

图 4 三聚体I-IV的合成路径[68]
2.3多聚体的合成
二聚体模型物结构简单且易于表征,被广泛应用于木质素的研究中,但在研究中用来代替天然木质素大分子又有其局限性:结构简单的二聚体只是复杂的三维立体天然木质素结构中的片段,不能完全反应聚合物的本质特征,其化学键断裂条件也不能用来推断木质素解聚所需条件[70-71]。以对-羟基苯丙烯醇为底物经过酶促反应生成的脱氢多聚物[51],虽然在很大程度上与天然木质素性质相似,但是其结构的复杂程度和天然木质素并无太大差别,对简化木质素结构方面研究的意义不大。近年来,对于大型低聚物的开发发展迅速,借鉴二聚体模型物的合成方法,合成含有单一或者多种连接键的多聚物,如含有β-O-4连接键的三聚物[71],只含有β-O-4连接键的四聚物[72-73],含有β-O-4和β-5′连接键的四聚物[74],含有β-O-4和5-5′连接键的四聚物[75],含有β-O-4和β-5′连接键的六聚物[76]以及分子质量更高的多聚物[77]。
Kishimoto等[70]通过2个连续的过程合成了β-O-4型人工木质素:1)以Williamson 反应为基础,通过缩聚阿魏酸乙酯的衍生物生成聚合物;2)对聚合物中的羰基进行还原(如图5所示)。由香草醛合成的化合物9经氯化钯催化[78],在不还原α位羰基的前提下经过脱苄基作用生成化合物10,通过CuBr2或者Br2与之反应生成β位活性较高的溴化产物,有利于后续发生取代反应生成β-O-4连接键的聚合物。该聚合过程条件借鉴了含有2个碳的侧链的木质素模型物聚合方法,是后者的一个延伸,生成的多聚物更接近于木质素的苯丙烷结构[79]。此方法以含有3个碳作为支链的单体为起始物,避免了后期在含有羰基的侧链上加成醇甲基,使产物得率大幅提高;聚合产物只含有单一的连接键,结构信息明确,在后期处理过程中的结构变化更容易分析,对于β-O-4连接键构型木质素的研究具有重要意义。
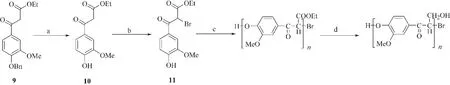
图 5 人工合成木质素聚合物的路线[70]
经过Kishimoto等后期对上述方法的改进,合成含有另外2种单体的聚合物,该系列聚合物可以通过乙酰化生成含有酰基的木质素多聚体。如图6所示,以4-羟基乙酰苯的3种溴化衍生物为起始单元,通过聚合、还原和乙酰化反应选择性生成含有不同单体、不同聚合度的模型物[80-81]。该方法聚合过程简单,对实验条件要求较低,单体得率较高。但是聚合物的还原过程产率只有30 %,使多聚物总产率大幅下降,造成时间和经济成本的增加,所以该还原过程有待于进一步研究。产物中只含有单一β-O-4连接键,为研究木质素中含量最多的连接键在聚合物中的性质和活性提供可能。该方法可以通过控制各种单体的比例,生成不同种类的聚合物(2a~2d),不同单体聚合产率有明显差别。该方法不足之处在于无法控制聚合物的聚合度,这与酶促反应生成的聚合物相似,可以探索通过控制反应温度或者反应时间及溶剂来调控单体聚合程度。

图 6 含有β-O-4连接键的人工木质素的合成方法[80]
2013年,Forsythe等[71]开发不同路线合成木质素六聚体和八聚体模型物。以价格低廉的香草乙酮作为底物,在Na2S2O4催化作用下经过聚合作用生成含有5-5′连接键的二聚体。为了防止活泼的酚羟基影响后续取代反应,在碱性二甲基甲酰胺(DMF)中用溴化苄将其进行保护。该二聚体在氢化钠作用下与碳酸二乙酯发生取代反应生成β-二酮酯二聚体。在该过程中,过量的氢化钠将聚合物羰基邻碳上的活泼氢拔去,碳酸二乙酯与该碳正离子发生亲核加成,生成苯丙烷为基本单元的二聚体。氢化钠与质子氢发生反应,所以该过程需要在无水条件下进行,碳酸二甲酯既是反应物又是溶剂,在保证产物纯度的前提下大大提高了反应的得率。从β-二酮酯二聚体的晶体结构可以看出,其扭转角的大小和起始物质的扭转角很相近,说明在反应的初期就形成了三维立体结构,与天然木质素结构更加相近,这一特点与其他处于同一平面的芳香环模型物相比具有很大优势[82]。最后经过N-溴代琥珀酰亚胺(NBS)的溴化作用,生成β位含有活性位点的对称化合物,经过脱苄基的聚合物含有酚羟基和β位2个活性位点,可以根据需要在碱性环境中发生聚合反应生成不同聚合度的多聚物。合成该中间产物步骤较少,有利于提高总反应得率,减少化学药品的浪费,除了碳酸二甲酯加成过程需无水环境外,该反应体系对实验条件和操作技术要求并不高,不失为一种5-5′模型物合成的有效途径。
含有活泼溴的二聚体成为木质素模型物合成的基础结构体,通过带有苯氧基的亲核试剂取代二聚体中的溴,可以生成对应的四聚物、六聚物和八聚物。如图7所示,通过FeCl3催化异紫丁香酚可以生成含有β-5′键的二聚体,该二聚体含有活泼的酚羟基,与含有活泼溴的二聚体可以在碱性条件下发生取代反应。生成的含有β酮和酯键的化合物经过还原反应和脱苄基作用生成含有5-5′、β-5′和β-O- 4连接键的六聚物。该反应首次提出了含有3种不同连接键的六聚物合成模式,不仅保证了产物的高得率(总得率12 %),而且合成过程简单易行,具有很强的可操作性,为研究不同键型的活性和断裂机理提供原材料[71]。
3 结语与展望
木质素的生物合成是一个非常复杂的过程。迄今为止,虽然已经认识到植物细胞壁的木质化过程起源于木质素的单体聚合,也已经阐明了木质素单体生物合成的3种基本途径,但木质素生物合成的微观机理仍不清楚。当今世界对这一复杂问题的研究产生了2种不同的理论。一种是由Freudenberg建立并由Ralph等深入发展的随机聚合理论,认为木质素单体的聚合是一个酚类自由基在简单化学和物理控制条件下的交联过程。另外一种理论是以Davin和Lewis为代表人物的新学派,认为木质素单体的沉积表现出一定的时间顺序和空间格局,从这种分布特征推断木质素的聚合是一个高度有序的过程,即严格调控论。在这两大对立的理论学派中,以Ralph为代表的 “组合自由基交联偶合理论”由于取得了更多令人信服的研究成果而被广泛接受。国内关于木质素单体合成低聚体的途径、机理及其结构表征等方面的报道很少。
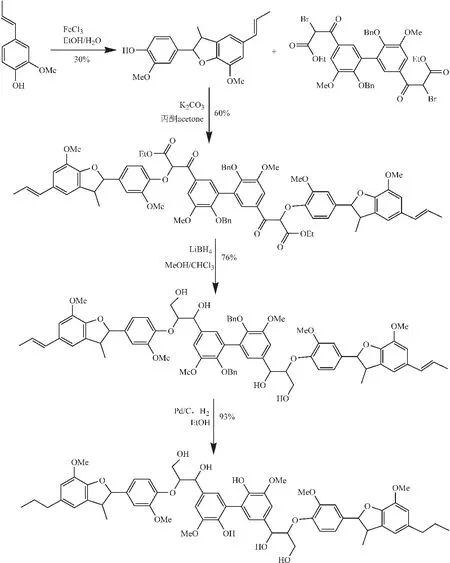
图 7 通过脱氢异丁子香酚二聚体和二溴代二聚体合成六聚物的合成途径[71]
因为木质素的合成过程非常复杂,所以研究人员采用结构简单,反应过程易于控制的模型化合物来进行实验室层面的模拟木质素合成途径研究,试图逐步揭示木质素合成过程的化学及生物反应机理,从而掌握木质素生物合成的规律,透彻认识这一过程的科学内涵,甚至达到人为调控木质素合成的目的。总之,目前的研究对木质素合成这一复杂过程来说仅是一个开端。笔者对已有研究进行了基本的梳理和阐述,以便于促进木质素合成研究的进展,并期待更多的科学家进行更深入的研究,为制浆造纸工业高效分离与脱除木质纤维原料中的木质素提供理论依据和技术支撑,并且为揭示木质素合成过程及其机理作出应有的贡献。
笔者认为,今后的研究重点应集中在以下3个方面: 1)在“组合自由基交联理论”指导下,研究木质素单体模型物的二聚、三聚及多聚反应过程及机理,建立交联反应的优化工艺技术体系和产物的标准检测表征方法; 2)建立一种理想的细胞生活环境模拟方法,使目前在实验室中主要以化学反应为主的机理研究深入到生物细胞或模拟生物细胞层面,从而有效研究自由基在生物体中的真实聚合反应及机理; 3)在采用木质素模型化合物阐明基本化学反应机理的基础上,进一步提高模型化合物的复杂性及其在反应过程中的可控性,从而推进向天然木质素生物合成过程及机理的研究。
[1]RAGAUSKAS A J,WILLIAMS C K,DAVISON B H,et al. The path forward for biofuels and biomaterials[J]. Science,2006,311(5760):484-489.
[2]STUDER M H,DEMARTINI J D,DAVIS M F,et al. Lignin content in naturalPopulusvariants affects sugar release[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(15):6300-6305.
[3]ZHONG R Q,MORRISON W H,HIMMELSBACH D S,et al. Essential role of caffeoyl coenzyme A O-methyltransferase in lignin biosynthesis in woody poplar plants[J]. Plant Physiology,2000,124(2):563-578.
[4]HAGE R E,BROSSE N,CHRUSCIEL L,et al. Characterization of milled wood lignin and ethanol organosolv lignin frommiscanthus[J]. Polymer Degradation and Stability,2009,94(10):1632-1638.
[5]RALPH J,BRUNOW G,BOERJAN W. Lignins[J]. eLS,2007,133(3):1051-1071.
[6]GUO D J,CHEN F,INOUE K,et al. Downregulation of caffeic acid 3-O-methyltransferase and caffeoyl CoA 3-O-methyltransferase in transgenic alfalfa:Impacts on lignin structure and implications for the biosynthesis of G and S lignin[J]. The Plant Cell,2001,13(1):73-88.
[7]RAES J,ROHDE A,CHRISTENSEN J H,et al. Genome-wide characterization of the lignification toolbox in Arabidopsis[J]. Plant Physiology,2003,133(3):1051-1071.
[8]ROGERS L A,DUBOS C,CULLIS I F,et al. Light,the circadian clock,and sugar perception in the control of lignin biosynthesis[J]. Journal of Experimental Botany,2005,56(416):1651-1663.
[9]李桢,王宏芝,李瑞芬,等. 植物木质素合成调控与生物质能源利用[J]. 植物学报,2009,44(3):262-272.
[10]KIM T H,KIM J S,SUNWOO C,et al. Pretreatment of corn stover by aqueous ammonia[J]. Bioresource Technology,2003,90(1):39-47.
[11]SUN R,TOMKINSON J,MAO F C,et al. Physicochemical characterization of lignins from rice straw by hydrogen peroxide treatment[J]. Journal of Applied Polymer Science,2001,79(4):719-732.
[12]李金花,张绮纹,牛正田,等. 木质素生物合成及其基因调控的研究进展[J]. 世界林业研究,2007,20(1):29-37.
[13]ZUBIETA C,KOTA P,FERRER J L,et al. Structural basis for the modulation of lignin monomer methylation by caffeic acid/5-hydroxyferulic acid 3/5-O-methyltransferase[J]. The Plant Cell,2002,14(6):1265-1277.
[14]RALPH J,LUNDQUIST K,BRUNOW G,et al. Lignins:Natural polymers from oxidative coupling of 4-hydroxyphenyl-propanoids[J]. Phytochemistry Reviews,2004,3(1/2):29-60.
[15]RALPH J,GRABBER J H,HATFIELD R D. Lignin-ferulate cross-links in grasses:Active incorporation of ferulate polysaccharide esters into ryegrass lignins[J]. Carbohydrate Research,1995,275(1):167-178.
[16]PILATE G,GUINEY E,HOLT K,et al. Field and pulping performances of transgenic trees with altered lignification[J]. Nature Biotechnology,2002,20(6):607-612.
[17]BAUCHER M,HALPIN C,PETIT-CONIL M,et al. Lignin:Genetic engineering and impact on pulping[J]. Critical Reviews in Biochemistry and Molecular Biology,2003,38(4):305-350.
[18]STEWART J J,KADLA J F,MANSFIELD S D. The influence of lignin chemistry and ultrastructure on the pulping efficiency of clonal aspen (PopulustremuloidesMichx. )[J]. Holzforschung,2006,60(2):111-122.
[19]LEPLE J C,DAUWE R,MORREEL K,et al. Downregulation of cinnamoyl-coenzyme A reductase in poplar:Multiple-level phenotyping reveals effects on cell wall polymer metabolism and structure[J]. The Plant Cell,2007,19(11):3669-3691.
[20]CUSTERS R. First GM trial in Belgium since 2002[J]. Nature Biotechnology,2009,27(6):506.
[21]FERREIRA L M,BLANES L,GRAGNANI A,et al. Hemicellulose dressing versus rayon dressing in the re-epithelialization of split-thickness skin graft donor sites:A multicenter study[J]. Journal of Tissue Viability,2009,18(3):88-94.
[22]BOERJAN W,RALPH J,BAUCHER M. Lignin biosynthesis[J]. Annual Review of Plant Biology,2003,54(1):519-546.
[23]GRIMA-PETTENATI J,GOFFNER D. Lignin genetic engineering revisited[J]. Plant Science,1999,145(2):51-65.
[24]ROGERS L A,CAMPBELL M M. The genetic control of lignin deposition during plant growth and development[J]. New Phytologist,2004,164(1):17-30.
[25]DOUGLAS C J. Phenylpropanoid metabolism and lignin biosynthesis:From weeds to trees[J]. Trends in Plant Science,1996,1(6):171-178.
[26]杨海涛,谢益民. 木质素脱氢聚合物生物合成的探讨[J]. 林产化学与工业,2008,28(1):1-5.
[27]赵华燕,魏建华,宋艳茹. 木质素生物合成及其基因工程研究进展[J]. 植物生理与分子生物学学报,2004,30(4):361-370.
[28]FREUDENBERG K,NEISH A C. Constitution and biosynthesis of lignin[J]. Constitution and Biosynthesis of Lignin,1968,1(6):171-178.
[29]DAVIN L B,LEWIS N G. Dirigent proteins and dirigent sites explain the mystery of specificity of radical precursor coupling in lignan and lignin biosynthesis[J]. Plant Physiology,2000,123(2):453-462.
[30]DAVIN L B,LEWIS N G. Lignin primary structures and dirigent sites[J]. Current Opinion in Biotechnology,2005,16(4):407-415.
[31]DAVIN L B,WANG H B,CROWELL A L,et al. Stereoselective bimolecular phenoxy radical coupling by an auxiliary(dirigent) protein without an active center[J]. Science,1997,275(5298):362-367.
[32]FREUDENBERG K. Lignin:Its constitution and formation fromp-hydroxycinnamyl alcohols[J]. Science,1965,148(3670):595-600.
[33]SARKANEN K V,LUDWIG C H. Lignins:Occurrence,formation,structure and reactions[M]. New York:Wiley-Interscience,1971.
[34]TERASHIMA N,FUKUSHIMA K,HE L F,et al. Comprehensive model of the lignified plant cell wall[J]. Forage Cell Wall Structure and Digestibility,1993,23(13):247-270.
[35]TERASHIMA N,ATALLA R H,RALPH S A,et al. New preparations of lignin polymer models under conditions that approximate cell wall lignification. I. Synthesis of novel lignin polymer models and their structural characterization by13C NMR[J]. Holzforschung:International Journal of the Biology,Chemistry,Physics and Technology of Wood,1995,49(6):521-527.
[36]RUEL K,BERRIO-SIERRA J,DERIKVAND M M,et al. Impact of CCR1 silencing on the assembly of lignified secondary walls inArabidopsisthaliana[J]. New Phytologist,2009,184(1):99-113.
[37]ANTEROLA A M,LEWIS N G. Trends in lignin modification:A comprehensive analysis of the effects of genetic manipulations/mutations on lignification and vascular integrity[J]. Phytochemistry,2002,61(3):221-294.
[38]RALPH J,BRUNOW G,HARRIS P J,et al. Lignification:Are lignins biosynthesized via simple combinatorial chemistry or via proteinaceous control and template replication[J]. Recent Advances in Polyphenol Research,2008,124(6):36-66.
[39]RALPH J. Hydroxycinnamates in lignification[J]. Phytochemistry Reviews,2010,9(1):65-`83.
[40] BRUNOW G. Methods to reveal the structure of lignin[J]. Biopolymers Online,2001,15(1):89-93.
[41]ZHANG A P,LU F C,SUN R C,et al. Ferulate-coniferyl alcohol cross-coupled products formed by radical coupling reactions[J]. Planta,2009,229(5):1099-1108.
[42]蔺占兵,马庆虎,徐洋. 木质素的生物合成及其分子调控[J]. 自然科学进展,2003,13(5):455-461.
[43]刘晓娜,刘雪梅,杨传平,等. 木质素合成研究进展[J]. 中国生物工程杂志,2007,27(3):120-126.
[44]SAKAKIBARA A. A structural model of softwood lignin[J]. Wood Science and Technology,1980,14(2):89-100.
[45]ROBLIN J P,DURAN H,DURAN E,et al. X-ray structure of a trimeric 5,5′-biaryl/erythro-β-O-4-ether lignin model:Evidence for through-space weak interactions[J]. Chemistry:A European Journal,2000,6(7):1229-1235.
[46]CRESTINI C,JURASEK L,ARGYROPOULOS D S. On the mechanism of the laccase-mediator system in the oxidation of lignin[J]. Chemistry:A European Journal,2003,9(21):5371-5378.
[47]KISHIMOTO T,URAKI Y,UBUKATA M. Chemical synthesis ofβ-O-4 type artificial lignin[J]. Organic & Biomolecular Chemistry,2006,4(7):1343-1347.
[48]SERGEEV A G,HARTWIG J F. Selective,nickel-catalyzed hydrogenolysis of aryl ethers[J]. Science,2011,332(6028):439-443.
[49]WATANABE T,KAWAMOTO H,SAKA S. Pyrolytic reactivities of deuteratedβ-ether-type lignin model dimers[J]. Journal of Analytical and Applied Pyrolysis,2015,112(20):23-28.
[50]LANDUCCI L L. Reaction ofp-hydroxycinnamyl alcohols with transition metal salts 3. Preparation and NMR characterization of improved DHPs[J]. Journal of Wood Chemistry and Technology,2000,20(3):243-264.
[51]FREUDENBERG K. Beiträge zur erforschung des lignins[J]. Angewandte Chemie,1956,68(16):508-512.
[52]HATFIELD R,VERMERRIS W. Lignin formation in plants. The dilemma of linkage specificity[J]. Plant Physiology,2001,126(4):1351-1357.
[53]VANHOLME R,MORREEL K,RALPH J,et al. Lignin engineering[J]. Current Opinion in Plant Biology,2008,11(3):278-285.
[54]GRABBER J H,HATFIELD R D,RALPH J. Apoplastic pH and monolignol addition rate effects on lignin formation and cell wall degradability in maize[J]. Journal of Agricultural and Food Chemistry,2003,51(17):4984-4989.
[55]VOM STEIN T,DEN HARTOG T,BUENDIA J,et al. Ruthenium-catalyzed C—C bond cleavage in lignin model substrates[J]. Angewandte Chemie International Edition,2015,54(20):5859-5863.
[56]ZAKZESKI J,JONGERIUS A L,WECKHUYSEN B M. Transition metal catalyzed oxidation of Alcell lignin,soda lignin,and lignin model compounds in ionic liquids[J]. Green Chemistry,2010,12(7):1225-1236.
[57]CHAKAR F S,RAGAUSKAS A J. Review of current and future softwood kraft lignin process chemistry[J]. Industrial Crops and Products,2004,20(2):131-141.
[58]COMINELLI E,SALA T,CALVI D,et al. Over-expression of the Arabidopsis AtMYB41 gene alters cell expansion and leaf surface permeability[J]. The Plant Journal,2008,53(1):53-64.
[59]CHU S,SUBRAHMANYAM A V,HUBER G W. The pyrolysis chemistry of aβ-O-4 type oligomeric lignin model compound[J]. Green Chemistry,2013,15(1):125-136.
[60]ADLER E,LINDGREN B O,SAEDEN U. The beta-guaiacyl ether of alpha-veratrylglycerol as a lignin moolel[J]. Svensk Papperstidn,1952,55(6):238-241.
[61]KRATZL K,KISSER W,GRATZL J,et al. Derβ-guajacyläther des guajacylglycerins,seine umwandlung in coniferylaldehyd und verschiedene andere arylpropanderivate[J]. Monatshefte Für Chemie Und Verwandte Teile Anderer Wissenschaften,1959,90(6):771-782.
[62]KATAYAMA T,NAKATSUBO F,HIGUCHI T. Degradation of arylglycerol-β-aryl ethers,lignin substructure models,byFusariumsolani[J]. Archives of Microbiology,1981,130(3):198-203.
[63]SHEN X H,HEININGEN A V. Synthesis ofβ-O-4 lignin model dimers and their chlorinated derivatives[J]. Canadian Journal of Chemistry,1992,70(6):1754-1761.
[64]MOSTAGHNI F,TEIMOURI A,MIRSHOKRAEI S A. Synthesis,spectroscopic characterization and DFT calculations ofβ-O-4 typelignin model compounds[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2013,110:430-436.
[65]LUNDQUIST K,STOMBERG R,VON UNGE S. Stereochemical assignment of the threo and erythroforms of 2-(2,6-dimethoxyphenoxy)-1-(3,4-dimethoxyphenyl)-1,3-propanediol from X-ray analyses of the synthetic intermediates (2)-2-(2,6-dimethoxyphenoxy) 3-(3,4-dimethoxyphenyl)-2-propenoic acid and threo-2-(2,6-dimethoxyphenoxy)-3-(3,4-dimethoxyphenyl)-3-hydroxypropanoic acid[J]. Acta Chemica Scandinavica. Series B. Organic Chemistry and Biochemistry,1987,41(7):499-510.
[66]SON S,TOSTE F D. Non-oxidative vanadium-catalyzed C—O bond cleavage:Application to degradation of lignin model compounds[J]. Angewandte Chemie International Edition,2010,49(22):3791-3794.
[67]RALPH J,CONESA M T G,WILLIAMSON G. Simple preparation of 8-5-coupled diferulate[J]. Journal of Agricultural and Food Chemistry,1998,46(7):2531-2532.
[68]ALVES V L,DRUMOND M G,STEFANI G M,et al. Synthesis of new trimeric lignin model compounds containing 5-5′ and beta-O-4′ substructures,and their characterization by 1D and 2D NMR techniques[J]. Journal of the Brazilian Chemical Society,2000,11(5):467-473.
[69]OUYANG X P,LIU C L,PANG Y X,et al. Synthesis of a trimeric lignin model compound composed ofα-O-4 andβ-O-4 linkages under microwave irradiation[J]. Chinese Chemical Letters,2013,24(12):1091-1094.
[70]KISHIMOTO T,URAKI Y,UBUKATA M. Chemical synthesis ofβ-O-4 type artificial lignin[J]. Organic & Biomolecular Chemistry,2006,4(7):1343-1347.
[71]FORSYTHE W G,GARRETT M D,HARDACRE C,et al. An efficient and flexible synthesis of model lignin oligomers[J]. Green Chemistry,2013,15(11):3031-3038.
[72]RALPH J,QUIDEAU S,GRABBER J H,et al. Identification and synthesis of new ferulic acid dehydrodimers present in grass cell walls[J]. Journal of the Chemical Society,1994,1(23):3485-3498.
[73]MESTER T,AMBERT-BALAY K,CIOFI-BAFFONI S,et al. Oxidation of a tetrameric nonphenolic lignin model compound by lignin peroxidase[J]. Journal of Biological Chemistry,2001,276(25):2985-2990.
[74]HYATT J A. Synthesis of some tetrameric lignin model compounds containingβ-O-4 and 5,5′-interunit linkages[J]. Holzforschung,1987,41(6):363-370.
[75]CASTELLAN A,COLOMBO N,CUCUPHAT C,et al. Photodegradation of lignin:A photochemical study of a phenolicα-carbonylβ-O-4 lignin model dimer 4-hydroxy-3-methoxy-α-(2′-methoxyphenoxy)-acetophenone[J]. Holzforschung,1989,43(3):179-185.
[77]KISHIMOTO T,URAKI Y,UBUKATA M. Synthesis ofβ-O-4-type artificial lignin polymers and their analysis by NMR spectroscopy[J]. Organic & Biomolecular Chemistry,2008,6(16):2982-2987.
[78]GRATZL J,FRIED-MATZKA M,MIKSCHE G E. Two diastereomeric forms of guaiacylglycerolβ-(2-methoxyphenyl) ether and of guaiacylglycerol[J]. Acta Chemica Scandinavica,1966,48(20):1038-1043.
[79]KISHIMOTO T,URAKI Y,UBUKATA M. Easy synthesis ofβ-O-4 type lignin related polymers[J]. Organic & Biomolecular Chemistry,2005,3(6):1067-1073.
[80]KISHIMOTO T,URAKI Y,UBUKATA M. Synthesis ofβ-O-4-type artificial lignin polymers and their analysis by NMR spectroscopy[J]. Organic & Biomolecular Chemistry,2008,6(16):2982-2987.
[81]KATAHIRA R,KAMITAKAHARA H,TAKANO T,et al. Synthesis ofβ-O-4 type oligomeric lignin model compound by the nucleophilic addition of carbanion to the aldehyde group[J]. Journal of Wood Science,2006,52(3):255-258.
[82]RUGGIERO S G,CASTELLAN A,COTRAIT M,et al. Luminescence properties and spatial arrangement of lignin model molecules in the solid. Part 1. Crystal structures of 5,5′-diacetyl-2,2′-dibenzyloxy-3,3′-dimethoxybiphenyl and 2,2′-dibenzyloxy-5,5′-diformyl-3,3′-dimethoxybiphenyl and their phosphorescence emission[J]. Journal of Molecular Structure,1997,435(1):77-87.
