固相萃取-高效液相色谱-二极管阵列/荧光检测器串联法快速检测汁用甜橙中9种多甲氧基黄酮成分
2018-02-28李贵节谭祥翟雨淋程玉娇王珺王华RUSSELLLEEROUSEFF吴厚玖
李贵节,谭祥,翟雨淋,4,程玉娇,王珺,王华*,RUSSELL LEE ROUSEFF ,3,吴厚玖
1(西南大学 柑桔研究所,重庆,400712) 2(重庆市功能性食品协同创新中心,重庆第二师范学院,重庆,400067) 3(西南大学食品科学学院,重庆,400715) 4(西南大学植物保护学院,重庆,400715)5(生物与化学工程学院,重庆第二师范学院,重庆,400067)
甜橙(CitrussinensisOsbeck)是全球消费量最大、栽培量最多的柑橘类群,因其特征性的酸甜口感和较高的营养价值深受人们的喜爱[1]。除了果实的加工性能、营养成分和口感风味等项目,其所含功能性物质也逐渐成为考察的备选项。
多甲氧基黄酮(polymethoxyflavones, PMFs)是柑橘果实中特有的类黄酮,其共性是多个羟基甲基化[2];该类物质比其他植物性黄酮有更高的生物利用度和生理作用,具有明确的抗癌活性和降血脂功能[3-5]。PMFs主要富集于果皮油胞层中,现已分离鉴别出数十种,常见有川陈皮素、橘皮素、甜橙黄酮、七甲氧基黄酮等[6]。甜橙含有丰富的多甲氧基黄酮资源,其果肉、果汁中的含量虽然与果皮相比甚微,然而不论是鲜食还是汁用,其日常消费量大且几乎伴随一生,因此人们摄入的PMFs总量相当可观。因此有必要对不同品种甜橙果汁中PMFs的种类和含量进行分析检测,以了解其差异性。
对于PMFs的分析和检测,传统上是用高效液相色谱搭配二极管阵列检测器(HPLC-DAD)[7-11]。该方法仪器设备简单、具有一定的定性能力,但仪器检测限较高,特别对于PMFs含量低、干扰物较复杂的橙汁来说,容易出现无法检出的情况。近年来,越来越多的研究采用高效液相色谱串联质谱(HPLC-MS/MS)法[12-15],串联质谱的突出优点在于灵敏度高、选择性好、定性准确,对于复杂样品色谱分离的要求大大降低。然而,HPLC-MS/MS价格昂贵、运行成本高、操作复杂、分析周期长,且不具备便携性,无法进行现场快速分析。对于一个应用型分析检测方法的开发,这些因素需要充分考虑在内。
固相萃取(SPE)是广泛应用在食品、生物、药学、环境等众多领域的样品前处理技术,具有提取浓缩目标物质、去除干扰物质、溶剂用量少、操作简单快速等优良性能[16]。利用SPE对甜橙汁中的PMFs进行富集和浓缩,在DAD的基础上再加入荧光检测器(FLD),通过对各个PMF物质的紫外和荧光特征光谱的获取,实现准确的定性分析,确定两种检测器定量分析的最佳条件,从而建立同时检测汁用甜橙中9种多甲氧基黄酮物质的快速、经济、实用的方法。
1 材料与方法
1.1 材料与试剂
汁用甜橙:共计11个品系。早熟甜橙,包括早熟长叶橙、渝早橙、早金和哈姆林;中熟甜橙,包括中熟长叶橙、鹅蛋柑(锦橙26号)、铜水72-1和特罗维塔;晚熟甜橙,包括晚熟长叶橙,德尔塔夏橙和奥林达夏橙。样品于2016年各自成熟期采自重庆市忠州区。固相萃取柱:HyperSep C18柱,德国Thermo-fisher Scientific公司;0.22 μm有机相微孔滤头:上海安谱科学仪器有限公司;H3PO4、甲醇、乙腈、乙酸乙酯、四氢呋喃:色谱纯,美国Sigma-Aldrich公司。标准对照品:异甜橙黄酮、甜橙黄酮、六甲氧基栎草亭、四甲氧基异野黄岑素、川陈皮素、四甲氧基野黄岑素、七甲氧基黄酮、5-去甲基川陈皮素、橘皮素等9种:其详细信息和结构简式见表1和图1。所有标准品经高效液相色谱串联质谱(TSQ Quantum,德国Thermo Scientific公司)检验确认,为其标称物质,达到标称纯度。

表1 多甲氧基黄酮标准物质信息
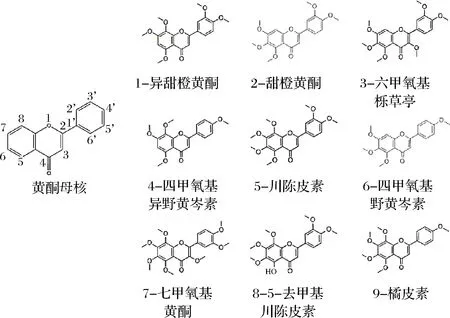
图1 九种多甲氧基黄酮结构简式Fig.1 Schematic structures of the nine polymethoxyflavones
1.2 仪器与设备
Ultimate 3000高效液相色谱仪串联二极管阵列检测器及荧光检测器(HPLC-DAD/FLD),德国Thermo Scientific公司;KQ5200DE超声清洗器,江苏昆山市超声仪器有限公司;VacMaster负压固相萃取系统,瑞典Biotage公司; HN200多功能氮吹仪,济南海能仪器股份有限公司;Milli-Q Reference超纯水系统,德国Merck-Millpore公司; MPZ9柑橘榨汁机,德国Braun公司。
1.3 方法
1.3.1 标准对照品溶液的配制
准确称取标准物质各5.00 mg,分别用甲醇溶解,并定容至5.00 mL,配成1.00 g/L的标准品储备液备用。吸取各储备液0.5 mL,混合并定容至5.00 mL,得到各物质质量浓度均为0.10 g/L的标准品混合溶液;逐级稀释得到一系列质量浓度分别为100、25、10、2.5、1、0.25、0.1 mg/L的混合标准品溶液。
1.3.2 橙汁前处理
SPE柱用5 mL甲醇活化、5 mL超纯水平衡备用。将甜橙洗净晾干后切半,利用锥式榨汁机手动榨取新鲜橙汁,经8层纱布粗滤,取适量滤后橙汁缓慢通过活化的SPE柱,以使柱床充分吸附PMFs等物质,再依次通入超纯水和清洗液(30%体积分数的乙腈水溶液)除去杂质;目标物质用5 mL乙酸乙酯洗脱,40°C经氮气吹干后用1 mL甲醇溶解,过0.22 μm微孔滤膜,制得 PMFs样品。
1.3.3 橙汁过柱体积-目标物质吸附总量曲线
将不同品种的橙汁等量均匀混合,以消除PMFs含量的种间差异。分别取5、10、15、20、25和30 mL混合橙汁过SPE柱,按前处理步骤制得不同浓度的PMFs样品。绘制PMFs响应值-过柱体积曲线,选择适宜的前处理体积。
1.3.4 色谱条件
色谱柱:Thermo Scientific Accucore C8(2.6 μm, 4.6 mm×50 mm);流动相:0.05% H3PO4溶液、甲醇和50%四氢呋喃溶液,流动相梯度见表2;检测器设置:DAD波长扫描范围为210~400 nm;FLD 激发波长扫描范围为250~400 nm,发射波长扫描范围为360~550 nm。其他设置:柱温30°C,流速1 mL/min,进样量5.0 μL 。
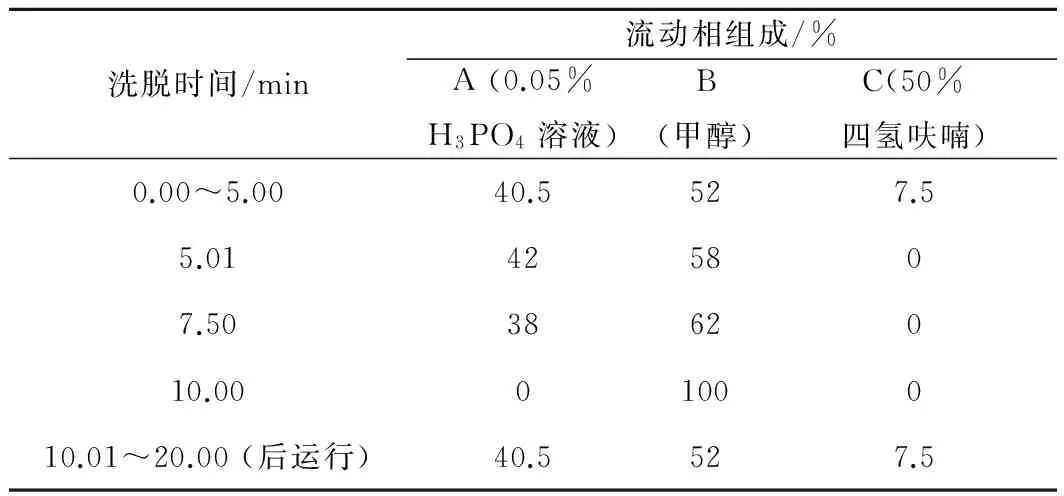
表2 HPLC流动相洗脱程序
1.3.5 样品成分的定性和定量分析
以紫外吸收光谱扫描图、荧光发射光谱扫描图以及色谱峰保留时间三者结合进行化合物的定性判断。采用外标法定量,检测波长的选择见下文。
2 结果、分析与讨论
2.1 紫外和荧光检测波长的选择
利用DAD和FLD对9种多甲氧基黄酮进行扫描,得到各物质的紫外吸收、荧光激发和发射光谱。如图2-A所示,9种PMFs的最大紫外吸收波长集中在320~345 nm;综合考虑各物质的紫外响应值,选择330 nm作为检测波长。荧光激发光谱与紫外光谱较为相似,故本处略去,选择340 nm为激发波长。图2-B显示该波长激发下,各物质的荧光发射光谱。由图2-B可知,四甲氧基异野黄岑素(4)、5-去甲基川陈皮素(8)和橘皮素(9)未检出荧光信号;异甜橙黄酮(1)和四甲氧基野黄岑素(6)为双峰,分别在400 nm和500 nm附近,且荧光强度显著低于其他物质;其他PMFs为单峰,最大响应值在450 nm附近。综合考虑选择450 nm和500 nm作为荧光检测波长。

图2 多甲氧基黄酮的紫外吸收光谱(A)和荧光发射光谱(B)Fig.2 UV absorbance spectra(A) and fluorescence emission spectra(B) of PMFs
2.2 色谱柱、流动相的选择和梯度条件优化
PMFs高度甲基化,极性中弱,使用C8键合相保留效果较好。PMFs含有相同的母核结构,性质较为接近,为实现其快速分离,在保证高柱效的前提下,需合理增大流速,同时又要避免反压超过HPLC的承压范围。综合以上因素,最终选用表面多孔实心填料短柱(2.6 μm, 4.6 mm×50 mm,Thermo Scientific Accucore)。该色谱柱为反相柱,采用C8填料,适用于中等极性到弱极性物质的分离。其最大特点在于,填料为部分多孔结构,即包含一个φ1.6 μm的实心核和0.5 μm厚的多孔外壳。与全多孔填料相比,该结构使分子运动路径更短,降低了被分离物质的轴向扩散,减小了色谱峰的展宽,从而获得更高的柱效和分辨率,同时将柱压维持在3×107Pa以下。
对于流动相,分别以水/甲醇(体积比50∶50)和水/乙腈(体积比60∶40)出发、对应的纯有机溶剂为终点,设置初始斜线梯度,并在此基础上分别对梯度进行调整。结果显示,水/甲醇体系下,川陈皮素(5)和四甲氧基野黄岑素(6)无法分离;水/乙腈体系下,(5)、(6)的分离度有所改善(≈1.0),但5-去甲基川陈皮素(8)和橘皮素(9)无法分离。因此再引入第3种组分四氢呋喃(THF),经系列调整确定水/甲醇/THF梯度洗脱能有效分离化合物1~7,但8、9分离效果仍不理想。从结构分析,5-去甲基川陈皮素(8)具有游离酚羟基,故可通过降低流动相pH调整其保留性质。由于H3PO4在各波长下均无显著紫外吸收,故采用色谱纯的H3PO4降低流动相的pH值,在优化的流动相组成和洗脱程序下(表2)。9种PMFs混标的紫外和荧光响应色谱图如图3所示。各物质峰型良好,在10 min内实现有效分离(分离度R>1.5);荧光信号以倒峰的形式呈现,以便更清晰的与紫外信号对应。
2.3 线性关系、检出限和定量限
在1.3.4色谱条件下,测定逐级稀释的混合标准溶液,以各物质响应的积分峰面积为纵坐标、质量浓度(mg/L)为横坐标,绘制标准曲线。测定仪器信噪比(S/N),当标准溶液稀释至信噪比3
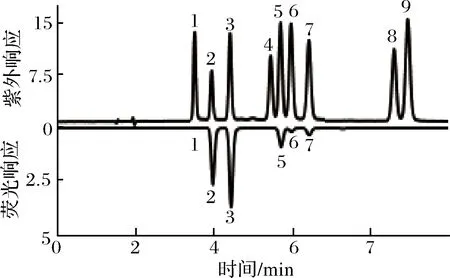
图3 多甲氧基黄酮混合标样的高效液相色谱图Fig.3 HPLC chromatogram of the mixed PMFs standard solution
表3紫外和荧光测定多甲氧基黄酮的线性关系、仪器检出限和定量限
Table3Linearrelativity,LODandLOQofthePMFsbyUVandfluorescenceexamination

多甲氧基黄酮UV测定值FL测定值线性范围/(mg·L-1)回归方程R2检出限/(mg·L-1)定量限/(mg·L-1)线性范围/(mg·L-1)回归方程R2检出限/(mg·L-1)定量限/(mg·L-1)异甜橙黄酮2.00~1000Y=2.59X-2.15b0.99980.1100.36630~1000Y=0.0325X-0.730.99941.8306.100甜橙黄酮4.00~1000Y=3.33X+0.231.00000.1840.6121.50~500Y=2.54X+0.111.00000.0840.280六甲氧基栎草亭1.50~500Y=1.57X+1.840.99990.0820.2721.50~500Y=0.478X+0.190.99950.0720.242四甲氧基异野黄岑素1.00~1000Y=2.87X+0.521.00000.0360.124-----川陈皮素1.50~1000Y=2.64X+4.410.99970.0600.2022.00~500Y=0.23X+0.490.99980.1020.338四甲氧基野黄岑素1.00~1000Y=5.19X+3.490.99960.0560.18810~1000Y=0.111X-1.440.99980.6042.014七甲氧基黄酮0.50~1000Y=5.29X+0.300.99990.0240.0785.00~500Y=0.21X-0.270.99960.2860.9545-去甲基川陈皮素1.00~500Y=2.41X+5.730.99990.0400.132-----橘皮素0.20~1000Y=6.88X+1.310.99980.0120.040-----
注:(1)异甜橙黄酮和四甲氧基野黄岑素的荧光信号在发射波长为500 nm处获得,其他荧光响应均在450 nm处采集(表4、表5同);(2)回归方程中Y为峰面积,X为物质浓度;-表示该物质没有荧光响应。
2.4 SPE前处理条件的确定
影响SPE前处理效果的因素有:键合相、柱体积、柱床填量、清洗液、洗脱液及过柱量等。考虑PMFs的性质、方法对快速前处理的要求以及成本控制,选用SPE柱规格为:C18键合相、6 mL柱体积,500 mg柱床填量。清洗除杂分为两步,先用超纯水去除残留橙汁的水溶性成分,如:糖类、有机酸、VC等;再用一定强度的溶剂去除吸附力较弱的干扰成分,如:黄酮苷、花色苷、类胡萝卜素等。就第二步清洗液的组成,分别考察体积分数为20%、30%、40%的甲醇和乙腈溶液,发现30%乙腈溶液除杂效果明显且对目标PMFs无洗脱作用。分别考察5 mL甲醇、乙腈、乙酸乙酯、三氯甲烷、异丙醇对PMFs的洗脱效率。结果表明,在1 mL/min流速下,5种溶剂均能将PMFs从SPE柱上完全洗脱;在2 mL/min流速下,甲醇洗脱不完全,其余4种溶剂能够完全洗脱。综合考虑毒性和挥发速率,选择乙酸乙酯为洗脱剂。
对于橙汁的过柱量,在避免柱床对目标物质吸附饱和的前提下,应尽量提高过柱体积以获得高浓度的最终样品,从而降低检测误差。过柱体积-目标物质吸附总量曲线见图4。其中PMFs吸附量由UV和FL响应分别表示,以橙汁所含总PMFs对应的峰面积为纵坐标单位。由图4可知,0~20 mL内,吸附量与过柱体积成良好的线性相关;进一步增加过柱体积,线性关系被破坏,最终洗脱得到的PMFs趋于恒定,说明大于20 mL上样使柱床吸附饱和,目标物质发生穿透现象而损失。考虑到加标回收实验的需要,SPE吸附量应留有至少一半的余量,故确定橙汁的过柱体积为10 mL。
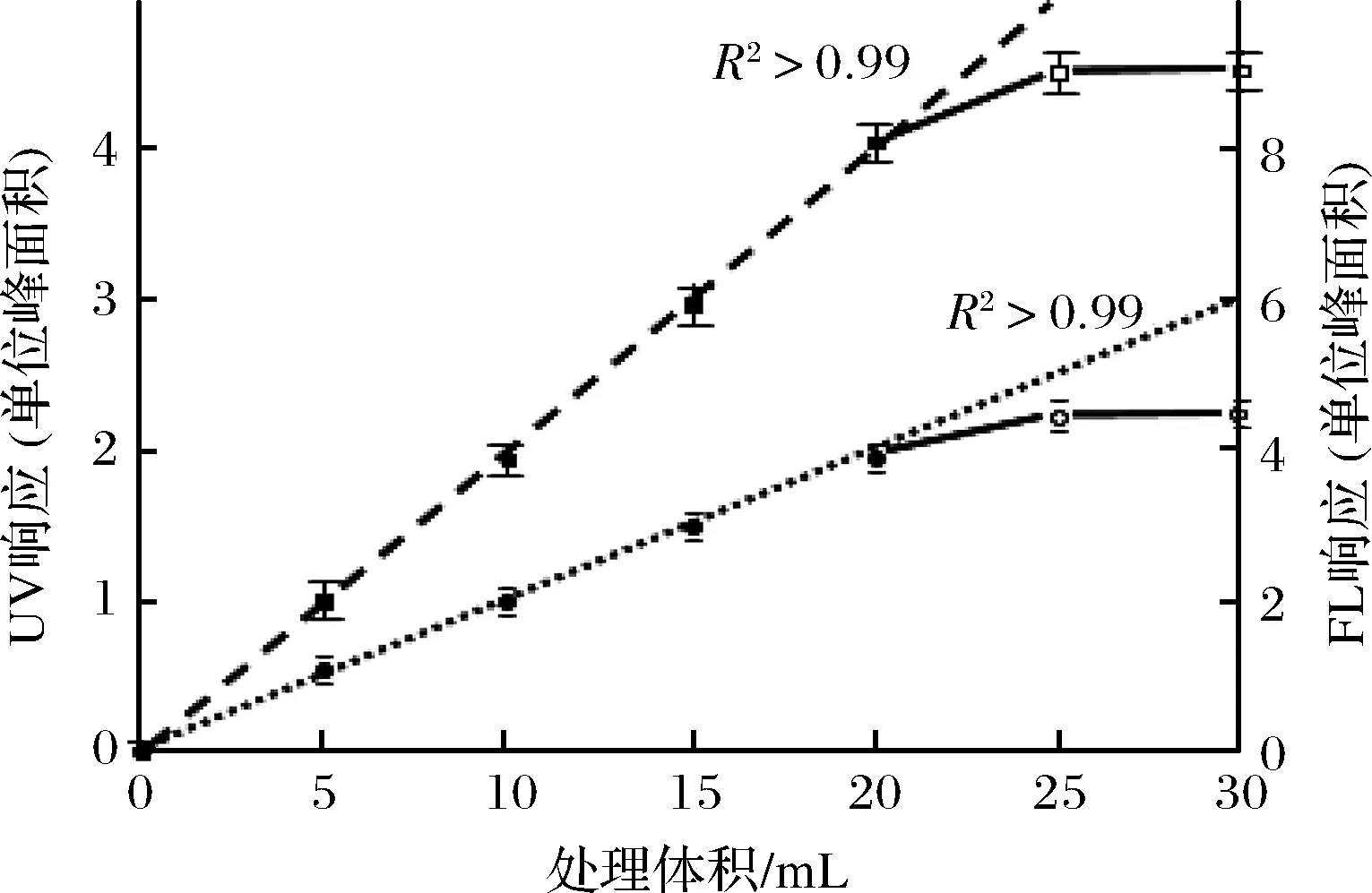
图4 固相萃取处理橙汁体积与最终样品中多甲氧基黄酮总响应值的关系Fig.4 Relationship between the processed volume of orange juice through SPE and the total response of PMFs in final HPLC samples注:■和●分别表示符合线性关系的紫外和荧光响应;□和○分别表示固相萃取柱吸附饱和时紫外和荧光响应。
2.5 重现性和精密度
混合橙汁经SPE前处理、HPLC-DAD/FLD法测定各PMF的本底含量。再分别以80%、100%、120%三个水平做加标回收实验,每个水平做3次重复测定,验证整套方法的重现性和精密度。结果如表4所示,各PMF回收率分别为UV: 96.4%~104.2%和FL: 94.2%~102.1%,相对标准偏差1.4%~5.9%和2.2%~7.6%。本方法准确度和精密性良好,UV和FL定量数据可相互验证,具有较高可信度。
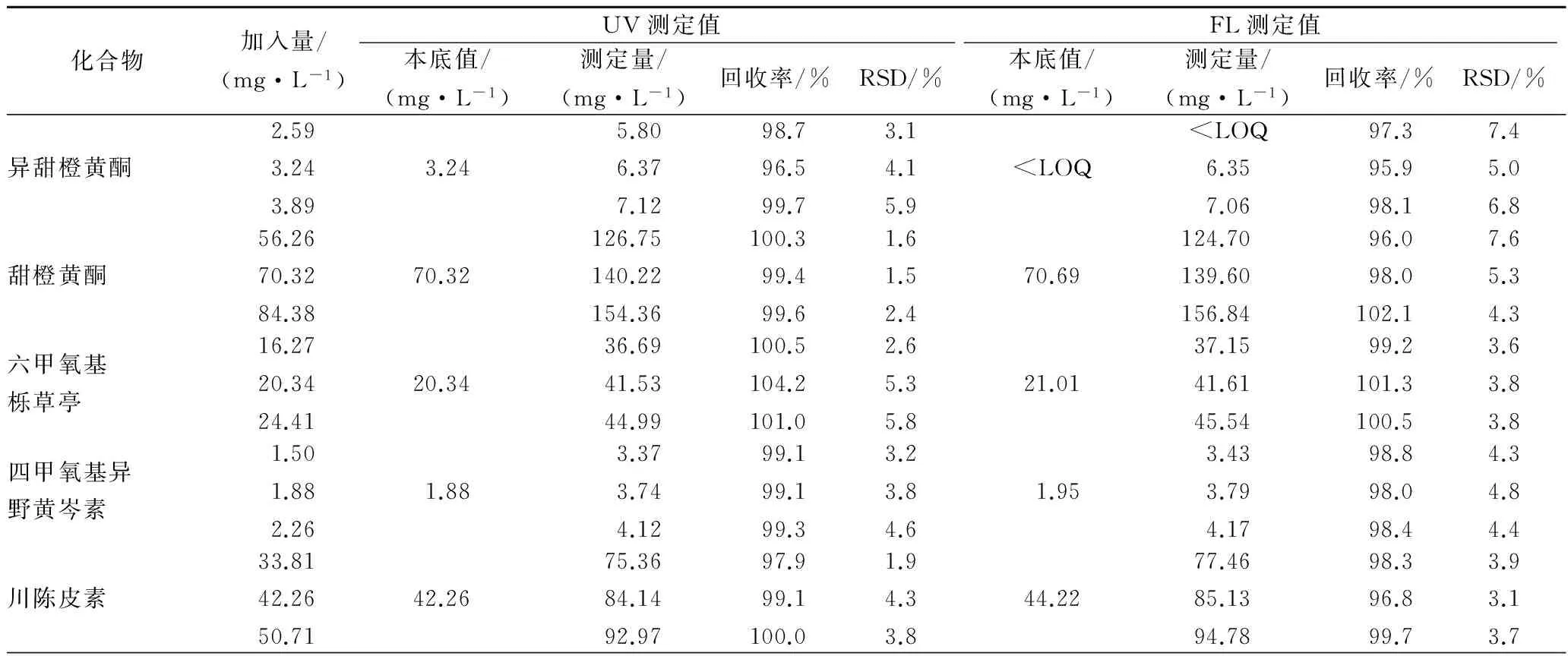
表4 甜橙混合果汁的多甲氧基黄酮回收率
续表4
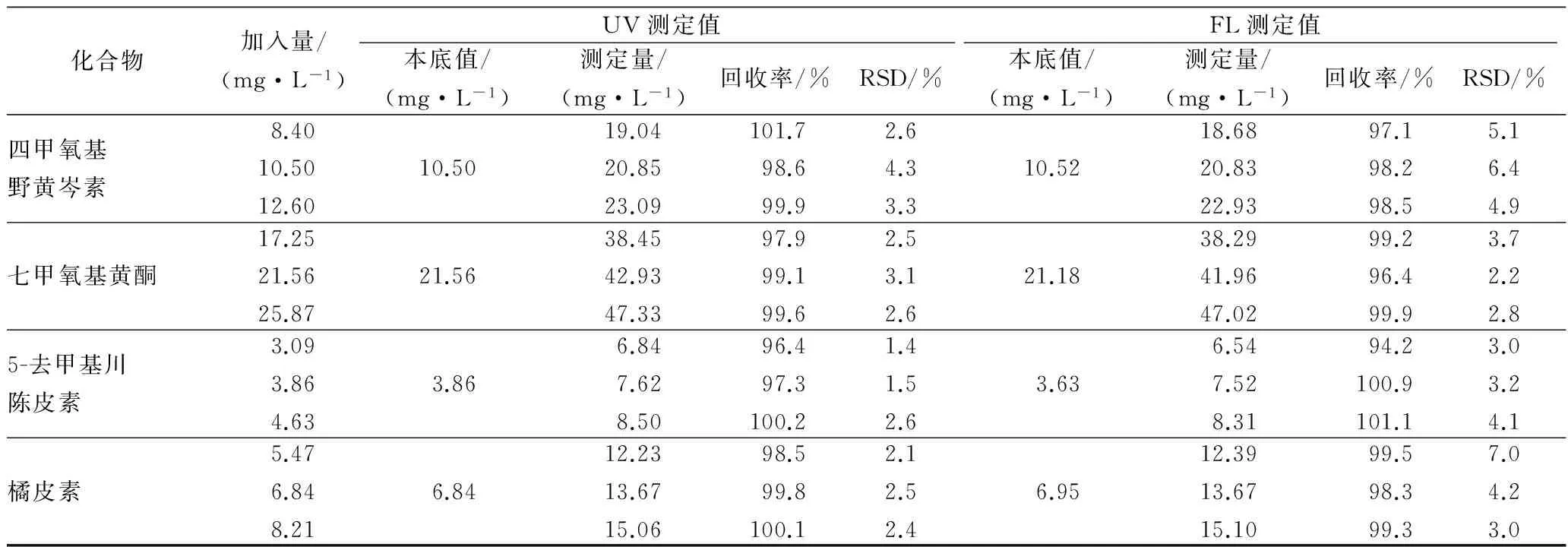
化合物加入量/(mg·L-1)UV测定值FL测定值本底值/(mg·L-1)测定量/(mg·L-1)回收率/%RSD/%本底值/(mg·L-1)测定量/(mg·L-1)回收率/%RSD/%四甲氧基野黄岑素8.4010.5012.6010.5019.0420.8523.09101.798.699.92.64.33.310.5218.6820.8322.9397.198.298.55.16.44.9七甲氧基黄酮17.2521.5625.8721.5638.4542.9347.3397.999.199.62.53.12.621.1838.2941.9647.0299.296.499.93.72.22.85-去甲基川陈皮素3.093.864.633.866.847.628.5096.497.3100.21.41.52.63.636.547.528.3194.2100.9101.13.03.24.1橘皮素5.476.848.216.8412.2313.6715.0698.599.8100.12.12.52.46.9512.3913.6715.1099.598.399.37.04.23.0
2.6 应用实例
用建立的SPE-HPLC-DAD/FLD法对11个常见汁用甜橙品系的果汁PMFs进行定性和定量测定。如图5所示,经SPE前处理后,各样品的UV和FL色谱峰型正常、分离度良好,杂质峰较少且集中在前3 min范围内,对目标物质分析干扰小。在此基础上,结合紫外光谱、荧光发射光谱和保留时间3种不同的手段定性,方法如下:各PMF标准物质的光谱信息互不相同,具有其特征性(图2);据此建立PMFs的UV/FL光谱数据库,将样品中目标峰的光谱与库中已知标准物质进行对比,再加上色谱峰保留时间的对应关系,从而准确判定该目标物质是否为已知PMF。
同时测定UV和FL响应值,采用外标法对样品中的PMFs定量分析,根据SPE前处理的富集倍数,计算汁用甜橙果汁中各物质的含量,结果见表5。2种信号的定量结果吻合度良好,相对平均偏差为0.03%~5.42%。数据显示,汁用甜橙果汁中总PMFs的平均含量为mg/L级;甜橙黄酮(2)是所有品系中含量最高的PMF,川陈皮素(5)含量次之,两者之和占橙汁总PMFs含量的50%以上,为其主要成分。MOULY等[17]利用C18SPE前处理和HPLC-DAD法对市售60种橙汁进行了PMFs含量分析,其结果与本实验数据处于同一数量级,但各PMF浓度均值普遍较低,且川陈皮素含量高于甜橙黄酮。这些差别也从侧面反映出加工甜橙品种选择对于橙汁品质的重要性。11个品系间比较,渝早橙PMFs总含量最高,为鹅蛋柑的10倍以上,加之其早熟的特性,具有进一步研究开发的潜力。
3 结论
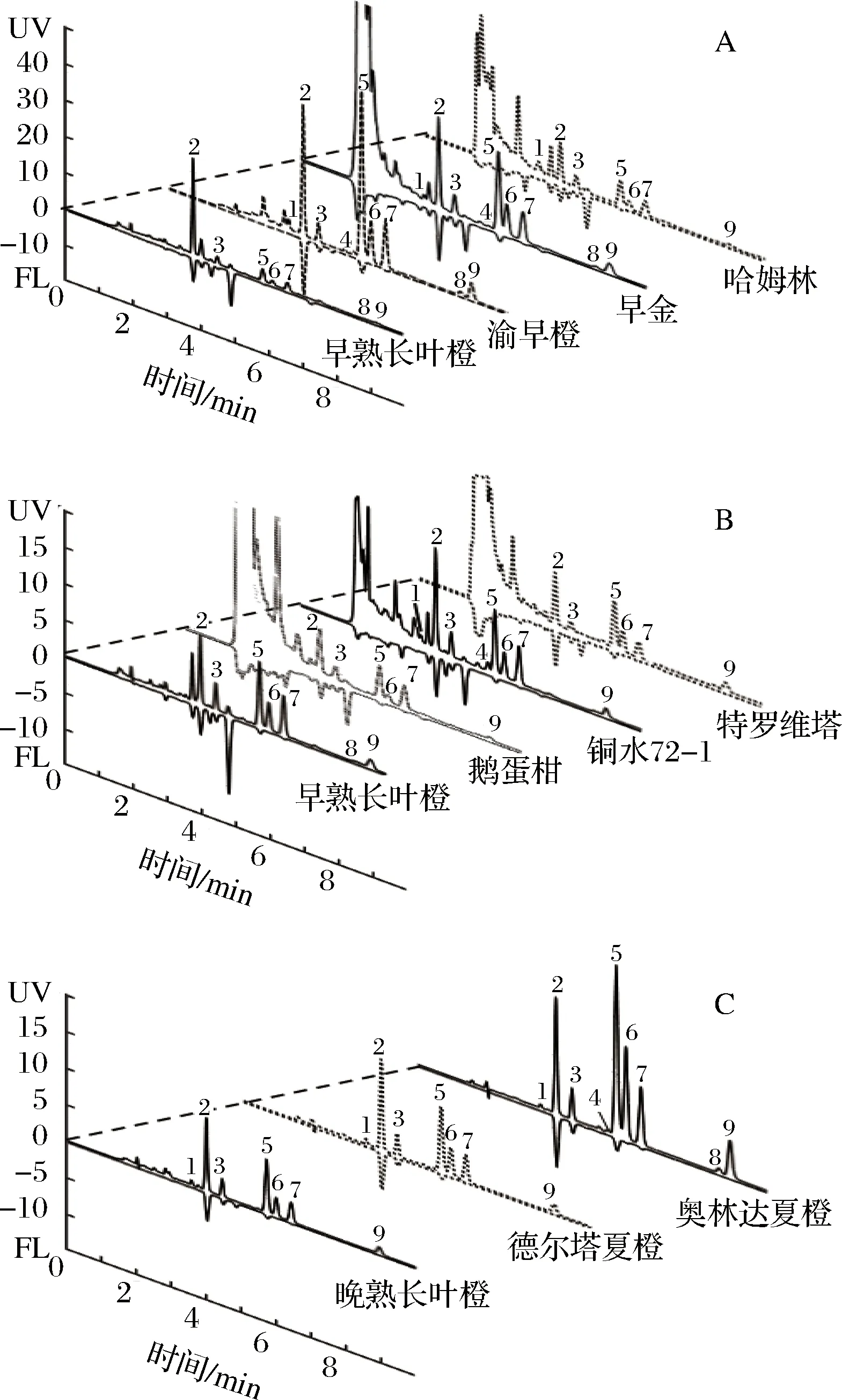
A-早熟品系;B-中熟品系;C-晚熟品系图5 11种汁用甜橙果汁样品中所含多甲氧基黄酮的高效液相色谱图Fig.5 HPLC chromatograms of PMFs contained in eleven juice-producing sweet orange juice samples
建立了SPE-HPLC-DAD/FLD快速前处理甜橙汁及检测其中9种多甲氧基黄酮成分的方法。前处理利用C18柱固相萃取,在去除杂质干扰的同时实现果汁样品中微量PMFs的富集,间接提升了样品检测的灵敏度。以0.05%磷酸、甲醇、50%四氢呋喃为流动相,使用表面多孔实心填料C8柱进行反相HPLC梯度洗脱,9种PMFs在10 min内实现快速分离。DAD和FLD的同时使用,从光谱学角度为样品中目标物质的定性提供了判断依据。在UV吸收波长330 nm,FL激发波长340 nm、发射波长450和500 nm的条件下,同时对样品PMFs定量分析,两者结果一致性良好。该方法定量限达mg/L级加标回收率为96.4%~104.2%(UV)和94.2%~102.1%(FL),具有良好的精密度和重现性。对11个品系的汁用甜橙进行了分析,利用该方法能满足常规HPLC对橙汁中微量PMFs的快速定量检测要求。

表5 11种汁用甜橙原汁中多甲氧基黄酮含量
注:根据SPE富集倍数,原汁浓度由最终制备样品的实测浓度换算而来,保留3位有效数字; ND为未检出(低于检测限), [1] 杨子玉, 唐颂, 任婧楠, 等. 不同品种柑橘汁胞的品质比较研究 [J]. 食品工业科技, 2015(13): 121-125. [2] LI Shi-ming, PAN MIN-HSING, LO CHIH-YU, et al. Chemistry and health effects of polymethoxyflavones and hydroxylated polymethoxyflavones[J]. Journal of Functional Foods, 2009, 1(1): 2-12. [3] MANTHEY J A, GUTHRIE N. Antiproliferative activities of citrus flavonoids against six human cancer cell lines[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 5 837-5 843. [4] 王巧玲, 贾绍华. 川陈皮素抗癌作用及机制的研究进展 [J]. 中草药, 2009(s1): 40-42. [5] EVANS M, GUTHRIE N, SHARMA P. Bioavailability of Citrus Polymethoxylated Flavones and Their Biological Role in Metabolic Syndrome and Hyperlipidemia[M]. INTECH Open Access Publisher, 2012: 276-281. [6] 付陈梅, 吴桂苹, 苏学素, 等. 液相色谱法测定柑橘果实中类黄酮的方法研究[J]. 食品与发酵工业, 2008, 34(2): 121-125. [7] 冉玥, 焦必宁, 赵其阳, 等. 超高效液相色谱法同时测定柑橘中 11 种类黄酮物质 [J]. 食品科学, 2013, 34(4): 168-172. [8] 章翀玮, 魏东芝, 周文瑜, 等. 柑橘类黄酮成分的同步 HPLC 检测 (英文) [J]. 中成药, 2007, 29(1): 99-104. [9] MOULY P, GAYDOU E M, AUFFRAY A. Simultaneous separation of flavanone glycosides and polymethoxylated flavones in citrus juices using liquid chromatography [J]. J Chromatogr A, 1998, 800(2): 171-179. [10] OOGHE W C, OOGHE S J, DETAVERNIER C L M, et al. Characterization of orange juice (Citrussinensis) by polymethoxylated flavones [J]. J Agr Food Chem, 1994, 42(10): 2 191-2 195. [11] PUPIN A M, DENNIS M J, TOLEDO M C F. Polymethoxylated flavones in Brazilian orange juice [J]. Food Chem, 1998, 63(4): 513-518. [12] ZHANG Jia-yu, LU Jian-qiu, GAO Xiao-yan, et al. Characterization of thirty-nine polymethoxylated flavonoids (PMFs) in the branches of Murraya paniculata by HPLC-DAD-ESI-MS/MS [J]. Chin J Nat Med, 2014, 11(1): 63-70. [13] CHO H E, AHN S Y, KIM S C, et al. Determination of flavonoid glycosides, polymethoxyflavones, and coumarins in herbal drugs of citrus and poncirus fruits by high performance liquid chromatography-electrospray ionization/tandem mass spectrometry [J]. Anal Lett, 2014, 47(8): 1 299-1 323. [14] ZHANG Jia-yu, ZHANG Qian, ZHANG Hong-xia, et al. Characterization of polymethoxylated flavonoids (PMFs) in the peels of 'Shatangju' mandarin (CitrusreticulataBlanco) by online high-performance liquid chromatography coupled to photodiode array detection and electrospray tandem mass spectrometry [J]. J Agric Food Chem, 2012, 60(36): 9 023-9 034. [15] CHEN Hai-fang, ZHANG Wu-gang, YUAN Jin-bin, et al. Simultaneous quantification of polymethoxylated flavones and coumarins in Fructus aurantii and Fructus aurantii immaturus using HPLC-ESI-MS/MS [J]. J Pharmaceut Biomed, 2012(59): 90-95. [16] 黄明发, 苏学素, 焦必宁, 等. 柑橘多甲氧基黄酮的检测及分离纯化技术研究进展 [J]. 食品科学, 2009(1): 275-281. [17] MOULY P P, GAYDOU E M, ARZOUYAN C. Separation and quantitation of orange juices using liquid chromatography of polymethoxylated flavones [J]. Analusis, 1999, 27(3): 284-288.
