高产β-葡萄糖苷酶野生酵母的快速筛选及其糖苷酶酿造适应性研究
2018-02-27马得草李爱华陶永胜
马得草,游 灵,李爱华,牟 含,陶永胜,3
(1西北农林科技大学 a葡萄酒学院,b食品科学与工程学院,陕西 杨凌712100;2宜宾学院 生命科学与食品工程学院,四川 宜宾644000;3陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌712100)
酿酒酵母(Saccharomycescerevisiae)由于具有较强的酒精和二氧化硫耐受性及发酵较为纯净的优点,在葡萄酒酒精发酵过程中被大量使用[1]。令人担忧的是,越来越多的酒庄和酿酒师采用酿酒酵母干粉启动发酵,使葡萄酒的品质风格面临单一化,葡萄酒产品有丧失葡萄本身品种特性和地域风格的危险[2-3]。葡萄酒香气特征是产品风格的重要呈现形式,葡萄酒的典型风味主要来源于葡萄本身丰富的糖苷类香气前体物质,它们通常需经过酸解或者酶解释放出游离态香气成分后才能表现出香气特征[4-5]。在葡萄酒酿造过程中,主要是酶促水解促进葡萄品种香气特征的形成,而水解香气糖苷形成挥发性香气成分的关键酶是β-葡萄糖苷酶。葡萄果粒和酿酒酵母是常规酿造过程中酶促反应主要酶的来源,但是典型的葡萄酒生产条件,如高糖、高酒精、低pH值和高浓度多酚等,限制了葡萄与酿酒酵母中糖苷酶的活性[6]。研究表明,某些野生酵母分泌的β-葡萄糖苷酶能够适应葡萄酒酿造环境,更充分地水解这些糖苷类物质[7-8],因此许多酿酒师开始注重这些优选野生酵母在酿酒中的应用[9-13]。
我国幅员辽阔,各地生态资源差异很大,野生酵母种属资源颇多。此外我国是白酒、啤酒产业大国,葡萄酒产业也已迅速成长,不同酿酒环境中也蕴含着大量适宜酿酒的酵母菌资源,筛选优良的野生酵母菌株并研究其酿酒特性对于酒类产业发展具有重要意义。对于高产β-葡萄糖苷酶酵母的筛选,一般实验室条件下经济适用的筛选方法是采用对硝基苯基葡萄糖苷(p-NPG)水解法,通过培养液的光谱吸收值计算酶活性[12],如果没有酶标仪的辅助,该法不适宜大量样本的快速筛选。因为野生酵母资源常常在野外采样,且中小型酒庄实验室条件有限,所以亟待开发简单、快捷的高产β-葡萄糖苷酶酵母的筛选方法。在河西走廊葡萄自然发酵环境下,侯晓瑞等[14]通过含p-NPG的培养基平板上黄色透明圈直径大小及颜色深浅,从115株野生酵母中初筛出44株高产β-葡萄糖苷酶的酵母菌株,但是该法效率仍需改进。本研究根据β-葡萄糖苷酶可以将七叶苷水解为七叶苷原并与Fe3+作用显棕黑色的原理,结合96孔板的酵母培养液试管,设计建立基于七叶苷半定量比色法的高产β-葡萄糖苷酶酵母菌株快速筛选方法,并研究优选菌株β-葡萄糖苷酶对葡萄酒酿造环境的适应性,旨在为具有高产β-葡萄糖苷酶菌株的筛选及其在酿酒产业中的应用提供依据。
1 材料与方法
1.1 供试菌株
供试的133株野生酵母菌株从四川宜宾多家浓香型白酒酒窖(糟醅、窖泥、曲房)中分离,于-20 ℃、体积分数40%甘油中保藏。
1.2 主要仪器与试剂
主要仪器:酶标仪(SpectraMax M2,美国Molecular Devices公司)、无菌操作台(SW-CJ-1FD,中国苏净安泰公司)、冷冻高速离心机(22331 Hamburg,德国Eppendorf 公司)、显微镜(Olympus BX51TF,日本Olympus公司)、微量紫外分光光度计(Nanodrop 1000,美国Thermo scitific公司)、电泳仪(DYY-8C型,北京六一仪器厂)、全自动凝胶成像分析系统(ChampGe I 5000增强型,北京赛智创业有限公司)。
所用试剂:七叶苷、对硝基苯酚、对硝基苯基葡萄糖苷(p-NPG),上海源叶生物科技有限公司;Premix Ex TaqTM、6×DNA Loading Buffer、2000 bp DNA Marker、引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)[15],购于大连宝生物公司;无水碳酸钠、柠檬酸、磷酸二氢钠,均为分析纯,购于天津化学试剂有限公司。
培养基:七叶苷筛选培养基(七叶苷3 g/L,柠檬酸铁0.5 g/L,NaCl 2 g/L,MgSO4·7H2O 0.5 g/L,KH2PO41 g/L,琼脂20 g/L)。其他培养基,如YEPD液体培养基、WLN固体培养基、扩增培养基、发酵培养基[16-17]。
1.3 七叶苷半定量显色法初筛菌株
根据β-葡萄糖苷酶可以将七叶苷水解为七叶苷原,七叶苷原与Fe3+作用显棕黑色的原理,使用半定量比色方法对菌株进行初筛。将活化的菌株接种到96孔板上的七叶苷培养基中,28 ℃培养72 h后,根据显色结果将颜色定义为最高酶活性(深黑“++++”)、高酶活性(黑“+++”)、中酶活性(深灰“++”)、低酶活性(灰“+”)和无酶活性(白“-”) 5种显色水平,原理如图1。通过目测比色法从133株野生酵母菌株中挑选出10~20株显色水平有差异的产β-葡萄糖苷酶菌株,检测β-葡萄糖苷酶活性,评价七叶苷半定量显色法的筛选效果。
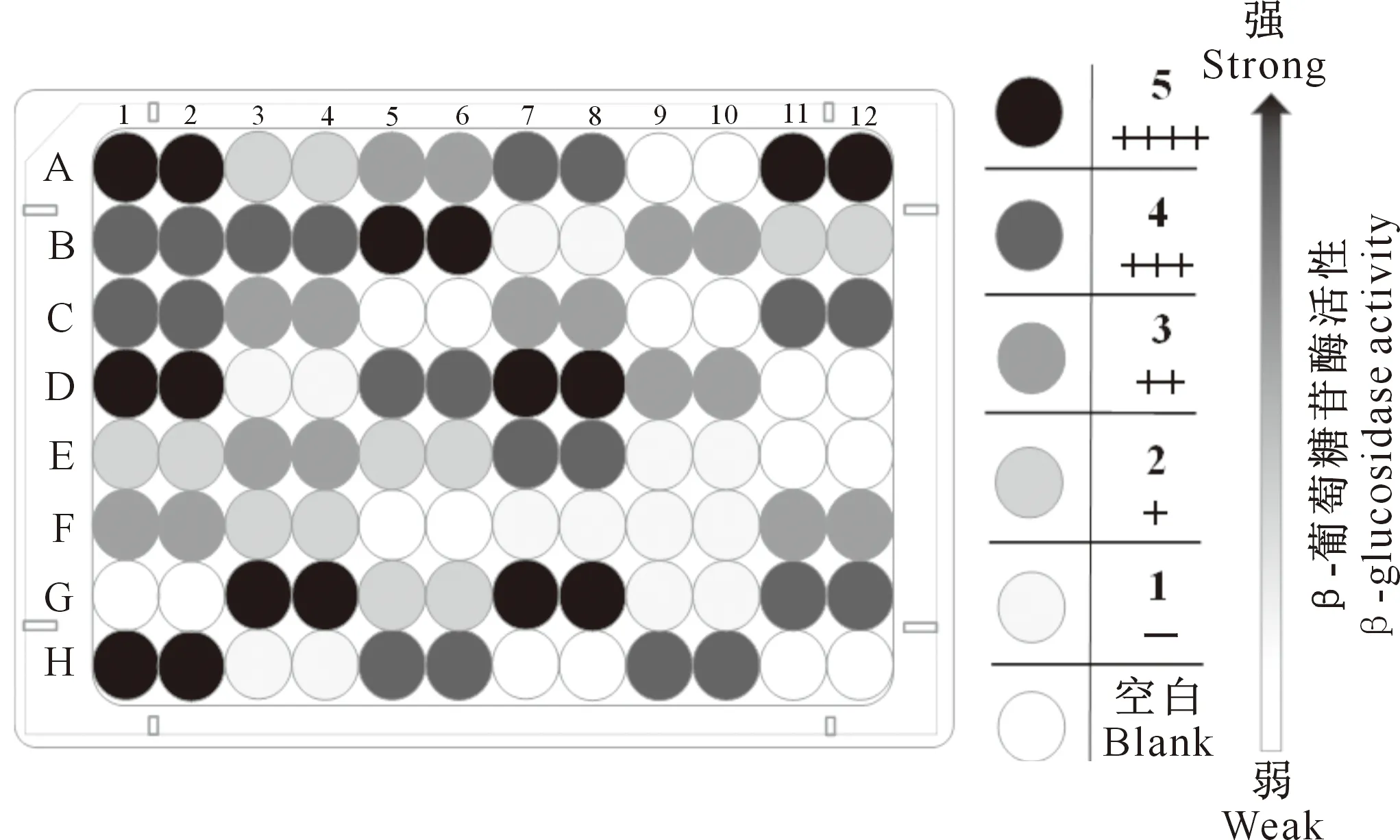
图1 七叶苷半定量比色法的筛选原理Fig.1 The screening principle of semi-quantitative colorimetric method with esculin hydrate
1.4 p-NPG法复筛验证菌株
将活化的初筛菌株以5%的接种量接于扩增培养基中,28 ℃、180 r/min扩增培养72 h后,以10%的接种量将扩培液接种到发酵培养基中,28 ℃、150 r/min下培养72 h后,8 000 r/min离心发酵液8 min后取上清液,经超滤去除10 ku大分子物质,制成糖苷酶提取液,用于复筛以及酶学特性研究,4 ℃条件下保存。
将200 μL糖苷酶提取液、750 μL柠檬酸-磷酸缓冲液(pH 5.0)和250 μL 1 mmol/Lp-NPG混合,40 ℃水浴30 min后加入1.0 mL的1 mol/L Na2CO3终止反应,酶标仪测定反应液的吸光值,根据标准曲线计算β-葡萄糖苷酶活性,并以此为依据复筛得到高产β-葡萄糖苷酶的菌株。β-葡萄糖苷酶活性单位(U)定义为:40 ℃、pH 5.0条件下1 min内催化生成1 μmol对硝基苯酚所要的酶量。
1.5 优选菌株的鉴定及其β-葡萄糖苷酶特性
1.5.1 菌落形态特征及细胞显微观察 将优选菌株活化后划线接种于WLN固体培养基中,30 ℃培养72 h,根据在WLN固体培养基的菌落特征对其进行初步分类,并在10×100倍显微镜下观察其细胞形态。
1.5.2 26S rDNA D1/D2区域序列分析 优选菌株DNA的提取:采用石英砂破壁法[18]。PCR扩增体系(25 μL):Premix Ex TaqTM12.5 μL,引物NL1和NL4各1 μL,DNA模板1 μL,添加双蒸水9.5 μL。PCR反应程序:95 ℃预变性5 min;94 ℃变性1 min,53 ℃退火1 min,72 ℃延伸1 min,循环36次;再72 ℃延伸10 min。PCR扩增产物用1%琼脂糖凝胶电泳检测,控制电压120 V,时间50 min,电泳结束后用2 μg/mL ED浸染20 min,蒸馏水洗脱5 min后置于凝胶成像系统调试拍照,并将PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序,根据测序结果,利用Blast软件从GenBank核酸序列数据库中进行同源序列搜索,确定菌株种属。
1.5.3β-葡萄糖苷酶的葡萄酒环境适应性 模拟葡萄酒酿造环境中的重要条件,设置酵母糖苷酶提取液在不同温度(20,30,40,50,60,70 ℃)、pH值(3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0)、葡萄糖质量浓度(100,150,200,250,300 g/L)和酒精度(体积分数) (5%,10%,15%)的试验条件,检测β-葡萄糖苷酶活性的变化,研究温度、pH值、葡萄糖质量浓度、酒精度对优选菌株β-葡萄糖苷酶活性的影响。
2 结果与分析
2.1 菌株的筛选
根据96孔板七叶苷培养基的显色深浅(图2),从133株菌株中快速筛选出19株显色水平有差异的菌株,该法一目了然,快速、便捷。使用p-NPG水解法测定19株菌株β-葡萄糖苷酶活性,得到显色水平及β-葡萄糖苷酶活性大小见表1。通过比较显色水平和β-葡萄糖苷酶活性数值大小,七叶苷半定量显色法的显色水平与p-NPG检测的β-葡萄糖苷酶活性具有正线性相关性,依据β-葡萄糖苷酶活性的大小筛选出2株活性较高且稳定的酵母菌株H5Y1和Z9Y3。

图2 供试菌株在七叶苷培养基中的显色筛选Fig.2 The color screening of strains in esculin medium

菌株编号No.ofstrains显色水平Colorlevelβ-葡萄糖苷酶活性/(mU·mL-1)β-glucosidaseactivities菌株编号No.ofstrains显色水平Colorlevelβ-葡萄糖苷酶活性/(mU·mL-1)β-glucosidaseactivitiesH5Y1++++39.71±1.44aG8Y2+++19.71±2.62dZ9Y3++++37.80±0.94abH9Y1+++19.22±2.51dH7Y9++++35.49±1.77abcH7Y8+++18.90±2.11dS6Y2++++33.86±1.96abcH8Y1+++18.59±2.72dH7Y5++++33.15±1.77bcW8Y1+++18.27±1.11dS5Y1++++32.16±1.74bcH9Y4++15.08±0.81dS8Y2++++30.15±1.44cH9Y2++14.95±2.46dS4Y9++++29.02±1.38cS4Y2++14.95±1.32dS8Y6+++19.95±1.73dS8Y5++14.28±2.84dW8Y5+++19.86±2.96d
注:++++、+++、++表示的显色水平同图1。同列数据后不同小写字母表示显著性差异(P<0.05)。
Note:++++,+++,and ++ mean same color levels as Fig.1.Different lowercase letters indicate significant difference (P<0.05).
2.2 优选菌株的鉴定
2.2.1 菌落形态与细胞形态 使用WLN固体培养基对优选酵母菌株培养72 h,观察菌落形态,并在显微镜下观察细胞形态,结果如图3所示。菌株H5Y1(图3-a)菌落呈米白色,不透明,表面有褶皱,边缘粗糙,细胞呈椭圆状,有出芽现象;菌株Z9Y3(图3-b)菌落呈乳白色,不透明,表面粗糙,有褶皱,边缘粗糙,细胞呈椭圆状,有出芽现象。

a.H5Y1 b.Z9Y3图3 优选酵母菌株的菌落形态及细胞形态Fig.3 The colony and cell morphology of yeasts selected
2.2.2 菌株26S rDNA D1/D2序列分析 对PCR扩增产物进行1%琼脂糖凝胶电泳检测,结果如图4所示。根据测序结果与GenBank中已发表的菌株进行核苷酸同源性对比,菌株H5Y1和菌株Z9Y3的基因与发酵毕赤酵母(Pichiafermentans)的KM589463.1和HE660054.1基因的同源性达到99%和99%,因此可确定2株菌株均为发酵毕赤酵母菌株。
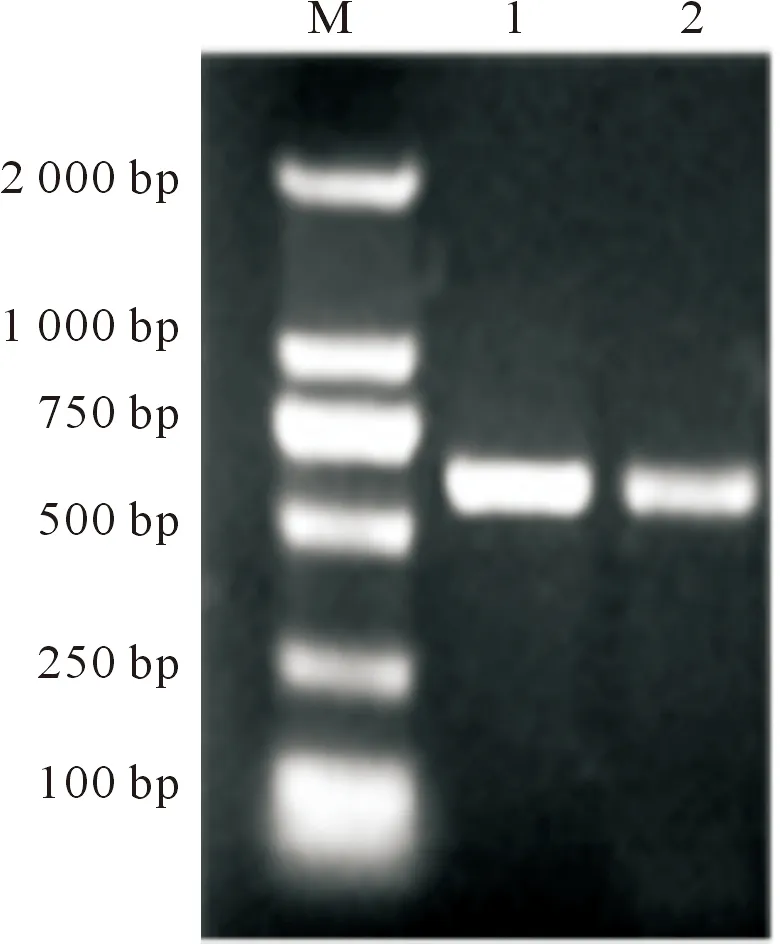
M.2 000 bp DNA Marker;1.H5Y1;2.Z9Y3
2.3 优选菌株β-葡萄糖苷酶的葡萄酒环境适应性
2.3.1 温度对β-葡萄糖苷酶活性的影响 将优选菌株糖苷酶提取液在不同温度下培养,1 h后测定β-葡萄糖苷酶活性,以提取液在40 ℃、pH 5.0条件下的β-葡萄糖苷酶活性(即100%)为比对,用相对酶活性表示不同温度条件对β-葡萄糖苷酶活性的影响(下同),结果如图5-a所示。由图5-a可以看出,在葡萄酒典型发酵温度(20~30 ℃)下,2株菌糖苷酶提取液中β-葡萄糖苷酶的相对酶活性在70%左右,50 ℃时相对酶活性最高,当温度高于50 ℃时优选菌株β-葡萄糖苷酶的相对酶活性急剧下降,70 ℃时相对酶活性分别为15.2%和22.0%。将2株菌糖苷酶提取液在20 ℃分别保温24,48,72 h,结果(图5-b)显示,β-葡萄糖苷酶相对酶活性随培养时间延长持续下降,72 h后H5Y1菌株的β-葡萄糖苷酶活性只保留了初始酶活性的51.1%,Z9Y3则保留了52.3%。

a.培养1 h后测定;b.20 ℃保温24,48,72 h后测定a.Measuring after being kept 1 h at different temperature;b.Measuring after being kept 24,48,72 h at 20 ℃
2.3.2 pH值对β-葡萄糖苷酶活性的影响 在pH值3.0~7.0,调整优选菌株糖苷酶提取液的pH 值,1 h后测定β-葡萄糖苷酶活性,结果(图6-a)显示,H5Y1与Z9Y3所产β-葡萄糖苷酶在pH 5.0时相对酶活性最高。12 h后测定β-葡萄糖苷酶活性,结果(图6-b)表明,在pH 3.0~6.0时,2株菌糖苷酶提取液中β-葡萄糖苷酶活性仍然能保持初始酶活性的90%左右,pH值7.0时相对酶活性降为78.1%和74.0%。说明优选菌株β-葡萄糖苷酶对葡萄酒酸性环境(pH值2.9~3.6)具有一定的耐受性。
2.3.3 葡萄糖和酒精度对β-葡萄糖苷酶活性的影响 葡萄糖质量浓度和酒精度对糖苷酶提取液中β-葡萄糖苷酶活性的影响结果见图7和图8。由图7可以看出,随着葡萄糖质量浓度的升高,2株菌β-葡萄糖苷酶活性均降低,葡萄糖质量浓度为100 g/L时β-葡萄糖苷酶活性能保持初始酶活性的95%以上,葡萄糖质量浓度为200 g/L时相对酶活性在85%左右,葡萄糖质量浓度300 g/L时2株菌的β-葡萄糖苷酶活性仅能保持初始酶活性的77.4%和79.0%。由图8可以看出,与葡萄糖的抑制作用不同,在酒精度为5%~15%时,随着酒精度的增加,提取液中β-葡萄糖苷酶活性呈上升趋势,酒精度为10%以上时,对β-葡萄糖苷酶活性有促进作用,尤其是对Z9Y3菌株的β-葡萄糖苷酶。因此,优选菌株的β-葡萄糖苷酶完全可适应葡萄酒的酒精环境。

a.培养1 h后测定;b.培养12 h后测定a.Measuring after being kept 1 h at different pH levels;b.Measuring after being kept 12 h at different pH levels
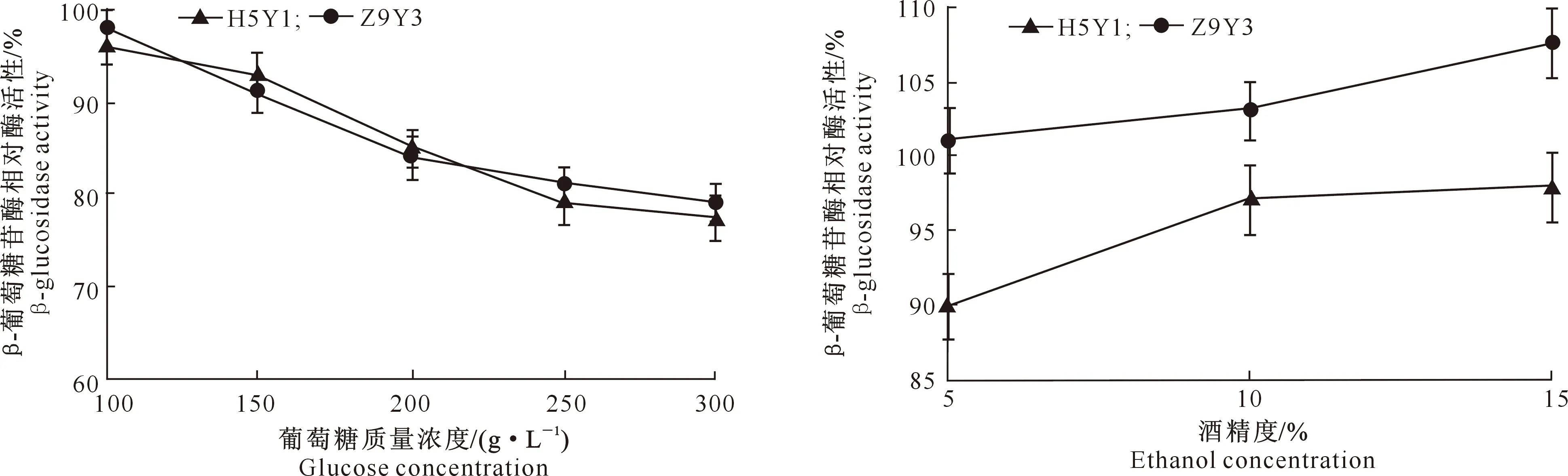
图7 葡萄糖质量浓度对β-葡萄糖苷酶活性的影响Fig.7 Effect of glucose content on β-glucosidase activity
3 讨论与结论
本研究中,配置七叶苷培养基,结合96孔板的酵母培养液试管,根据β-葡萄糖苷酶可以将七叶苷水解为七叶苷原并与Fe3+作用显棕黑色的原理,设计了七叶苷半定量显色法筛选高产β-葡萄糖苷酶的野生酵母菌株,筛选结果中高产菌株培养基显色明显、直观明了,与此前研究报道的纤维素-刚果红筛选培养基[19]和以p-NPG为底物的YEPD平板培养基[14]的筛选效果相比,具有很高的辨识度,并且七叶苷半定量显色法的成本较低,方便快捷,具有明确的创新性。
近些年来,许多研究报道了优选野生酵母在葡萄酒酿造中的应用,比如裂殖酵母(Schizosaccharomyces)[20]、异常汉逊酵母(Hansenulaanomala)[21-22]、有孢汉逊酵母(Hanseniasporauvarum)[23-24]等,它们大多通过与酿酒酵母的混合接种发酵,提高葡萄酒的风味复杂性。本试验以β-葡萄糖苷酶活性大小作为选择标准,最终优选2株高产菌株H5Y1和Z9Y3,β-葡萄糖苷酶活性分别达到39.71和37.80 mU/mL,2株菌经26S rDNA D1/D2 序列分析均鉴定为发酵毕赤酵母(Pichiafermentans)。同时,提取液在20 ℃条件下保温72 h后,β-葡萄糖苷酶活性能够保持初始酶活性的51.1%以上,在pH 3.0条件下保持12 h后,β-葡萄糖苷酶活性能够保持在初始酶活性的90.0%以上,在100~200 g/L葡萄糖质量浓度和5%~15%(体积分数)酒精度的2个不同条件下,β-葡萄糖苷酶活性分别能够保持在初始酶活性的84.0%和90.0%以上。说明优选菌株β-葡萄糖苷酶具有较好的葡萄酒酿造环境适应性。虽然已有研究报道了发酵毕赤酵母与酿酒酵母的混合发酵可提高葡萄酒中发酵香气成分的含量,如1-丙醇、乙酸乙酯、正己醇、2,3-丁二醇等[25],但优选发酵毕赤酵母菌株在发酵中影响葡萄品种香气的相关研究数据缺乏,优选菌株及其糖苷酶进行葡萄酒增香酿造的应用效果还需进一步深入研究。
[1] Lee P R,Kho S H C,Yu B,et al.Yeast ratio is a critical factor for sequential fermentation of papaya wine byWilliopsissaturnusandSaccharomycescerevisiae[J].Microbial Biotechnology,2013,6(4):385-393.
[2] Rainieri S,Pretorius I S.Selection and improvement of wine yeasts [J].Annals of Microbiology,2000,50(1):15-32.
[3] Mannazzu I,Clementi F,Ciani M.Strategies and criteria for the isolation and selection of autochthonous starters [J].Biodiversity and Biotechnology of Wine Yeasts,2002:19-33.
[4] Ganss S,Kirsch F,Winterhalter P,et al.Aroma changes due to second fermentation and glycosylated precursors in Chardonnay and Riesling sparkling wines [J].Journal of Agricultural and Food Chemistry,2011,59(6):2524-2533.
[5] Rodríguez-Bencomo J J,Selli S,Muoz-González C,et al.Application of glycosidic aroma precursors to enhance the aroma and sensory profile of dealcoholised wines [J].Food Research International,2013,51(2):450-457.
[6] Loscos N,Hernandez P,Cacho J,et al.Release and formation of varietal aroma compounds during alcoholic fermentation from nonfloral grape odorless flavor precursors fractions [J].Journal of Agricultural and Food Chemistry,2007,55(16):6674-6684.
[7] Rodríguez M E,Lopes C A,Barbagelata R J,et al.Influence ofCandidapulcherrimaPatagonian strain on alcoholic fermentation behaviour and wine aroma [J].International Journal of Food Microbiology,2010,138(1):19-25.
[8] Comitini F,Gobbi M,Domizio P,et al.Selected non-Saccharomyceswine yeasts in controlled multistarter fermentations withSaccharomycescerevisiae[J].Food Microbiology,2011,28(5):873-882.
[9] Jolly N P,Varela C,Pretorius I S.Not your ordinary yeast:non-Saccharomycesyeasts in wine production uncovered [J].Federation of European Microbiological Societies Yeast Research,2014,14(2):215-237.
[10] Ciani M,Comitini F,Mannazzu I,et al.Controlled mixed culture fermentation:a new perspective on the use of non-Saccharomycesyeasts in winemaking [J].Federation of European Microbiological Societies Yeast Research,2010,10(2):123-133.
[11] Dashko S,Zhou N,Tinta T,et al.Use of non-conventional yeast improves the wine aroma profile of Ribolla Gialla [J].Journal of Industrial Microbiology and Biotechnology,2015,42(7):997-1010.
[12] Maturano Y P,Assof M,Fabani M P,et al.Enzymatic activities produced by mixedSaccharomycesand non-Saccharomycescultures:relationship with wine volatile composition [J].Antonie van Leeuwenhoek,2015,108(5):1239-1256.
[13] Renault P,Coulon J,de Revel G,et al.Increase of fruity aroma during mixedT.delbrueckii/S.cerevisiaewine fermentation is linked to specific esters enhancement [J].International Journal of Food Microbiology,2015,207:40-48.
[14] 侯晓瑞,王 婧,杨学山,等.甘肃河西走廊葡萄酒产区高产β-葡萄糖苷酶酵母菌株筛选 [J].食品科学,2014,35(23):139-143.
Hou X R,Wang J,Yang X S,et al.Screening of yeast strains producingβ-glucosidase from Hexi Corridor wine-producing regions of Gansu Province [J].Food Science,2014,35(23):139-143.
[15] Kurtzman C P,Robnett C J.Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit (26S) ribosomal DNA partial sequences [J].Antonie van Leeuwenhoek,1998,73(4):331-371.
[16] 王星晨,胡 凯,陶永胜.葡萄汁有孢汉逊酵母和酿酒酵母的混合酒精发酵动力学 [J].食品科学,2016,37(3):103-108.
Wang X C,Hu K,Tao Y S.Kinetics of alcohol fermentation by mixed cultures ofHanseniasporauvarumandSaccharomycescerevisiae[J].Food Science,2016,37(3):103-108.
[17] Hu K,Zhu X L,Mu H,et al.A novel extracellular glycosidase activity fromRhodotorulamucilaginosa:its application potential in wine aroma enhancement [J].Letters in Applied Microbiology,2015,62(2):169-176.
[18] 周小玲,沈 微,饶志明,等.一种快速提取真菌染色体DNA的方法 [J].微生物学通报,2004,31(4):89-92.
Zhou X L,Shen W,Rao Z M,et al.A rapid method for preparation of fungal chromosome DNA [J].Microbiology China,2004,31(4):89-92.
[19] 陈 静,郝伟伟,王春梅,等.产β-葡萄糖苷酶真菌的筛选鉴定、纯化及酶学性质分析 [J].食品科学,2013,34(5):191-196.
Chen J,Hao W W,Wang C M,et al.Screening and identification ofβ-glucosidase-producing fungi,and purification and enzymatic analysis [J].Food Science,2013,34(5):191-196.
[20] Benito S,Palomero F,Morata A,et al.Physiological features ofSchizosaccharomycespombeof interest in making of white wines [J].European Food Research and Technology,2013,236(1):29-36.
[21] Domizio P,Romani C,Lencioni L,et al.Outlining a future for non-Saccharomycesyeasts:selection of putative spoilage wine strains to be used in association withSaccharomycescerevisiaefor grape juice fermentation [J].International Journal of Food Microbiology,2011,147(3):170-180.
[22] Kurita O.Increase of acetate ester-hydrolysing esterase activity in mixed cultures ofSaccharomycescerevisiaeandPichiaanomala[J].Journal of Applied Microbiology,2008,104(4):1051-1058.
[23] Andorrà I,Berradre M,Rozès N,et al.Effect of pure and mixed cultures of the main wine yeast species on grape must fermentations [J].European Food Research and Technology,2010,231(2):215-224.
[24] Hu K,Qin Y,Tao Y S,et al.Potential of glycosidase from non-Saccharomycesisolates for enhancement of wine aroma [J].Journal of Food Science,2016,81(4):M935-M943.
[25] Domizio P,Romani C,Comitini F,et al.Potential spoilage non-Saccharomycesyeasts in mixed cultures withSaccharomycescerevisiae[J].Annals of Microbiology,2011,61(1):137-144.
