白藜芦醇诱导人前列腺癌DU145细胞凋亡的作用机制
2018-02-15许学芬
李 伟,许学芬
(南京中医药大学 1基础医学院;2医学与生命科学院,南京 210023)
前列腺癌作为男性生殖系统常见的恶性肿瘤之一,在欧美国家的发病率远高于亚洲国家[1-2]。但近年来,随着经济水平的不断提高,人口老龄化进一步明显,亚洲国家的前列腺癌发病率也明显增加[3]。前列腺是雄激素依赖性器官,早期治疗主要依赖于手术治疗及局部放疗[1]。但事实上,由于早期前列腺癌发病隐匿,在我国发现前列腺癌时往往已经到达中晚期[4]。因此针对我国中晚期前列腺癌的病情,常用治疗手段是雄激素撤除治疗[5]。但是随着治疗进程推进,大部分患者最终会发展为雄激素非依赖性前列腺癌,治疗效果不佳,最终肿瘤细胞转移导致死亡[4]。因此迫切需要寻找有效的前列腺癌治疗方法或抗肿瘤效果确切但不良反应较小的药物。
白藜芦醇(resveratrol,Res)是一种非黄酮类多酚化合物,广泛存在于葡萄属植物中,目前已在70多种植物中被发现[6]。近年来对白藜芦醇研究发现,该药能诱导多种肿瘤细胞凋亡且副作用小,因而成为近年来研究的热点[7]。研究表明,白藜芦醇对肺癌[8]、乳腺癌[9]等多种肿瘤细胞均有很好的增殖抑制作用,但是对前列腺癌作用的研究较少。本实验以人前列腺癌DU145细胞为研究对象探讨白藜芦醇诱导其凋亡的分子机制,从而为前列腺癌的预防和治疗提供理论基础。
1 材 料
1.1 药品与试剂
白藜芦醇(美国Sigma公司);人前列腺癌细胞系DU145(中国科学院上海细胞库);RPMI1640培养液、胰蛋白酶(美国Gibco公司);胎牛血清(杭州四季青公司);青霉素、链霉素(华北制药公司);Annexin V-FITC细胞凋亡检测试剂盒、细胞周期检测试剂盒、ROS检测试剂盒、JC-1检测试剂盒(南京凯基生物科技公司);兔抗人Cyclin A抗体、兔抗人Cyclin D1抗体、兔抗人p21抗体、兔抗人p27抗体、兔抗人Bcl-2抗体、兔抗人caspase-3抗体、兔抗人Bax抗体、兔抗人caspase-8抗体、兔抗人caspase-9抗体、兔抗人Cytc抗体、兔抗人AIF抗体、兔抗人Histone抗体、兔抗人COX-IV抗体(北京博奥森生物技术有限公司);鼠抗人β-actin抗体(美国Sigma公司)
1.2 仪 器
3111型CO2细胞培养箱、Varioskan flash型酶标仪(美国Thermo Scientific公司);Epics elite-Esp型流式细胞仪(美国Beckman Counter公司);UV Transil luminator型化学发光凝胶成像仪、垂直电泳槽、DYY-6C型电泳仪(美国Bio-Rad公司)。
2 方 法
2.1 细胞培养
用含100 U/mL青霉素、100 U/mL链霉素和10%小牛血清的RPMI-1640培养液培养以适量浓度接种在培养瓶中的人前列腺癌DU145细胞,培养条件为37 ℃恒温、5% CO2、饱和湿度的培养箱。细胞呈贴壁生长。每2~3天传代1次。细胞呈单层贴壁生长,选对数生长期细胞进行实验。
2.2 四甲基偶氮唑盐(MTT)法
将处于对数生长期的DU145细胞用0.02% EDTA消化,制成细胞悬液,以每毫升2×105的细胞浓度加入96孔酶标板内,每孔100 μL,于 37 ℃、5% CO2条件下培养24 h,在每孔中分别加入浓度倍比稀释的白藜芦醇100 μL,孵育24 h,再在每孔中加入质量浓度为5 mg/mL的四甲基偶氮唑溶液20 μL,继续培养4 h,弃上清液,在每孔加入二甲亚砜(DMSO)100 μL,置于微型振荡器上震荡约5 min,使结晶完全溶解,于酶联仪波长570 nm处测定吸收度。吸收度越高,活细胞数越多。根据吸收度计算药物对细胞的活力抑制率,并根据改进寇氏法计算出半数抑制浓度IC50。
2.3 Annexin V-FITC/PI双染检测细胞凋亡
将正处于对数生长期的DU145细胞的细胞悬液(含1×106个细胞)接种于6孔板上,每孔2 mL,并培养24 h。分别加入不同浓度的白藜芦醇(12.5,25和50 μmol/L),另设对照组。24 h后,收集悬液细胞至10 mL离心管中,板中未脱壁细胞用不含EDTA的胰酶消化收集(胰酶消化时间不宜过长,以防引起假阳性)。2 000 r/min离心5 min。预冷的PBS洗涤细胞3次。去离子水稀释试剂盒中的4×结合缓冲液稀释至使用浓度,1×结合缓冲液400 μL悬浮细胞,浓度大约为每毫升1×106个细胞。取细胞悬液195 μL加入Annexin V-FITC 5 μL。混匀,避光,室温下染色10 min。再用PBS清洗细胞,1×结合缓冲液190 μL重悬细胞,加入PI(20 μg/mL)10 μL。避光染色20 min,用流式细胞仪检测。
2.4 PI单染检测细胞周期
将DU145细胞接种到6孔板上,培养24 h,分别加入不同浓度的白藜芦醇(12.5,25和50 μmol/L),另设对照组和阳性组。24 h后,收集悬液细胞至10 mL离心管中,板中未脱壁细胞用不含EDTA的胰酶消化收集(胰酶消化时间不宜过长,以防引起假阳性)。2 000 r/min离心5 min。预冷的PBS洗涤细胞3次。离心,弃去上清液,用70%乙醇固定20 min,用PBS清洗2~3次,加入RNA抑制剂和PI(20 μg/mL)10 μL,避光染色30 min。用流式细胞仪检测细胞周期。
2.5 细胞内ROS水平的检测
分别用12.5,25,50 μmol/L的白藜芦醇分别作用于接种于6孔板的DU145细胞24 h,同时设立空白对照组,收集细胞于1.5 mL离心管。按照1∶1 000 用无血清培养液稀释DCFH-DA,使终浓度为100 mmol/L。细胞收集后悬浮于稀释好的DCFH-DA中,37 ℃细胞培养箱内孵育20 min。每隔3~5分钟颠倒混匀,使探和细胞充分接触。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。用流式细胞仪器分析。
2.6 细胞内线粒体膜电位(ΔΨm)的检测
分别用12.5,25,50 μmol/L的白藜芦醇分别作用于DU145细胞24 h,同时设立空白对照组,收集细胞于1.5 mL试管。按照试剂盒说明,每组加入缓冲液1 000 μL,然后加入JC-1 2 μL,混匀。在37 ℃,5% CO2的培养箱中孵育15~20 min。2 000 r/min离心5 min,去除上清液,用PBS清洗后,用流式细胞仪器分析。
2.7 线粒体蛋白和胞浆蛋白的分离
对数生长期的DU145细胞贴壁后至细胞密度为70%~80%,分别加入12.5,25,50 μmol/L白藜芦醇,同时设立空白对照组。提取线粒体蛋白和胞浆蛋白前需要将5×胞浆提取液用去离子水稀释成1×胞浆提取液,并且配成胞质提取液(1 mL)+蛋白酶抑制剂(2 mL)+DTT(1 mL)和线粒体提取液(1 mL)+蛋白酶抑制剂(2 mL)+DTT(1 mL)。细胞孵育24 h后,4 ℃,2 400 r/min离心5 min,收集5×107个细胞。用冰PBS 10 mL洗涤细胞,然后4 ℃,2 400 r/min离心5 min,弃上清液。每组细胞沉淀中加1 mL混有DTT和蛋白酶抑制剂的1×胞浆提取液。冰上孵育10 min。将细胞置于细胞匀浆器中在冰上匀浆30~40次,在显微镜下观察细胞周围无光环即可。匀浆液转移入1.5 mL试管中,4 ℃,2 500 r/min离心10 min。将上清液转移到新的1.5 mL试管中,4 ℃,10 600 r/min离心30 min。上清液即为胞浆蛋白,沉淀为线粒体。在线粒体沉淀中加入含有DTT和蛋白酶抑制剂的线粒体提取液0.1 mL,冰上裂解10 min,再涡旋10 s,即为线粒体蛋白。
2.8 Western blot检测
细胞经各浓度药物处理后按照试剂盒要求提取质蛋白和膜蛋白,进行SDS-PAGE 凝胶电泳,然后将蛋白经恒流电转移到PVDF膜上,用封闭液封闭1 h,加入稀释好的Cyclin A、Cyclin D1、p21、p27、Bax、Bcl-2、caspase-3、caspase-8、caspase-9、Cytc、AIF、COX-IV、Histone、β-actin一抗(1∶500),4 ℃恒温摇床孵育12 h,PBST洗膜,二抗IgG(1∶15 000),4 ℃避光孵育1 h,再用PBST洗膜后用Odyssey红外荧光扫描成像系统进行检测。
2.9 统计学分析
实验数据经SPSS 19.0和Excel软件进行统计分析,所有实验和数据处理均重复3次。
3 结 果
3.1 白藜芦醇对DU145细胞增殖抑制作用
MTT实验结果如下图1所示。在白藜芦醇作用于人前列腺癌DU145细胞约24 h,结果发现白藜芦醇可以显著抑制DU145细胞的增殖,并呈时间和剂量依赖性。白藜芦醇对人前列腺癌DU145细胞的作用24 h后IC50为(50.95±8.66)mol/L。确定12.5、25和50 μmol/L作为之后体外实验中白藜芦醇的给药低、中、高剂量,给药时间为24 h。


3.2 PI单染检测白藜芦醇对DU145细胞周期的影响
根据PI单染结果计算出细胞分布在各细胞周期的百分比柱状图,如图2所示。从结果可以看出,随着白藜芦醇给药浓度的增加,G0/G1期细胞比例明显增加,S期和G2/M期细胞比例明显减少。说明白藜芦醇对DU145细胞的周期阻滞主要发生在G0/G1期,白藜芦醇具有明显的G0/G1期周期阻滞作用。

Figure2 Influence of paclitaxel treatment on cell cycle by Res Summary of the percentage of cells at G0/G1,S and G2/M phase was performed
3.3 Western blot检测白藜芦醇对DU145细胞周期相关蛋白表达水平的影响
如图3所示,不同浓度的白藜芦醇(12.5,25,50 μmol/L)作用于DU145细胞24 h后,可以发现,随着给药剂量的增加,G0/G1期周期阻滞相关蛋白Cyclin A和Cyclin D1蛋白表达逐渐减少,而细胞周期激酶相关蛋白p21和p27蛋白表达逐渐增加。免疫印迹实验的结果表明,白藜芦醇可以通过上调Cyclin A和Cyclin D1蛋白的表达和下调p21和p27蛋白表达使DU145细胞中阻滞在G0/G1期。
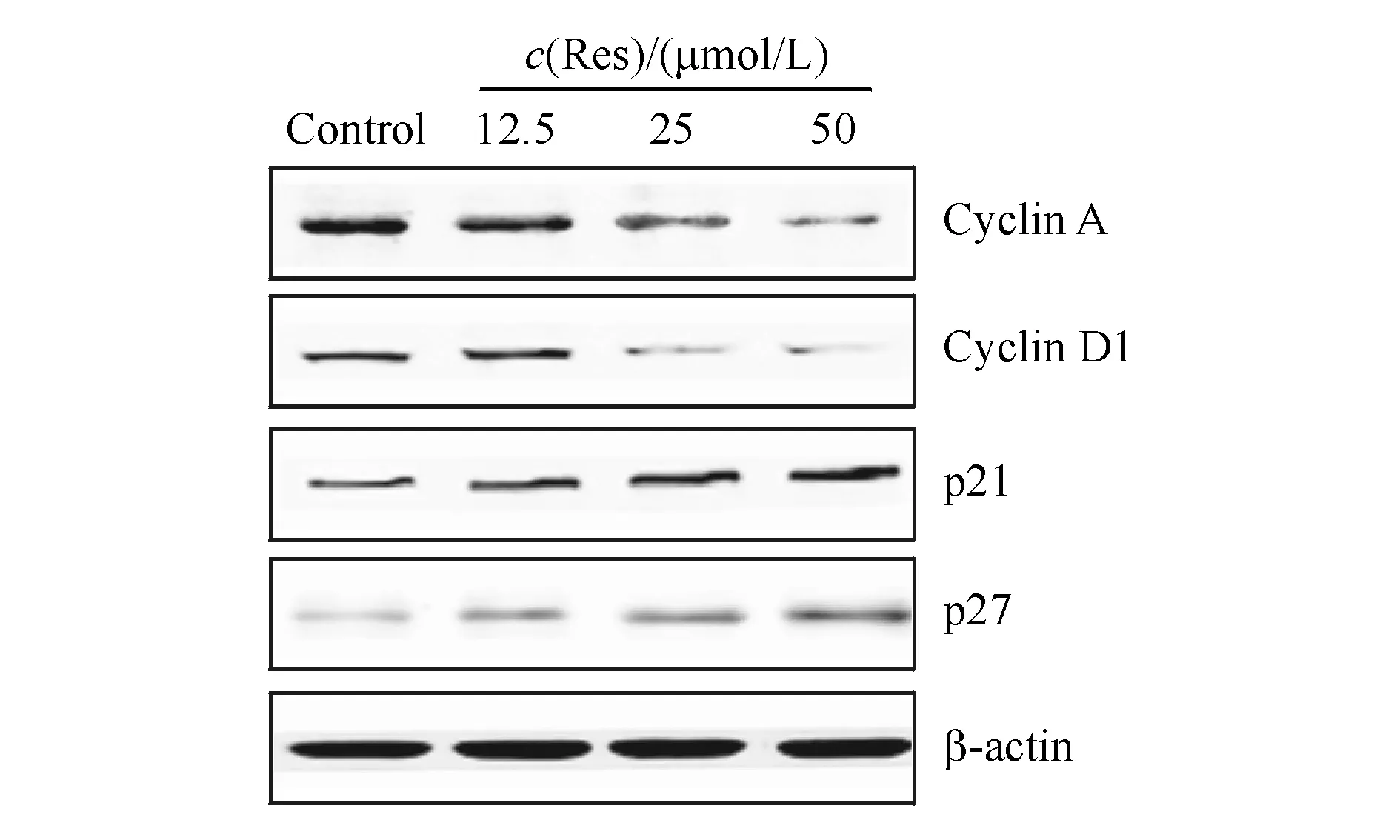
Figure3 Western blot analysis of Cyclin A,Cyclin D1,p21 and p27 of the DU145 cells treated with 12.5,25 and 50 μmol/L of Res for 24 h
3.4 Annexin V/PI双染检测白藜芦醇对DU145细胞凋亡率的影响
如图4所示,白藜芦醇作用24 h后,凋亡细胞占比显著升高。其中,对照组早期和晚期凋亡的细胞占比分别为2.8%和6.0%。随着加入的白藜芦醇剂量的升高(12.5,25,50 μmol/L),早期和晚期凋亡的细胞数量也明显升高。早期凋亡的细胞从对照组的2.4%分别上升到7.0%,17.7%和40.4%;晚期凋亡的细胞从4.0%分别上升到9.9%,11.0%和13.1%。实验结果说明,白藜芦醇对DU145细胞有明显的凋亡诱导作用,且高剂量组(50 μmol/L)诱导凋亡的作用更明显。


3.5 白藜芦醇对DU145 细胞凋亡相关蛋白表达水平的影响
如图5所示,不同浓度的白藜芦醇(12.5,25,50 μmol/L)作用于DU145细胞24 h后,可以发现,随着给药剂量的增加,Bcl-2蛋白表达逐渐减少,而Bax蛋白表达逐渐增加。DU145细胞中Bax/Bcl-2的蛋白水平变化可以启动Caspase级联反应,即激活caspase-9,caspase-9接着又激活caspase-3及其他信号蛋白,从而发生诱导凋亡作用。因此,从图6中还可以发现,DU145细胞在经不同剂量的白藜芦醇作用24 h后,procaspase-3的表达下降,同时caspase-3的激活形式cleaved-caspase-3表达增加,procaspase-9的表达下降,同时caspase-9的激活形式cleaved-caspase-9表达增加。

Figure5 Western blot analysis of Bcl-2,Bax,and caspase-8,-9,-3 of the DU145 cells treated with 12.5,25 and 50 μmol/L of Res for 24 h
3.6 白藜芦醇对DU145细胞内ROS水平的影响
线粒体是ROS的主要产生部位。ROS的积累会导致线粒体膜电位的崩解,并触发细胞凋亡。如图6所示,用25和50 μmol/L Res作用DU145细胞24 h后,相对于对照组,给药后细胞内ROS生成显著增多,且成剂量依赖性。


3.7 白藜芦醇对DU145细胞内线粒体膜电位的影响
JC-1是一种荧光染料,在正常细胞内聚集在线粒体内,形成多聚体,呈鲜红色荧光;而在凋亡细胞内,由于线粒体跨膜电位的破坏,不能聚集到线粒体内,以单体的形式存在于胞质内发绿色荧光。JC-1的荧光强度可以用流式细胞仪检测(激发波长488 nm;发射波长530 nm),绿色荧光通过FITC通道通常为FL1来检测;红色荧光通过PI通道通常为FL2来检测。实验结果显示,在DU145细胞中,和空白组比较,随着白藜芦醇剂量的增加,线粒体膜电位ΔΨm降低明显,且有剂量依赖性。如图7可见,12.5,25和50 μmol/L分别作用时,线粒体膜电位耗散分别为5.81%,10.74%和25.66%。


3.8 白藜芦醇对DU145细胞AIF蛋白和Cytc释放的影响
AIF是正常健康细胞内的一种黄素蛋白,由于参加了线粒体能量和氧化还原反应,所以和线粒体功能有关。在凋亡信号刺激下AIF先从线粒体转移到细胞质再到细胞核,在细胞核引起染色体凝聚和DNA大片段断裂最终导致细胞凋亡。白藜芦醇处理后的DU145细胞中,发现AIF进入细胞核,并呈剂量依赖性。如图8所示,随着白藜芦醇给药剂量的增加,线粒体中的Cytc逐步释放到细胞胞浆内,激活了线粒体凋亡途径。

Figure8 Transposition of apoptotic-inducing factor (AIF) from mitochondria to nucleus was detected.DU145 cells were treated with Res (12.5,25,and 50 μmol/L)
4 讨 论
前列腺癌是中老年男性发病率较高的肿瘤之一,是引起美国男性死亡的第二大肿瘤杀手,而在我国前列腺癌发病率也在迅速增加[1-4],由于前列腺癌的发病机制极其复杂,目前并无有效的药物能够根治。有研究证实,黄酮和多酚类化合物能够很好地预防、治疗前列腺癌[10-11]。白藜芦醇是广泛存在于葡萄、虎杖、花生等药用植物中的一种多酚类化合物,作为低毒性的天然药物具有抗炎、抗氧化、抗血小板聚集、抗动脉粥样硬化等多方面作用,许多研究表明白藜芦醇是一种很有前景的抗肿瘤药物[12]。临床大量研究均表明,在治疗如肝癌[13]、乳腺癌[9]、肺癌[8]等多种晚期恶性肿瘤患者时,应用化疗药物联合白藜芦醇临床疗效显著。本研究结果显示,在人前列腺癌DU145细胞中白藜芦醇作用24 h之后,IC50为(50.95±8.66) μmol/L。白藜芦醇可以显著地抑制人前列腺癌DU145细胞的增殖,并呈剂量和时间依赖性。
白藜芦醇抗肿瘤作用机制尚未完全明确,通过诱导肿瘤细胞发生周期阻滞是一种重要的抑制细胞增殖的作用机制。本实验从细胞周期阻滞的角度,研究白藜芦醇对人前列腺癌DU145细胞的增殖抑制作用。结果发现,不同浓度白藜芦醇作用下的DU145细胞经流式细胞仪分析表明,与空白对照组相比,随着浓度增加,G0/G1期细胞比例显著升高。免疫印迹实验表明,白藜芦醇通过上调Cyclin A、CyclinD1蛋白表达水平和下调p21、p27蛋白表达水平,使DU145细胞阻滞在G0/G1期,抑制细胞从G0/G1期向S期转变,从而抑制肿瘤细胞增殖。
细胞凋亡是在多种基因调控下,指为维持内环境稳定,细胞自主的有序的死亡,在细胞衰老、肿瘤的发生中起重要作用,细胞凋亡是一个复杂并且涉及多条通路的过程[14]。通过Annexin V-FITC/PI双染实验,发现白藜芦醇具有诱导人前列腺癌DU145细胞凋亡作用,并随着给药浓度的增加,早期凋亡和晚期凋亡的细胞比例均显著增加。有研究结果表明,Bax、Bcl-2蛋白家族是调节细胞内凋亡信号的关键蛋白[15]。并且,在许多肿瘤细胞的凋亡过程中都发现有caspase-3的活化,caspase-3是Caspase家族中的最重要的凋亡执行者之一,是细胞凋亡过程中的主要效应因子[16-17]。免疫印迹实验证明白藜芦醇对人前列腺DU145细胞凋亡通路蛋白的作用。白藜芦醇可以下调Bcl-2蛋白水平,上调Bax蛋白水平,激活caspase-3并引发其它Caspase蛋白级联反应,诱导细胞发生凋亡。实验结果表明了白藜芦醇可以通过调节Bax、Bcl-2蛋白水平从而激活Caspase级联反应诱导人前列腺DU145细胞发生凋亡。
细胞凋亡分为外源性和内源性两条通路[18-19]。白藜芦醇作用内源性凋亡通路,也就是线粒体依赖性凋亡通路[20],导致了Cytc的释放与caspase-3的激活。此外,ROS聚集诱导MMP的破坏,被认为是细胞凋亡级联反应过程中最早发生的事件之一,一旦MMP崩溃,则细胞凋亡不可逆转[21]。DU145细胞在给予白藜芦醇之后,其线粒体膜电位出现了明显的破坏,提示凋亡的发生。MMP的快速降低诱导线粒体凋亡蛋白的释放,引发了Caspase依赖性的细胞凋亡。此外研究还发现,在白藜芦醇诱导的细胞凋亡中,细胞内ROS的升高且呈明显的剂量依赖性,诱导线粒体释放AIF入核,产生凋亡现象。AIF是一种非Caspase依赖性的死亡效应子,当它从线粒体膜间隙转移到细胞核中时,会引发细胞染色质的凝聚,磷脂酰丝氨酸的暴露,以及大规模的DNA断裂,最终细胞死亡。
综上所述,白藜芦醇可以将人前列腺癌DU145细胞阻滞在G0/G1期,并诱导DU145细胞凋亡。主要是通过ROS-线粒体途径,引发Caspase级联反应,调节相关下游蛋白表达,从而诱导凋亡的产生。白藜芦醇也可以通过周期阻滞产生明显的抑制细胞增殖作用,从而抑制DU145细胞的生长。然而,在整个凋亡过程的发生中,白藜芦醇是否通过其他通路发挥抗肿瘤作用,以及更加详细的作用机制,都需要进一步研究与探讨。本研究为进一步开发白藜芦醇成为新的抗前列腺癌用药提供了理论基础。
