抑制NtVTC1 基因的表达延缓烟草生长发育
2018-02-14陈丽华李鸿彬
陈丽华,李鸿彬
(石河子大学生命科学学院 /石河子大学农业生物技术重点实验室,新疆 石河子 832003)
抗坏血酸 (Ascorbic acid,AsA)也称维生素 C(Vitamin C,VTC),是植物中广泛存在的一种水溶性抗氧化有机小分子。AsA参与植物的衰老调控[1,2]、细胞生长和分裂[3]、激素信号转导[4]、糖代谢[5]、成花诱导[6]和胁迫响应[7]等多种生理过程;此外,有研究表明AsA与棉花纤维的发育紧密相关[8]。
在植物中,L-半乳糖途径是最主要的AsA合成途径。GDP-甘露糖磷酸化酶 (GDP-mannose pyrophosphorylase,GMPase)也称为 VTC1,能够催化 D-甘露糖-1-磷酸 (D-mannose-1-P)生成GDP-D-甘露糖(GDP-D mannose),是抗坏血酸合成中L-半乳糖途径的第一个关键限速酶,在抗坏血酸合成过程中发挥着重要作用。此外,NtVTC1催化的产物GDP-甘露糖除了用于合成AsA外,还参与细胞壁碳水化合物的合成和蛋白糖基化[9]。许多研究表明 NtVTC1基因与植物中AsA的合成密切相关并调控着植物的生长发育[10-11]。将拟南芥NtVTC1 基因在番茄中过表达显著提高植物叶片、绿色果实及成熟果实中的AsA含量[12];将番茄中的 NtVTC1基因在烟草和马铃薯中过量表达,能显著提高 的酶活及细胞内AsA含量[13-14]。
为了进一步研究NtVTC1基因的功能,本研究利用RNA干扰技术,以植物NtVTC1基因编码蛋白的N端催化结构域保守序列为参考,构建烟草NtVTC1基因的RNAi干扰表达载体 ,并遗传转化烟草,通过观察NtVTC1基因干扰表达的转基因烟草RI的表型、AsA含量测定及抗氧化系统酶活性分析,进一步研究NtVTC1基因影响植物发育的重要功能,以期为探索NtVTC1 基因在植物的生长发育过程中的重要作用提供参考。
1 材料与方法
1.1 材料
大肠杆菌DH5α感受态细胞、根癌农杆菌(Agrobacterium tumefaciens)菌株GV3101为本实验室保存,植物表达载体pCAMBIA2300、干扰载体构建的基本质粒pRI221分别由石河子大学生命科学学院的黄先忠教授、崔百明教授惠赠。野生型烟草(Nicotiana tabacum)由本实验室保存和种植。质粒提取试剂盒以及琼脂糖凝胶回收试剂盒购自天根公司;限制性内切酶、T4 DNA连接酶、DNA Marker、pMD19-T Vector及其他相关的试剂购自宝生物公司。
1.2 方法
1.2.1 干扰载体的构建
以植物NtVTC1 基因编码蛋白的N端催化结构域保守序列作为参考,以烟草NtVTC1 基因的cDNA作为模版,选择编码N端催化结构域56-134氨基酸序列的168-402核酸序列为参考序列,设计包含限制性酶切位点 Ⅰ和 Ⅰ的特异性引物NtVTC1F和NtVTC1R并进行PCR扩增,回收扩增产物并与pMD-19T载体连接,转化大肠杆菌感受态细胞DH5α,提取质粒DNA并进行双酶切鉴定后送至上海生工进行进一步测序鉴定(表1)。
重组质粒pMD-19T-NtVTC1经SaiⅠ和SpeⅠ酶切后,正向连接至用相同酶切的干扰载体pRI221,再将HbaⅠ和HBOⅠ酶切过后的回收产物反向连接至 SaiⅠ和SpeⅠ双酶切的干扰载体pRI221。重组质粒经Hind Ⅲ和 EcoRⅠ酶切后连接至同样酶切后的植物表达载体pCAMBIA2300。通过 Hind Ⅲ和 EcoRⅠ双酶切鉴定后,将构建成功的NtVTC1 基因RNAi干扰表达载体命名为RNAi-NtVTC1。
1.2.2 农杆菌介导转化及转化体筛选
采用冻融法将载体 转化农杆菌GV3101、叶盘法[15]转化烟草。将遗传转化的烟草在含有 6-BA(2mg/L)、NAA(0.25mg/L)、Kan(100mg/L)、Cef(500mg/L)的MS培养基中进行抗生素初步筛选,将通过抗生素初步筛选的转基因烟草进行分子鉴定和NtVTC1基因表达量检测。
1.2.3 RI转基因株系NtVTC1 基因的表达量检测
RI转基因株系材料采用Trizol方法提取烟草总RNA,参照试剂盒的操作说明,以烟草RNA为模板反转录成cDNA,用反转录后的cDNA作为模板分别进行RT-PCR和qRT-PCR检测分析。

表1 本研究中使用的引物Tab.1 Primers used in this study
1.2.4 RI转基因株系AsA含量测定
AsA含量测定参照Kampfenkel等[16]的方法。约0.5 g植物材料加入2 mL 6%TCA研磨成匀浆,4℃、12000 r/min离心5 min后收集上清液并立即用于AsA含量的测定。AsA测定的反应液包括0.2 mL提取液 (6%TCA作为空白对照)、0.6 mL 0.2M PBS(pH7.4)、0.2mL ddH2O、1mL 6% TCA、0.8 mL 42% H3PO4、0.8mL4% 2,2’- 二 联 吡 啶 和 0.4 mL 3%FeCl3。总 AsA(还原型 AsA与氧化型 DHA之和)的测定以0.2 mL 10 mM L-1 DTT和0.4 mL 0.2 M PBS (pH7.4)代替上述0.6 mL 0.2 mol/L PBS。反应液42℃温浴1 h后,测定525 nm吸光值。DHA(氧化型AsA)含量为总AsA含量减去未加DTT所测得还原型AsA含量的差值。每个处理重复3次,结果以平均值±标准误差表示。
1.2.5 抗氧化系统酶活性测定
酶活性的测定参考Noctor等[17]的方法。酶液的提取:在液氮中研磨100-150 mg组织,加入约50 mg PVP,然后加入1.5 mL 0.1 mol/L磷酸盐缓冲液、1 mmol/L EDTA (pH7.5),在解冻过程中继续研磨,直至悬液均匀。在4℃和15000 r/min离心20 min,收集的上清液用于酶活性测定。
抗坏血酸过氧化物酶 (Ascorbate peroxidase,APX)酶活性的测定:测定的反应体系中包括:890 μL 0.1 mM 磷酸钾缓冲液 (1m MEDTA)、50 μL 10 mmol/L AsA、10 μL 20 mmol/L H2O2,加入 50 μL 酶液后 2 min内290 nm处室温记录OD值的变化。
谷胱甘肽还原酶 (Glutathione reductase,GR)酶活性测定:测定的反应体系为 10 μL 10 m mol/L NADPH、880μL0.1m mol/L磷酸钾缓冲液 (1 mmol/L EDTA,PH7.5),加入 10 μL 50 mmol/L GSSG后2-3 min内340 nm处室温记录OD值的变化。
过氧化氢酶 (Catalase,CAT)酶活性的测定:测定的反应体系为900 μL 0.1 mmol/L磷酸钾缓冲液 (1 mmol/L EDTA,PH7.5)、20 μL 40 mmol/L H2O2,加入100 μL酶液后在加1~2 min内240 nm处室温记录OD值的变化。
脱氢抗坏血酸还原酶 (Dehydroascorbate reductase,DHAR)酶活性的测定:测定的反应体系为50 μL 4 mmol/L DHA、25 μL 100 mmol/L GSH、905 μL 0.1 mmol/L磷酸钾缓冲液 (1 mmol/L EDTA),加入20 μL酶液后3 min内265 nm处室温记录OD值的变化。
1.2.6 数据统计与分析
试验所获数据为独立3次重复实验的平均值,数据差异性检验分析用 检验 (Student’s test)完成,图的制作用Adobe Illustrator软件完成。
2 结果与分析
2.1 RNAi载体的构建与烟草的遗传转化
从Genbank核酸数据库中调取烟草NtVTC1 基因序列,将烟草NtVTC1 基因和植物中NtVTC1 基因编码的氨基酸序列进行序列比对,选择编码VTC1蛋白N端催化结构域56-134保守序列的168-402核酸序列设计引物,按照图1所示构建干扰表达载体。利用叶盘法将RNAi干扰表达载体遗传转化烟草。

图1 RNAi-NtVTC1载体构建示意图Fig.1 Schematic diagram of NtVTC1 RNAi vector construction
2.2 RI转基因烟草株系鉴定和表达量检测
将获得的NtVTC1 基因抑制表达的阳性转基因烟草株系RI进行基因表达检测,结果如图2所示,NtVTC1 基因的RT-PCR和qRT-PCR结果表明:与野生型烟草WT相比,转基因株系RI中NtVTC1 基因的表达量较低,说明构建的NtVTC1 基因RNAi载体能够有效干扰靶标基因 的表达,获得的3个转基因株系中NtVTC1 基因的表达获得了显著的抑制,可以用于后续的实验分析。
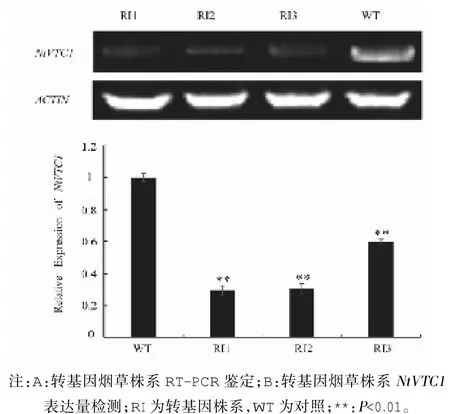
图2 RI转基因烟草株系 表达量检测Fig.2 RT-PCR Identifications and Relative Expression analysis of in RI transgenic lines
2.3 RI转基因烟草株系AsA含量分析
为了研究NtVTC1 基因调控AsA合成的功能,进一步测定了RI转基因株系的AsA含量,结果显示:与对照WT相比,不同的RI转基因烟草株系 (RI1、RI2、RI3)中AsA含量均显著降低,最高的降低了约60%(图3),表明NtVTC1 基因能够调控烟草中 AsA的合成。

图3 RI转基因烟草株系AsA含量检测Fig.3 Measurement of AsA content of transgenic lines
2.4 RI转基因烟草株系叶片表型观察和长度统计
对RI转基因烟草株系的生长表型观察发现:与野生型烟草相比,RI烟草的生长发育严重受到了抑制,苗期表现出生长发育迟缓的表型(图 4、图 5),花期表现出开花延迟的现象(图4)。有研究报道基因与细胞伸长发育密切相关,我们前期的研究也发现棉花NtVTC1 基因的表达与纤维的伸长发育联系紧密,因此,我们测定了烟草叶片的长度,结果显示:与野生型烟草叶片相比,RI转基因烟草株系叶片的的长度显著变短,长度仅约为WT的64%(图5),表明 的抑制表达对显著抑制了烟草叶片的延展发育。

图4 RI转基因烟花期表型分析Fig.4 Flowering phenotype analysis of RI transgenic tobacco plants

图5 RI转基因烟草株系叶片表型分析Fig.5 Leaf phenotype analysis of RI transgenic tobacco plant lines
2.5 RI转基因烟草株系抗氧化系统酶活性分析
作为细胞内重要的还原性物质和抗氧化系统的重要分子,AsA的含量变化会影响整个抗氧化系统酶的变化。
对RI转基因烟草株系进行抗氧化系统的主要酶APX、GR、CAT和DHAR活性测定发现:与野生型烟草相比,转基因烟草RI的抗氧化系统酶APX、GR、CAT和DHAR活性均表现出显著的下降,其活性分别降低了约38%、35%、30%和22%。结果表明:抗氧化系统酶活性的降低可能是导致RI转基因烟草生长发育迟缓的原因之一。

图6 RI转基因烟草株系抗氧化系统酶活性分析Fig.6 Antioxidant enzyme activity analysis of RI transgenic tobacco plant lines
3 讨论
VTC1是植物细胞中抗坏血酸合成L-半乳糖途径中第一个关键酶,其通过催化D-甘露糖-1-P生成GDP-D-甘露糖,GDP-甘露糖是原核生物和真核生物细胞代谢的重要物质[18]。已从土豆[19]、烟草[20]、拟南芥[21]等植物中克隆了NtVTC1 基因。本研究以烟草
基因为研究对象,通过将其编码的蛋白质与其他植物 蛋白质进行比对,选择NtVTC1 基因编码的保守催化结构域序列,构建RNAi干扰表达载体图1),并通过叶盘法转化烟草,获得反义表达烟草NtVTC1 基因的RI转基因烟草株系。与野生型烟草相比,RI转基因烟草AsA含量仅达到野生型的40%(图3),说明NtVTC1 基因抑制表达能够显著降低植物细胞内AsA的含量,NtVTC1 基因的表达直接调控着植物细胞内AsA合成。近年来已有许多研究表明 能够调控植物细胞内AsA的生物合成,Keller等[22]获得了转反义NtVTC1 基因的马铃薯,发现转基因植株AsA含量比对照下降;Conklin[21]等对拟南芥抗坏血酸缺陷突变体vct1的研究发现与野生型相比,突变体中AsA含量比野生型低30%;Badejo等[23]发现提高NtVTC1 基因的表达水平可以增加殷桃果实成熟过程中的AsA含量。
RNAi通过引入与内源靶基因具有相同序列的双链RNA,从而诱导内源靶基因的 mRNA降解,达到抑制基因表达的目的[24],通常选择基因的保守序列作为干扰序列参考会达到较好的干扰效果。Lawerence等[25]使用RNAi的方法通过对拟南芥天然四倍体的研究表明,通过合理设计双链RNA可以有效的同时对一个基因家族的基因表达进行沉默。植物细胞中AsA的合成由多个基因编码的酶催化连续的化学反应产生,其中 是第一个关键限速酶,研究表明NtVTC1 基因对植物细胞中AsA的含量起着决定性作用[26]。烟草作为异源四倍体物种,其染色体上可能存在两个高度保守的同源NtVTC1 基因。本研究选择烟草NtVTC1 基因,以其编码 蛋白的N端的保守结构域序列的核酸序列作为参考干扰序列(图1),达到了较好的抑制基因表达效果(图2),并进一步研究其通过影响AsA含量调控植物发育的作用。后期可结合 CRISPR-Cas9基因定点敲除技术获取该基因功能完全缺失的突变体材料,准确验证NtVTC1 基因的功能。
RI烟草转基因株系的生长表现出延迟发育的表型,整个植株的生长和开花均受到显著的抑制(图 4、图 5);尤其是叶片发育显著低于野生型,叶片长度仅为野生型的64%(图5)。有研究证明高含量的AsA促进细胞分裂和生长,Cordoba等[27]发现AsA通过抑制细胞壁固化和增强根的新陈代谢来刺激调节根系的生长;黄文敏等[28]研究发现外源施加2mM AsA能够促进BY2烟草悬浮细胞分裂和生长速度,说明烟草叶片生长受阻可能是由AsA含量降低引起的。RI转基因株系中抗氧化系统酶的活性显著低于野生型烟草(图6),说明 的抑制表达对植物抗氧化系统具有显著的影响,这可能与AsA含量的降低密切相关[29],NtVTC1 基因的表达与植物的抗氧化能力密切相关[13],植物细胞内高含量的AsA将有助于提高抗氧化胁迫的能力。
4 结论
VTC1是调控植物细胞内AsA合成的关键酶,本研究通过构建烟草NtVTC1 基因的烟RNAi干扰载体并遗传转化烟草,转基因烟草表现出在植株生长、叶片延展和开花等方面的显著延迟,并且AsA含量和抗氧化系统酶的表达显著降低。本研究结果为进一步研究NtVTC1 基因的功能及其调控植物发育分子机制解析提供了良好参考。
