基于ATP再生体系快速检测乳品中微生物
2018-02-09伍金娥
常 超,王 凌,伍金娥,*
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.武汉轻工大学 大宗粮油精深加工省部共建教育部重点实验室,农产品加工与转化湖北省重点实验室,湖北 武汉 430023)
近年来,乳品安全成为人们关注的焦点,除了化学源污染以外,微生物超标也备受关注。乳品在整个生产过程中都受到微生物污染的威胁,对乳品生产过程中实施微生物在线监测是保障乳品安全的重要手段。目前检测乳品微生物的方法主要有传统的培养方法[1-2]、聚合酶链式反应(polymerase chain reactions,PCR)[3]、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)[4]等,这些方法虽然准确,但具有耗时、不易在线监测和在基层推广使用等缺点,研发乳品微生物快速检测方法显得尤为迫切。
三磷酸腺苷(adenosine triphosphate,ATP)生物发光法是一种快速、便捷、易于操作的方法,整个检测过程仅为数分钟,其原理是将细菌内的ATP以自由的可溶解的状态释放出来,在有荧光素酶、镁、氧气存在条件下与虫荧光素发生反应产生荧光,通过荧光信号的强弱计算出测出ATP的含量,即可推算出样品中的含菌量[5-8],反应过程见图1主反应。传统的ATP生物发光目前成功用于检测细菌[9-13]、酵母[14]以及其他真菌[15-17],并且与平板计数法具有良好的相关性[18],但是灵敏度不高,仅能检测细菌数103~104CFU/mL[19-20],制约了该技术的应用。国内外的研究人员仍在不断尝试通过多种方式降低该方法的检测限,其中建立ATP再生系统以提高反应体系中的荧光信号值,是一种非常有效的解决方法[21-27]。所谓ATP再生系统是指利用生物发光主反应产物焦磷酸(pyrophosphoric acid,PPi)和一磷酸腺苷(adenosine monophosphate,AMP)为原料,加入相应的底物和酶系,使得PPi或AMP再生成ATP,增强反应体系的荧光信号,提高方法的灵敏度,两条再生路线见图1[25]。现有的文献报道大多选择两条路线同时再生以提高方法的灵敏度,但是这样使得反应体系中酶系较多,酶促反应相互干扰,造成测定结果不稳定,重复性差,实际运用多用于在环境、水质监测[28-33],很少有食品基质的报道,并且已报道的生物发光法大多建立的是以ATP标准品为检测对象的标准曲线,较少建立以菌液为检测对象的工作曲线,以ATP标准品为检测对象的标准曲线存在结果偏大的问题。此外,据文献报道PPi再生ATP途径转化效率高,是ATP再生优选的途径[26]。因此,本研究选择路线1再生ATP途径(图1虚线),利用ATP硫酸化酶(ATP sulfurylase,ATPS)/腺苷酰硫酸(adenosine phosphosulfate,APS)系统实现ATP再生,偶联传统的生物发光法,减少试剂的使用,简化操作,优化各反应条件,建立混合菌液工作曲线,改进乳品基质前处理程序,评价方法的灵敏度、准确度、精密度和稳定性,实现对乳品中微生物灵敏快速检测,具有一定创新性和重要的经济价值。

图1 ATP再生途径Fig. 1 Recycling pathways for ATP amplification system
1 材料与方法
1.1 材料与试剂
鲜奶、奶粉 武汉中百超市;萤火虫荧光素酶、D-虫荧光素 美国Promega公司;APS、ATPS、ATP水解酶、牛血清白蛋白(bovine serum albumin,BSA)、ATP标准品 美国Sigma公司;其他试剂均为国产AR级;大肠杆菌(Escherichia coli)、铜绿假单胞菌(Pseudomonas aeruginosa)由武汉轻工大学教育部大宗粮油精深加工省部共建重点实验室保藏。
1.2 仪器与设备
BHP9505-03型ATP快速检测仪 北京滨松光子技术股份有限公司;Milli-Q超纯水器 美国Millipore公司。
1.3 方法
1.3.1 生物发光主反应条件的确定
参考本实验室前期研究结果[34],生物发光主反应条件为D-荧光素质量浓度70 mg/L、萤火虫荧光素酶质量浓度50 mg/L、Mg2+浓度0.25 mmol/L、Tris浓度25 mmol/L、BSA质量浓度0.5 mg/L、反应时间15 s、反应温度室温(25~30 ℃)。
1.3.2 PPi再生ATP循环条件的确定
采用单因素试验优化PPi再生ATP反应条件。固定ATPS活力(0.2 U/mL),加入不同浓度的APS(0~50 µmol/L)和10-11mol/mL PPi(相当于107CFU/mL),观察不同浓度APS对荧光信号的影响,确定最佳APS浓度。同理,考察不同ATPS活力(0~0.2 U/mL)、pH(7.5~8)对ATP再生的影响,确定最佳ATPS活力、最佳反应pH值。
1.3.3 工作曲线的建立
在最优的PPi再生ATP条件下偶联生物发光主反应建立混合菌液工作曲线。将大肠杆菌和铜绿假单胞菌配制成102~107CFU/mL混合菌液(浓度比1∶1),利用ATP再生系统结合的生物发光法检测其相对发光强度(relative luminescence,RLU),以菌液浓度的对数值(lg(CFU/mL))为横坐标,lg(RLU)为纵坐标,绘制工作曲线。
1.3.4 最低检测能力的确定
用系列浓度的ATP标准品(10-18~10-14mol/mL)、大肠杆菌(10~105CFU/mL)、铜绿假单胞菌(10~105CFU/mL)评价偶联方法的最低检测限,同时与传统的ATP生物发光法进行对比,考察偶联方法的灵敏度。
1.3.5 准确度、精密度、稳定性的测定
选择无菌水样、鲜奶、奶粉3 种基质,添加3 个水平的大肠杆菌,测定回收率,评价方法的准确度和精密度。测定103CFU/mL和105CFU/mL的大肠杆菌各10 次,评价方法的重复性及稳定性。
1.3.6 与传统方法的比较
制备20 个鲜奶样品,采用偶联方法和平板计数方法测定同一个样品,考察两种方法的相关性。平板计数操作参考GB/T 4789.2—2010《食品微生物学检验 菌落总数测定》[35]。
1.3.7 测定程序及样品前处理
1.3.7.1 方法测定简要程序
测定前向无菌测试杯中依次加入25 mmol/L Tris、0.5 mg/L BSA、0.25 mmol/L Mg2+、10 µmol/L APS、0.15 U/mL ATPS、70 mg/L D-荧光素、50 mg/L萤火虫荧光素酶,无菌加样器吸取10 μL ATP提取液或ATP标准溶液于反应体系中,反应体系pH 7.8,反应15 s检测发光值。
1.3.7.2 改进样品前处理程序
奶粉用无菌水5 倍稀释,鲜奶和水样无需稀释,取待测样品加入等体积的0.4% Triton X-100溶液,再加入0.15 U/mL ATP水解酶水解5 min,95 ℃加热时间10 min,上机检测。
2 结果与分析
2.1 ATP再生循环条件

图2 APS浓度(A)、ATPS活力(B)、pH值(C)对PPi再生ATP再生循环的影响Fig. 2 Effects of APS concentration (A), ATPS activity (B) and pH (C) on ATP generation from PPi
如图2A所示,当APS浓度超过10 µmol/L,RLU趋于平稳,故APS最佳浓度为10 µmol/L。如图2B所示,当ATPS活力超过0.15 U/mL,RLU趋于平稳,故最佳ATPS活力为0.15 U/mL。如图2C所示,当pH值增加到7.8时,反应体系的RLU达到峰值,故pH值选择7.8。
2.2 工作曲线
在最佳ATP再生条件下偶联生物发光法,以菌液浓度的对数值(lg (CFU/mL)) 为横坐标、lg(RLU)为纵坐标,建立大肠杆菌和铜绿假单胞菌混合菌液(浓度比1∶1)工作曲线,曲线在102~107CFU/mL范围内,线性关系好,回归方程y=0.72x+0.29,R=0.984。
2.3 最低检测限
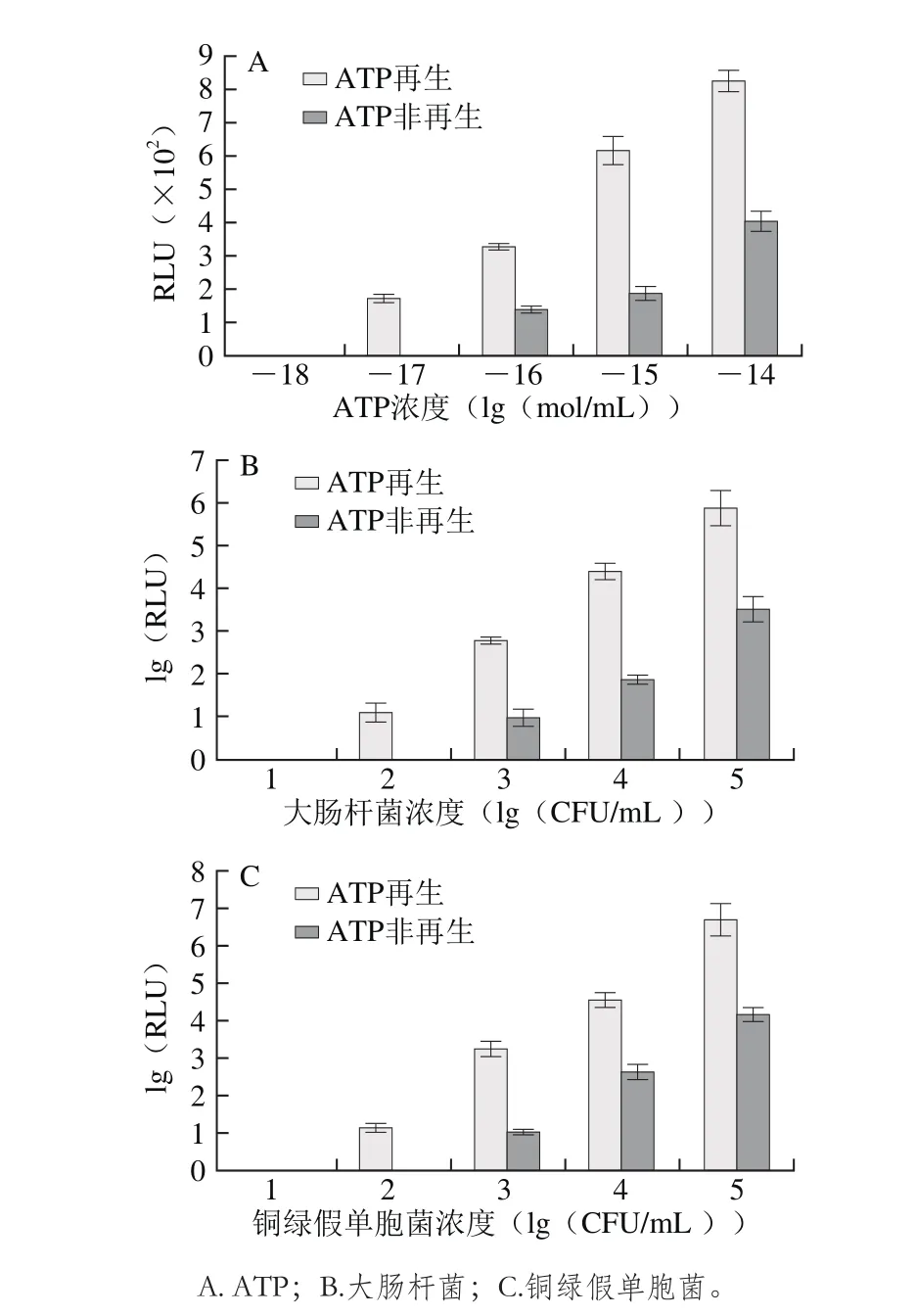
图3 ATP再生与非再生体系最低检测限Fig. 3 Lowest detection limits in ATP amplification system and ATP nonamplification system
分别用系列浓度的ATP标准品(10-18~10-14mol/mL)、大肠杆菌(10~105CFU/mL)、铜绿假单胞菌(10~105CFU/mL)在ATP再生和非再生检测体系中进行灵敏度对比实验,考察ATP标准品、大肠杆菌、铜绿假单胞菌在两种检测体系中的检测限。如图3所示,传统ATP生物发光法即ATP非再生检测体系对ATP标准品、大肠杆菌、铜绿假单胞菌的检测限分别为10-16mol/mL、103CFU/mL和103CFU/mL,但偶联ATP再生反应后,表现更低的检测限,灵敏度下降了一个数量级,分别为10-17mol/mL、102CFU/mL和102CFU/mL,低于现有文献报道的103CFU/mL[12-13]。我国最新国家乳品标准GB 19644—2010《乳粉》规定乳粉微生物标准5×105CFU/mL,原料奶微生物标准105CFU/mL,本方法线性范围为102~107CFU/mL,对菌液的检测限为102CFU/mL,因此能够更灵敏地完成对乳品微生物检测。
2.4 回收率及变异系数

表1 回收率及变异系数(n=5)Table1 Recoveries and coefficients of variation of E. coli in spiked samples (n= 5)
快速、易于在线监测乳品微生物动态变化等优势,是检测乳品微生物一种可靠的替代方法。

图5 鲜奶样品中ATP再生生物发光法与平板计数法的相关性Fig. 5 Correlation between the presented method and the plate count method for fresh milk
3 讨 论
如表1所示,3 种基质中回收率为81.33%~97.78%,变异系数为14.24%~22.17%,除了个别组变异系数超过20%,这与微生物在实验操作过程中较化学物质具有不稳定性有关,其他均小于20%,达到检测方法对回收率和变异系数的要求。乳品基质与水样结果比较可知,乳品基质对样品的测定干扰较小,表明本实验改进的样品前处理方法可行。
2.5 稳定性实验结果
测定103CFU/mL和105CFU/mL的大肠杆菌各10 次,评价方法的重复性及稳定性。图4显示在103、105CFU/mL两个浓度下,其荧光值在均值上下波动,波动范围较小,重复性好,测定结果稳定。

图4 方法的稳定性Fig. 4 Stability analysis of the method for detection of E. coli at concentrations of 103 and 105 CFU/mL
2.6 方法的考察结果
采用偶联方法测定人为制备未知浓度的20 个鲜奶样品,同时进行平板计数,比较与国标方法的相关性。如图5所示,两种方法检测具有良好的相关性(R=0.96),表明本方法测定结果可靠,较国标方法具有操作简单、
乳品微生物监测是控制乳品质量安全的重要技术手段之一,但目前实际应用的多为培养方法[1-2]、PCR[3]、ELISA[4]等,这些方法存在检测结果滞后等问题。ATP再生循环系统偶联生物发光法具有快速、准确等优势,适用于在线监测和在基层推广使用。本研究表明,ATP再生循环系统偶联生物发光法对ATP标准品、大肠杆菌、铜绿假单胞菌的检测限分别为10-17mol/mL、102CFU/mL和102CFU/mL,对乳品基质的回收率为81.33%~97.78%,变异系数为14.24%~22.17%,与国标平板计数法具有良好的相关性。本方法是一种灵敏、准确、简单的检测方法。
方法学转化成试剂盒是检测方法能否实际运用的关键一步,由于本研究体系中应用酶系较多,酶的稳定性以及酶的保护剂对方法学指标的影响有待进一步研究。
[1] 孟宪梅, 杨志国, 孙肖明. 原料乳细菌总数快速检测方法研究进展[J]. 食品研究与开发, 2014, 35(23): 138-141. DOI:10.3969/j.issn.1005-6521.2014.23.038.
[2] 王洪亮, 程艳宇, 王梦晓. 食品中金黄色葡萄球菌定量检测方法的研究[J]. 食品研究与开发, 2016, 37(9): 185-187. DOI:10.3969/j.issn.1005-6521.2016.09.044.
[3] 盖冬雪, 任洪林, 卢士英, 等. 乳品中大肠杆菌PMA-qPCR活菌检测方法的建立[J]. 中国畜牧兽医, 2016, 43(2): 493-498.
[4] 兰欣怡, 刘慧敏, 郑楠, 等. 免疫分离技术在生鲜乳致病菌检测中的研究进展[J]. 中国农业科学, 2015, 48(增刊1): 49-57. DOI:10.3864/j.issn.0578-1752.2015.S.006.
[5] ADDANKI S, SOTOS J F, REARICK P D. Rapid determination of picomole quantities of ATP with a liquid scintillation counter[J].Analytical Biochemistry, 1966, 14(2): 261-264. DOI:10.1016/0003-2697(66)90135-7.
[6] FRAGA H. Firefly luminescence: a historical perspective and recent developments[J]. Photochemical & Photobiological Sciences, 2008,7(2): 146-158. DOI:10.1007/978-1-4020-9272-5_2.
[7] 李利霞, 伍金娥, 常超, 等. ATP生物发光检测技术的建立及应用可行性分析[J]. 食品科技, 2012, 37(1): 275-278.
[8] 唐倩倩, 叶尊忠, 王剑平, 等. ATP生物发光法在微生物检验中的应用[J]. 食品科学, 2008, 29(6): 460-465. DOI:10.3321/j.issn:1002-6630.2008.06.103.
[9] BOTTARI B, SANTARELLI M, NEVIANI E. Determination of microbial load for different beverages and foodstuff by assessment of intracellular ATP[J]. Trends in Food Science & Technology, 2015,44(1): 36-48. DOI:10.1016/j.tifs.2015.02.012.
[10] HAN T, WREN M, DUBOIS K, et al. Application of ATP-based bioluminescence for bioaerosol quantification: effect of sampling method[J]. Journal of Aerosol Science, 2015, 90: 114-123.DOI:10.1016/j.jaerosci.2015.08.003.
[11] LEE J Y, DEININGER R A. Detection of E. coli in beach water within 1 hour using immunomagnetic separation and ATP bioluminescence[J].Luminescence, 2004, 19(1): 31-36. DOI:10.1002/bio.753.
[12] CHENG Y, LIU Y, HUANG J, et al. Combining biofunctional magnetic nanoparticles and ATP bioluminescence for rapid detection of Escherichia coli[J]. Talanta, 2009, 77(4): 1332-1336. DOI:10.1016/j.talanta.2008.09.014.
[13] QIU J M, ZHOU Y, CHEN H, et al. Immunomagnetic separation and rapid detection of bacteria using bioluminescence and microfluidics[J].Talanta, 2009, 79(3): 787-795. DOI:10.1016/j.talanta.2009.05.003.
[14] 王凌, 伍金娥, 常超, 等. ATP生物发光法检测布拉氏酵母菌总数的研究[J]. 食品工业科技, 2013, 34(7): 330-332.
[15] LEE J Y, DEININGER R A. A rapid screening method for the detection of viable spores in powder using bioluminescence[J]. Luminescence,2004, 19(4): 209-211. DOI:10.1002/bio.775.
[16] 丛苑, 卢彦廷, 杜奕君, 等. ATP发光法快速检测玉米中的霉菌[J].中国食品学报, 2014, 14(8): 233-239.
[17] RAKOTONIRAINY M S, HERAUD C, LAVÉDRINE B. Detection of viable fungal spores contaminant on documents and rapid control of the effectiveness of an ethylene oxide disinfection using ATP assay[J].Luminescence, 2003, 18(2): 113-121. DOI:10.1002/bio.710.
[18] CHEN F C, GODWIN S L. Comparison of a rapid ATP bioluminescence assay and standard plate count methods for assessing microbial contamination of consumers’ refrigerators[J]. Journal of Food Protection, 2006, 69(10): 2534-2538. DOI:10.4315/0362-028X-69.10.2534.
[19] COSTA P D, ANDRADE N J, BRANDÃO S C C, et al. ATP-bioluminescence assay as an alternative for hygiene-monitoring procedures of stainless steel milk contact surfaces[J]. Brazilian Journal of Microbiology, 2006, 37(3): 345-349. DOI:10.1590/S1517-83822006000300026.
[20] UKUKU D O, SAPERS G M, FETT W F. ATP bioluminescence assay for estimation of microbial populations of fresh-cut melon[J]. Journal of Food Protection, 2005, 68(11): 2427-2432. DOI:10.4315/0362-028X-68.11.2427.
[21] SATOH T, SHINODA Y, ALEXANDROV M, et al. Continuous-flow ATP amplification system for increasing the sensitivity of quantitative bioluminescence assay[J]. Analytical Biochemistry, 2008, 379(1): 116-120. DOI:10.1016/j.ab.2008.04.045.
[22] KAMEDA A, SHIBA T, KAWAZOE Y, et al. A novel ATP regeneration system using polyphosphate-AMP phosphotransferase and polyphosphate kinase[J]. Journal of Bioscience and Bioengineering,2001, 91(6): 557-563. DOI:10.1016/S1389-1723(01)80173-0.
[23] RESNICK S M, ZEHNDER A J B. In vitro ATP regeneration from polyphosphate and AMP by polyphosphate: AMP phosphotransferase and adenylate kinase from Acinetobacter johnsonii 210A[J].Applied and Environmental Microbiology, 2000, 66(5): 2045-2051.DOI:10.1128/AEM.66.5.2045-2051.2000.
[24] SATOH T, KATO J, TAKIGUCHI N, et al. ATP amplification for ultrasensitive bioluminescence assay: detection of a single bacterial cell[J]. Bioscience, Biotechnology, and Biochemistry, 2004, 68(6):1216-1220. DOI:10.1271/bbb.68.1216.
[25] LEE H J, HO M R, BHUWAN M, et al. Enhancing ATP-based bacteria and biofilm detection by enzymatic pyrophosphate regeneration[J].Analytical Biochemistry, 2010, 399(2): 168-173. DOI:10.1016/j.ab.2009.12.032.
[26] LEE H J, HO M R, TSENG C S, et al. Exponential ATP amplification through simultaneous regeneration from AMP and pyrophosphate for luminescence detection of bacteria[J]. Analytical Biochemistry, 2011,418(1): 19-23. DOI:10.1016/j.ab.2011.07.013.
[27] 陈颖, 邹秉杰, 朱术会, 等. 利用ATP扩增反应与生物发光法结合检测微量微生物[J]. 微生物学报, 2009, 49(6): 826-830. DOI:10.3321/j.issn:0001-6209.2009.06.019.
[28] WHITEHEAD K A, SMITH L A, VERRAN J. The detection of food soils and cells on stainless steel using industrial methods: UV illumination and ATP bioluminescence[J]. International Journal of Food Microbiology, 2008, 127(1): 121-128. DOI:10.1016/j.ijfoodmicro.2008.06.019.
[29] 侯玉柱, 田雨, 柯润辉, 等. ATP生物发光法快速测定物体表面的菌落总数[J]. 食品与发酵工业, 2015, 41(2): 217-220.
[30] 张凤兰, 徐潇, 王海燕, 等. ATP生物发光法评价餐饮具的微生物污染研究[J]. 食品安全质量检测学报, 2016, 7(3): 911-916.
[31] 张秋卓, 毛映丹, 杨洁, 等. 利用ATP生物发光法快速检测丽娃河中细菌总数[J]. 环境科学与技术, 2011, 34(7): 152-155. DOI:10.3969/j.issn.1003-6504.2011.07.036.
[32] 刘阳, 牟金明. ATP生物发光法在快速检测物体表面清洁度中的应用[J]. 安徽农业科学, 2016(1): 125-128. DOI:10.3969/j.issn.0517-6611.2016.01.042.
[33] 王惠荣, 池勇志, 辛丽花, 等. ATP生物发光法在饮用水和再生水活菌生物量快速检测中的应用[J]. 给水排水, 2016, 42(4): 27-33.DOI:10.3969/j.issn.1002-8471.2016.04.006.
[34] 李利霞, 伍金娥, 常超, 等. 优化的ATP生物发光法快速检测面粉中细菌总数[J]. 安徽农业科学, 2011, 39(7): 4055-4057. DOI:10.3969/j.issn.0517-6611.2011.07.110.
[35] 卫生部. 食品微生物学检验 菌落总数测定: GB/T 4789.2—2010[S].北京: 中国标准出版社, 2010: 1-4.
