异甘草素对失血性休克大鼠动物模型肾脏EPCR表达的影响及其肾脏功能保护机制
2018-02-05展翔
展 翔
0 引言
研究表明,大约1/3的失血性休克(Hemorrhagic shock,HS)患者会发生急性肾损伤(Acute kidney injury,AKI)[1]。AKI会导致HS患者多器官衰竭发病率和死亡率增加[2]。肾脏组织对血液低灌注和缺氧非常敏感[3]。目前,已将抗炎和抗凝列为HS新的治疗靶点。血管内皮细胞广泛参与机体的炎症反应与凝血过程。近年来发现,内皮细胞蛋白C受体(Endothelial protein C receptor,EPCR)是新型蛋白受体,是体内蛋白激酶C系统的重要组成[4-5]。在血管内皮细胞受到损伤后,内皮细胞释放大量EPCR,增加了血浆中的可溶性EPCR。目前,血管内皮细胞受损可采用血浆中可溶性EPCR的水平来体现与表征。
异甘草素(Isoliquiritigenin,ISO)作为异黄酮类化合物的一种,在豆科植物甘草的根、黄芪、滇黄精的根、豆芽、鹰嘴豆的幼苗、串果藤、香殊兰的球茎等中大量存在[6-7]。异甘草素在抗病毒、抗炎、抗血管生成、催眠等方面具有较好的效果,现代药理学研究发现,其可以降低TNF-α等炎症因子的表达,减轻血管内皮细胞的损伤[8-9]。本研究旨在通过失血性休克大鼠模型,以血清尿素氮和肌酐水平以及肾组织EPCR的表达水平为研究指标,观察HS前后的改变,初步探讨HS早期AKI损伤的发生机制以及异甘草素的干预作用。
1 材料与方法
1.1 试剂与仪器 戊巴比妥钠、林格液和异甘草素购自上海阿拉丁试剂有限公司,Trizol试剂盒购自美国Invitrogen公司,琼脂糖凝胶购自美国Sigma公司,兔抗大鼠EPCR单克隆抗体、β-actin抗体和二抗购自美国R&D Systems公司;UniCel DxC 800型全自动生化分析仪来源于美国Beckman Coulter公司,Gene Amp PCR System 2400型购自美国PE等。
1.2 动物分组 成年SD大鼠75只,雄性,周龄7周左右,体重250~300 g,由实验动物中心提供。随机分为5组:空白对照组(C组)、假手术组(S组)、失血性休克组(HS组)、林格液复苏组(R组)和异甘草素复苏组(I组),每组15只。动物房温度维持在(25.0±0.5)℃,采用常规饲料喂养,自由饮水。
1.3 失血性休克模型的建立 参考Umeda等[10]的方法。50 mg/kg戊巴比妥钠腹腔注射,待麻醉后将其仰卧并于鼠板上固定。C组:无其他操作,6 h后取外周血和肾组织。其余四组均进行股动静脉插管。分离右侧股动脉,使用PowerLab 15T行动脉插管,通过三通及压力传感器,动脉插管与多功能监护仪相连,对平均动脉压进行监测。经股静脉放血,液体复苏。S组:动静脉插管后无其他操作,在6 h后对外周血和肾组织进行取样。HS组:在插管成功后15 min内进行放血,并使MAP降至35 mmHg,使其稳定60 min,即为HS造模成功。6 h后取外周血和肾组织。林格液复苏组:造模成功后,30 min内输注3倍失血量的林格液复苏。于造模成功6 h后取外周血和肾组织。I组:异甘草素20 μg/mL,再输入林格液补充至失血量3倍,所有液体在30 min内输完。于造模成功6 h后取外周血和肾组织。
1.4 反转录多聚酶链反应(RT-PCR) 应用RT-PCR检测肾组织EPCR mRNA的表达。参考上海生工生物工程技术服务有限公司基因库设计合成,EPCR引物系列:上游引物:5′-TCTACCTGTCCCAGTTCAA-3′;下游引物:5′-CATACCGAGTCCGATTGT-3′。β-actin引物系列:上游引物:5′-AAAGAAAGGGTGTAAAACGCA-3′;下游引物:5′-TCAGGTCATCACTATCGGCAAT-3′。采用Trizol试剂盒对总RNA进行提取。按Takara公司说明书步骤在Gene Amp PCR System 2400型严格操作反转录合成cDNA。PCR循环条件:94 ℃预变性5 min,94 ℃变性30 s,EPCR 53.3 ℃,β-actin 58 ℃,分别退火30 s,72 ℃延伸1 min,共30~32个循环;循环结束后于72 ℃延伸5 min,-20 ℃保存备用。将5 μL PCR扩增产物与1 μL 6×Loading buffer液相混匀后进行琼脂糖(1.5%)电泳,5 V/cm条件,灰度扫描采用Gel 3.0进行分析。目的基因mRNA水平的相对指标为目的基因与β-actin的PCR产物条带的灰度之比。
1.5 Western blot检测 肾脏组织经过研磨、裂解后,通过酶标仪测定蛋白浓度。上样总蛋白质量为80 μg,经SDS-PAGE凝胶电泳分离后,将蛋白质通过电印迹转移法转至PVDF膜,采用丽春红S染色,并根据所需要的目标条带进行剪膜,用含有脱脂奶粉(质量浓度为5%)的TBS-T溶液在室温下封闭2 h,分别加入兔抗大鼠EPCR单克隆抗体和β-actin抗体,于4 ℃下过夜孵育,在室温下采用TBS-T溶液洗膜,随后加入二抗进行孵育2 h,用TBS-T溶液洗膜后与ECL试剂进行反应,胶片曝光,扫描胶片,用Image J软件计算条带光密度(OD)值,以EPCR与β-actin条带的OD比值来评定蛋白质的表达水平。
1.6 病理损伤评分系统 肾小管受损采用以下损伤评分系统:0分:没有肾小管上皮细胞凋亡、管腔扩张或出血;1分:<5%的肾小管出现上皮细胞凋亡,管腔扩张或出血;2分:5%~25%的肾小管出现上皮细胞凋亡,管腔扩张或出血;3分:25%~75%的肾小管出现上皮细胞凋亡,管腔扩张或出血;3分:>75%的肾小管出现上皮细胞凋亡,管腔扩张或出血。
1.7 血清尿素氮和肌酐水平检测 取大鼠外周血2 mL,3 000 r/min离心15 min,取上层血清,采用UniCel DxC 800型全自动生化分析仪(Beckman Coulter,美国)测量血清尿素氮和肌酐水平。
2 结果
2.1 大鼠肾组织EPCR mRNA水平比较 与C组比较,S组肾组织EPCR mRNA的表达有所增加,但差异无统计学意义(P>0.05);与C组和S组比较,HS组肾组织EPCR mRNA的表达显著增加,差异有统计学意义(P<0.05);与HS组比较,R组肾组织EPCR mRNA的表达明显降低,差异有统计学意义(P<0.05);与HS组和R组比较,I组肾组织EPCR mRNA的表达显著降低,差异有统计学意义(P<005)。见图1。
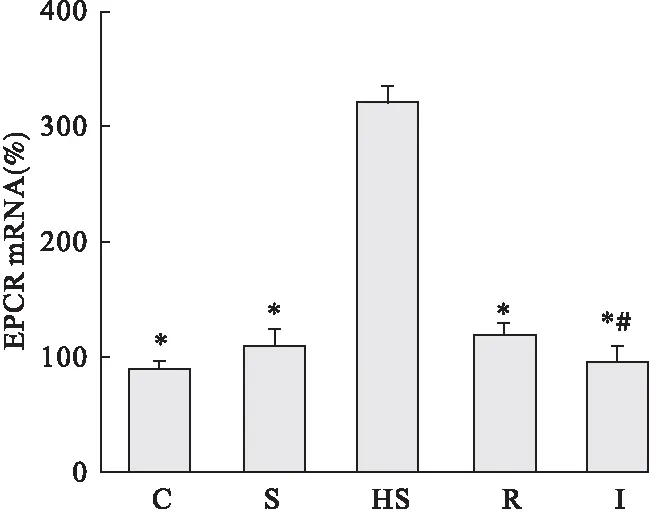
图1 大鼠肾组织EPCR mRNA水平比较
2.2 大鼠肾组织EPCR蛋白质水平比较 与C组比较,EPCR蛋白质肾组织的表达在S组稍有增加,但是差异无统计学意义(P>0.05);与C组和S组比较,HS组均明显增加,差异有统计学意义(P<0.05);与HS组比较,林格液复苏后表达显著降低,差异有统计学意义(P<0.05);I组较HS组和R组的肾组织EPCR 蛋白质表达亦明显下降,差异有统计学意义(P<0.05),见图2。

图2 大鼠肾组织EPCR蛋白质水平比较
2.3 大鼠血清尿素氮和肌酐水平比较 与C组比较,S组血清尿素氮和肌酐的水平提升,但是差异无统计学意义(P>0.05);与C组和S组比较,HS组均有明显增加,差异有统计学意义(P<0.05);与HS组比较,林格液复苏后水平显著降低,差异有统计学意义(P<0.05);与HS组和R组比较,I组的血清尿素氮和肌酐的水平也显著降低,且差异有统计学意义(P<0.05)。见表1。

表1 大鼠血清尿素氮和肌酐水平比较
注:与HS组比较,*P<0.05;与R组比较,#P<0.05
2.4 大鼠肾脏组织损伤情况比较 HS组损伤评分明显高于C组与S组,差异有统计学意义(P<0.05);林格液和异甘草素复苏后,肾脏组织损伤明显减轻,损伤评分明显低于HS组,差异有统计学意义(P<0.05)。见图3。
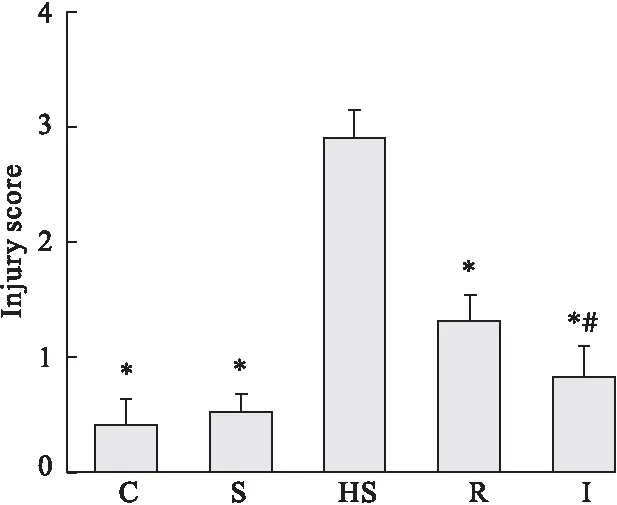
图3 大鼠的肾组织损伤评分比较
3 讨论
血管内皮细胞广泛参与机体的炎症与凝血过程。在机体发生HS时,血管内皮细胞大量表达各种免疫分子,如:Toll样受体、补体受体及T淋巴细胞共刺激分子等。1994年,Fukudome等[11]首次根据基因克隆技术从内皮细胞基因文库中获得了一种能够编码蛋白质C结合位点的蛋白,即EPCR。EPCR分子结构与主要组织相容性复合物Ⅰ型分子相似,因此是一种Ⅰ型跨膜蛋白。EPCR通过与蛋白质C结合,可使蛋白质C的活化效率提高5~20倍[12]。EPCR在机体内以结合型和可溶型2种形式存在,结合型EPCR主要存在于大血管内皮细胞的表面,可溶型EPCR(sEPCR)来自于结合型EPCR。当内毒素或凝血酶与大血管内皮细胞接触时,其通过蛋白酶介导结合型EPCR从血管内皮细胞表面脱落,以sEPCR的形式进入循环系统[13-14]。目前,有学者将血浆中sEPCR的水平作为反映血管内皮细胞受损的生物标志物[15]。
本研究结果表明,与C组比较,S组肾组织EPCR mRNA和蛋白质表达升高,但差异无统计学意义,表明创伤对肾脏组织EPCR的表达起到了诱导提升的作用,这可能与创伤导致的机体应激反应导致肾小管血管内皮细胞损伤有关。但是,因本研究S组的创伤较轻微(仅仅暴露了左股动静脉),其程度不足以导致肾组织EPCR mRNA和蛋白质的表达升高到有统计学意义的程度。HS组肾组织EPCR mRNA和蛋白质的表达显著高于C组和S组,说明除创伤因素诱导肾小管血管内皮细胞受损之外,短时间内大量失血导致的休克参与诱导肾脏组织EPCR mRNA和蛋白质表达水平的增加。这可能是体内多种炎症细胞因子共同作用的结果。经液体复苏后,R组和I组肾脏组织EPCR mRNA和蛋白质的表达显著低于HS组,表明失血性休克前期经过充足的液体复苏,使血液得到了充分的补充,林格液和异甘草素都可以改善机体的微循环,以保护肾小管血管内皮细胞。另外,I组的EPCR mRNA和蛋白质表达水平更低,提示其抗凝和抗炎活性较高,与林格液比较,能够更加有效地保护肾小管血管内皮细胞。另外,与C组比较,S组大鼠肾组织血清尿素氮和肌酐水平增加,但差异无统计学意义,说明创伤在一定程度上影响肾脏功能。HS组明显高于C组和S组,提示除创伤因素导致肾功能障碍外,因短时间内大量失血导致肾脏缺氧和血流低灌注,严重影响了大鼠的肾功能。经液体复苏后,R组及I组大鼠血清尿素氮和肌酐水平明显低于HS组,提示失血性休克早期经过充分的液体复苏,血液得到了补充,纠正了肾脏缺氧和血流低灌注,从一定程度上恢复了肾脏的正常功能。C组与S组的肾小管形态基本正常,HS组可见大量的肾小管上皮细胞损伤,损伤评分明显高于C组与S组;经过林格液和异甘草素复苏后,肾脏组织损伤明显减轻。从形态学的角度再次证实了异甘草素可以保护失血性休克大鼠的肾功能。
综上所述,失血性休克大鼠血清尿素氮和肌酐水平及肾脏组织EPCR表达增加,与失血性休克时急性肾脏损伤有关。异甘草素可以抑制肾组织EPCR的表达,从而起到保护肾脏功能的作用。
[1] Angele MK,Schneider CP,Chaudry IH.Bench-to-bedside review:latest results in hemorrhagic shock[J].Crit Care,2008,12(4):218.
[2] Gomes E,Antunes R,Dias C,et al.Acute kidney injury in severe trauma assessed by RIFLE criteria:a common feature without implications on mortality[J].Scand J Trauma Resusc Emerg Med,2010,18:1.
[3] Bihorac A,Delano MJ,Schold JD,et al.Incidence,clinical predictors,genomics,and outcome of acute kidney injury among trauma patients[J].Ann Surg,2010,252(1):158-165.
[4] Mohan RLV,Esmon CT,Pendurthi UR.Endothelial cell protein C receptor:a multiliganded and multifunctional receptor[J].Blood,2014,124(10):1553-1562.
[5] Navarro S,Bonet E,Estellés A,et al.The endothelial cell protein C receptor:its role in thrombosis[J].Thromb Res,2011,128(5):410-416.
[6] Gong H,Zhang BK,Yan M,et al.A protective mechanism of licorice (Glycyrrhiza uralensis):isoliquiritigenin stimulates detoxification system via Nrf2 activation[J].J Ethnopharmacol,2015,162:134-139.
[7] Zhao Z,Park SM,Guan L,et al.Isoliquiritigenin attenuates oxidative hepatic damage induced by carbon tetrachloride with or without buthionine sulfoximine[J].Chem Biol Interact,2015,225:13-20.
[8] 任欢欢,韩吉春,卢宁,等.异甘草素对心肌缺血再灌注损伤的保护作用[J].石河子大学学报(自然科学版),2016,34(3):343-348.
[9] 杨永明,荔志云.异甘草素对创伤性脑损伤大鼠神经保护作用的实验研究[J].实用临床医药杂志,2014,18(21):1-4.
[10]Umeda K,Takahashi T,Inoue K,et al.Prevention of hemorrhagic shock-induced intestinal tissue injury by glutamine via heme oxygenase-1 induction[J].Shock,2009,31(1):40-49.
[11]Fukudome K,Esmon CT.Identification,cloning,and regulation of a novel endothelial cell protein C/activated protein C receptor[J].J Biol Chem,1994,269(42):26486-26491.
[12]Pendurthi UR,Rao LV.Factor VIIa interaction with endothelial cells and endothelial cell protein C receptor[J].Thromb Res,2010,125(Suppl 1):S19-S22.
[13]Ruf W,Schaffner F.Role of the protein C receptor in cancer progression[J].Thromb Res,2014,133(Suppl 2):S85-S89.
[14]Bouwens EA,Stavenuiter F,Mosnier LO.Mechanisms of anticoagulant and cytoprotective actions of the protein C pathway[J].J Thromb Haemost,2013,11(Suppl 1):242-253.
[15]Sarig G,Meir A,Wollner M,et al.Soluble endothelial protein C receptor and coagulation parameters as prognostic factors in non-small cell lung carcinoma[J].J Thromb Haemost,2013,11(4):768-771.
