MicroRNA-204在非小细胞肺癌患者组织中的表达及对癌细胞增殖和凋亡的影响
2018-02-05许有忠作春李才
许有忠,田 作春,李才
(海南省第三人民医院 心胸外科,海南 三亚 572000)
非 小 细 胞 肺 癌(non-small-cell lung cancer,NSCLC)是癌症死亡的主要原因之一[1]。由于早期诊断率低,只有大约20%的病例能够在早期进行有效的手术切除[2]。此外,非小细胞肺癌复发率高,约50%的患者手术后会发生远处复发。因此,寻找特异性和敏感性均较高的肿瘤标志物,并与多种筛查方法相结合有望提高对非小细胞肺癌的早期诊断。微小RNA(microRNA)在肿瘤组织中性质稳定、功能广泛[3]。研究发现,microRNA-204(miR-204)在子宫内膜样腺癌[4]、鼻咽癌[5]等肿瘤组织中表达降低,并与临床病理特征及预后相关;且上调肿瘤细胞中miR-204,可以抑制细胞增殖及促进肿瘤细胞凋亡、抑制迁移、增加对化疗药物的敏感性。在胆管癌的研究中发现,将miR-204模拟物导入胆管癌细胞系后能够负向调控Bcl-2的表达,且能够促进化疗药物氟尿嘧啶激发的细胞凋亡[6]。但miR-204在非小细胞肺癌中的作用尚不十分明确。本研究通过对NSCLC患者病变组织中miR-204的表达进行检测,以便了解miR-204在非小细胞肺癌中的临床意义,并对miR-204影响癌细胞增殖和凋亡的机制进行初步探究。
1 资料与方法
1.1 临床资料
选择海南省第三人民医院收治的NSCLC患者60例,其中,男性34例,女性26例;年龄42~77岁、平均(56.4±7.9)岁。分别取其肺癌组织及对应的癌旁组织,手术切除标本立即放入液氮中保存,随后转入-80℃冰箱保存备用。同时收集患者临床病理特征资料。所有病例术前均尚未接受化疗或放疗。所有样本均经研究对象同意,并签署知情同意书。
1.2 主要试剂
人非小细胞肺癌A-549细胞株购自上海中国科学院细胞库,F12K培养基、胎牛血清、双抗购自美国Gibco公司,CCK-8细胞增殖检测试剂盒、细胞凋亡检测试剂盒购自南京凯基生物技术公司,RNA提取试剂盒购自美国Omega公司,逆转录试剂盒、DNA Marker、SYBR实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒等均购自大连宝生物工程有限公司。miR-204模拟物、miR-204抑制物及miR-204和内参U6的引物由上海英骏生物技术有限公司设计合成,兔抗人Bcl-2抗体购自美国Cell Signaling Tech nology公司,HRP标记的羊抗兔二抗、兔抗人b-actin购自北京博奥森生物技术有限公司,脂质体2000购自美国Invitrogen公司,BCA试剂盒购自广州碧云天有限公司。
1.3 细胞转染及细胞增殖实验
非小细胞肺癌A-549细胞株培养在37℃、5%二氧化碳CO2饱和湿度细胞培养箱中,细胞培养液为F12K培养基(含有10%胎牛血清、100 u/ml青霉素和100 u/ml链霉素)。转染分为4组:对照组、阴性对照组、miR-204模拟物组、miR-204抑制物组。按说明书将各组转染物与脂质体2000混合静止后转染A-549细胞。另取各组转染48 h后的细胞以100μl/孔(约含1×104个细胞)接种于96孔板中,每组设6个平行孔,细胞培养箱培养24、48和72 h后,各孔加入10μl CCK-8溶液,继续孵育4 h,酶标仪(CliniBiog酶标仪)在450 nm 波长测定各孔吸光度(OD值),以OD值代表细胞相对增殖水平。实验重复3次。
1.4 细胞凋亡情况检测
4组细胞转染后培养48 h,分别取1×105个细胞,1 000 r/min离心5 min,弃上清,加入500μl结合液重悬细胞。随后加入5μl Annexin V-FITC混匀后,加入5μl Propidium Iodide,混匀,室温避光孵育15 min。采用流式细胞仪(BD FACSCzlibur)检测细胞凋亡情况,计算凋亡率。实验重复3次。
1.5 肺癌组织和细胞中总RNA提取及qRT-PCR检测
冻存肺癌组织及其对应癌旁组织各取约100 mg×6份、4组转染后的A-549细胞各收集约1×107个细胞,分别加入1 ml Trizol,用总RNA试剂盒提取总RNA,经紫外分光光度计对提取的总RNA检测纯度及定量。将总RNA按照逆转录试剂盒说明书逆转录成cDNA;取cDNA采用ABI 7500荧光定量PCR仪进行qRT-PCR检测。qRT-PCR反应条件:95℃预变性30 s;95℃ 5 s,60℃ 1 min,共40个循环。引物序列见表1。采用2-ΔΔCt方法表示相对表达量。
1.6 Western blot检测
各组转染细胞培养48 h,胰酶消化收集各组的细胞,蛋白裂解液处理并制备蛋白样品。BCA试剂盒检测蛋白浓度,根据蛋白定量结果调整每孔上样量,将蛋白样品在10% SDS-PAGE胶中进行电泳(Bio-Rad SDS-PAGE电泳仪),电泳结束后用湿转法将蛋白转到PVDF膜上,5%脱脂奶粉室温震荡封闭2 h,TBS-T洗膜后分别加入Bcl-2(1︰1 000稀释)、β-actin(1︰300稀释)一抗,4℃冰箱孵育过夜。TBS-T洗膜后,加入二抗(1︰5 000稀释)室温孵育1 h,加发光液进行化学发光显影,凝胶成像仪(JS-300凝胶图像分析仪)拍照。
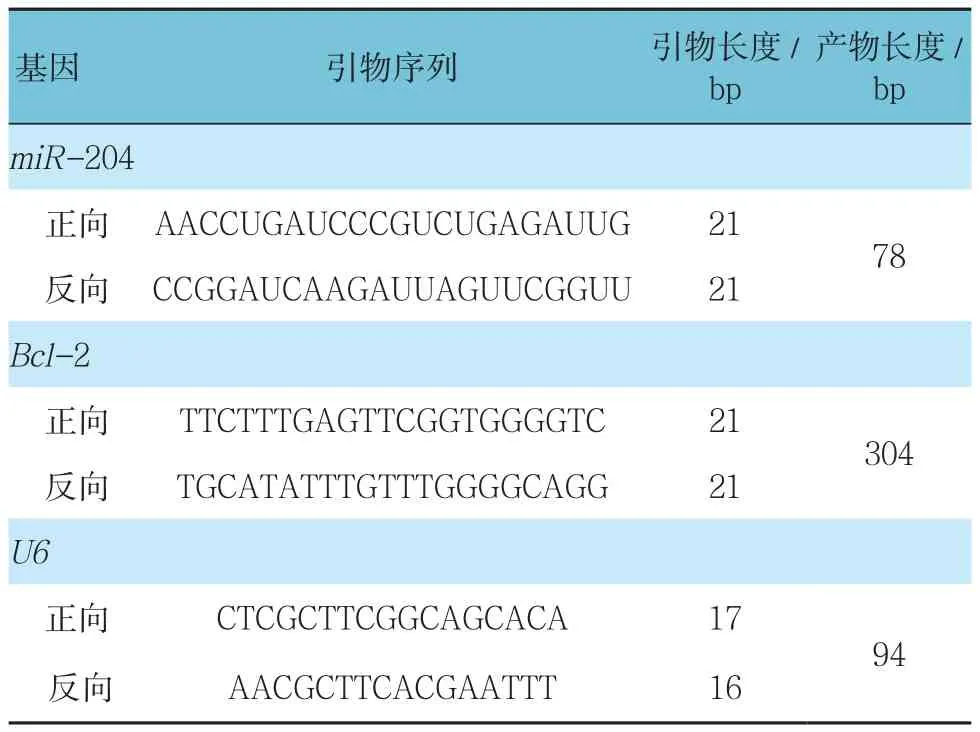
表1 qRT-PCR的引物序列
1.7 统计学方法
采用SPSS 20.0软件进行数据分析。计量资料均符合正态分布,以均数±标准差(±s)表示,多组间的比较采用单因素方差分析,两两组间比较为HSD-q检验,多时点的比较采用重复测量设计的方差分析,不同组织的mRNA表达水平的比较为配对t检验,miR-204相对表达与肺癌患者临床病理参数的关系采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同组织中miR-204的mRNA表达水平及其与各临床特征参数的关系
与对应癌旁组织比较,肺癌组织中miR-204 的mRNA表达水平降低,差异有统计学意义(P<0.05)(见表2)。人为界定肺癌组织中miR-204 的mRNA相对表达量<2.41为低表达,≥2.41为高表达。再按基线指标或临床病理特征的不同水平进行比较,结果显示,肺癌组织中miR-204低表达与分期、淋巴结转移及肿瘤大小相关(P<0.05)(见表 3)。
2.2 miR-204对A-549细胞增殖和凋亡的影响
miR-204对人A-549细胞增殖和凋亡影响资料的比较 ,采用重复测量设计的方差分析,结果:①不同时间点间的细胞增殖相对量差异有统计学意义(F=416.149,P=0.000)。②4组细胞增殖相对量的整体比较差异有统计学意义(F=136.071,P=0.000)。③4组的细胞增殖相对量的变化趋势差异有统计学意义(F=35.666,P=0.000)。见表 4。
表2 肺癌组织及其对应癌旁组织中miR-204的mRNA表达水平 (n =6,±s)

表2 肺癌组织及其对应癌旁组织中miR-204的mRNA表达水平 (n =6,±s)
组别 mRNA(2-ΔΔCt) t值 P值肺癌组织 2.41±0.91 9.361 0.000癌旁组织 5.62±1.08
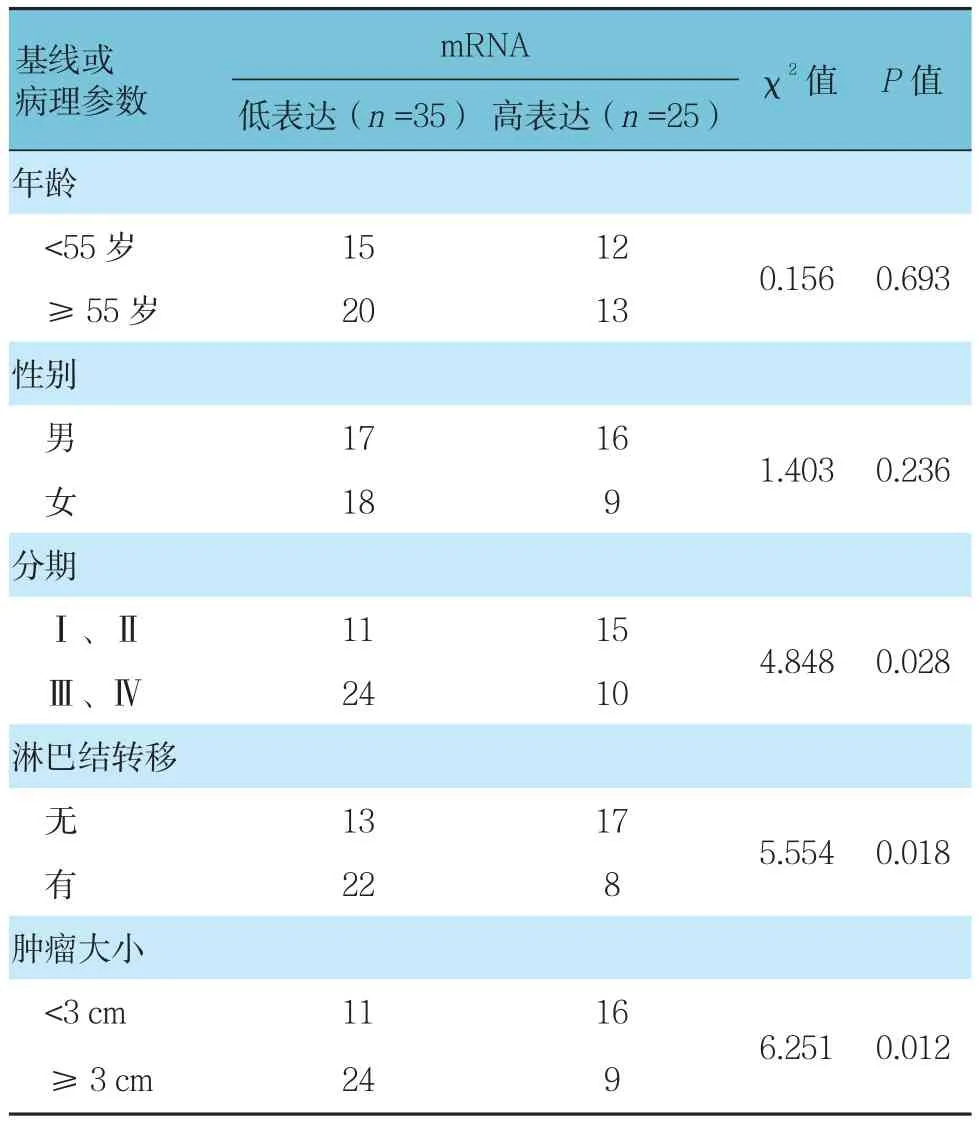
表3 miR-204相对表达与肺癌患者临床病理参数的关系
表4 miR-204对人A-549细胞增殖和凋亡的影响比较 (n =6,±s)
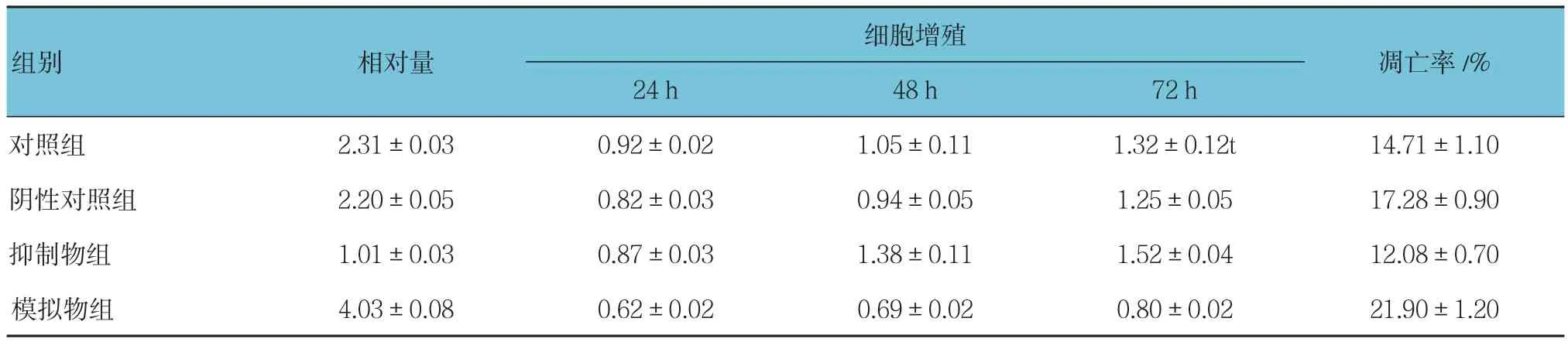
表4 miR-204对人A-549细胞增殖和凋亡的影响比较 (n =6,±s)
细胞增殖凋亡率/%24 h 48 h 72 h对照组 2.31±0.03 0.92±0.02 1.05±0.11 1.32±0.12t 14.71±1.10阴性对照组 2.20±0.05 0.82±0.03 0.94±0.05 1.25±0.05 17.28±0.90抑制物组 1.01±0.03 0.87±0.03 1.38±0.11 1.52±0.04 12.08±0.70模拟物组 4.03±0.08 0.62±0.02 0.69±0.02 0.80±0.02 21.90±1.20组别 相对量
经qRT-PCR检测A-549细胞转染miR-204效果。与阴性对 照组相比,miR-204模拟物组的A-549细胞增殖水平降低,差异有统计学意义(P<0.05),而miR-204抑制物组细胞增殖水平则略有增高。miR-204模拟物组细胞凋亡率较阴性对照组升高,而miR-204抑制物组细胞凋亡率降低,差异有统计学意义(P<0.05)。此结果提示miR-204表达水平可能与A-549细胞增殖及凋亡密切相关。miR-204对A-549细胞增值和凋亡影响见图1、2。
2.3 miR-204对A-549细胞Bcl-2表达的影响
为了进一步探讨miR-204影响A-549细胞增殖及凋亡的机制,本研究检测了转染miR-204模拟物后A-549细胞中Bcl-2的表达水平。结果发现,与阴性对照组相比,转染miR-204模拟物的A-549细胞中Bcl-2的mRNA和蛋白水平均降低,而转染miR-204抑制物的细胞中Bcl-2的mRNA和蛋白水平则增加,差异有统计学意义(P<0.05),提示了miR-204可能是通过调节Bcl-2的表达水平来影响癌细胞的增殖及凋亡。见表5、图3。
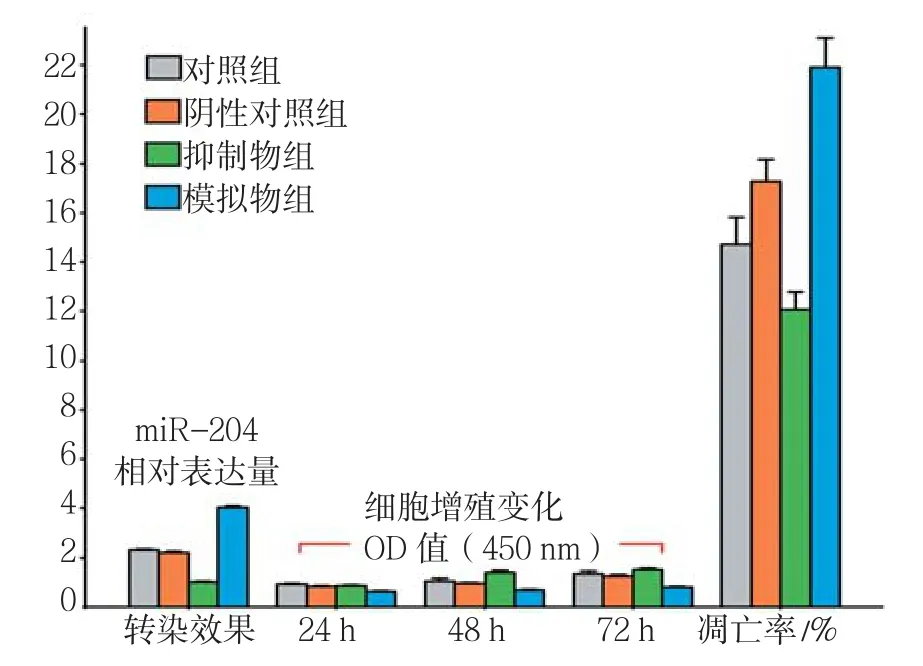
图1 miR-204对A-549细胞增殖和凋亡的影响
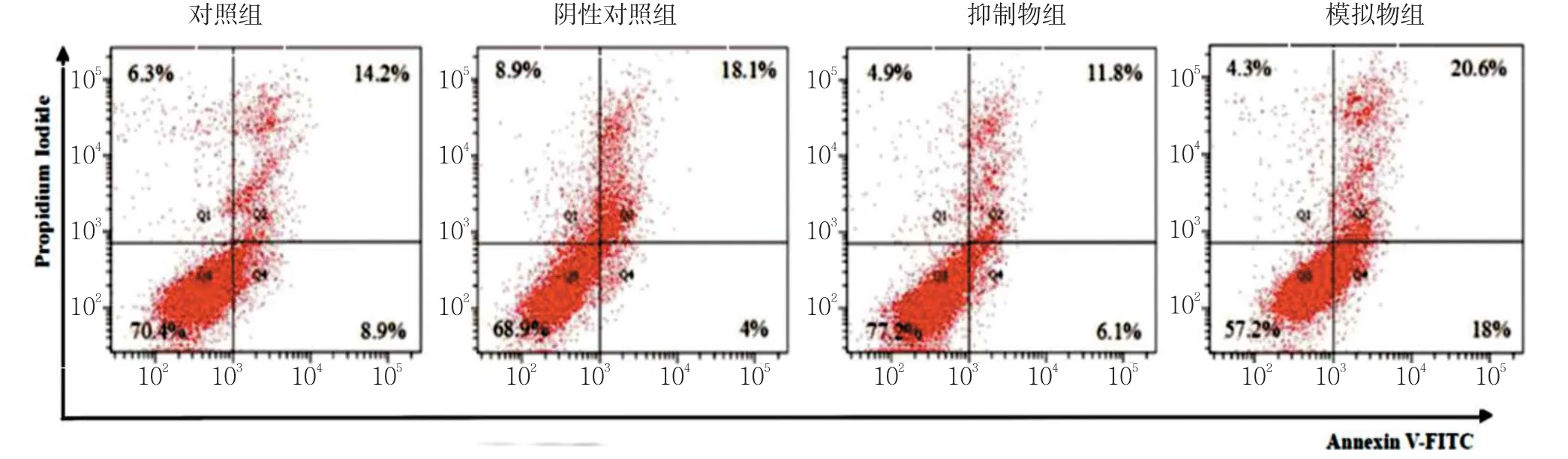
图2 miR-204对A-549细胞凋亡的影响
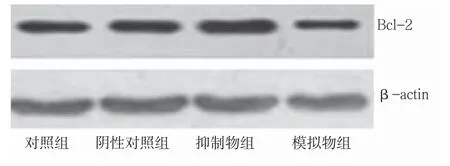
图3 各组转染细胞中Bcl-2蛋白表达水平
表5 miR-204对A-549细胞Bcl-2表达水平的影响 (n =6,±s)
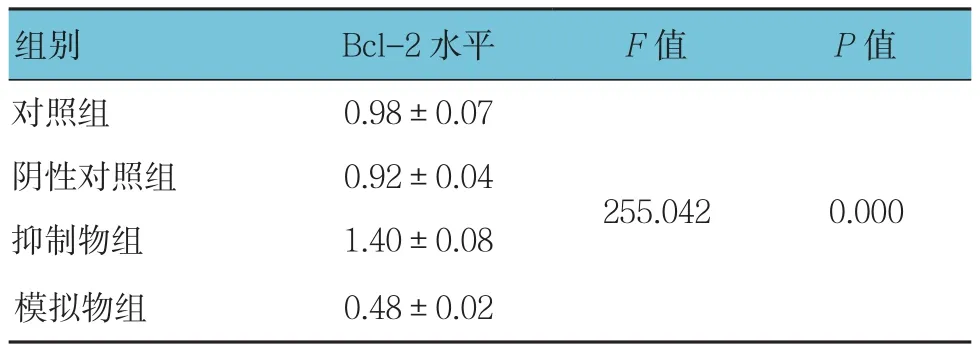
表5 miR-204对A-549细胞Bcl-2表达水平的影响 (n =6,±s)
组别 Bcl-2水平 F值 P值对照组 0.98±0.07阴性对照组 0.92±0.04抑制物组 1.40±0.08模拟物组 0.48±0.02 255.042 0.000
3 讨论
尽管非小细胞肺癌的发病机制在蛋白及基因水平得到深入认识,手术、放化疗等为主的综合治疗有了长足的发展,但非小细胞肺癌的早期诊断和预后并没有明显进展。miRNAs是一类高度保守的非编码单链小分子RNA,在细胞生物学中发挥重要作用。最近,研究证明NSCLC中miRNAs的表达与其预后有关[7-8],研究发现在有淋巴结转移的NSCLC患者中,肿瘤细胞高表达miRNA-21提示预后较好。在非小细胞肺癌组织中有多种miRNAs表达上调或下调,可作为非小细胞肺癌的癌基因或抑癌基因,在非小细胞肺癌分化、浸润及转移过程中发挥重要的作用[9]。
近年来,研究表明miR-204可能成为一种新的致癌基因或抑癌基因[10-11]。在前列腺癌中,miR-204发挥癌基因的作用,miR-204的高表达能导致前列腺衍生上皮因子(prostate-derived epithelial factor,PDEF)的丢失从而促使前列腺癌发生[12]。而在头颈部鳞状上皮细胞癌细胞株中过表达的miR-204,通过抑制肿瘤相关靶基因的表达,并在体外抑制肿瘤的黏附、迁移和侵袭,减少了实验性肺转移的程度,发挥抑癌基因的作用[13]。本研究发现,非小细胞肺癌组织中miR-204相对表达量低于癌旁组织,并且在细胞增殖实验中,转染miR-204模拟物的A-549细胞增殖水平受到抑制,而转染miR-204抑制物细胞增殖水平则略有增高。实验结果提示 miR-204可能作为一种抑癌基因通过抑制癌细胞的增殖来参与非小细胞肺癌的发生、发展。
Bcl-2是细胞凋亡调控因子,作为一种原癌基因能广泛抑制细胞凋亡,从而有利于肿瘤细胞的生长[14-16]。CHEN等[6]将miR-204模拟物导入胆管癌细胞系中,发现外源性miR-204具有负向调控Bcl-2的作用,且有利于化疗药物氟尿嘧啶激发的细胞凋亡。在本研究细胞增殖实验中,转染miR-204模拟物的细胞增殖水平受到抑制,而转染miR-204抑制物细胞增殖水平则略有增高。流式检测转染后细胞凋亡情况,发现模拟物组细胞凋亡率较阴性对照组升高,而抑制物组细胞凋亡率降低。为进一步探讨miR-204影响肺癌细胞增殖及凋亡的可能机制,本研究检测了转染miR-204肺癌细胞中Bcl-2的表达情况,结果表明,高表达miR-204后,肺癌细胞中Bcl-2的mRNA和蛋白表达水平均降低,抑制miR-204后细胞中Bcl-2的表达水平则升高,提示miR-204影响肺癌细胞增殖及凋亡的作用可能通过调控Bcl-2的表达而发挥效应。
综上所述,miR-204在非小细胞肺癌的发生与发展过程中可能发挥类似抑癌基因的作用,这种作用可能是通过调节靶基因Bcl-2影响细胞增殖及凋亡而实现的。
[1]SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2015[J].CA Cancer J Clin, 2015, 65(1): 5-29.
[2]丁斐嘉, 邵群慧, 张鸣号, 等. 检测GK19基因对诊断非小细胞肺癌外周血微转移的意义[J]. 宁夏医科大学学报, 2014, 36(9):962-965.
[3]PILECZKI V, COJOCNEANU-PETRIC R, MARALANI M, et al.MicroRNAs as regulators of apoptosis mechanisms in cancer[J].Clujul Med, 2016, 89: 50-55.
[4]刘婕, 万晓春, 吕卫东, 等. miRNA在防治非小细胞肺癌中的研究进展[J]. 现代生物医学进展, 2015, 15(10): 1966-1970.
[5]MA L, DENG X, WU M, et al. Down-regulation of miRNA-204 by LMP-1 enhances CDC42 activity and facilitates invasion of EBV-associated nasopharyngeal carcinoma cells[J]. FEBS Lett, 2014,588(9): 1562-1570.
[6]CHEN L, YAN H X, YANG W, et al. The role of microRNA expression pattern in human intrahepatic cholangiocarcinoma[J]. J Hepatol, 2009, 50(2): 358-369.
[7]YU S L, CHEN H Y, CHANG G C, et al. MicroRNA signature predicts survival and relapse in lung cancer[J]. Cancer Cell, 2008,13(1): 48-57.
[8]LANDI M T, ZHAO Y, ROTUNNO M, et al. MicroRNA expression differentiates histology and predicts survival of lung cancer[J].Clin Cancer Res, 2010, 16(2): 430-441.
[9]SKRZYPSKI M, CZAPIEWSKI P, GORYCA K, et al. Prognostic value of microRNA expressio n in operable non-small cell lung cancer patients[J]. Br J Cancer, 2014, 110(4): 991-1000.
[10]SHI Y, HUANG J, ZHOU J, et al. MicroRNA-204 inhibits proliferation, migration, invasion and epithelial-mesenchymal transition in osteosarcoma cells via targeting Sirtuin 1[J]. Oncol Rep, 2015, 34(1): 399-406.
[11]YIN J J, LIANG B, ZHAN X R. microRNA-204 inhibits cell proliferation in T-cell acute lymphoblastic leukemia by downregulating SOX4[J]. Int J Clin Exp Pathol, 2015, 8(8): 9189-9195.
[12]TURNER D P, FINDLAY V J, MOUSSA O, et al. Mechanisms and functional consequences of PDEF protein expression loss during prostate cancer progression[J]. Prostate, 2011, 71(16):1723-1735.
[13]LEE Y, YANG X, HUANG Y, et al. Network modeling identifi es molecular functions targeted by miR-204 to suppress head and neck tumor metastasis[J]. PLoS Comput Biol, 2010, 6(4):e1000730.
[14]BRENNER D, MAK T W. Mitochondrial cell death eff ectors[J].Curr Opin Cell Biol, 2009, 21(6): 871-877.
[15]GHIOTTO F, FAIS F, BRUNO S. BH3-only proteins: the deathpuppeteer’s wires[J]. Cytometry A, 2010, 77(1): 11-21.
[16]CZABOTAR P E, LESSENE G, STRASSER A, et al. Control of apop tosis by the BCL-2 protein family:implications for physiology and therapy[J]. Nat Rev Mol Cell Biol, 2014, 15(1):49-63.
