MicroRNA-31在上皮性 卵巢癌中的表达及其与预后的关系*
2018-02-05徐志宏吴小华姚铁柱梁秀琴
徐志宏,吴小华,姚铁柱,梁秀琴
(1.河北医科大学第四医院 肿瘤内科,河北 石家庄 050011;2.白求恩国际和平医院 妇产科,河北 石家庄 050000;3.河北医科大学第四医院 心内科,河北 石家庄 050011;4.河北省保定第七医院 妇产科,河北 保定 071000)
卵巢恶性肿瘤是女性生殖系统常见的3大恶性肿瘤之一,其中上皮性卵巢癌(epithelial ovarian cancer,EOC)占卵巢恶性肿瘤的86%~91%,好发于55~65岁妇女,其具有早期症状隐匿、易发生多脏器种植、淋巴结转移等特点,5年生存率徘徊在30%左右,病死率居恶性妇科肿瘤之首[1]。因此,尽量早期明确诊断、寻找新的治疗靶点以及判断其预后的意义重大。临床急需高敏感性和特异性的卵巢癌早期诊断及预后标志物以降低疾病死亡率,寻找新的治疗靶点改善卵巢癌的预后迫在眉睫。
人们首先在海拉细胞(Hela cell)中发现了micorRNA-31(miR-31),并确定其定位在染色体9p21.3上[2]。有研究发现miR-31在肺癌、结直肠癌中呈高表达状态,而在乳腺癌、胃癌及卵巢癌中则呈低表达[3-4],miR-31不但能使结肠癌细胞的生长速度增快,并且与结肠癌远处转移、病理学分期以及预后等因素相关[5]。然而,miR-31在上皮性卵巢癌的临床意义及预后的价值尚未研究。本实验采用实时荧光定量聚合酶链反应(quantitative real-time polymerassee chain reactiioonn, qRT-PCR) 检 测 研 究 了miR-31在EOC中的表达变化,并分析其和临床病理指标及其与卵巢癌预后之间的关系。
1 资料与方法
1.1 临床资料
选取病理学证实的EOC患者共150例,均来自2010年1月-2015年1月河北医科大学第四医院手术后标本。其中,年龄≥60岁86例,<60岁64例。病理分化程度:低分化(G3)51例,中高分化(G1、G2)99例。组织学类型:浆液性卵巢癌占88例,非浆液性卵巢癌占62例。淋巴结转移情况:有淋巴结转移70例,无淋巴结转移80例。腹膜转移情况:存在腹膜转移84例,无腹膜转移66例。FIGO分期:Ⅰ、Ⅱ期60例,Ⅲ、Ⅳ期90例。用随访至死亡日期来计算生存时间即总生存时间(OS)。
1.2 qRT-PCR检测miR-31的表达
取 1μg总 RNA 使 用 PrimeScript® miRNA cDNA合成试剂盒进行cDNA的合成,具体操作参照使用说明。qRT-PCR的PCR扩增使用ABI 7500PCR仪器,采用20μl的反应体系。所有的反应运行3遍。U6 siRNA 1 min作为内对照,反应均在95℃条件下1 min完成,然后95℃、15 s,60℃、1 min,40个循环。对照U6通过2-ΔΔCT方法计算miR-31的表达。
1.3 统计学方法
应用SPSS 18.0统计学软件进行数据分析,计数资料采用χ2检验。多因素分析采用Cox回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 miR-31在卵巢癌组织和癌旁正常卵巢组织中的表达
为了研究miR-31在卵巢癌变中起到的作用,本研究对150例卵巢癌组织和正常卵巢组织miR-31的表达情况进行统计分析。结果提示,miR-31在卵巢癌组织和癌旁正常卵巢组织中表达差异有统计学意义(P<0.05),卵巢癌组织中的表达低于正常卵巢组织中的表达。见附图。
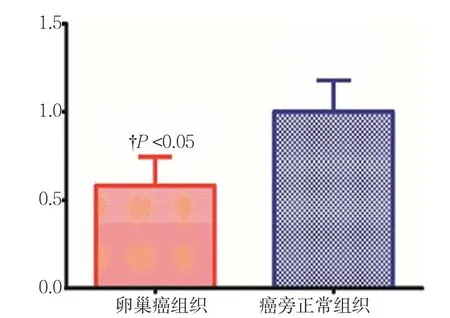
附图 人卵巢癌组织和癌旁正常组织miR-31的表达
2.2 miR-31在上皮性卵巢癌组织中的表达水平与临床病理学指标之间的关系
在150例上皮性卵巢癌组织中,miR-31在74例患者中呈低水平表达,在76例患者中呈高水平表达。由表1可见,miR-31的低表达与较差的组织学分级、较多的淋巴结转移、更广泛的腹膜转移、更晚期的病理分期有关(P<0.05),而与其他临床病理学因素(年龄、组织学类型无关)(P>0.05)。
2.3 miR-31在上皮性卵巢癌中的表达与预后的关系
生存分析显示,淋巴结转移、腹膜转移、分化、FIGO分期和miR-31表达是预后的危险因素,差异有统计学意义(P<0.05)。见表 2。
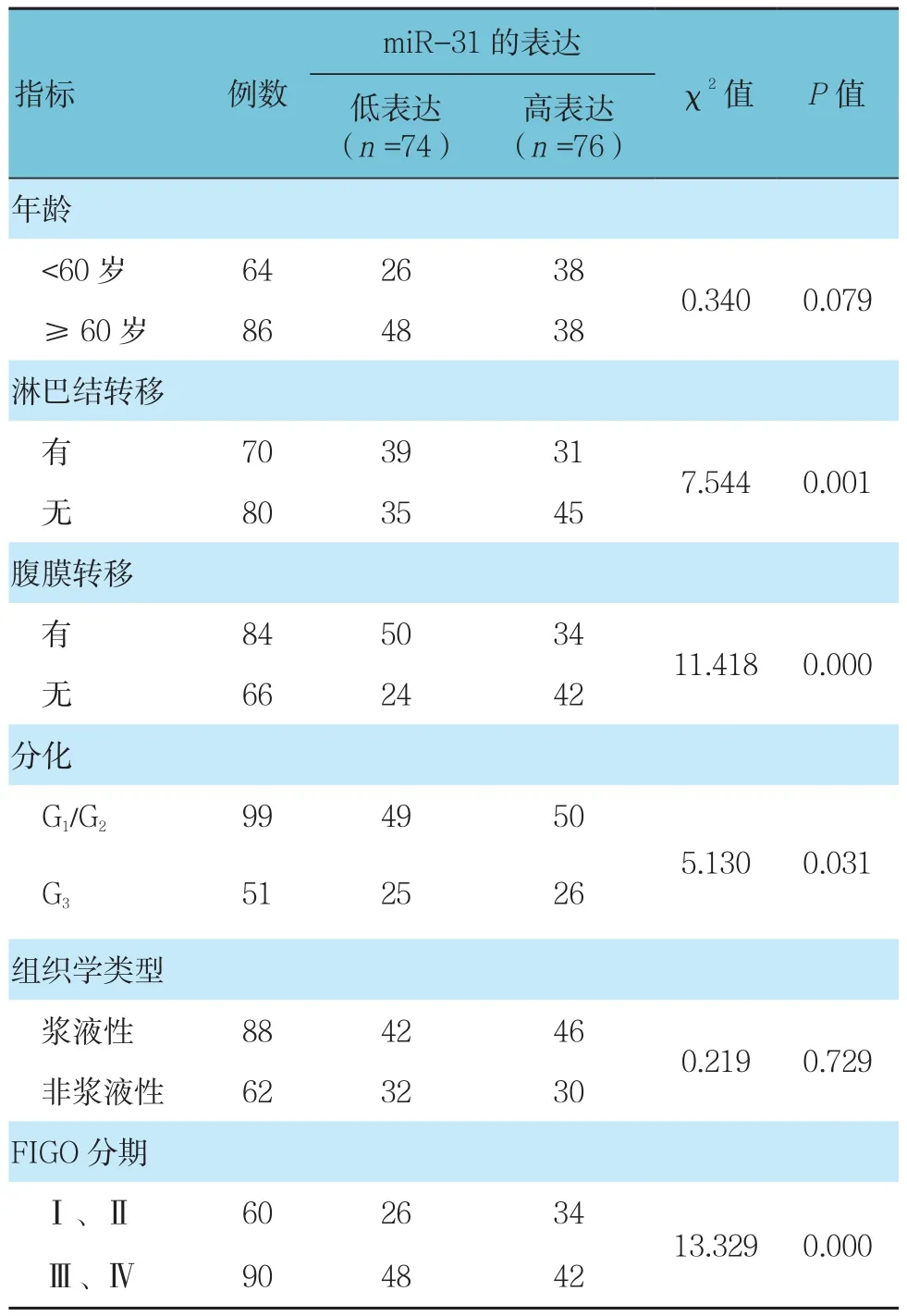
表1 miR-31的表达和临床病理学指标之间的关系 例
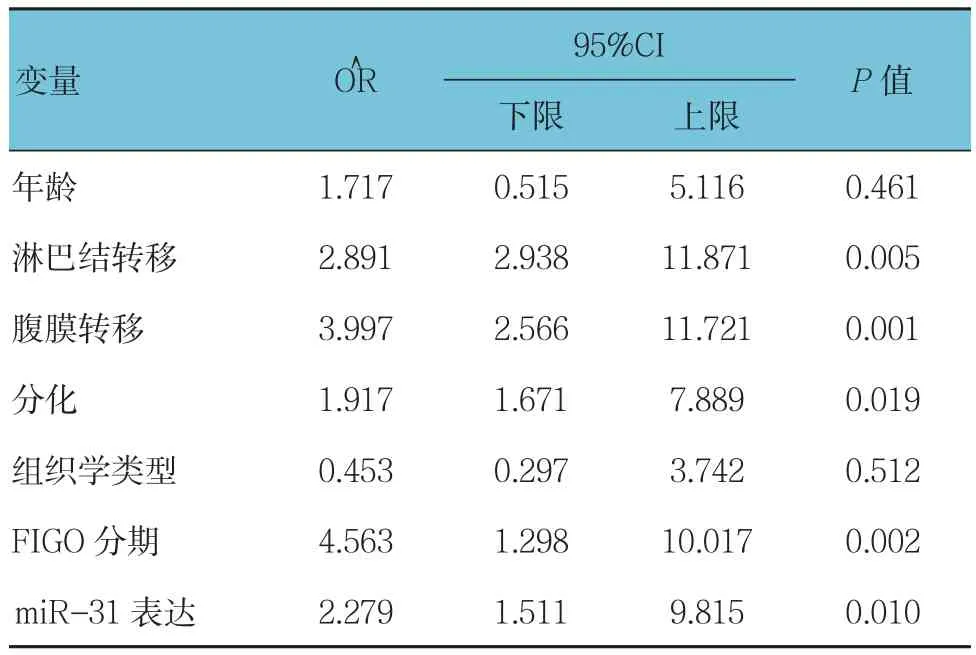
表2 Cox回归分析EOC患者总生存预测因子
3 讨论
MiRNA在卵巢癌领域的研究备受人们关注,它是最近几年来新发现的长为21~26个核苷酸的RNA,它在人体内发挥着很多生物学作用,通过与其靶点非编码区域配对,使mRNA受到翻译水平调节[6-7],并且其具有预后评价、早期诊断的指导价值,可能成为卵巢癌新的治疗靶点,是非常有应用价值的生物标志物。
MiRNA参与包括细胞的增殖、分化、迁移以及凋亡在内的多种生物学过程。以往的相关研究证实了miRNA的异常表达与肿瘤的发生发展有关[8]。现在,研究的miRNAs中有65%在基因组学上定位于脆性位置,其起到的作用为癌基因或抑癌基因,通过调节肿瘤基因及肿瘤不同的通路在癌症的发病过程起关键作用[9-10]。对某些肿瘤的miRNA分子的特定检测可能对疾病的早诊早治及预后具有重要的指导意义。如miR-200c已成为Ⅰ期上皮性卵巢癌患者预测生存和复发的生物标志物。
更多的试验表明miRNAs与卵巢癌的发生发展有关。研究报道[11-13],在卵巢癌组织miR-16、miR-15a和miR-200表达上调,相反miRNA-34a/b/c、miRNA-100,miR-31和mir-99a表达下调。
已发现的miRNAs中,miR-31是调节恶性肿瘤生物学行为的关键基因。最近研究报道[5],在结肠癌细胞系LS174T中,miR-31可以通过MTI等靶基因增加恶性肿瘤细胞的迁移,通过抑制miR-31可以增强SW480细胞对奥沙利铂的敏感性。miR-31在不同的肿瘤中表达水平不同。LEIDNER等[14]研究证实miR-31能促使乳腺癌肺转移病灶缩小,其表达增强能抑制乳腺癌细胞的活动及侵袭能力,因此研究人员认为在乳腺癌中miR-31是一种抑癌基因,相反在结肠癌中miR-31的表达增强促进肿瘤发展,因此认为miR-31同时是一种癌基因。miR-31在不同肿瘤中截然不同的表达现象在很多实验得到印证。有研究证实miR-31在结肠癌Ⅳ期患者中表达要强于Ⅱ期患者,MENG等[15]研究发现miR-31在肺癌中高表达与TNM分期及浸润深度有关,miR-31增强表达与患者预后较差即总生存期较短相关。然而,miR-31在上皮性卵巢癌中的临床意义及预后的价值尚未研究。
本课题为研究miR-31在卵巢癌变中的作用,采用qRT-PCR检测分析miR-31在150例卵巢癌组织和癌旁正常卵巢组织的表达,结果提示,在EOC组织miR-31的表达较癌旁正常卵巢组织降低。实验同时发现miR-31的低表达与更晚期的病理分期、更广泛的腹膜转移、较多的淋巴结转移和较差的组织学分级有关,而与其他临床病理学因素无关。此外,本研究进一步探讨了miR-31在卵巢癌患者预后的价值,并分析miR-31表达与卵巢癌患者总生存的关系,结果表明,miR-31低水平表达与卵巢癌患者生存期较差有关,在多变量分析中,miR-31的表达是卵巢癌患者总生存的独立预后因素。因此,miR-31可能是卵巢癌一个新的诊断和预后标志物。
[1]SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics,2013[J]. Ca Cancer J Clin, 2013, 63(1): 11-30.
[2]VALASTYAN S, CHANG A, BENAICH N, et al. Activation of miR-31 function in already-established metastases elicits metastatic regression[J]. Genes Dev, 2011, 25(6): 646-659.
[3]王生, 王启呜, 王慧娟, 等. microRNA-31在原发性肺癌组织中的表达及临床意义[J]. 肿瘤防治研究, 2012, 39(003): 28l-284.
[4]蒋敏, 顾国浩, 朱敏, 等. 采用xMap技术检测肺癌患者外周血单个核细胞mieroRNA的表达变化及其意义[J]. 广东医学,2013, 34(1): 57-59.
[5]KARNUTH B, DEDY N, SPIEKER T, et al. Diff erentially expressed miRNAs in Ewing sarcoma compared to mesenchymal stem cells: low miR-31 expression with effects on proliferation and invation[J]. PLoS One, 2014, 9(3): e93067.
[6]CHUNG Y W, BAE H S, SONG J Y, et al. Detection of microRNA as novel biomarkers of epithelial ovarian cancer from the serum of ovarian cancer patient[J]. Int J Gynecol Cancer, 2013, 23(4): 673-679.
[7]TAKESHITA N, HOSHINO I, MORI M, et al. Serum microRNA expression profi le: miR-1246 as a novel diagnostic and prognostic biomarker for oesophageal squamous cell carcinoma[J]. Br J Cancer, 2013, 108(3): 644-652.
[8]YAMASAKI T, SEKI N, YOSHINO H, et al. microRNA-218 inhibits cell migration and invasion in renal cell carcinoma through targeting caveolin-2 involved in focal adhesion pathway[J]. J Urol,2013, 190(3): 1059-1068.
[9]CHAN J K, BLANSIT K, KIET T, et al. The inhibition of miR-21 promotes apoptosis and chemosensitivity in ovarian cancer[J].Gynecol Oncol, 2014, 132: 739-744.
[10]BRATMJ, HOANG VU C, DRALLE H, et al. Downregulation of microRNAs directs the EMT and invasive potential of anaplastic thyroid carcinomas[J]. Oncogene, 2010, 29(29): 4237.
[11]TANG H, KONG Y, GUO J, et al. Diallyl disulfide suppresses proliferation and induces apoptosis in human gastric cancer through Wnt-1 signaling pathway by up-regulation of miR-200b and miR-22[J]. Cancer Letters, 2013, 340(1): 72-81.
[12]SUN J, CHEN Z, TAN X, et al. MicroRNA-99a/100 promotes apoptosis by targeting Mtor in human esophageal squamous cell carcinoma[J]. Med Oncol, 2013, 30(12): 411-419.
[13]SCHEE K, BOYE K, ABRABAMSEN T W, et a1. Clinical relevance of microRNA miR-21, miR-31, miR-92a, miR-101,miR-106a and miR-145 in eolorectal cancer[J]. BMC Cancer,2012, 12: 505.
[14]LEIDNER R S, RAVI L, LEAHY P, et al. The microRNAs, MiR-31 and MiR-375, as candidate markers in Barrett’s esophageal carcinogenesis[J]. Genes Chromosomes Cancer, 2012, 51(5):473-479.
[15]MENG W, YE Z, CUI R, et al. MicroRNA-31 predicts the presence of lymph node metastases and survival in patients with lung adenocarcinoma[J]. Clin Cancer Res, 2013, 19(19): 5423-5433.
