牛体外受精囊胚双重染色方法的优化
2018-02-02刘海军黄承俊
刘海军,黄承俊
(1.天津市畜牧兽医研究所,天津 300384;2.辽宁省畜牧业经济管理站,沈阳 110032)
自从牛体外胚胎生产体系成功建立以来,人们试图从不同的角度对这一体系进行改进,例如改变培养系统[1],添加脂质代谢调节因子[2-3]和 cAMP 调节因子[4]等,但和体内胚胎相比牛体外胚胎的质量仍然较差[5-6],不仅囊胚细胞数较少而且移植妊娠率也不高。这使得人们认识到提高牛胚胎质量的必要性,因此胚胎质量的检验逐渐成为评估体外培养体系好坏的重要指标之一。与传统单一染色方法相比,双重染色方法能清晰地将囊胚内细胞团(ICM)和滋养层细胞(TE)区分开来,在评估上具有更高的准确性。基于ICM与TE细胞免疫差异性的囊胚双重染色[7],已被人们成功地运用于小鼠、牛、绵羊的囊胚上,在质量的评估上取得了很好的效果[8-9]。鉴于免疫法较高的成本与较长的处理时间,Thouas等[10]利用TritonX-100实现了囊胚双重染色的简化,大大缩短了染色时间。然而这种基于TritonX-100对ICM与TE细胞膜通透性改变差异的染色,受胚胎质量及处理程序的影响很大,往往同一处理程序在不同的实验有着巨大的差异,因而人们时常对TritonX-100的处理过程加以改进以适应实验的需求[11]。
1 材料与方法
实验中所用的化学试剂除特别说明外,均购自Sigma公司。
1.1 卵母细胞的采集
牛卵巢取自河北省大厂屠宰场。屠宰后卵巢置于37℃加有双抗的生理盐水中,2~3 h运回实验室,除尽周围脂肪组织,然后用加有双抗的生理盐水冲洗5~6次。抽吸法吸取直径2~8 mm的卵泡,根据不同的实验需求挑选裸卵、半裸卵及具有3层及其以上卵丘的卵丘-卵母细胞复合体(cumulus oocyte complexes,COCs)用于实验。
采卵液:TCM-199(Gibco)+5%胎牛血清(FBS,Gibco)+30 μg/mL 肝素钠 +4.766 g/L Hepes。
1.2 体外成熟培养
将收集的卵母细胞用成熟液洗3遍,然后每40~60个移入平衡至少2 h的1 mL成熟液中(四孔板),于5%CO2、95%空气、38.5℃、饱和湿度的CO2培养箱中培养23~24 h。若卵丘细胞共培养则用微滴法(100 μL),以排出第一极体为卵母细胞成熟的标志。
成熟液:TCM-199+10%FBS+10 μg/mL FSH(宁波三生)+20 μg/mL LH(宁波三生)+1 μg/mL E2。
1.3 体外受精
受精液为IVF-100(Research Institute for the Functional Peptides,Yamagata,Japan),用直接离心法对精子洗涤。即用6 mL洗精液稀释解冻的精液并于2 000 r/min下离心7 min,弃去上清液,重复一次后用受精液稀释精子,密度为 1×106~6×106个/mL,然后放入 CO2培养箱中备用。IVF-100受精时间为6 h。
1.4 胚胎的体外培养
将经体外受精的假定受精卵用胚胎培养液洗3遍,并用1 mL移液管部分或全部去除周围的卵丘细胞。以10枚假定受精卵/100 μL微滴将假定受精卵随机平等地移入平衡至少2h的微滴中进行体外培养。从体外受精开始算起,第48小时对各组卵裂率进行观察与记录,第7~9天对各组囊胚率进行观察与记录,中途不换液。
1.5 囊胚细胞数染色及双重染色
囊胚细胞数染色:将培养至7~9 d的牛囊胚去除卵丘细胞后放入含 10 μg/mL Hoechst33342(PBS)的染色液中染色 5 min,然后在 10%甘油(PBS)中浸泡 10~20 s,吸取少量的甘油和胚胎一起压片并置于倒置荧光显微镜(型号:TE300,Nikon)紫外光下观察照相。囊胚差异染色:将培养至7~9 d的牛囊胚按照不同的方法染色,压片后置于倒置荧光显微镜紫外光下观察照相。囊胚内细胞团(ICM)细胞核呈蓝色,滋养层(TE)细胞细胞核呈红色,各组染色囊胚数至少3枚。
1.6 囊胚差异染色试验设计
方案一:对李瑞岐等[12]方法加以改进。由于长时间用0.5%链蛋白酶处理会导致囊胚的裂解,因而调整为55~60 s。用 PBS 洗 2~3 遍后于 10 μg/mL Hoechst33342中染色 5~10 min,然后移入 0.05%TritonX-100(PBS)中处理 60、50、30 和 18 s,于 PBS 中洗 2~3 遍后移入10 μg/mL PI、50 μg/mL PI中染色,每次根据上次染色结果进行调整,染色时间分 20 s、30 s、40 s、1 min、5 min、10 min。用PBS洗2~3遍后进行压片照相。
方案二:对李荣等[13]方法加以改进。用0.5%链蛋白酶处理囊胚1 min后,于PBS中洗2~3遍,在0.5%TritonX-100中处理 20 s,于 PBS中洗 2~3遍后移入50 μg/mL PI、100 μg/mL PI中处理 30 s,用 PBS 洗 2~3遍后转入 10 μg/mL Hoechst33342中染色 5 min和 15 min,用PBS洗2~3遍后压片照相。
方案三:对Walker等[14]方法加以改进。用0.5%链蛋白酶处理囊胚1 min后于PBS中洗2~3遍,100 μg/mL PI(0.5%TritonX-100/PBS)中染色 30 s,于 PBS 中洗 2~3遍后移入50 μg/mL Hoechst33342中染色15 min,用PBS洗2~3遍后压片观察;然后调整方法为用0.5%链蛋白酶处理囊胚1 min后于PBS中洗2~3遍,在10、20、50 μg/mL Hoechst33342 中染色 2~5 min,在 PBS 中洗 2~3遍后移入 100 μg/mL PI(0.5%TritonX-100/PBS)中染色30 s、20 s,用 PBS洗 2~3 遍后进行压片照相。
方案四:对Thouas等[10]方法加以改进。用0.5%链蛋白酶处理囊胚 50~55 s后于 PBS中洗 2~3遍,在100 μg/mL PI(1%TritonX-100/PBS) 中染色 18~20 s,于PBS中洗2~3遍后移入45 μg/mL Hoechst33342中染色30~50 s,用 PBS洗 2~3 遍后压片照相。
1.7 统计分析
实验重复3次以上。用SPSS 11.0统计软件进行数据的整理与分析。囊胚细胞总数用卡方(χ2)进行显著性检验,P<0.05为差异显著。
2 结果与分析
2.1 方案一牛囊胚双重染色结果
去透明带的牛囊胚在10 μg/mL Hoechst33342中染色30 min后,很大概率在随后的处理过程中发生碎裂,因而实验中将Hoechst33342染色时间调整为5~10 min。按照李瑞岐等[12]的方法,对 Hoechst33342、TritonX-100、PI不同浓度及处理时间的牛囊胚双重染色结果见表1。用 Hoechst33342 处理 30 min、TritonX-100 处理 60 s、PI处理10 min,进行染色时囊胚细胞几乎全部染为红色,染色结果见图1C;调整TritonX-100处理时间为60 s、PI处理时间为1 min时囊胚细胞仍几乎全部染为红色,染色结果见图1D;调整TritonX-100处理时间为30 s、PI处理时间为30 s时能将ICM细胞与TE细胞基本分别染上色,染色结果见图1E;当继续降低TritonX-100处理时间为18 s、PI处理时间为20 s时表现为PI着色浅的现象,而且囊胚细胞多数为蓝色,染色效果见图1F。因而当TritonX-100与PI处理时间都定为30s时,运用此方法基本上能够达到牛囊胚双重染色的效果,由于每次重复照片都比较模糊,因而无法对ICM与TE进行统计分析。

表1 方案一不同染色结果

图1 方案一囊胚差异染色效果
2.2 方案二牛囊胚双重染色结果
去透明带的囊胚是否再次孵化对染色的效果影响不大,因而本实验中将这一步骤去除。对Hoechst33342、TritonX-100、PI不同浓度及处理时间的牛囊胚双重染色结果见表2。结果显示,PI浓度为50 μg/mL 和 100 μg/mL 时,囊胚细胞均染为蓝色,见图 2G;PI浓 度 为 100 μg/mL、Hoechst33342 染 色 时间降到5 min时,也只有少部分细胞染为红色,见图2H。所有染色未能将ICM细胞与TE细胞分别着色。

表2 方案二不同染色结果

图2 方案二囊胚差异染色效果
2.3 方案三牛囊胚双重染色结果
对 Hoechst33342、TritonX-100、PI不同浓度及处理时间的牛囊胚双重染色结果见表3。按照100 μg/mL PI中染色 30 s、50 μg/mL Hoechst33342 中染色 15 min 的方法进行染色,囊胚细胞基本上全部染为蓝色,染色结果见图3I;调整染色方法为5 μg/mL Hoechst33342中染色 20 min、5 μg/mL PI中染色 20 s,基本上将 ICM 与TE细胞分别染为蓝色与红色,但染色效果不稳定,见图 3J;将 Hoechst33342 浓度调整为 20 μg/mL,染色时间调为5 min,5μg/mL PI中染色20 s,将ICM与TE细胞分别染为蓝色与红色,染色效果见图3K。对调整后的方案进行统计,结果见表4。囊胚细胞总数与Hoechst33342染色结果无显著性差异(P>0.05),ICM与囊胚细胞总数的比值为0.338 2,接近0.33。染色时间在5 min左右。说明此改进的方法基本上达到了牛囊胚快速双重染色的目的。

表3 方案三不同染色结果

表4 方案三双重染色效果
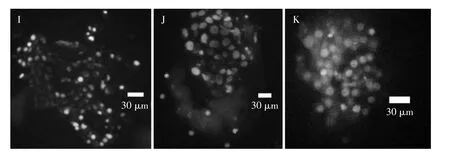
图3 方案三囊胚差异染色效果
2.4 方案四牛囊胚双重染色结果
对 Hoechst33342、TritonX-100、PI不同浓度及处理时间的牛囊胚双重染色结果见表5。将Thouas等[10]方法中4℃过夜步骤改为室温下45 μg/mL Hoechst33342中染色30~50 s,染色结果见图4L,ICM细胞染为蓝色,TE细胞染为红色,界限较为明显。对染色后数据进行统计,结果见表6。囊胚细胞总数有高于Hoechst33342染色的趋势,但差异不显著(P>0.05)。ICM与囊胚细胞总数的比值0.335 6,接近0.33。染色时间在3 min左右。说明此改进方法基本上达到了牛囊胚快速双重染色的目的。

表5 方案四不同染色结果

表6 方案四双重染色效果

图4 方案四囊胚差异染色效果
3 讨论
本实验结果显示,在4个改进的方案中有3个方案基本上能够将ICM与TE分别着色,但只有改进的方案三、方案四能够达到快速双重染色的目的,其中改进的方案四效果最好,也最为稳定。运用低浓度的TritonX-100对囊胚进行短时处理,能够在不破坏ICM细胞膜的情况下增加TE细胞的通透性,使得分子量较大的红色荧光染料PI可通过TE细胞膜对其进行染色,从而达到囊胚双重染色的效果。对于Hoechst33342着色的细胞,当细胞膜通透性增大时,PI很容易对其进行复染,并显示为红色;而对于PI着色的细胞,低浓度的Hoechst33342则需要较长时间进行复染,并且细胞颜色由红色逐渐变化为蓝色。这表明不管是先用Hoechst33342染色还是先用PI染色,膜通透性大的细胞都将显示为红色,最终两者染色的效果都是一样的,通过本实验改进方案三和方案四中ICM/囊胚细胞总数的对比(33.82 VS 33.56)也证实了这一点。
随着囊胚的不断发育,细胞数量也在不断增加,所需TritonX-100处理的时间也相应增加[15]。在方案一中李瑞岐等[12]的方法是用于第8天牛扩囊或孵化囊胚,而本实验中所染色的胚胎为标准囊胚,在细胞数上要少于扩囊与孵化囊胚很多,因而TritonX-100处理60~69 s已不再适用。通过实验发现,在牛标准囊胚上运用李瑞岐等[12]囊胚双重染色方法时,TritonX-100的处理时间在30 s是可行的。同时建议0.5%链蛋白酶处理时间调整为 1 min,Hoechst33342处理时间调整到 2~10 min,PI处理时间缩短到30 s左右。因为牛囊胚在0.5%链蛋白酶中处理1 min左右透明带就基本上被去除了,如果处理时间过长不仅会影响到ICM细胞膜的通透性,还会使细胞间的连接变得太松散,在接下来的处理过程中会增强TritonX-100对ICM细胞膜通透性的改变,而且胚胎还容易散裂。
在改进的方案四中显示,Hoechst33342室温短时处理也能达到牛囊胚双重染色的目的,而且这种方法大大缩短了染色时间,提高了评估囊胚质量的效率。李荣等[15]的染色方法和 Walker 等[14]的方法与 Thouas 等[10]的染色方法相似,都是通过先改变细胞膜的通透性对TE细胞进行染色,再对ICM细胞进行着色,然而本实验并未在原有方法的基础上成功对牛囊胚进行双重染色,这有可能与胚胎阶段及所重复的次数有关。然而对方法三改进时发现,先进行ICM细胞的染色,再对TE细胞着色也能够达到牛囊胚双重染色的目的,这反过来也说明了改进的方案一是可行的。囊胚简易差异染色对胚胎时期的一致性要求很高,因而在染色过程中要特别注意。总体而言,改进的方案三、方案四效果最好、时间最短,达到了快速检测的目的。运用改良的Walker等[14]的方法能够将单个胚胎染色时间降到5 min,但效果不如改良的Thouas[10]等的方法好。运用改良的Thouas等[10]的方法能够将单个胚胎染色时间降到3 min。
4 小结
改进的方案四染色最为稳定,效果较好,整个染色时间由原来的12 h(过夜)降到不到3 min,极大地提高了染色效率,可以作为一种快速、简洁、有效的牛囊胚质量的鉴别方法。
[1]Al Darwich A,Perreau C,Tsikis G,et al.Effect of different culture systems on adipocyte differentiation-related protein (ADRP) in bovine embryos[J].Animal Reproduction Science,2014,145(3):105-113.
[2]Ruiz A,Hansen P J,Block J.Effects of lipidmetabolic regulators during bovine embryo culture on blastocyt development and cryosurvival[J].Reproduction,Fertility and Development,2014,26(1):138.
[3]Stinshoff H,Wilkening S,Hanstedt A,et al.Dimethylsulfoxide and conjugated linoleic acids affect bovine embryo developmentin vitro[J].Reproduction,Fertility and Development,2014,26(4):502-510.
[4]Ulloa S M,Heinzmann J,Herrmann D,et al.Effects of different oocyte retrieval andin vitromaturation systems on bovine embryo development and quality[J].Zygote,2015,23(3):367-377.
[5]Ushijima H,Akiyama K,Tajima T.Transition of cell numbers in bovine preimplantation embryos:in vivocollected andin vitroproduced embryos [J].Journal of Reproduction and Development,2008,54(4):239-243.
[6]Pontes J H F,Nonato-Junior I,Sanches B V,et al.Comparison of embryo yield and pregnancy rate betweenin vivo and in vitromethods in the same Nelore(Bos indicus)donor cows[J].Theriogenology,2009,71(4):690-697.
[7]Handyside A H,Hunter S.A rapid procedure for visualising the inner cell mass and trophectoderm nuclei of mouse blastocysts in situ using polynucleotide-specific fluorochromes[J].Journal of Experimental Zoology,1984,231(3):429-434.
[8]芦天罡,郭勇,倪和民,等.一种鉴定小鼠胚胎质量的双重荧光染色方法[J].动物学报,2008,54(5):928-932.
[9]Park S B,Kim H J,Choi Y B,et al.The effect of various assisted hatching techniques on the mouse early embryo development[J].Clinical and Experimental Reproductive Medicine,2014,41(2):68-74.
[10]Thouas G A,Korfiatis N A,French A J,et al.Simplified technique for differential staining of inner cell mass and trophectoderm cells of mouse and bovine blastocysts[J].Reproductive Biomedicine Online,2001,3(1):25-29.
[11]万鹏程,石文艳,周平,等.绵羊体外受精胚胎培养系统优化与囊胚差异染色[J].新疆农业科学,2010,47(12):2469-2476.
[12]李瑞岐,桑润滋.以囊胚双重染色方法检验果糖对牛胚胎早期发育效果的影响[J].中国畜牧杂志,2010(9):23-25.
[13]李荣,刘颖,赵兴波,等.无血清培养基IVD101和G1/G2在牛体细胞核移植中的应用研究[J].畜牧兽医学报,2008,39(11):1487-1492.
[14]Walker D J,Seidel Jr G E.Vitrofication of bovine embryos in medium with polyvinyl alcohol replacing BSA[J].Reproduction,Fertility and Development,2005,18(2):165.
[15]李瑞岐,王文军,欧阳能勇,等.小鼠囊胚内细胞团和滋养层细胞的双重染色方法[J].广东医学,2012,33(14):2058-2060.
