双模态对比剂Fe3O-Cy5.5-NGR在卵巢癌的体外靶向效能研究
2018-01-30张紫欣梁宇霆
张紫欣 孟 颖 梁宇霆
(首都医科大学附属北京妇产医院放射科, 北京 100026)
卵巢癌是病死率最高的女性生殖系统来源的恶性肿瘤[1],由于发病隐匿、进展迅速,70%~80%的患者发现时已为晚期,5年生存率仅为20%~30%[2]。目前,临床上常用于卵巢癌治疗的方式包括外科手术和全身应用化学治疗药物,但是,高复发率和肿瘤耐药性严重影响到患者的预后[3]。卵巢癌细胞表面可以表达多种与肿瘤血管生成相关的生物因子,包括血管内皮生长因子(vascular endothelial growth factor, VEGF)、整合素家族、CD13等,这些分子在肿瘤血管的生成、肿瘤侵袭及远处转移方面有重要作用[4],其中,CD13作为一种较新型的生物分子受到越来越多的关注。CD13,即氨肽酶-N(aminopeptidase-N,APN),是一种基于Zn2+的跨膜糖蛋白,主要表达于骨髓及非造血细胞表面[5]。在炎性反应和免疫反应、信号转导、神经肽降解及抗原加工等生物学反应中有重要作用[6]。CD13的体外特异性配体是天冬酰胺-甘氨酸-精氨酸短肽,即NGR短肽[7],它可以特异地结合于内皮细胞表面表达的CD13[8]。
在分子影像研究中,为了弥补单一成像方式的缺陷,获取更全面的图像信息,联合使用磁共振(nuclear magnetic resonance,MR)和荧光成像(near infrared fluorescence,NIRF)显像受到越来越多的认可。MR作为常用的影响学检查方法,具有高软组织分辨率、无电离辐射等特点[9]。在成像过程中,为了提高不同组织器官间的对比,多采用静脉注射对比剂的方式来显像,其中包括T1-阳性对比剂(顺磁性对比剂)和T2-阴性对比剂(超顺磁性对比剂),后者是指超顺磁性氧化铁颗粒,即Fe3O4颗粒。它具有表面能量高、磁性偶极子反应等特点可以被网状内皮系统摄取而实现特异性成像[10]。NIRF对比剂,尤其以聚甲炔花菁染料(Cy3,Cy5,Cy5.5,Cy7及其派生物)在生物医学成像中的应用最为广泛[11]。花菁类染料是由两个含氮芳香杂环通过聚甲炔桥连接而形成的有机分子[12],可以与多种生物分子稳定地连接。但是,Fe3O4颗粒和花菁染料都不具备靶向性,在实验研究中,多尝试以特异性生物分子与其连接进行肿瘤的诊断与治疗。
本研究通过实验构造一种新型的MR和NIRF的双模态对比剂Fe3O4-Cy5.5-NGR,通过测定该粒子于体外的各项指标、参数,明确其是否符合在体动物实验的实验标准,并且,其各项测量数据为后续动物实验提供参考依据。
1 材料与方法
1.1 生物材料
铁(Ⅲ)乙酰丙酮化合物[Fe(acac)3]、三辛胺、苄醚、1,2-十六烷、油酸、油胺均购买于Sigma-Aldrich公司,美国;NGR(c-RYKNG)由吉尔生化上海公司合成;聚乙二醇(H2N-PEG2000-NH2、H2N-PEG3500-NH2)购自JenKem公司,美国;N-(三甲氧基甲硅烷)乙二胺三乙酸、TETT(45%水溶)购自 Gelest公司,美国;实验用水均经Milli-Q Plus 185水净化系统处理(Millipore, Bedford, MA);DAPI购自于Sigma Aldrich公司,美国(No.D9564);鼠抗人一抗ICC购自BD Horizon公司,美国(No.564649);兔抗鼠二抗488购自于BD Horizon公司,美国(No.564416);鼠抗人FITC(Fluorescein isothiocyanate)抗体购自Abcam贸易有限公司,英国(No.ab7417);ES-2人卵巢透明细胞癌及培养基购于中国医学科学院细胞医学研究所。
1.2 仪器设备
透射电镜(transmission electron microscopy,TEM)图像从JEM-2010F (JEOL, 日本)得到,设置电压为100 kV;铁含量通过电感耦合等离子体仪进行测量(ICP-OES, Varian 710-ES, 美国);吸光度图像从UV-2600(Ultraviolet spectrophotometer-2600)(Shimadzu,日本)仪器得到;红外光谱图像从光谱仪得到(Thermo Nicolet 公司);弛豫率检测中使用7.0MRI(Burker,德国);细胞表面荧光强度使用流式细胞仪(Millipore, 美国)检测。
1.3 对比剂的合成和特征分析
1.3.1 油酸氧化铁纳米粒子的合成[Fe3O4-(Oleic acid,OA)]
Fe3O4-OA粒子通过热分解法合成。首先,1.413 g Fe(acac)3、5.169 g 1,2-十六烷酸、4 mL油酸、4 mL油胺和40 mL苄醚混合,真空环境中加热至100 ℃维持1 h,氮气环境中加热至200 ℃维持2 h、300 ℃维持1 h后,冷却至室温。向混合物中加入乙醇用于沉淀,去掉上清液,沉淀溶解于乙烷和0.5 mL油酸、0.5 mL油胺的混合物中,于离心机(6 000 r/min,10 min)离心。重复以上步骤2次。热干燥后即得油酸氧化铁纳米颗粒。
1.3.2 硅烷羧酸化的氧化铁纳米粒的合成(TETT-Fe3O4)
通过受体-配体介导反应合成TETT-Fe3O4纳米粒。取100 mg Fe3O4-OA粒子溶解于60 mL甲苯、60 μL冰醋酸的混合物,超声波10 min后,向其中缓慢加入3 mL硅烷羧酸。连接磁性热搅拌装置,混合物于70 ℃下反应48 h。收集所得沉淀物,甲苯、乙醇各清洗3次。离心沉淀后,溶液在纯水中透析24 h,冷冻干燥48 h。所得粉末即TETT-Fe3O4纳米颗粒。
1.3.3 Fe3O4-Cy5.5纳米粒子的合成
首先,制备H2N-PEG2000-Cy5.5纳米粒:1 mgCy5.5-NHS、60 mg H2N-PEG2000-NH2溶解于纯水(pH=8),摇床搅拌24 h(室温,135 r/min)。然后,活化Fe3O4-TETT纳米粒:100 mg Fe3O4-TETT纳米粒、16.2 mg EDC、16 mg NHS和110 mg H2N-PEG3500-NH2混合加入10 mL PBS(phosphate buffered saline溶液(pH=5.5),摇床搅拌30 min(室温,135 r/min)。将H2N-PEG2000-Cy5.5粒子加入混合物中,调节pH=8,搅拌24 h。收集溶液,置于透析袋内纯水透析(MWCO=5 000),冷冻干燥得Fe3O4-Cy5.5纳米颗粒。
1.3.4 Fe3O4-Cy5.5-NGR纳米粒的合成
60 mg Fe3O4-Cy5.5粒子、9.0 mg NHS、6.0 mg EDC溶解于3 mL PBS溶液(pH=6),搅拌30 min(室温,135 r/min)。加入3.0 mg NGR肽、66 mg H2N-PEG3500-NH2,调节pH=8,搅拌12 h(室温,135 r/min)。混合物加入透析袋(MWCO=5 000)于纯水中透析24 h,冷冻干燥得到Fe3O4-Cy5.5-NGR纳米粒。
1.3.5 对比剂的性质检测
TEM观察纳米颗粒的形态和表征,计算平均粒子直径;红外成像仪扫描推测颗粒的化学结构,紫外分光光度仪下测定粒子的荧光波谱和吸光度,定量分析两种对比剂的Fe含量。
1.4 细胞培养
1.4.1 细胞培养
人卵巢透明细胞癌ES-2细胞株(P72),贴壁生长,2~3 d传代。在McCoy’s 5A培养基中进行传代培养,添加10%(体积分数)胎牛血清作为营养,100 U/mL青霉素及0.1 mg/mL链霉素,37 ℃、5%(体积分数) CO2潮湿培养箱内孵育。
1.4.2 细胞表面CD13免疫组织化学染色
取ES-2细胞,PBS冲洗3遍去除多余培养基。加入4%(质量分数)多聚甲醛1 mL固定,细胞分装为4组,即不破细胞膜(加一抗、不加一抗)、triton液破膜组(加一抗、不加一抗),30 min后去除多余液体、冲洗;10%(体积分数)羊血清350 μL封闭细胞表面,冲洗后加入兔抗鼠二抗反应30 min,去除多余液体;避光条件下,使用DAPI染细胞核10 min,冲洗多余液体,在荧光显微镜下观察细胞表面荧光情况。
1.4.3 细胞毒性检测
Fe3O4-Cy5.5-NGR及Fe3O4-Cy5.5的细胞毒性通过CCK-8试剂盒进行检测。步骤如下:ES-2细胞种于96孔板,浓度越1×104/板,设置8个复孔。细胞在培养基中培育24 h后加入不同浓度(0, 12.5, 25, 50,100 mg /L)两种对比剂各0.01 mL,共培养24 h。去除培养基,PBS液冲洗3遍,各加入10 μL CCK试剂共培养4 h。在酶标仪450 nm波长下测定A值,以此计算细胞活性。
1.5 对比剂体外特异性摄取率
1.5.1 对比剂指标测定
对比剂的体外特异性摄取率指Fe3O4-Cy5.5无靶对比剂及Fe3O4-Cy5.5-NGR有靶对比剂分别与细胞共同培养后,该细胞对两种对比剂的亲和能力。方法如下:ES-2卵巢癌细胞以1×105/孔接种于6孔板,培养基中培育24 h。不同浓度(40,80,160 μmol/L)的Fe3O4-Cy5.5及Fe3O4-Cy5.5-NGR对比剂加入其中共培养12 h。去除培养基,PBS溶液冲洗3遍,胰蛋白酶消化、离心分离、PBS重悬后备用。溶液的荧光强度从流式细胞仪下进行检测。
1.5.2 弛豫率测定
弛豫率为评价对比剂效能的重要指标。含Fe对比剂为MR阴性对比剂,主要影响横向弛豫时间(T2),因此通过r2(即1/T2)的数值作图,直观表达对比剂效能。不同Fe浓度(500,250,125,62.5,31.25 μmol/L)的Fe3O4-Cy5.5及Fe3O4-Cy5.5-NGR对比剂配液完成后在7.0T MRI下测定两者的弛豫率。获得对应的弛豫时间、Rmaps图。T2弛豫率为1/T2与Fe的不同浓度的斜率。MR参数设置如下:TR=3 000 ms,TE=45 ms,矩阵=256×256,FOV=4.0 cm×4.0 cm,层厚=1 mm。
1.6 统计学方法
采用SPSS 19.0软件进行的统计分析,计数资料的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 对比剂微观形态及粒径分布
TEM观察粒子的形态和表面情况,两种对比剂的分散性良好,Fe3O4-Cy5.5-NGR较Fe3O4-Cy5.5边缘略锐利,体积稍大(图1)。通过测定100个单独纳米粒子的直径得到Fe3O4-Cy5.5和Fe3O4-Cy5.5-NGR的平均直径分别为(7.480±0.695)nm,(8.930±0.773)nm(图2)。合并有-NGR的纳米粒子的分布范围及峰值较无-NGR组均向右偏移,偏移量为1~3 nm,初步推测-NGR短肽稳定的附着于Fe3O4-Cy5.5粒子周围。
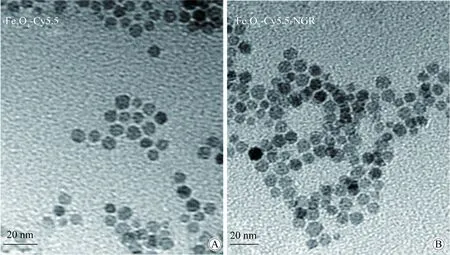
图1 纳米粒子的形态Fig.1 Morphology of the nanoparticles
A:Fe3O4-Cy5.5;B:Fe3O4-Cy5.5-NGR;The morphologies of Fe3O4-Cy5.5-NGR and Fe3O4-Cy5.5 were observed under TEM, with each gray patch density representing a single nanoparticle;TEM:transmission electron microscopy.
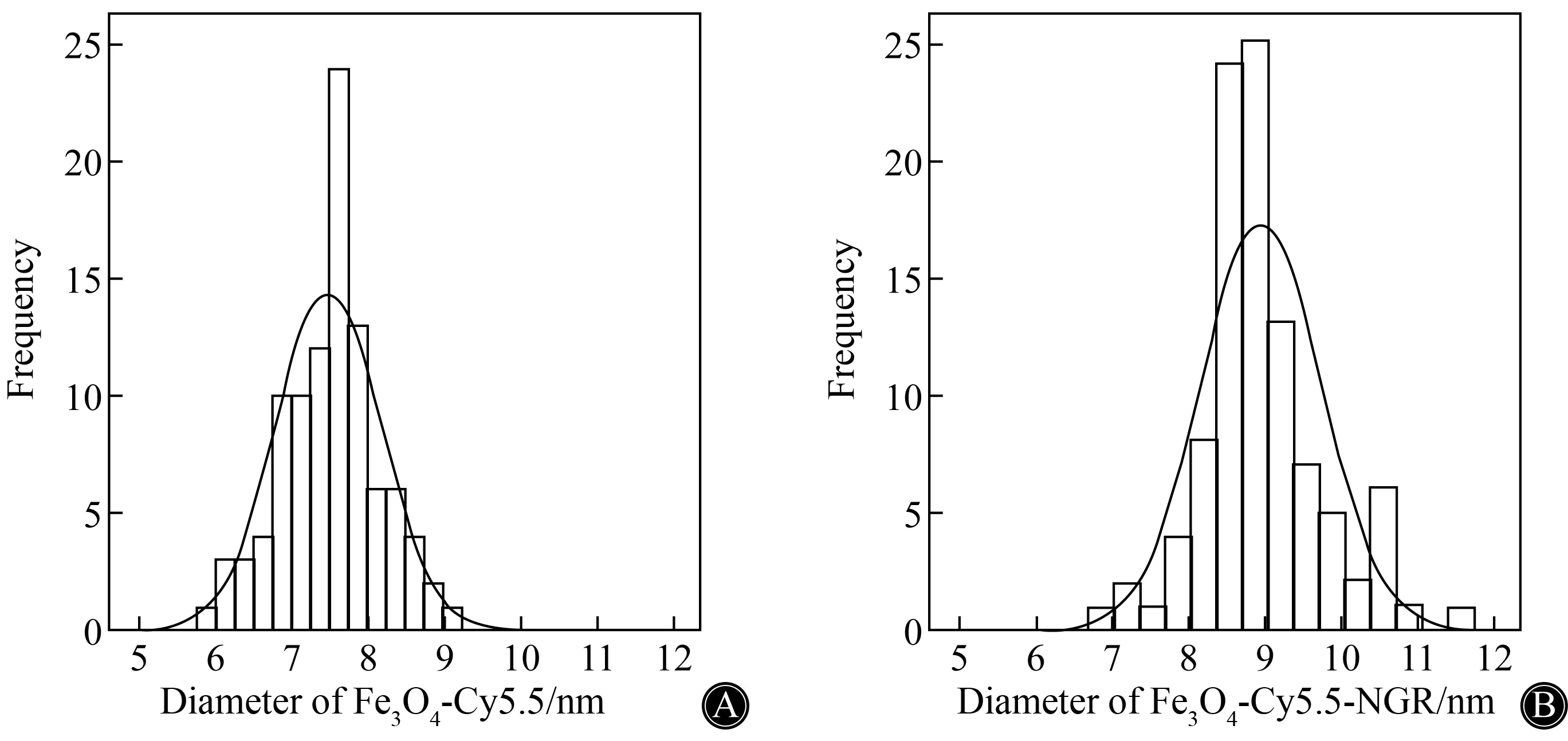
图2 纳米粒子的平均直径Fig.2 Average diameter of the nanoparticlesA:Fe3O4-Cy5.5;B:Fe3O4-Cy5.5-NGR;The average diameters of the two contrast agents were obtained from 100 individual nanoparticles.
2.2 对比剂物化学性质检测
单纯Cy5.5、Fe3O4-Cy5.5、Fe3O4-Cy5.5-NGR的傅里叶变换红外光谱图(far infrared spectrometer,FTIR),Fe3O4-Cy5.5、Fe3O4-Cy5.5-NGR比Cy5.5的光谱在2 882 cm-1处多显示了高强度的带、1 632 cm-1处有中等强度的波峰。Fe3O4-Cy5.5-NGR较Fe3O4-Cy5.5在841 cm-1处有明显的波峰(图3)。
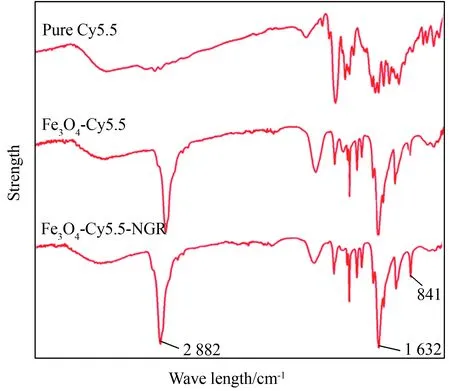
图3 不同阶段粒子的红外波谱Fig.3 Infrared spectrum of particles at different stages
Images of pure Cy5.5, Fe3O4-Cy5.5, Fe3O4-Cy5.5-NGR displayed on FITR devices;FITR:far infrared spectrometer.
UV-2600检测Fe3O4-Cy5.5-NGR和Fe3O4-Cy5.对比剂的吸光度,两种对比剂的激发波均为628.0 nm,发射波均为675.2 nm; Fe3O4-Cy5.5-NGR的吸光度略低于Fe3O4-Cy5.5(图4)。
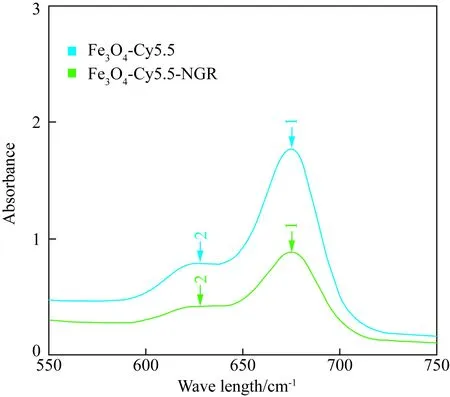
图4 纳米粒子的吸光度Fig.4 Absorbance of nanoparticles
Arrow1:675.2 nm;Arrow2:628nm; spectra and absorbance of Fe3O4-Cy5.5-NGR and Fe3O4-Cy5.5 on the UV-2600 device.
2.3 对比剂细胞毒性
通过CCK试剂盒检测Fe3O4-Cy5.5、Fe3O4-Cy5.5-NGR的细胞毒性。ES-2细胞与不同浓度的Fe3O4-Cy5.5、Fe3O4-Cy5.5-NGR共孵育24 h后,向混合液中添加了CCK 试剂,A值通过公式计算反应细胞活性情况[(Viability=(|ANPs-APBS|/|A0-APBS|)×100](图5)。两组细胞存活率在90%左右,差异无统计学意义(χ2=1.680,P=0.195),两种纳米粒未见明显的毒性。
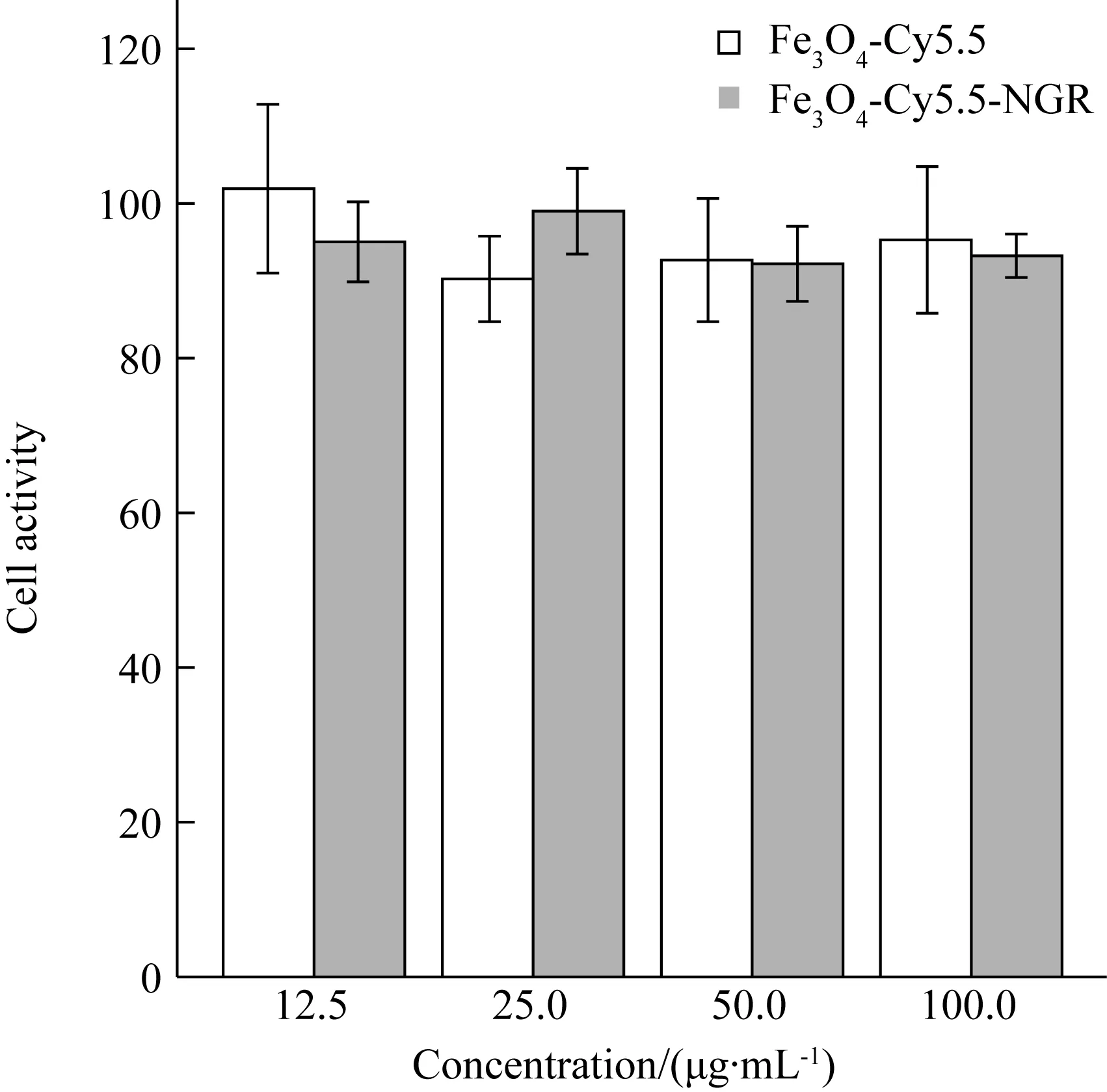
图5 纳米粒子的细胞毒性检测Fig.5 Detection of cytotoxicity of nanoparticles
TheAvalues detected from a microplate reader were calculated by the formula cell activity. And the cell viability in both groups remained at about 90%.
2.4 细胞水平免疫组织化学检测
通过对细胞表面的CD13进行免疫组织化学染色,在荧光显微镜下观察的结果绿色为ES-2细胞表面的CD13荧光染色,细胞显像良好,形态显示清楚,呈侵袭生长,边界不规则,细胞膜位置CD13高表达,细胞核及周围间质表达量很低;细胞核在DAPI染色后成蓝色(图6)。
2.5 体外特异性结合率测定
流式细胞仪下定量分析细胞水平的纳米粒子特异性摄取情况。不同浓度的纳米粒子较PBS对照组均有明显的信号增强,差异有统计学意义(χ2=6.06,P=0.035)。两组粒子随着浓度的增加,信号强度逐渐增强,差异有统计学意义(χ2=19.62,P<0.01)。在连接有NGR的纳米粒子在不同浓度信号强度均较高,分别是未连接组的3.1、1.65和1.26倍(浓度40、80和160 μmol/L)(图7)。

图6 细胞荧光染色Fig.6 Fluorescent staining of cells
A:CD13;B: DAPI;C:merge;CD13 fluorescence staining on the surface of the cell membrane, green part on the left for CD13 imaging, blue points on the DAPI position after dark staining in the middle, and right for the fusion image.

图7 细胞与粒子共培养后细胞表面的荧光强度Fig.7 Fluorescence intensity of cell surface afterco-culture of cells with particles
Fluorescence intensity of Fe3O4-Cy5.5-NGR and Fe3O4-Cy5.5 at different concentrations observed by flow cytometry after co-culture with cells.
2.6 弛豫率
MR下测定两种纳米粒的弛豫率(r是R关于时间t作图的斜率。而R=1/T)Fe3O4-Cy5.5-NGR和Fe3O4-Cy5.5NPs 的r2值分别为 155.49 mmol·L-1·s-1, 180.74 mmol·L-1·s-1(图8)。
3 讨论
肿瘤血管生成在肿瘤细胞的生长、侵袭和转移等方面发挥着重要作用。CD13是肿瘤血管生成过程中重要的生物因子之一,主要在内皮细胞、上皮细胞表面高表达,并且表达量稳定。

图8 纳米粒子的磁共振弛豫率Fig.8 Magnetic resonance relaxation rate of nanoparticles
Magnetic susceptibility of Fe3O4-Cy5.5-NGR and Fe3O4-Cy5.5 at 7.0T MR was measured and reacted at T2 relaxivity.
本实验中,使用的NGR短肽就是CD13的体外特异性配体,两者可以特异地、牢固地结合。本研究合成了两种纳米级别的双模态对比剂Fe3O4-Cy5.5-NGR和Fe3O4-Cy5.5,它们的核心是油酸包裹的氧化铁颗粒,通过热分解法制备所得[13]。通过表面包裹油酸,可有效地防止粒子聚集和沉淀,所获得的对比剂在非极性溶液中有很好的水溶性,这对于动物实验的进行意义重大。通过对两种颗粒的物理化学性质进行检测,本研究可以肯定对比剂成功合成,且分散性、水溶性良好,通过NGR短肽的连接,使Fe3O4-Cy5.5颗粒的直径增加了1.5 nm左右。
UV结果显示通过各种生物分子的连接,Fe3O4-Cy5.5-NGR和Fe3O4-Cy5.5中Cy5.5的荧光特性未受到影响,两者的波谱与单纯Cy5.5的波谱相同。但是,Fe3O4-Cy5.5-NGR的吸光度低于Fe3O4-Cy5.5,这可能是由于实验配制溶液过程中以对比剂浓度进行了定量,导致了Cy5.5在前者的浓度较低所致。荧光特性的存在和保持使得对比剂可以在荧光成像技术中显影,提供更多的图像信息。FTIR图像中Fe3O4-Cy5.5-NGR和 Fe3O4-Cy5.5粒子较单纯Cy5.5多了2 882 cm-1处的高强度波峰,来源于PEG包裹时携带的C-H产生的弹性振动;1 632 cm-1处的中等强度的波峰显示了C=N的引入。Fe3O4-Cy5.5-NGR比Fe3O4-Cy5.5多出了841 cm-1处的中等波峰,这是来自于NGR短肽的1,4-二取代的苯环。最后,本研究测定了两组纳米粒子的铁含量以备后续实验中定量使用,Fe3O4-Cy5.5 和Fe3O4-Cy5.5-NGR NPs中铁含量分别为9.617%、5.527%。
在CCK细胞毒性试验中,不同浓度的纳米粒子培养后细胞活性均处于90%左右,并没有受到明显影响。另外,后续在体实验中静脉注入裸鼠体内的对比剂的最高剂量约5.5 mg/kg,相当于1.96 μmol Fe,这远远低于细胞毒性试验中的使用剂量(0.215~1.712 mmol Fe3O4-Cy5.5和0.124~0.987 mmol Fe3O4-Cy5.5-NGR)。因此,笔者确信纳米粒子在后续的动物在体实验中是安全的。
体外检测Fe3O4-Cy5.5-NGR与CD13的结合率,在流式细胞仪下以Cy5.5的荧光强度为基准进行验证,不同浓度对比剂的荧光强度均有较明显的差异,表明了在没有体内环境影响的情况下,连接了多种生物分子的NGR与CD13的结合能力未受到明显的影响,这也是后续在体实验得以进行的基础。细胞表面CD13免疫组化染色可以更加直观的观察细胞的形态,细胞膜表面的荧光强度标高,而细胞核及周围纤维间质的荧光强度比较低,这与CD13是细胞膜表面高表达的抗体相符合。
另外,磁性纳米颗粒的磁敏感性会受到多重因素的影响,如颗粒组成,颗粒直径,表面包被物以及数据采集参数等。由于Fe3O4-Cy5.5-NGR和Fe3O4-Cy5.5颗粒需要作为MR对比剂来成像,化学合成的纳米颗粒的磁敏感性是否满足MR成像需求且能被MR设备检测到则至关重要。典型的Fe3O4磁性颗粒的弛豫率为100 mmol·L-1·s-1(37℃,0.47T),而Fe3O4-Cy5.5-NGR、Fe3O4-Cy5.5对比剂由于表面修饰物的存在,使T2弛豫率会有所增高,与相关报道[14]的结果相一致。而Fe3O4-Cy5.5的r2比Fe3O4-Cy5.5-NGR高25 mmol·L-1·s-1,这可能是由于随着粒子体积增大,胶体稳定性受到了影响。总之,Fe3O4-Cy5.5-NGR和Fe3O4-Cy5.5的磁特性理论上可满足MR成像的需求。
众所周知,随着MR特异性对比剂在生物化学领域的研究进展,纳米粒子介导的MR靶向对比剂受到了越来越多的关注。超顺磁性氧化铁纳米颗粒常被用于粒子的核心部分,是因为它具有较好的磁敏感性、生物兼容性比较好并且无毒。本实验中合成了超小超顺磁性氧化铁纳米颗粒,希望利用它缩短T2弛豫时间,降低T2及T2*信号的特性来进行成像[15]。在动物实验进行之前,证明了所合成的以Fe3O4为核心,表面连接有NGR短肽及Cy5.5荧光染料的靶向对比剂在特异性识别ES-2细胞表面高表达的CD13的能力良好,NGR与CD13的结合特性、Cy5.5的荧光特性、Fe3O4颗粒的磁敏感特性均未受到影响,而使用剂量范围的对比剂无明确细胞毒性,说明我们所合成的Fe3O4-Cy5.5-NGR双模态对比剂的可使用于进一步实验。
[1] Jayson G C, Kohn E C, Kitchener H C, et al. Ovarian cancer[J]. Lancet, 2014, 384(9951): 1376-1388.
[2] Raave R, de Vries R B, Massuger L F, et al. Drug delivery systems for ovarian cancer treatment: a systematic review and meta-analysis of animal studies[J]. Peer J, 2015, 3: e1489.
[3] Prat J, FIGO Committee on Gynecologic Oncology. Staging classification for cancer of the ovary, fallopian tube, and peritoneum: abridged republication of guidelines from the international federation of gynecology and obstetrics (FIGO)[J]. Obstet Gynecol, 2015, 126(1): 171-174.
[4] Shao M, Hollar S, Chambliss D, et al. Targeting the insulin growth factor and the vascular endothelial growth factor pathways in ovarian cancer[J]. Mol Cancer Ther, 2012, 11(7): 1576-1586.
[5] Cui S X, Qu X J, Gao Z H, et al. Targeting aminopeptidase N (APN/CD13) with cyclic-imide peptidomimetics derivative CIP-13F inhibits the growth of human ovarian carcinoma cells[J]. Cancer Lett, 2010, 292(2): 153-162.
[6] Pereira F E, Cronin C, Ghosh M, et al. CD13 is essential for inflammatory trafficking and infarct healing following permanent coronary artery occlusion in mice[J]. Cardiovasc Res, 2013, 100(1): 74-83.
[7] Li G, Xing Y, Wang J, et al. Near-infrared fluorescence imaging of CD13 receptor expression using a novel Cy5.5-labeled dimeric NGR peptide[J]. Amino Acids, 2014, 46(6): 1547-1556.
[8] Craddock K J, Chen Y, Brandwein J M, et al. CD13 expression is an independent adverse prognostic factor in adults with Philadelphia chromosome negative B cell acute lymphoblastic leukemia[J]. Leukemia Res, 2013, 37(7): 759-764.
[9] Zhang Z, Hu Y, Yang J, et al. Facile synthesis of folic acid-modified iron oxide nanoparticles for targeted MR imaging in pulmonary tumor xenografts[J]. Mol Imaging Biol, 2016,18(4):569-578.
[10] Savla R, Garbuzenko O B, Chen S, et al. Tumor-targeted responsive nanoparticle-based systems for magnetic resonance imaging and therapy[J]. Pharm Res, 2014, 31(12): 3487-3502.
[11] Onoe S, Temma T, Kanazaki K, et al. Development of photostabilized asymmetrical cyanine dyes for in vivo photoacoustic imaging of tumors[J]. J Biomed Opt, 2015, 20(9): 096006.
[12] Luo S, Zhang E, Su Y, et al. A review of NIR dyes in cancer targeting and imaging[J]. Biomaterials, 2011, 32(29): 7127-7138.
[13] Chen N, Shao C, Li S, et al. Cy5.5 conjugated MnO nanoparticles for magnetic resonance/near-infrared fluorescence dual-modal imaging of brain gliomas[J]. J Colloid Interface Sci, 2015, 457: 27-34.
[14] Xiao N, Gu W, Wang H, et al. T1-T2 dual-modal MRI of brain gliomas using PEGylated Gd-doped iron oxide nanoparticles[J]. J Colloid Interface Sci, 2014, 417: 159-165.
[15] Wang Y X, Hussain S M, Krestin G P. Superparamagnetic iron oxide contrast agents: physicochemical characteristics and applications in MR imaging[J]. Eur Radiol, 2001, 11(11): 2319-2331.
