固态发酵法制备榛仁肽工艺优化及其生物活性
2018-01-30包怡红刘冬蕾
王 銮 ,包怡红 ,张 宇 ,刘冬蕾
(1.东北林业大学 林学院,黑龙江 哈尔滨 150040;2.阿荣旗星河实业集团有限公司,内蒙古 呼伦贝尔 162750)
随着国家退耕还林和生态文明建设的不断深入,人们对经济林的重视程度也不断提高。通过科学经营管理,经济林可以产生巨大的经济效益和生态效益[1]。作为经济林中重要树种之一的榛树,是珍贵的木本粮油树种[2]。其果实榛仁含油脂量高达50%~60%,蛋白质含量20%~30%。榨油后的副产物榛仁粕中仍含有大量的优质植物蛋白,其含量占榛仁粕干质量的40%~50%,但其利用率较低,常被作为饲料或肥料低价出售[3]。因此榛仁粕进一步的加工利用不仅可以提高榛树的经济附加值,还可以提供一种新型的蛋白质资源。
众多研究表明,蕴藏在蛋白质中的多肽具有极强的生物活性,且食用安全,因而得到广泛关注[4]。从目前的报道来看,活性肽的制备主要采用酶解法和微生物发酵法。榛仁肽的制备研究多集中于采用酶解法,王明爽等[5]利用Alcalase 2.4 L碱性蛋白酶酶解榛仁蛋白,发现不同水解度的酶解物对小鼠的免疫功能具有不同的增强效果。而微生物发酵法制备榛仁肽的研究报道较为鲜见。与酶解法相比,微生物发酵法具有成本低、效率高等优点,因而越来越受到研究学者们的关注,目前已有采用固态发酵和液态发酵方法制备大豆肽[6]、油茶肽[7]、花生肽[8]等活性肽的报道。与液态发酵相比,固态发酵法成本较低,发酵产物易回收,适合工业化生产活性肽。因此本研究中采用固态发酵法制备榛仁肽。
为充分利用榛仁蛋白资源,制备天然生物活性肽,本研究中以枯草芽孢杆菌和米曲霉为发酵菌株,利用混菌固态发酵的方法,通过单因素试验和正交试验对榛仁粕发酵工艺进行优化,并对不同发酵时间产物的体外抗氧化性及降血压活性进行研究,旨在为经济林作物资源高效开发利用提供参考。
1 材料与方法
1.1 材料、菌株与试剂
榛仁粕使用石油醚脱脂处理,油脂含量≤5%,蛋白质含量51.19%,-20 ℃保存。
枯草芽孢杆菌Bacillus subtilis,来自东北林业大学食品微生物实验室;米曲霉Aspergillus oryzae,来自中国普通微生物菌种保藏中心(CGMCC)。
1,2-二苯基代苦味肼基自由基(DPPH·),购自上海源叶生物科技有限公司;血管紧张素酶(ACE)、马尿酰-组氨酰-亮氨酸(HHL),购自美国Sigma公司;喹啉、苯磺酰氯,购自上海麦克林生化科技有限公司;茚三酮、三氯乙酸、铁氰化钾、硫酸铜等其他试剂均为分析纯。枯草芽孢杆菌培养采用营养肉汤培养基;米曲霉培养采用察氏培养基;固态培养基:榛仁粕10 g,pH自然,121 ℃灭菌20 min。
1.2 仪器与设备
iMark 型酶标仪,日本BIO RAD公司;H/T20MM型台式高速离心机,湖南赫西仪器装备有限公司;DK-8D型电热恒温水槽,巩义市予华仪器有限公司;YXQ-LS-50A立式压力蒸汽灭菌器,上海博讯实业有限公司;DH6000A型电热恒温培养箱,天津市泰斯特仪器有限公司;HZQ-X100型振荡培养箱,哈尔滨市东明医疗仪器厂;FA2004B型电子分析天平、721可见分光光度计,上海佑科仪器仪表有限公司。
1.3 试验方法
1.3.1 固态发酵工艺流程
固态发酵工艺流程如图1所示。

图1 固态发酵工艺流程Fig.1 Process fl ow of solid state fermentation
1.3.2 种子液的制备
在100 mL的相应培养基中,接入1环活化后的菌种。设定培养条件为:枯草芽孢杆菌160 r/min、37 ℃培养24 h;米曲霉160 r/min、28 ℃培养72 h。用无菌生理盐水调节菌数为108cfu/mL,即可用于固态发酵。
1.3.3 固态发酵及多肽溶液的制备
向固态发酵培养基中按一定比例加入2种菌悬液,用无菌水调整培养基的水分含量,搅拌均匀后打散,在一定条件下发酵制备榛仁肽,发酵结束后于121 ℃灭酶10 min,加入100 mL蒸馏水磁力搅拌30 min,自然沉淀10 min,将上清液10 000 r/min,离心20 min。离心后的上清液微孔滤膜(0.45 μm)过滤,滤液即为粗多肽溶液,储存于4 ℃条件下,用于进一步分析测定。
1.3.4 水解度的测定
采用茚三酮方法[9-10]测定榛仁蛋白水解度。取粗多肽溶液0.5 mL定容至50 mL,取0.1 mL稀释液于试管中并加入1.9 mL蒸馏水、1.0 mL显色剂,同时做空白试验。混匀后置沸水浴中加热15 min,然后冷水冷却,加入5.0 mL 40%乙醇溶液混匀,放置15 min后以空白管调零,于570 nm处测定吸光值。水解度计算公式为:

式中:Ah为不同粗多肽溶液中的总游离—NH2含量(μmol/mL);A0为原料蛋白中固有的游离—NH2含量(μmol/mL);A总为原料蛋白强酸水解后的总游离—NH2含量(μmol/mL)。
1.3.5 多肽得率的测定
多肽含量以酸可溶性多肽计,将等体积的三氯乙酸(TCA)加入到粗多肽溶液中,静置30 min后以10 000 r/min离心10 min,去除酸不溶性的蛋白。用双缩脲法测定上清液中的多肽含量[11]。肽得率[12]计算公式为:
肽得率=[(待测液中肽含量×总体积)/样品总量]×100%。
1.3.6 固态发酵单因素试验
以水解度和肽得率为指标进行单因素试验。各因素分别设置为:枯草芽孢杆菌和米曲霉接种比例 2∶1、3∶ 2、1∶1、2∶3、1∶ 2,接种量5%、7.5%、10%、12.5%、15%,水分含量30%、40%、50%、60%、70%,发酵温度28、31、34、37、40 ℃。在不同条件下发酵培养48 h。
1.3.7 正交试验设计
在单因素试验的基础上,采用4因素3水平即L9(34)进行正交试验优化,并在最佳组合的基础上进行验证试验。
1.3.8 多肽活性的测定
1.3.8.1 不同发酵时间榛仁肽的体外抗氧化活性
总还原力的测定参照Kaur等的方法[13];DPPH自由基(DPPH·)清除率的测定参照Orhan 等的方法[14];羟基自由基(OH·)清除率的测定参照包怡红等的方法[15];超氧阴离子自由基(O2-·)清除率的测定参照裴斐等的方法[16]。
1.3.8.2 不同发酵时间榛仁肽的体外降血压活性
通过测定ACE酶抑制率来评价体外降血压活性,参照黎观红的方法[17]进行测定。
1.3.9 数据分析
采用Origin 8.0制图,采用SPSS 20.0对数据进行显著性检验,显著性水平设置P<0.05。所有试验重复3次以上,数据均取“平均值±标准差”。
2 结果与分析
2.1 单因素试验
2.1.1 菌种比例对水解度和多肽得率的影响

图2 菌种比例对水解度和多肽得率的影响Fig.2 Effects of bacteria ratio on hydrolysis degree and polypeptide yield
菌种比例对水解度和多肽得率的影响如图2所示。由图2可知,随着枯草芽孢杆菌和米曲霉接种比减小,榛仁粕的水解度和多肽得率均呈现先增加后降低的趋势。当枯草芽孢杆菌和米曲霉接种比为2∶1时,多肽得率最低,为12.43%;当接种比为3∶2时,水解度最低,为14.15%。这可能是因为枯草芽孢杆菌接种比例过高时,在固体培养基中能迅速成为优势菌种,抑制米曲霉生长发育,因此各项指标均呈现较低值。同理,在米曲霉比例高时,各项指标也呈现降低趋势。当接种比为2∶3时,水解度和多肽得率均达到最大值,分别为22.52%和15.15%,2种菌株可以共生,共同产生蛋白酶,水解榛仁蛋白,生成小分子肽。经综合分析,选取菌种比例1∶1、2∶3、2∶1 这3个水平用于正交试验。
2.1.2 接种量对水解度和多肽得率的影响

图3 接种量对水解度和多肽得率的影响Fig.3 Effects of inoculation concentration on hydrolysis degree and polypeptide yield
接种量对水解度和多肽得率的影响如图3所示。由图3可知,接种量在5.0%~12.5%时,水解度和多肽得率呈现上升趋势,在接种量为12.5%时水解度和多肽得率达到最大值,分别为24.08%和15.78%。随着接种量的增加,水解度趋于平稳,而多肽得率呈现了下降趋势。这可能是因为接种量太小,微生物菌体数目过少,导致蛋白质底物不能被微生物完全水解;而接种量过大时,微生物会优先利用小分子肽用于自身的生长发育,造成肽含量的降低。经综合分析,选取接种量10%、12.5%、15%这 3个水平用于正交试验。
2.1.3 水分含量对水解度和多肽得率的影响
水分含量对水解度和多肽得率的影响如图4所示。由图4可知,随着水分含量的增加,榛仁粕的水解度和多肽得率均呈现先升高后降低的趋势,在水分含量为50%时水解度达到最大值25.59%;水分含量为60%时多肽得率达到最大值16.55%。之后,随着水分含量的增加,榛仁粕的水解度和多肽得率均有所降低。这可能是因为接入的枯草芽孢杆菌和米曲霉均是好氧微生物,在微生物生长发育和繁殖时期均需要一定的水分参加生理反应。水分含量较低时,不利于微生物生长、酶生产及酶水解过程;水分含量过高时,会使固体培养基变为糊状,透气性差,不利于微生物的繁殖,甚至导致微生物的死亡。经综合分析,选取水分含量40%、50%、60% 这3个水平用于正交试验。

图4 水分含量对水解度和多肽得率的影响Fig.4 Effects of water content on hydrolysis degree and polypeptide yield
2.1.4 发酵温度对水解度和多肽得率的影响
发酵温度对水解度和多肽得率的影响如图5所示。由图5可以发现,榛仁粕水解度和多肽得率在28~31 ℃呈下降趋势,在31~37 ℃呈上升趋势,并在37 ℃达到最大值,分别为23.58%和15.90%。高于37 ℃时再次呈现下降趋势。这可能是由于28 ℃和37 ℃分别为米曲霉和枯草芽孢杆菌的最适生长温度,在最适温度下微生物可以快速生长繁殖。当发酵温度在31 ℃时偏离2种菌的最适发酵温度,微生物不能快速恢复生长,因此水解度和多肽得率均呈现降低的趋势。而随着发酵温度的升高,接近菌种的最适生长温度,水解度和多肽得率又呈现上升趋势,直至再次超过菌种的最适温度。经综合分析,选取发酵温度34、37、40 ℃ 这3个水平用于正交试验。

图5 发酵温度对水解度和多肽得率的影响Fig.5 Effects of fermentation temperature of hydrolysis degree and polypeptide yield
2.2 正交试验
根据以上各单因素试验结果确定的正交试验设计及试验结果如表1所示。根据表1中极差分析结果可知,以水解度为指标的影响程度由高到低依次为菌种比例(A)、水分含量(D)、发酵温度(C)、接种量(B),得到的最佳发酵组合为A1B3C3D3,即菌种比例1∶1,接种量15%,发酵温度40 ℃,水分含量60%。以多肽得率为指标的影响程度由高到低依次为菌种比例(A)、水分含量(D)、接种量(B)、发酵温度(C),得到的最佳发酵组合为A1B1C3D3,即菌种比例1∶1,接种量10%,发酵温度40 ℃,水分含量60%。
由2个考察指标所得的最佳工艺条件除因素B即接种量外均一致,通过综合平衡法可知接种量对于水解度的增加量大于对多肽得率的增加量,因此选择A1B3C3D3为最佳发酵组合。在此最佳组合条件下,进行正交验证试验,在发酵时间为48 h时,水解度为27.91%,多肽得率为18.77%。
2.3 发酵时间对水解度和多肽得率的影响
发酵时间对水解度和多肽得率的影响如图6所示。由图6可以发现,随着发酵时间的延长,榛仁肽的水解度一直处于上升趋势,此时菌体仍在生长繁殖,不断产生蛋白酶,酶解榛仁蛋白,在发酵48 h后多肽得率达到最大值18.77%,之后随着发酵时间的增加呈下降趋势,其原因可能是当微生物积累到一定数量时,需要部分榛仁蛋白用于生长繁殖,大分子蛋白尚未被水解,所以微生物会优先利用分子量小的多肽,因此出现下降的趋势。若继续发酵下去肽类物质可能迅速减少,因此最佳发酵时间应选择48 h。

表1 正交试验设计及结果Table1 Orthogonal experiment design and experiment results
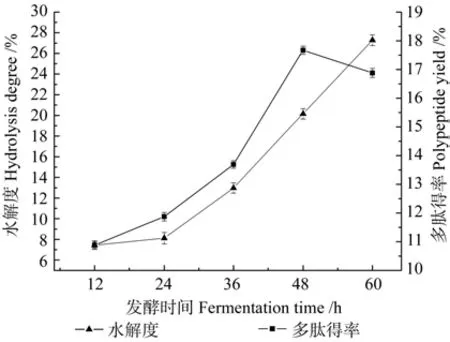
图6 发酵时间对水解度和多肽得率的影响Fig.6 Effects of fermentation time on hydrolysis degree and polypeptide yield
2.4 不同发酵时间榛仁肽体外抗氧化活性测定
还原力的测定、DPPH自由基、羟基自由基和超氧阴离子自由基清除活性是评价多肽体外抗氧化活性的常用方法[18-19]。发酵时间对榛仁肽体外抗氧化活性的影响如图7~10所示。由图7可以发现,总还原力随着发酵时间的增加而显著增加(P<0.05)。在发酵时间为48 h时,总还原力达到最高0.935。与发酵0 h的样品相比,经过固态发酵的榛仁粕的还原力显著增强。由图8~10可以看出,不同发酵时间下产物对不同自由基均有较强的清除效果,发酵36 h后的榛仁肽对DPPH自由基和羟基自由基清除率达到最大值,分别为94.51%和63.88%。随着发酵时间的延长,清除率趋于稳定。发酵48 h后的榛仁肽对超氧阴离子自由基清除率达到98.75%,随后清除能力变化缓慢。与发酵0 h的样品相比,发酵后的样品各自由基清除率均显著增加。这是因为还原能力与水解后的蛋白结构及其肽链断裂的位置有一定的相关性,水解后蛋白质结构发生变化,产生一些具有一定抗氧化性的多肽[20]。随着发酵时间的增加,蛋白质的水解度逐渐增加,所以样品的抗氧化性指标均显著增加。

图7 发酵时间对总还原力的影响Fig.7 Effect of fermentation time on total reducing force

图8 发酵时间对DPPH·清除率的影响Fig.8 Effect of fermentation time on DPPH· scavenging rate

图9 发酵时间对OH·清除率的影响Fig.9 Effect of fermentation time on OH· scavenging rate

图10 发酵时间对O2-·清除率的影响Fig.10 Effect of fermentation time on O2-· scavenging rate
2.5 不同发酵时间榛仁肽体外降血压活性测定
发酵时间对榛仁肽体外降血压活性的影响如图11所示。由图11可以看出,随着发酵时间的增加ACE抑制率显著增加(P<0.05)。在发酵时间为60 h时,ACE抑制率达到25.28%。可以预测随着发酵时间的延长,长链肽继续被水解为短肽,而ACE抑制肽多为相对分子质量不大于3 000 kD的多肽[21],发酵产物的ACE抑制率还会继续上升。由此看出,发酵产物具有一定的体外降血压活性。

图11 发酵时间对ACE抑制率的影响Fig.11 Effects of fermentation time on ACE inhibition rate
3 结论与讨论
以枯草芽孢杆菌和米曲霉为发酵菌株,采用固态发酵的方法,制备榛仁活性肽。通过单因素试验和正交试验得到固态发酵最佳工艺为:菌种比例1∶1,接种量15%,发酵温度40 ℃,水分含量60%。在此条件下发酵48 h的产物水解度及多肽得率可达最高,分别为27.91%和18.77%。对不同发酵时间的活性肽进行体外抗氧化活性和降血压活性评价,结果表明发酵48 h后的产物具有较强的抗氧化性,尤其是对DPPH自由基和超氧阴离子自由基的清除能力分别可以达到94.51%和98.75%。发酵60 h的产物的ACE抑制率可达25.28%,而且可能随着发酵时间的延长其ACE抑制率会继续提高。
本试验中仅研究了少量榛仁粕固态发酵的情况,具有一定的局限性,应进一步研究大批量榛仁粕固态发酵情况,从而为其工业化生产提供参考。另外榛仁肽是一种天然活性肽,有待于进一步分离纯化,并对其生物活性进行深入研究。
[1] 王成达,王秀云,张来春.榛子生长特性及其研究利用现状[J].林业勘查设计,2009(4):83-84.
[2] 侯智霞,原牡丹,刘雪梅,等.我国榛子生产研究概况[J].经济林研究,2008,26(2):123-126.
[3] 王 晶.榛仁肽的制备及特性研究[D].长春:吉林农业大学, 2006.
[4] 武万兴,陈朝银,赵声兰,等.固态发酵核桃粕制备活性肽及其抗氧化活性的研究[J].食品工业科技,2013,34(16):266-271.
[5] 王明爽,闵伟红,沈明浩,等.长白山榛仁(Corylus heterophylla Fisch)蛋白酶解物对小鼠免疫功能的影响[J]. 现代食品科技,2016,32(2):1-6,45.
[6] 管 瑛,汪瑨芃,李 文,等.豆渣固态发酵过程中主要营养成分及抗氧化特性变化[J].食品科学,2016,37(21):189-194.
[7] 马 力,陈永忠,彭邵锋,等.油茶粕最优培养基及混菌生产蛋白饲料的研究[J].中南林业科技大学学报,2013,33(10):34-37.
[8] 柳 杰,张 晖,郭晓娜,等.液态发酵制备花生抗氧化肽的优化研究[J].中国油脂,2011,36(2):25-30.
[9] 赵新淮,冯志彪.大豆蛋白水解物水解度测定的研究[J].东北农业大学学报,1995,26(2):178-181.
[10] 包怡红,于阳阳,赵若诗.酶解山核桃蛋白制备降血压肽的工艺[J].食品科学,2013,34(1):220-224.
[11] 鲁 伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学,2005,26(7):169-171.
[12] 鞠兴荣,王雪峰,王立峰,等.混菌固态发酵菜籽粕制备菜籽肽的菌种筛选[J].食品与发酵工业,2011,37(9):104-108.
[13] Kaur R, Arora S, Singh B. Antioxidant activity of the phenol rich fractions of leaves of Chukrasia tabularis A Juss [J]. Bioresource Technology, 2008, 99(16):7692-7698.
[14] 彭 昕,黄 亮,王 平,等.雷竹笋总黄酮和总甾醇的抗氧化性与抑菌性[J].经济林研究,2017,35(3):179-185.
[15] 包怡红,王 芳,王文琼.大豆多肽硒螯合物的制备及抗氧化活性分析[J].食品科学,2013,34(16):27-32.
[16] 裴 斐,陶虹伶,蔡丽娟,等.响应面试验优化辣木叶多酚超声辅助提取工艺及其抗氧化活性[J].食品科学,2016, 37(20):24-30.
[17] 黎观红.食物蛋白源血管紧张素转化酶抑制肽的研究[D].无锡:江南大学,2005.
[18] 侯雅坤,王 晟,黄 昆,等.核桃蛋白酶解工艺优化与酶解液抗氧化活性分析[J].食品与发酵工业,2012,38(4):99-103.
[19] 张友维.枯草芽孢杆菌发酵花生粕制备抗氧化肽的研究[D].无锡:江南大学,2012.
[20] KONG BH, XIONG YL. Hydroxyl radical-stressed whey protein isolate: Functional and rheological properties[J]. Food and Bioprocess Technology, 2013, 16(1): 169-176.
[21] 王晓丹,薛 璐,胡志和,等. ACE抑制肽构效关系研究进展[J].食品科学,2017,38(5):305-310.
