响应面法优化杜仲叶中绿原酸提取工艺
2018-01-30邓爱华李红勇彭才旺程丽楠
邓爱华 ,李红勇 ,谢 鹏 ,王 云 ,彭才旺 ,程丽楠
(1.湖南文理学院 生命与环境科学学院,湖南 常德 415000;2.湖南人文科技学院 农业与生物技术学院,湖南 娄底 417000)
杜仲Eucommia ulmoides Oliv为杜仲科落叶乔木,是我国特有经济植物,主要分布于湘、桂、川、滇及长江中下游流域等[1-2]。据《本草纲目》记载,杜仲皮为名贵滋补药材,而杜仲树剥皮后容易死亡,制约了杜仲的药用价值推广[3]。现代研究发现,杜仲叶与杜仲皮具有相同的功能成分和药理功效,杜仲叶中活性成分绿原酸含量高达5%,且富含京尼平苷、桃叶珊瑚苷等[4-5]。绿原酸具有抗肿瘤、抗氧化、抗病毒、保护心血管和清除体内自由基等作用[6-7],对治疗血液、消化及生殖系统等方面的疾病有显著效果[8]。因此,杜仲中绿原酸的提取开发成为研究者关注的热点[9-11]。
绿原酸属于极性有机酸,一般采用极性较强的水提取杜仲叶中绿原酸[12-13]。然而,绿原酸在强极性溶剂和高温下容易发生水解和分子内酯基迁移现象[14],从而异构化形成新绿原酸和隐绿原酸,导致新绿原酸和隐绿原酸含量升高,绿原酸含量下降。为了强化提取效率和缩短提取时间,研究人员采用微波辅助提取法[15]、超声波辅助提取法[16]和生物酶法[17]等进行提取,这些方法在一定程度上改善了提取效果,但由于设备投资大,运行成本高,不适合工业化生产。除此之外,采用水提取法所提取绿原酸的杂质较多,加大了后续分离的成本。为此,有人尝试用极性适中的有机溶剂提取法,有机溶剂能够抑制植物酶对绿原酸的催化分解作用,减少水溶性杂质的溶出[18]。同时还发现,绿原酸在乙醇体系中比在甲醇、丙酮等有机体系中更加稳定,乙醇成为提取绿原酸的首选溶剂[19]。传统的单因素和正交设计试验误差较大,已不能满足杜仲叶的绿原酸提取工艺优化要求[20-21],基于数学与统计学结合的响应面分析法不仅能够缩短优化时间,而且建模速度快,工程应用的可信度高[22]。为此,本文中以乙醇水溶液作为提取溶剂,在单因素试验基础上,通过响应面法分析乙醇浓度、料液比、提取温度等工艺参数对杜仲叶中绿原酸提取率的影响,旨在为优化杜仲叶绿原酸的提取工艺提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
杜仲叶(湖南广源生物科技有限公司),绿原酸标准品(北京盛世康普化工技术研究院),其他试剂为分析纯(国药集团)。
1.1.2 主要仪器设备
UV-5100型紫外分光光度计(上海元析仪器有限公司),BT25S型电子天平(赛多利斯有限公司),101-2AB型电热鼓风干燥箱(天津市泰斯特仪器有限公司),FW135型中草药粉碎机(天津市泰斯特仪器有限公司),TDL-40B型高速离心机(上海安宁科学仪器厂),HWS-12型电热恒温水浴锅(上海一恒仪器有限公司)。
1.2 方 法
1.2.1 标准曲线的制备
参考相关文献[23],精密称取10.4 mg的绿原酸标准品,用40%乙醇溶液定容至10 mL,配制1.04 mg/mL的母液,再将母液分别稀释成5.2、10.4、15.6、20.8、31.2、41.6 μg/mL 的标准溶液。测定各标准溶液在325、345 nm的A325、A345值,求得ΔA。以吸光度ΔA为横坐标,绿原酸浓度C为纵坐标,绘制标准曲线,C=47.281 0ΔA-0.510 5,R2=0.999 3,说明标准曲线线型相关性良好。
1.2.2 样品检测
将杜仲叶在鼓风干燥机中烘干后粉碎,过筛,称取粉碎后的样品20.0 g置于500 mL烧杯中,加入280 mL 40%的乙醇水溶液,放于60 ℃恒温水浴锅中回流提取30 min后,滤液真空抽滤,然后将提取液5 000 r/min离心5 min,取上清液稀释50倍。以40%乙醇溶液为参比,用紫外分光光度计测定A325、A345值,求出提取液中的绿原酸含量。
1.2.3 稳定性测定
将待测样品置于室温下24 h,再进行吸光度测定,结果见表1。由表1可知,各样品在40%乙醇溶液中的吸光度值变化不大,说明各样品在40%乙醇溶液中表现稳定。

表1 样品放置24 h后吸光度变化Table1 Changes of absorbances of placed samples after 24 h
1.2.4 单因素试验设计
称取20.0 g杜仲叶粉末加入500 mL三颈烧瓶中,然后加入一定浓度的乙醇水溶液,加热至设定温度,回流提取一定的时间后,按照1.2.2方法检测提取液中绿原酸含量,分别考察乙醇质量分数(10%、20%、40%、60%、80%、100%)、 温度(30、50、60、70、80、90 ℃)、时间(30、45、60、75、90、105 min)、料液比(1∶ 6、1∶8、1∶10、1∶12、1∶14、1∶16)以及提取次数等因素对绿原酸提取率的影响。
1.2.5 响应面法优化设计
在单因素实验基础上,确定料液比、乙醇质量分数、提取温度3个因素及水平值,运用Design-Expert 8.0软件进行Box-Behnken响应面设计和数据分析。料液比、乙醇质量分数、温度分别以A、B、C表示,每个因素的高中低水平分别以1、0、-1进行编码,各试验因素及水平值见表2。
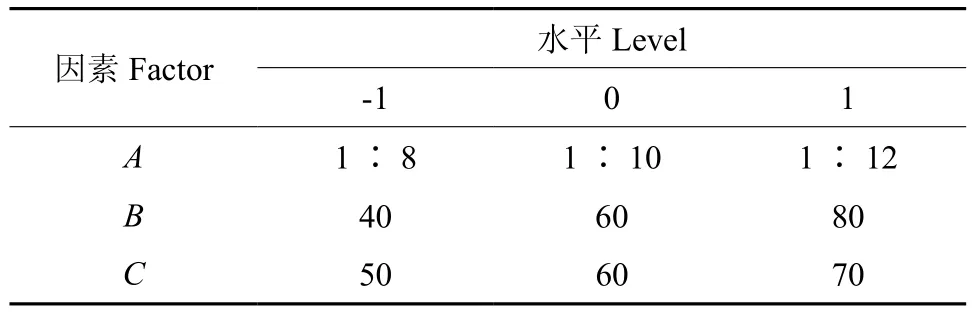
表2 试验因素及水平Table2 Factors and levels of experiment
2 结果与分析
2.1 单因素试验
2.1.1 乙醇质量分数对绿原酸提取率的影响
在料液比1∶14、提取温度60 ℃、提取时间30 min条件下,考察不同乙醇质量分数对绿原酸提取率的影响,结果如图1所示。由图1可以看出,随着乙醇质量分数的增高,绿原酸的提取率呈先上升后下降的趋势,选择40%乙醇作为提取溶液质量分数。

图1 乙醇质量分数对绿原酸提取率的影响Fig.1 Effect of ethanol mass fraction on extraction rate of chlorogenic acid
2.1.2 提取温度对绿原酸提取率的影响
在料液比1∶14、乙醇质量分数40%、提取时间30 min条件下,考察提取温度对绿原酸提取率的影响,结果如图2所示。由图2可知,在30~60 ℃之间,绿原酸提取率随着温度的升高而增加,达到60 ℃后,随着温度的进一步升高,绿原酸的提取率呈缓慢下降趋势。绿原酸为热敏性物质,在高温下容易失去活性,所以适宜的提取温度为60 ℃。
2.1.3 提取时间对绿原酸提取率的影响
在料液比1∶14、乙醇质量分数40%、提取温度60 ℃条件下,考察提取时间对绿原酸提取率的影响,结果如图3所示。由图3可知,绿原酸的提取率随着提取时间的增加而迅速增长,60 min时提取率最高,之后随着提取时间的增加提取率迅速降低,可能是随着提取时间的延长,部分绿原酸在高温下分解。因此,选择提取时间60 min。

图2 提取温度对绿原酸提取率的影响Fig.2 Effect of extraction temperature on extraction rate of chlorogenic acid
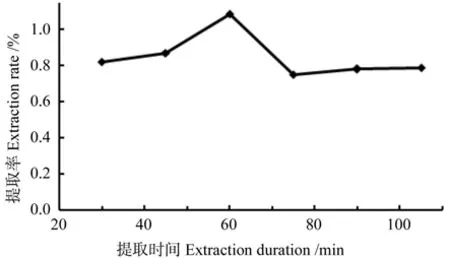
图3 提取时间对绿原酸提取率的影响Fig.3 Effect of extraction duration on extraction rate of chlorogenic acid
2.1.4 料液比对绿原酸提取率的影响
在乙醇质量分数40%、提取时间60 min、提取温度60 ℃条件下,考察料液比对绿原酸提取率的影响,结果如图4所示。由图4可知,绿原酸的提取率随着料液比的增加而不断上升,当料液比为1∶14时提取率最大,随后趋于平稳。
2.1.5 提取次数对绿原酸提取率的影响

图4 料液比对绿原酸提取率的影响Fig.4 Effect of solid-liquid ratio on extraction rate of chlorogenic acid
取杜仲叶粉20.0 g,在乙醇质量分数为40%、温度为60 ℃、料液比为1∶14的条件下提取60 min,并提取4次,如图5所示,绿原酸的提取率在2次提取后趋于稳定,所以选择2次作为提取次数。

图5 提取次数对绿原酸提取率的影响Fig.5 Effect of extraction times on extraction rate of chlorogenic acid
2.2 响应面法试验
2.2.1 响应值结果及其拟合模型
采用Box-Behnken中心组合试验设计原理,结合单因素试验结果,固定液料比1∶14,提取次数2次,分析乙醇质量分数、提取温度和提取时间对绿原酸提取率的影响。试验设计及结果如表3所示。

表3 响应面试验设计及结果Table3 Design and results of the response surface experiment
2.2.2 模型方程的建立及显著性分析
利用Design-Expert 8.0 Trial软件对表3中数据进行多元回归拟合,得表4。

表4 回归模型及其显著性检验Table4 Test of the regression model and its signiciances
当P值小于0.05时,表示此项指标显著,说明自变量和响应值之间线性关系显著。各因素经回归拟合后,得回归方程:

其中,Y为提取率,A为料液比,B为乙醇质量分数,C为温度。
由方差分析结果可知,该回归方程呈极显著性(P<0.01),模型失拟项也呈极显著性(P<0.01)。B、C2对绿原酸提取率的影响极显著(P<0.01),B2对绿原酸提取率的影响显著(P<0.05),A、C、AB、AC、BC、A2对绿原酸提取率的影响不显著(P>0.05)。
2.2.3 响应曲面分析
根据回归分析结果,做出响应面图,如图6~8所示。由图6可知,在各料液比中,随着乙醇质量分数的增加,绿原酸的提取率开始快速增加而后减缓。由图7可知,在各料液比中,随着提取温度的增加,绿原酸的提取率先上升后下降,可能是由于绿原酸为热敏性物质,随着温度的升高绿原酸分解,从而导致提取率下降。由图8可知,在乙醇质量分数较低时,随着温度的增加绿原酸的提取率先上升后下降;在乙醇质量分数增大为40%~60%时,提取率达最大;随着乙醇质量分数的进一步增加,持续提高温度,提取率下降。

图6 料液比和乙醇质量分数对绿原酸提取率的影响Fig.6 Effect of solid-liquid ratio and ethanol mass fraction on extraction rate of chlorogenic acid

图7 料液比和提取温度对绿原酸提取率的影响Fig.7 Effect of solid-liquid ratio and extraction temperature on extraction rate of chlorogenic acid

图8 乙醇质量分数和提取温度对绿原酸提取率的影响Fig.8 Effect of ethanol mass fraction and extraction temperature on extraction rate of chlorogenic acid
2.2.4 提取工艺条件检验
考虑到实际情况,将提取工艺条件修改为料液比1∶11,乙醇质量分数40%,提取温度61 ℃。采用修正条件进行试验,得绿原酸实际提取率为0.870 8%,与0.872 8%相比,相差0.23%,说明此方程与实际情况拟合良好,所建模型可靠。
3 结论与讨论
通过响应面优化杜仲叶中绿原酸的提取工艺,获得最佳提取条件:料液比1∶11、乙醇质量分数40%、提取温度61.42 ℃。在此工艺条件下绿原酸提取率为0.872 8%。3个工艺条件对绿原酸提取率影响程度由大到小依次为乙醇质量分数、料液比、提取温度。考虑到实际操作的限制,将提取工艺条件参数修改为料液比1∶11,乙醇浓度40%,提取温度61 ℃。采用修正条件进行试验,结果与理论预测值基本一致。
为了进一步提高杜仲叶中绿原酸的提取效率,除了微波和超声波辅助外,还可以通过一些生物技术来改善提取效果。如陈晓娟等[24]分别通过酶法和半仿生法从杜仲叶中提取绿原酸,提取率达到1.44%和1.29%;刘艺等[25]通过超临界流体萃取绿原酸,避免了提取过程中高温氧化分解绿原酸;余少冲等[26]采用罐组动态逆流提取技术提取绿原酸,提取率是传统单罐提取的2.3倍。温度对绿原酸的稳定性和提取效率起到双重影响的作用,一方面,温度的维持不利于绿原酸的稳定,另外一方面,升高温度有利于提高绿原酸的表观活化能,加快绿原酸扩散至杜仲叶颗粒表面,增加其在溶剂中的溶解度,进而提高绿原酸提取率[27]。因此,还需进一步探讨温度和乙醇对绿原酸的浸出动力学原理,绿原酸粗提工艺也需要向精提工艺转变。
[1] 魏艳秀,刘慧东,杜红岩,等.外源激素提高杜仲叶中有效成分含量的效果[J].中南林业科技大学学报,2017,37(5):42-49.
[2] 冯 攀.杜仲叶中绿原酸提取纯化绿色工艺的研究[D].西安:陕西科技大学,2014.
[3] 朱周靓, 严 峻, 郑云燕, 等.杜仲叶安全性的毒理学评价[J].浙江预防医学,2017,29(5):443-448.
[4] 杨 凌,张正香,莫开林,等.不同影响因素下杜仲叶中绿原酸含量变化特征研究[J].四川林业科技,2012,33(1):50-52.
[5] 杜笑林,朱高浦,闫文德,等.基于叶、皮、材兼用的高密度杜仲栽培模式研究[J].经济林研究,2016,34(3):1-7.
[6] 赖玲林,肖 苑,彭小芳.杜仲叶绿原酸提取物联合西红花苷对肝癌细胞胆固醇代谢的影响[J].山东医药,2017,57(8):17-20.
[7] 王学军,梁旭华,徐 恒. HPLC法同时测定杜仲叶中4种成分的含量[J].中医药信息,2017,34(1):33-35.
[8] 相 俊,卞崔冬,万晓东,等.杜仲叶提取物对人精子膜功能损伤的保护作用[J].同济大学学报(医学版),2017,38(3):46-49.
[9] 孙 阳,黄 和,胡 燚.绿原酸提取纯化方法的研究进展[J].化学试剂,2017,39(3):257-262.
[10] 张小斌,陈书存,雷燕妮.商洛杜仲叶中绿原酸的提取工艺优选研究[J].陕西农业科学,2016,62(3):34-39.
[11] 项丽玲,温亚娟,苗明三.杜仲叶的化学、药理及临床应用分析[J].中医学报,2017,32(1):99-102.
[12] 魏 锐,田惠玲,周建军,等.响应面分析法优化杜仲叶中绿原酸水提工艺[J].安徽农业科学,2011,39(7):3965-3967.
[13] 张吉波,孔 丽,于海辉.杜仲叶中绿原酸水提工艺的优化及其防腐效果研究[J].食品科技,2013,38(4):232-236.
[14] Nichiforescu E, Coucou V. On the distribution of odihydroxyphenols of the caffeic acid type in the artichoke leaves and on their variation as a function of temperature[J]. Annales Pharmaceutiques Francaises, 1966, 24(2): 127-132.
[15] 邵 平,洪 台,刘青梅,等.杜仲叶绿原酸的微波提取及高速逆流色谱分离纯化[J].核农学报,2011,25(4):760-767.
[16] 岳 鹍,王 芃,崔荣健.超声波辅助提取杜仲叶中绿原酸的工艺研究[J].农产品加工(学刊),2010(2): 33-35.
[17] 张雪梅,谢金芮,陈玉甫,等.全酶解法提取杜仲叶中绿原酸及其含量测定[J].中国酿造,2016,35(10):149-152.
[18] 李进飞.杜仲叶中绿原酸的提取及动力学研究[D].长沙:中南大学,2004.
[19] 杨小峰.乙醇回流法提取苹果中绿原酸的工艺研究[J].河北北方学院学报(自然科学版),2017,33(3):6-11.
[20] 张 蕾,张 娜,展雯琳.正交法优选杜仲叶中绿原酸提取工艺[J].粮食流通技术,2016(14):97-100.
[21] 冯慧娟,吴利强,周海玲,等.正交实验优化金银花中绿原酸的提取工艺[J].广东化工,2017,44(8):53-54,3.
[22] 韩建军,宁 娜,郁建生,等.响应面法优化微波协同酶法提取杜仲叶中绿原酸的工艺[J].贵州农业科学,2015,43(8):227-231.
[23] 孙 波,彭密军,于华忠,等.紫外可见分光光度法测定杜仲绿原酸含量的方法研究[J].中国野生植物资源,1999,18(3):54-55.
[24] 陈晓娟,周春山.酶法及半仿生法提取杜仲叶中绿原酸和黄酮[J].精细化工,2006,23(3):257-260.
[25] 刘 艺,李云淼,冯伟博.提取工艺对色谱法检测芦荟叶多酚含量的影响[J].食品工业,2017,38(5):300-303.
[26] 余少冲,杨祖金,袁雨婕,等.罐组动态逆流提取中药杜仲叶中总黄酮和绿原酸的研究[J].中药材,2009,32(2):300-302.
[27] 谷楠楠,王天贵,肖清贵,等.杜仲叶中绿原酸的浸出动力学[J].过程工程学报,2016,16(4):590-595.
