以混培法离体诱导油茶多倍体细胞的初步研究
2018-01-30卢梦琪蔡耀通吴旭平何超银曾艳玲
卢梦琪,蔡耀通,吴旭平,何超银,曾艳玲
(中南林业科技大学 a.经济林培育与保护教育部重点实验室;b.经济林育种与栽培国家林业局重点实验室;c.经济林培育与利用湖南省协同创新中心,湖南 长沙 410004)
油茶Camellia oleifera属山茶科山茶属常绿小乔木,在我国已有2 300多年的栽培历史,是我国南方重要的木本油料树种,与油橄榄、椰子、油棕合称为世界四大木本植物油料树种。茶油富含不饱和脂肪酸,具有预防和治疗高血压、心血管系统疾病等功效,是国际粮农组织重点推荐的保健植物食用油,也是我国政府提倡的纯天然木本食用油,有“东方橄榄油”之称[1-3]。据报道,全国油茶林面积约400多万hm2,茶油产量约51.8万t。但是,油茶种植生产中还存在优质品种少、产量不稳定且低产等问题[4]。我国食用油对外依存度较高,研发和培育高产、高抗、高质油茶新品种,不仅可以有效缓解国内植物油缺乏的局面,而且可以带动其相关产业的发展,充分发挥油茶的生产潜力。
自然界中多倍体植株普遍存在。自从1937年Blakeslee等发现并证实秋水仙素可诱导植物多倍体之后,世界便掀起了一股多倍体研究热潮。秋水仙素能抑制纺锤体的形成,使细胞在分裂前期或者后期染色体不能移向两极而使染色体加倍[5]。现已在猕猴桃[6]、苹果[7]、三色堇[8]、矮牵牛[9]、番茄[10]、西瓜[11]、滇杨[12-13]和杜仲[14]多种林木、花卉、农作物多倍体育种中获得了成功。多倍体植株染色体成倍增加,基因也成倍增加,新陈代谢活跃,蛋白质、碳水化合物、维生素、植物碱等物质的合成速率加快,含量增多,其茎、叶、花、果实等变大[15]。目前,关于油茶多倍体育种的研究报道很少,国外的尚未见到,国内也只有极少数。譬如,李铁柱等[16]用秋水仙素处理油茶种子,获得了多株普通油茶变异体,有的表现出叶、花、果实增大,有的则表现出早花早果。但是,种子本身异质性强,所以本研究选取性状差异小的同株系嫩叶为材料,采用组织培养与秋水仙素诱导相结合的方法(简称为“混培法”)诱导多倍体细胞,以期为后期筛选培育油茶多倍体优良种质,提高油茶产量提供科学依据。
1 材料与方法
1.1 供试材料
供试材料为油茶国家审定品种‘华硕’[17]当年春季新抽嫩叶,采集地为中南林业科技大学生命科学楼顶楼油茶资源圃。
1.2 材料的处理
春季4月选取当年生完全展开的嫩叶,用超纯水冲洗2~3次,放入灭菌的烧杯中。在超净工作台上,用75%的酒精浸洗30~40 s,无菌水冲洗3~5次;用0.1%升汞溶液浸洗8 min,无菌水冲洗5~6次。用无菌滤纸吸干叶面水分后,将叶片切成0.5 cm×0.5 cm大小的叶盘,接种在附加了不同浓度秋水仙素的愈伤组织诱导培养基上。
1.3 愈伤组织的诱导和再分化
愈伤组织诱导培养基参照毕方铖等[18]的油茶子叶愈伤组织最佳诱导配方,即为MS+2.0 mg·L-12,4-D+1.0 mg·L-1KT。秋水仙素的浓度梯度和处理时间参照陈杰等[19]诱导滇杨多倍体的秋水仙素浓度和时间设计,共组成30个处理,详见表1。将消毒好的叶盘接种在附加了不同浓度秋水仙素的愈伤组织诱导培养基上,暗培养7 d后转入光照条件下培养,培养温度为(29±2)℃,光强约为6 000 lx,光照时间为16 h。每个处理接种 10瓶,每瓶3枚叶盘,每隔3 d观察1次,记录叶盘的死亡情况、愈伤组织形成情况及愈伤组织的生长状态、颜色等性状。2个月后,统计愈伤率、死亡率等指标。采用SPSS Statistics v19.0软件进行数据统计与分析。
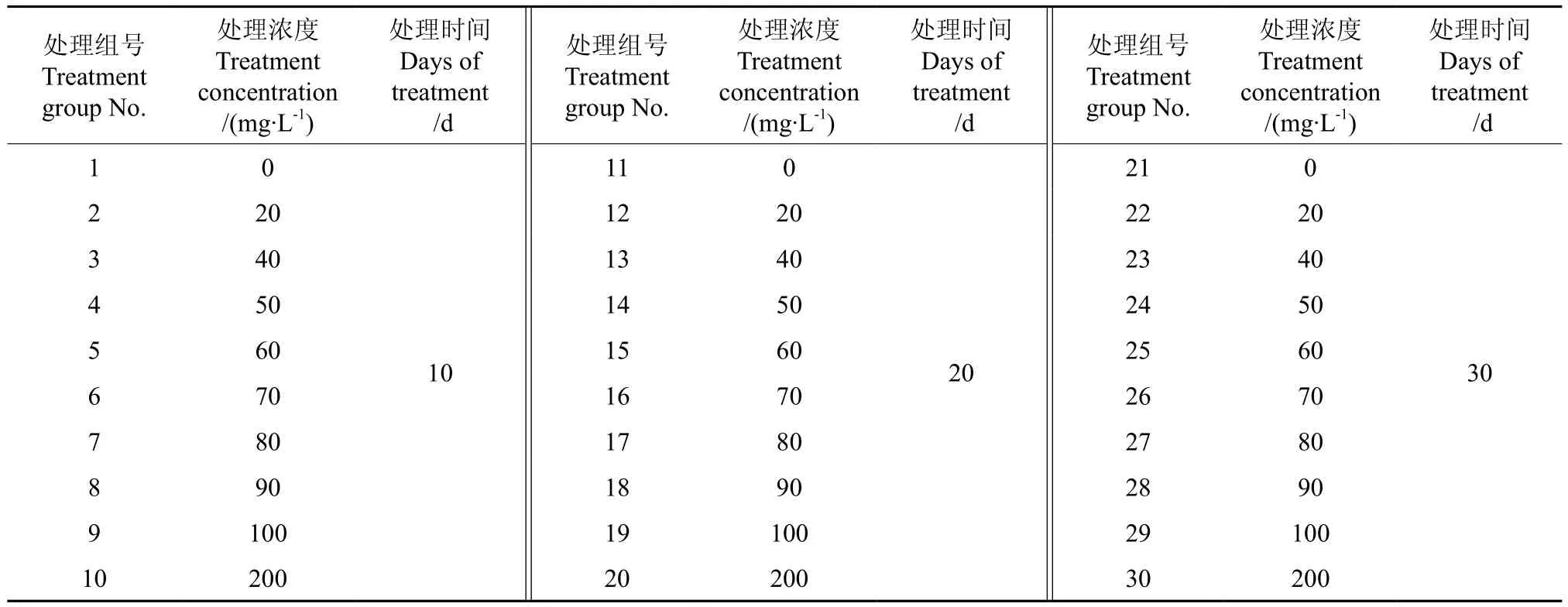
表1 秋水仙素浓度梯度设计Table1 Design of colchicine concentration gradient
愈伤率=(诱导愈伤组织数/接种叶片总数)×100%;
死亡率=(褐化材料数/接种叶片总数)×100%。
1.4 愈伤组织倍性的测定
以二倍体博白大果油茶[20]作为参照,用Sysmex流式细胞仪检测愈伤组织相对DNA含量,电压设为422 V。在超净工作台上取少量长势良好、没有褐化的愈伤组织放入培养皿中,加入400 mL的细胞解离液,用刀片将愈伤组织切碎,用400目的尼龙网筛过滤至离心管中制成单细胞悬浮液。在黑暗条件下,加入800 mL的DNA染色液,立即检测。每次检验至少收集4 000个颗粒。
1.5 细胞核大小的观察
参照赵云等[21]石蜡切片制作方法,调整固定到复水等步骤的处理时间。使用苏木精-伊红对染法染色,用2%的爱式苏木精避光浸泡14 h,洗去浮色后用1%的水溶性伊红染色20 s左右。用中性树胶封片,用Olympus BX-51光学显微镜观察细胞及细胞核的大小,进行显微照相。
将细胞和细胞核均看作球形进行核质比的计算,其计算公式为:
NP=VN/(Vc-VN)。
式中,NP为核质比,VN为核的体积,Vc为细胞的体积。
2 结果与分析
2.1 秋水仙素对叶盘的存活及愈伤组织诱导的影响
接 种 第 2天, 3、6、8、13、16、18、23、26、29号处理组的叶盘均出现了轻微的褐化(图1A);接种14 d后,各处理组的叶盘均出现褐化,褐化比较严重的处理组号分别为8、9、10、18、19、20、28、29、30。培养14d 后,2、12、15、17号处理组的叶盘开始变厚,边缘泛黄,长出少量愈伤组织(图1B);培养20 d后,11、12、13、15、17、27号等处理组开始长愈伤组织。培养30 d后,每个处理组均诱导出愈伤组织;“混培法”对油茶多倍体细胞诱导的影响情况如表2所示。整体而言,愈伤组织的生长状况均一般,生长速度快的却褐化严重,生长速度慢的而其愈伤组织量低。以秋水仙素处理30 d的愈伤组织其生长状况比处理10与20 d的明显差一些。从颜色上来说,当秋水仙素的浓度为20~80 mg·L-1时,处理20 d后诱导出来的愈伤组织长势最好,颜色呈现绿色或者黄绿色,长速较快(图1C)。从愈伤组织生长的量来说,以秋水仙素处理20 d的处理组要多于处理时间分别为10、30 d的处理组。

图1 愈伤组织诱导情况Fig.1 Callus induction status
一般认为,秋水仙素对外植体有毒害作用,会使外植体存活率随着秋水仙素浓度的增高而降低。从表2中可以看出, 1、2、3、11、12、21、22号处理组的死亡率均相对较低,且组间无显著差异; 1、2、3、4、11、12、21号处理组的愈伤率均相对较高,且组间无显著差异。这一结果说明,在较低浓度的秋水仙素处理下,处理时间的长短对叶盘的死亡率、愈伤率的影响均不大;而较高浓度秋水仙素处理组的数据显示,虽然处理时间长短不同,死亡率无显著差异,但是愈伤率存在差异。当秋水仙素浓度达到200 mg·L-1时,无论处理时间长或短,叶盘的死亡率均较高,而愈伤率均较低,当处理天数为30 d时,愈伤率约为0。低浓度处理组和高浓度处理组之间,无论死亡率还是愈伤率均存在显著差异,且均呈现出随着处理浓度增高,死亡率逐渐增加,愈伤率逐渐减少的规律。
对表2数据进行相关性分析,结果如表3所示。由表3可知,死亡率与处理时间长度、秋水仙素浓度间均呈极显著正相关,其相关系数分别为0.445和0.598;愈伤率与处理时间长度、秋水仙素浓度间均呈极显著负相关,其相关系数分别为-0.379和-0.666;其中,处理浓度与愈伤率的相关性最高。
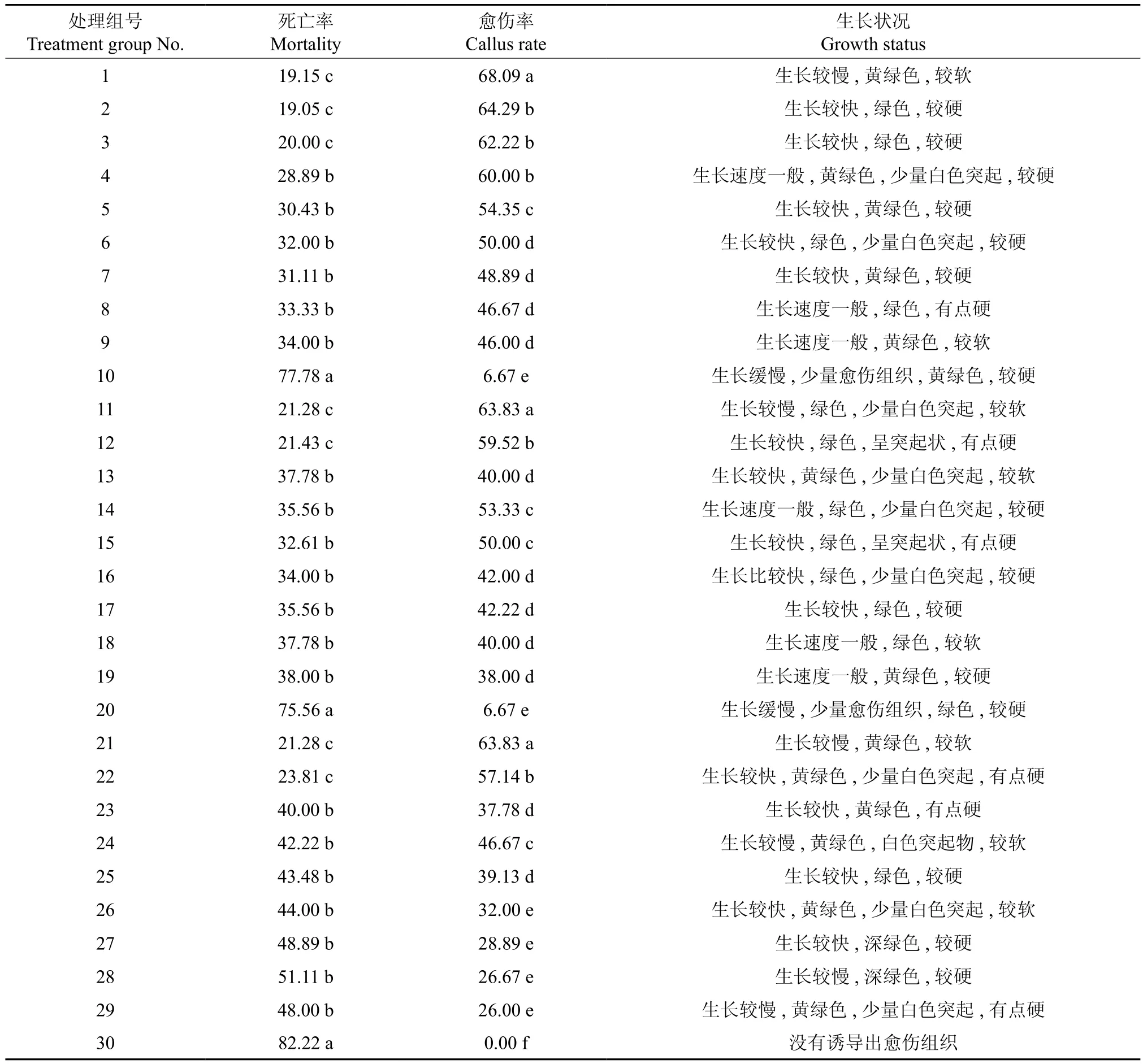
表2 “混培法”对油茶多倍体细胞诱导的影响†Table2 Influence of mixed tissue culture on inducing polyploid cells in C. oleifera %

表3 不同处理下叶盘培养结果的相关性分析结果†Table3 Correlation analysis of different treatments on leaf disc culture
2.2 秋水仙素处理对愈伤组织相对DNA含量及其细胞核大小的影响
参比二倍体油茶‘博白大果’的相对DNA含量,根据未添加秋水仙素的1、11、21号对照组的愈伤组织相对DNA含量,计算出的‘华硕’愈伤组织相对DNA含量均值是348.92。以此为参照,求出各处理组愈伤组织相对DNA含量与对照组相对DNA含量之间的比值,即为倍数,计算结果如表4所示。从表4中可以看出,各处理组的倍数都大于1.0,愈伤组织相对DNA含量均有所增加,说明各处理组都有多倍体细胞产生。倍数在2.0左右的处理组包括4、8、9、13、14、15、16、25号。

表4 愈伤组织细胞相对DNA含量及核质比†Table4 Relative DNA contents and nuclear-cytoplasmic ratios in callus cells
根据愈伤组织切片分析不同处理组的细胞核质比(见表4),在此基础上统计了不同倍数的核质比均值,结果如表5所示。倍数为1.0的愈伤组织细胞核质比为(0.098±0.036),其相对DNA含量为348.05(如图2 A1和B1所示);倍数为2.0的愈伤组织细胞核质比为(0.130±0.023),其相对DNA含量为677.33(如图2 A2和B2所示),比倍数为1.0的要大,细胞相对DNA含量增多,其相应的核质比也会增大。Pearson相关性分析结果显示,倍数与核质比之间的相关系数为0.441,表示两者在P<0.05水平上呈显著正相关,即核质比随着相对DNA含量的增多而增大。
培养相同天数后,只有13与22号处理组的愈伤组织有分生细胞团(分别如图3A和B所示)出现。根据袁德义[22]油茶叶片组织培养试验结果可知:不是所有形态的愈伤组织都能分化成芽,而是一定形态、一定结构的愈伤组织在适宜的培养条件下才能分化成芽。处理组13与22号的愈伤组织生长速度相对来说较快些,均呈黄绿色,有少量白色突起。

表5 不同倍数的核质比均值Table5 Mean values of nuclear-cytoplasmic ratios of different multiples


图2 愈伤组织的石蜡切片及相对DNA含量Fig.2 Paraff i n sections and relative DNA contents of calluses

图3 处理组13与22号的愈伤组织分生区和分生细胞团Fig.3 Callus meristematic zones and meristematic cells of the treatment group No.13 and No.22
3 结论与讨论
油茶是我国重要的木本食用油料树种,通过倍性育种可快速创新种质资源,培育高产优质品种。秋水仙素诱导是目前最常用的方法,可采用以其溶液浸泡种子、点滴处理生长点或者结合组织培养等方法[23]。本研究采用添加秋水仙素的植物组织培养混培法进行培养,研究结果表明,低浓度秋水仙素处理对油茶叶片离体培养的副作用相对较小,致死率低,同时能获得相当数量的多倍体细胞;但是,高浓度的秋水仙素处理会严重影响外植体的活性,导致叶盘或愈伤组织褐化死亡,随着秋水仙素浓度的升高和处理时间的延长,叶盘的死亡率逐渐升高,愈伤率逐渐降低。这与张静静[24]和刘丽[25]的研究结果一致。
本研究结果表明,以不同浓度秋水仙素处理油茶叶盘,均能诱导多倍体细胞的产生,其中以40 mg·L-1的秋水仙素处理 20 d 和以 20 mg·L-1的秋水仙素处理30 d培养获得的油茶愈伤组织细胞相对DNA含量的倍数均在2.0以上,而且在显微镜下均能观察到细胞分生团,但后期是否能分化出多倍体植株还有待进一步观察。此外,本研究结果产生了多种倍数的相对DNA含量的愈伤组织,说明愈伤组织的倍性是不稳定的。其原因可能是,在愈伤组织的诱导和增殖过程中,不同倍性的细胞相互融合;在愈伤组织的生长过程中,染色体发生变异等。其原因也有可能是,切取的材料正好是分裂旺盛的部位,导致倍数偏高等。
目前,关于油茶多倍体育种仅见于李铁柱[16,26]和包梅荣[27]的相关报道,他们采用的材料分别是种子和实生苗,以浸泡法和点滴处理生长点的方法诱导多倍体植株,虽然获得了几株变异株,但是种子和实生苗个体之间本身存在较大差异,这就影响了研究结果的科学性。本研究采用同株系当年生嫩叶为材料,保证了材料基因型的一致,但是,油茶叶片离体快繁技术瓶颈尚未攻克,迄今尚未见有培育出完整植株并且存活的报道[22,28]。本研究中有2个处理组的愈伤组织可观察到分生细胞团,但是,培养了90 d左右仍未见有芽分化出。后续研究将在此基础上继续探索油茶叶片愈伤组织多倍体分生团出芽成苗的培养体系,从而为后期快速得到多倍体油茶奠定基础。
[1] 庄瑞琳.中国油茶[M].第2版.北京:中国林业出版社,2008.
[2] 董占能,邢思敏.从茶籽中提取茶油、茶皂素的研究[J].昆明理工大学学报,1998,23(2):83-88.
[3] 马 力,陈永忠.茶油的功能特性分析[J].中国农学通报,2009, 25(8):82-84.
[4] 王 瑞,陈永忠.我国油茶产业的发展现状及提升思路[J].林业科技开发,2015,29(4):6-10.
[5] 周慧文,冯 斗,严华兵.秋水仙素离体诱导多倍体研究进展[J].核农学报,2015,29(7):1307-1315.
[6] 李升星,刘 峥,贺 笑,等.猕猴桃多倍体育种研究进展[J].现代农业科技,2015(17):112-114.
[7] 马 跃,宣景宏,张志宏.苹果多倍体育种研究进展[J].北方果树,2015(6):1-3.
[8] 郑思乡,胡 秀,雷小云,等.离体培养条件下三色堇多倍体诱导研究[J].云南农业大学学报,2003,18(4):397-400.
[9] 陈 一,李春楠.矮牵牛多倍体诱导试验与快速鉴定[J].浙江农业科学,2016,57(3):361-363.
[10] 陈圣栋,杨建平,曹德航,等.秋水仙碱诱导番茄多倍体的研究[J].山东农业科学,2007(3):22-24.
[11] 王友平,朱金英,徐光东,等.西瓜多倍体研究应用进展[J].长江蔬菜,2010(20):8-12.
[12] 辛培尧,陈 杰,唐军荣,等.滇杨多倍体的诱导研究[J].中南林业科技大学学报,2014,34(3):24-28,57.
[13] 邱 芬,辛亚龙,唐军荣,等.不同倍性滇杨叶片解剖结构差异分析[J].中南林业科技大学学报,2017,37(6):56-59,69.
[14] 张海凤,郭宝林,张成合,等.杜仲四倍体的诱导与鉴定[J].园艺学报,2008,35(7):1047-1052.
[15] 程金水.园林植物遗传育种学[M].北京:中国林业出版社,2006.
[16] 李铁柱,田大伦,乌云塔娜,等.四倍体油茶的鉴定及变异[J].林业科学,2009,45(3):150-154.
[17] 谭晓风,袁德义,袁 军,等.大果油茶良种‘华硕’[J].林业科学,2011,47(12):184,209.
[18] 毕方铖,谭晓风,张智俊,等.油茶离体培养诱导再生植株的研究[J].经济林研究,2004,22(2):5-9.
[19] 陈 杰,周 军,孙正海,等.组织培养结合秋水仙素诱导滇杨多倍体的研究[J].云南农业大学学报,2013,28(2):251-256.
[20] 庄瑞林,董汝湘.我国油茶主要物种花粉大小、变异性及染色体数的初步观察[J].林业科技通讯,1984(3):15-17.
[21] 赵 云,李 涛,陈增洁.含羞草石蜡切片的制作[J].宁夏农林科技,2011,52(4):45-46.
[22] 袁德义,范晓明,谭晓风,等.油茶带芽茎段及叶片离体培养再生体系的建立[J].南京林业大学学报(自然科学版),2013,37(5): 35-39.
[23] 彭尽晖,张良波,彭晓英.秋水仙素在植物倍性育种中的应用[J].湖南林业科技,2004,31(5):22-25.
[24] 张静静.铁皮石斛多倍体的诱导及其鉴定[D].杭州:浙江农林大学,2013.
[25] 刘 丽,林苗苗,方金豹,等.秋水仙素对‘琼露’猕猴桃多倍体诱导的影响[J].经济林研究,2017,35(3):147-151.
[26] 李铁柱,包梅荣,乌云塔娜.油茶秋水仙素诱导苗光合作用变异研究[J].内蒙古农业大学学报,2008,29(4):155-160.
[27] 包梅荣,李铁柱,乌云塔娜,等.秋水仙素处理油茶种子和幼苗变异的初步研究[J].内蒙古农业大学学报,2009,30(2):46-51.
[28] 蔡冬元.油茶叶片初始诱导培养技术研究[J].湖南农业科学,2014(20):5-7.
