海南白花油茶花药再生体系的初步建立
2018-01-30周广振栾林莉宋玉凤吴友根胡新文何朝族陈健妙
周广振 ,栾林莉 ,宋玉凤 ,吴友根 ,胡新文 ,何朝族 ,陈健妙
(海南大学a.热带农林学院;b.海南省热带生物资源可持续利用重点实验室海南,海南 海口 570228)
油茶Camellia oleifera Abel.又名茶子树、油茶树,为常绿小乔木或灌木,分布于我国海南、福建、湖南、江西、广西等省区,与油橄榄、油棕、椰子并称为世界四大木本油料植物,是我国得天独厚的植物资源,茶油具有“东方橄榄油”之美称[1]。油茶也是海南省传统的油料经济作物,充分利用海南油茶资源和生态优势,发展具有地方特色的茶籽油及其副产品,将进一步促进海南省农业产业结构调整和农民增收,还可以改善油茶适种市县的生态环境,为海南省打造国际旅游岛而锦上添花[2-3]。近年来,我国食用油供需矛盾突出,而油茶作为我国特有的木本油料作物其产业经济效益差、产量低等问题明显[4-5]。将其他省区的油茶良种引种到海南地区种植,普遍存在生长适应性差、生长慢、难开花或坐果率低等问题。因此,生产、种植适合海南本地土壤和气候条件的良种壮苗是促进海南油茶产业健康可持续发展的关键。
各油茶适种省区的生产实践经验证明,油茶杂交难度大,成功率低,品种改良难度极大[6]。芽苗砧嫁接是已经被生产实践证明了的成熟度非常高的无性繁殖技术,而目前适合海南土壤、气候条件的本地芽苗砧嫁接油茶良种壮苗,因为接穗有限,导致芽苗砧嫁接苗极其匮乏[5]。组织培养作为植物无性繁殖的方式之一,被广泛应用于各种经济作物的良种繁育之中。油茶通过以不同器官、组织和细胞培养,经器官发生途径产生的丛芽可作为嫁接接穗用苗,而通过体细胞胚发生途径形成的再生植株,具有主根,可直接用作栽培用苗[7-8]。以本地优良品系为外植体母株,通过两种途径繁育组培苗,是解决海南省油茶良种苗匮乏的有效途径。目前,国内外陆续有不同产区油茶组织培养的研究报道,但因地区土壤气候不同,所用油茶基本培养基也相差甚远;已有成功形成再生植株的油茶再生体系多数以成熟和未成熟子叶作为外植体[9]的研究报道,而以油茶花药作为外植体,仅限于愈伤组织的诱导,鲜见有再生植株成功培育的报道,而海南白花油茶组培方面的报道更为鲜见。为了拓展海南白花油茶的再生体系和完善国内外油茶花药诱导再生体系,本实验以海南白花油茶未开放花蕾为外植体,建立了油茶花药体细胞胚植株再生体系,探讨了影响油茶花药再生体系的关键因子,旨在加快海南省油茶品种改良进程、生产优质组培苗供应当下紧缺的油茶良种壮苗以及建立高效稳定的油茶再生体系,为今后有关油茶功能基因等方面的研究奠定基础。
1 材料与方法
1.1 供试材料
花药外植体材料于2015年1月采自海南大学与琼海市市校合作项目“琼海油茶高产优质配套栽培关键技术研究与示范”的油茶高产栽培技术实验基地(海南省琼海市阳江镇卢家村)所选育的油茶高产单株。
1.2 实验方法
1.2.1 花粉发育时期与花蕾外部形态的对应观测
于晴天上午8:00—9:00时,选摘未开放的海南白花油茶花蕾,及时放进冰盒带回实验室。根据横径大小将花蕾分为4组(i、ii、iii和iv),观察并记录4组花蕾的外观形态特征,用游标卡尺测量花蕾的纵径(cm)和横径(cm),计算纵横径的比值(纵横径之比=纵径长度/横径长度),然后撕开花瓣,观察花蕾中花药的生长发育状态,记录花药、花丝的形态和颜色等生物学特征。每处理3次重复,取平均值。
将4组油茶花蕾分别用卡诺固定液(纯酒精∶冰醋酸∶氯仿=6∶1∶3)固定24 h,然后剥取不同花蕾的花药,将花粉轻轻挤压在载玻片上,滴1滴改良苯酚品红染色液,去除杂质,盖上盖玻片,2~3 min后,用体视显微镜观察,数取视野中处于单核早期、单核靠边期、双核期等不同发育阶段的花粉数目。结合花蕾外观形态特征及其纵径、横径和纵横径之比,对比分析以确定海南白花油茶花蕾的外部形态与花粉发育时期的对应关系,作为日后花药外植体选材的外观依据。
1.2.2 接种方法、培养方式和培养基种类
取出花蕾,先用低浓度的洗洁精浸泡20 min,然后用自来水冲洗干净,并用吸水纸吸干水分。在超净工作台上,将花蕾置于无菌烧杯中,用70%的酒精浸泡45 s,用无菌水冲洗1次,然后用0.1%的HgCl2表面消毒14 min,以无菌水冲洗6次。表面消毒完毕后,用解剖刀和镊子剥去外层花萼,取下花药(切除花丝),平铺接种在胚性愈伤组织诱导培养基上。每皿接种不少于25粒花药,每处理3次重复。然后置于培养室内进行暗培养,培养温度为(27±2)℃。每隔15 d转接1次,待愈伤组织诱导出来后,统计愈伤组织诱导率(%),继续按时进行继代培养,并统计愈伤组织生长速率(g·d-1),培养50 d后,根据愈伤组织的生长形态,筛选出类胚性愈伤组织。将类胚性愈伤组织继续转接到体细胞胚分化诱导培养基上,诱导出体细胞胚,再转接至体细胞胚成熟和萌发培养基上,形成花药体细胞胚再生植株。
初代愈伤组织诱导培养基用如下2种:I号为改良MS(大量元素减至2/3)+NAA1mg·L-1+Kt1mg·L-1+ 5% 椰汁+蔗糖 30 g·L-1+琼脂7g·L-1,其pH值为5.5;II号为改良MS(大量元素减至2/3)+ 2,4-D2mg·L-1+ Kt 0.5 mg·L-1+ 5% 椰汁+蔗糖 30 g·L-1+琼脂7g·L-1,其 pH 值亦为 5.5。
胚性愈伤组织增殖与再分化的培养基为:改良MS(大量元素减至1/2)+NAA 0.5 mg·L-1+6-BA2mg·L-1+ Zt1mg·L-1+ 10% 椰汁 +蔗糖30 g·L-1+琼脂7g·L-1,其 pH 值为 5.5。
体细胞胚成熟和植株再生的培养基为:改良MS(大量元素减至1/2)+NAA 0.1 mg·L-1+6-BA 0.5 mg·L-1+ 0.1% 活性炭+蔗糖 30 g·L-1+琼脂7g·L-1,其 pH 值为 5.5。
1.2.3 愈伤组织诱导率的统计
培养30 d后统计愈伤组织诱导率,每个处理3次重复,取平均值。
愈伤组织诱导率(%)=(诱导出愈伤组织的花药数目/接种总花药数目)×100%。
1.2.4 愈伤组织增殖生长和再分化状态的观测
称取一定重量的新鲜愈伤组织接种到新鲜培养基上,继代培养20 d后,称取总愈伤组织鲜质量,计算其生长速率,每个处理3次重复,取平均值。
生长速率(g·d-1)=(培养第20天的胚性愈伤组织质量-原接种愈伤组织的质量)/20。
观测诱导分化过程中胚性愈伤组织的形态学参数,即清晰可见的原胚组织(calli bearing clearly visible proembryos,EC)、褐色或坏死性愈伤组织(brown or necrotic calli,BC)和松碎的愈伤组织(friable calli,FC),以百分比统计,每个处理3次重复,取平均值。
1.2.5 体细胞胚的成熟和植株的再生
挑取暗培养条件下肉眼可见的已分化出球形胚状体的胚性愈伤组织,将之接种到体胚成熟诱导培养基上,光照培养,等诱导出胚根和胚芽时,再转接到植株再生培养基(与体细胞胚成熟基本培养相同,未添加激素)上,光照强度约2 000 lx,每天光照培养12 h。
1.2.6 花药再生植株的移栽
待再生植株长出2片真叶时,即可移栽到装有基质(腐殖土∶蛭石=1∶1)的育苗杯中,培养20 d后统计移栽成活率。
2 结果与分析
2.1 海南白花油茶花蕾的外部形态及其与花粉发育时期的对应关系
对于多数植物而言,花粉发育处于单核靠边期时的花药最容易诱导胚性愈伤组织,且有利于后期体细胞胚状体的分化。因此,选择花蕾作为花药离体培养的外植体时,应严格掌握花粉粒的发育时期,从而提高花药愈伤组织植株再生的效率。海南白花油茶花蕾的外部形态及其与花粉发育时期的对应关系如表1所示。由表1 可知,与i组花蕾的横径相比,ii、iii和iv组的横径分别显著增加了28.3%、39.8%和62.4%,其中,ii与iii组间无显著差异;与i组的花蕾纵径相比,ii、iii和iv组花蕾的纵径分别显著增加了10.2%、24.4%和36.9%,组间差异显著;与i组花蕾的纵、横径之比值相比,随着纵、横径的增加,ii、iii和iv组花蕾的纵横径之比与i组的均无显著差异,其相互间也无显著差异。

表1 海南白花油茶花蕾的外部形态及其与花粉发育时期的对应关系†Table1 Corresponding relationship between external morphology of flower buds and pollen development phases of C. oleifera in Hainan
花粉不同发育时期的花蕾外观形态分别如表1和图1所示。由表1和图1可知,i组花蕾全萼包被着花瓣,淡黄色的花药中,花粉发育以单核居中期为主;ii和iii组的花蕾也是全萼包被着花瓣,花药发育变成橘黄色,花粉发育以单核靠边期为主;而iv组的花蕾花瓣已露白,花粉发育以双核期为主。
2.2 不同初代诱导培养基对海南白花油茶花药愈伤组织诱导的影响
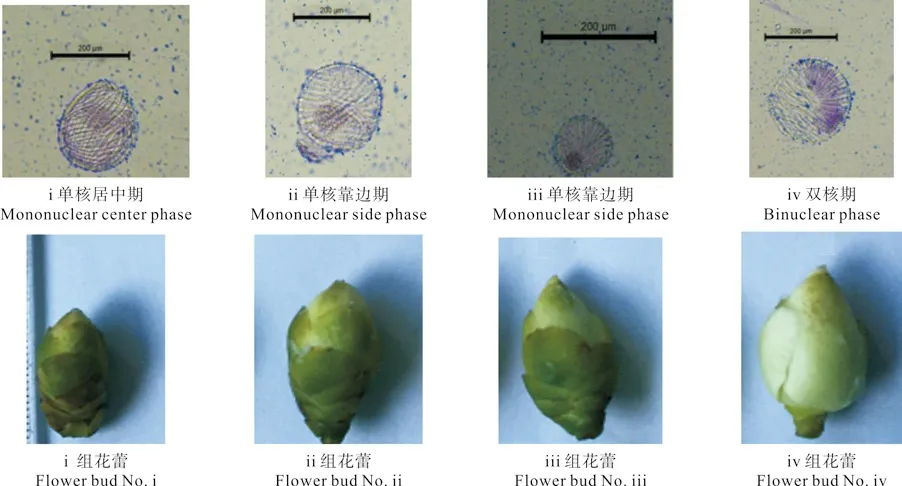
图1 花粉不同发育时期不同处理组别花蕾的外观形态Fig.1 External appearances of fl ower buds at different development phases of pollens in different treatments
适宜的初代愈伤组织诱导培养基是确保植物花药诱导出胚性愈伤组织的前提。以海南白花油茶花粉不同发育时期的花蕾为外植体,经表面消毒后,剥取花药分别接种到I和II号两种不同初代愈伤组织诱导培养基上,暗培养第10天时观察外植体生长情况,第40天时观察愈伤组织诱导情况,以筛选合适的花药外植体和初代愈伤组织诱导培养基,观测结果如图2所示。在两种初代愈伤组织诱导培养基上暗培养第10天时,iii和ii组花蕾的花药生长均较好,其花药基本保持鲜黄色,褐变较少,花药均有明显的脱分化诱导,在I号培养基上的尤其明显;而i和iv组花蕾的花药褐变均较明显,却均未见明显的花药脱分化诱导。由表2和图2可知,在I号初代愈伤组织诱导培养基上培养第40天时,i组花蕾的花药愈伤组织诱导率低于10%,与i组花蕾的花药愈伤组织诱导率相比,iii和ii组花蕾的分别显著增加约5与7倍,而iv与i组花蕾的花药愈伤组织诱导率间却无显著差异;愈伤组织多呈紧实、规则凸球状的类原胚性愈伤组织。在II号初代愈伤组织诱导培养基上培养第40天时,i组花蕾的花药愈伤组织诱导率约为5.38%,iii和ii组花蕾的花药愈伤组织诱导率比i组花蕾的分别显著增加约5与10倍,而iv与i组花蕾的花药愈伤组织诱导率间却无显著差异;但愈伤组织松软不规则,呈水渍状的多,多数呈现出非胚性愈伤组织。
2.3 不同培养方式对花药胚性愈伤组织增殖和再分化的影响
挑取I号培养基上生长质地紧实、呈规则小凸球状的类原胚性愈伤组织接种至胚性愈伤组织的增殖与再分化培养基上,采取光照与暗培养两种方式进行继代培养。培养15 d后,观测愈伤组织的生长速率和生长状态,结果分别如图3A与B所示。从图3A中可以看出,暗培养能明显维持胚性愈伤组织的胚性特性(EC),组织质地坚实、松碎(FC)而略带透明,呈现出明显的体细胞胚再分化球形胚状态,褐色组织(BC)相对少。从图3B中可以看出,光照培养条件下,愈伤组织虽也能生长,但只有少部分能维持胚性愈伤组织的胚性特性(EC),而大多数变褐,部分甚至坏死(BC)。经测定,两种愈伤组织生长速率间的差异不显著,其生长速率分别为0.078和0.056 g·d-1。
2.4 花药体细胞胚的萌发和植株再生状况
将肉眼可见的具球形体细胞胚的胚性愈伤组织转接至体细胞胚成熟诱导培养基上,继续暗培养30 d左右,陆续看到有球形的体细胞胚逐渐再分化形成子叶形体细胞胚(如图4A所示),随着时间的延长,胚芽萌发,胚根伸长,形成具有主根的花药体细胞胚再生植株(如图4B所示),但体细胞胚诱导率极低,仅约有8%。把已具主根的体细胞胚再生植株转接到没有激素的植株再生培养基上,培养20 d即可长成具主根和胚芽的花药胚性愈伤再生植株(如图4C所示)。

表2 不同发育时期的花药在不同初代诱导培养基上的生长情况Table2 Growth status of anthers at different development phases in different primary induction media

图2 花粉不同发育时期的花药在不同初代诱导培养基上的诱导生长情况Fig.2 Growth status of anthers at different development phases in different primary induction media
2.5 花药再生植株的移栽情况
待油茶花药体细胞胚再生植株在培养瓶里长出展开的新叶后取出再生植株,在慢速流水下冲洗粘在根部的培养基,洗干净后用吸水纸吸干多余的水分,即时移栽到装有腐殖土和蛭石的比例为6∶4的混合基质的育苗杯中,浇足定根水,遮阴处理2周后即可看到新芽长出(如图4D所示)。本次实验诱导出一小批花药再生植株,以蛭石和椰糠(1∶1)的混合物为基质,全部移栽成活。
3 讨论与结论
3.1 花药胚性愈伤组织诱导的合适花蕾外植体的筛选

图3 不同培养方式对海南白花油茶花药愈伤组织增殖和分化的影响Fig.3 Effects of different culture modes on proliferation and differentiation of anther calli of white fl ower C. oleifera in Hainan

图4 海南白花油茶花药诱导体细胞胚形成再生植株Fig.4 Somatic embryogenesis regenerated plants of white fl ower C. oleifera anthers in Hainan
花粉粒所处的发育时期对花药胚性愈伤组织的诱导起关键作用,很多研究结果都表明,大多数植物处于单核期的花粉粒其诱导成功率更高[10-11],我们的实验结果与此相符,ii和iii组花蕾的花粉粒发育大多处于单核靠边期,花萼全包裹花瓣,花药橘黄色,诱导胚性愈伤组织的效果均明显优于i和iv组花蕾的。综合花蕾的纵径长、横径长及纵横径之比来看,对于海南白花油茶而言,其横径的长度(1.19~1.30 cm)与花粉发育单核靠边期的对应关系最近。处此发育阶段的花蕾其花萼全包被花瓣,花粉粒大多数处于单核靠边期,小孢子活力大,最利于诱导花药胚性愈伤组织。闻丽等[12]的研究结果也表明,在盛花初期所采样品的愈伤组织诱导率高于盛花末期所采样品的诱导率。另外,整个花蕾被花萼包裹得很紧实,外界环境中的微生物、昆虫等也不易进入,接种外植体污染率低,这是海南白花油茶适合花药诱导愈伤组织的合适外植体,可作为外植体采摘的外观评价指标。而纵径间差异显著、纵横径比值间的差别微小,与花粉发育单核靠边期的对应关系不密切,不宜作为外植体采摘的外观评价指标。本实验研究第1次采摘花蕾分析花粉发育时期,经验尚不足,下一步的优化实验可采摘横径为0.93~1.19 cm的花蕾,再适当细化其横径梯度,以便更加精准地筛选出海南白花油茶花粉粒处于单核靠边期的花蕾,从而提高今后实验研究和栽培生产的效率。
3.2 花药胚性愈伤组织诱导的合适初代诱导培养基的筛选
胚性愈伤组织是植物体细胞胚状体间接发生的前提。一般胚性愈伤组织质地较坚实,颜色为乳白色或黄色,表面具小球形颗粒,细胞内容丰富;而分化能力差的非胚性愈伤组织则与之相反,其组织结构疏松,细胞相对巨大,内含一大液泡,几乎无细胞器,多呈水浸或褐化状。实验结果表明,I号培养基(改良MS+NAA+Kt组合)上的愈伤组织诱导率(%)比II号培养基(改良MS+2,4-D+Kt组合)上的略低,但I号培养基诱导出的愈伤组织呈白色略显透明发亮,松碎,具小凸球状,原胚性愈伤组织特征明显,容易诱导出体细胞胚;而II号培养基诱导出的愈伤组织呈白色略显暗沉或水渍状,松软,不规则块状,不适合诱导体细胞胚。故选用I号培养基作为海南白花油茶花药胚性愈伤的初代诱导培养基较为合适,下一步可通过调整NAA和Kt的浓度配比来优化胚性愈伤组织的诱导培养基,以提高胚性愈伤组织诱导率。丁植磊等的研究结果表明,以MS或N6培养基为基本培养基,添加激素配比如NAA 0.5 mg·L-1+2,4-D 0.6 mg·L-1或 6-BA 0.2 mg·L-1+ 2,4-D 0.5 mg·L-1,以适用于白花油茶与红花油茶等不同物种愈伤组织的诱导[10],而本研究中以改良MS为基本培养基,添加了NAA+Kt的组合培养基,诱导出的愈伤组织质量更适于体细胞胚的分化,说明2,4-D并不是油茶花药愈伤组织诱导所必需的培养基,比较而言,同样在添加细胞分裂素类的生长调节剂Kt的基础上,辅以添加生长素类的生长调节剂,而添加NAA比添加2,4-D更适用于海南白花油茶愈伤组织的诱导,在后期的增殖培养阶段也显示出了同样的效果。丁植磊等的研究结果也表明,油茶花药愈伤组织增殖过程中,在同样添加生长素类生长调节剂物质NAA的基础上,辅以添加如玉米素Zt、6-BA和Kt等细胞分裂素,均能获得较好的愈伤组织增殖效果[10],综合成本和愈伤组织后期体细胞胚分化的态势来考虑,NAA+Kt的组合培养基较有利于体细胞胚后期的分化和节约成本。
3.3 花药胚性愈伤组织体细胞胚状体的再分化
胚状体的诱导与外植体所处的生理状况、培养方式和内源激素的变化及遗传性、倍性等都有密切关系。在海南白花油茶花药愈伤组织增殖和再分化过程中,对比分析暗培养和光照培养结果得知,暗培养和光照培养的生长量相差不大,但暗培养能使原胚性愈伤组织有效增殖且能再分化出体细胞胚(再分化率极低,尚待进一步优化筛选培养基和培养条件),而光照培养条件下,花药愈伤组织早期有绿色芽点突显,但后期原胚性组织逐渐老化褐死,再生植株分化难。丁植磊等的研究结果表明,油茶花药愈伤组织暗培养5~10 d即可改善愈伤组织继代增殖的生长状况,以叶片作为外植体诱导出的愈伤组织,在光照条件下,前期嫩绿、致密的愈伤组织能正常增殖,但随着继代培养时间的延长,愈伤组织会褐死,也不能分化出体细胞胚状体[10],故油茶花药愈伤组织的增殖与再分化宜在暗培养条件下诱导。因此,下一步的研究可以采用暗培养的培养方式,对I号培养基中所含激素的种类和配比进行调整,以筛选与优化添加辅助有机物的种类,以提高原胚组织的增殖和再分化效率,促进油茶花药再生植株的生长。
据相关文献报道,在大多数植物的花药培养中,给予一定温度和时间的低温预处理是必要的,低温处理对于雄核发育的影响涉及到花药内部一系列复杂结构及生理生化的变化[13-14]。低温可以改变纺锤丝的轴向,破坏纺锤丝的微管蛋白,从而阻止纺锤丝的形成,使有丝分裂的正常过程被打破,从而导致分化过程的发生[15]。虽然本次研究设置的各处理都能诱导出海南白花油茶的花药愈伤组织,但诱导率都还不够高,尤其是再分化率太低。据有关油茶花药再生体系的研究报道,国内油茶以花药为外植体,目前以花药愈伤组织的诱导和增殖为主[10,12],鲜有形成植株的报道,油茶再生植株形成,目前多数仍以嫩茎段、叶片和子叶为外植体[9],其中,以嫩茎段为外植体形成的再生植株,可以很好地保持外植体母株的优良性状,属自根植株,但诱导生根属于不定根,所育种苗类似于扦插苗。国家林业局在油茶种苗培育规定中明确规定,禁止使用不定根苗造林,故此类植株更适合作为油茶采穗圃种植供苗,比较而言,其优于遗传相对不稳定的叶片诱导再生植株。以子叶作为外植体的体细胞胚植株或不定芽植株,虽然相对容易诱导出体细胞胚植株,但由于子叶已属有性繁殖产物,即使能生产出再生植株,种苗性质也类似于以种子繁育的实生苗,外植体母株的优良性状因性状分离会造成遗传不稳定,故以叶片、子叶为外植体形成的再生体系,更适合作为油茶遗传转化技术体系。而以未授粉花药为外植体,通过诱导花药胚性愈伤组织体细胞胚胎发生途径所形成的再生植株,是由体细胞诱导出的具有胚芽和强壮主根的体细胞胚再生植株,可以稳定遗传外植体母株的优良性状,又具有强壮主根,省略了当前油茶良种壮苗为了拥有强壮的主根而采取的嫁接环节,可以节省更多的人力、物力和财力。故下一步的研究应对海南白花油茶花药再生体系进行优化改良,以期早日建立高效、稳定的油花花药再生体系,为今后利用花药体细胞胚再生体系生产良种壮苗,建立高效、稳定的海南白花油茶遗传转化体系,从而为后期的油茶功能基因研究和利用基因工程技术加速油茶抗病、高产育种而奠定基础。
[1] 庄瑞林.中国油茶[M].第2版.北京:中国林业出版社,2008.
[2] 黄明智,王 锋. 油茶发展的有利条件及对策[J].现代农业科技,2009(17):62.
[3] 杨枝林,曾祥全,陈飞飞,等.海南岛油茶资源现状[J].经济林研究,2015,33(3):138-144.
[4] 符泽华,段伟华,渠心静.不同品种接穗对油茶高接换冠后产量及经济性状的影响[J].中南林业科技大学学报,2017,37(10): 75-79.
[5] 朱丛飞,罗汉东,胡冬南,等.油茶林土壤生化性对磷素水平的响应研究[J].中南林业科技大学学报,2017,37(2):57-62.
[6] 摹先胜.我国油茶资源的开发利用研究[J].湖南科技学院学报,2005,26(11):127-129.
[7] 韩宁林.油茶丰产栽培技术研究进展[J].林业科技开发,2000,14(1):10-13.
[8] Wang R, Chen Y Z. Camellia tissue culture and plant regeneration research[J]. Hunan Forestry Science and Technology, 2006,33(5):63-66.
[9] 张智俊,罗淑萍,李亚玲,等.油茶优良无性系子叶体细胞胚植株再生[J].植物学通报,2005,22 (S1):43-49.
[10] 丁植磊.油茶花药愈伤组织诱导及继代培养研究[D].长沙:中南林业科技大学,2007.
[11] 范晓明,袁德义,谭晓风,等.油茶花药离体培养影响因子研究[J].南京林业大学学报(自然科学版),2011,35(5):125-128.
[12] 闻 丽,张日清,刘友全,等.不同培养条件对油茶花药愈伤组织形成的影响[J].经济林研究,2007,25(2):9-14.
[13] 刘国民.花药离体培养中若干问题的研究进展[J].海南大学学报,1994,12(3):53-59.
[14] 张日清,闻 丽,刘友全,等.低温预处理对油茶花药愈伤组织诱导的影响[J].中南林学院学报,2005,25(6):24-28.
[15] Sato S, Katoh N, Iwai S, et al. Effect of low temperature pretreatment of buds on inf l orescence on isolated microspore culture in Brassica rapa (syn B campestris) [J]. Breeding Science, 2002,52(1): 23-26.
