硫离子选择电极法间接测定重金属含量*
2018-01-27栾崇林陈耀斌陈少如
栾崇林,陈耀斌,陈少如
(深圳职业技术学院 应用化学与生物技术学院,广东 深圳 518055)
由于重金属的高毒性、不可降解性和高蓄积性,重金属污染不仅造成重大的经济损失,而且对生态环境和人类健康危害较大.受重金属污染的食品,通过食物链可进入人体,在体内蓄积,当重金属在体内的含量超过阈值时,可造成中毒,重金属中毒对机体的危害是多系统、多器官、多指证和不可逆的[1].目前,能够同时检测多种重金属的方法主要有电感耦合等离子体光谱法[2,3]和溶出伏安法[4,5].前者方法灵敏度和准确度高,但设备昂贵、检测成本高、操作条件和技术要求高,给实际应用带来困难.后者作为电化学分析方法,使用仪器设备简单、小巧,便于实现自动化、遥控测定和现场分析,但该法一般也只能同时分析 2~4种元素[4~6].本文对硫离子选择电极测定多种重金属进行了探讨,并应用于食品添加剂CaCl2中重金属检测.
1 实验部分
1.1 实验原理
在一定的pH值范围内,溶液中的重金属离子与硫离子反应生成溶度积极小的金属硫化物沉淀,其反应式为(以铅为例):Pb2++S2-=PbS.因此以硫离子选择电极为工作电极,以双液接甘汞电极为参比电极,通过直接电位法可以测定含一定硫离子(c1)溶液的电极电位 E1,然后加入一定量的铅标液(设加入铅标液后溶液中铅离子浓度为cPb),测定铅离子和硫离子反应后溶液(c2)的电极电位E2.
根据Nernst方程:

其中E代表电极电位,单位mV;E0代表标准电极电位,单位mV;c代表硫离子浓度,单位mol/L.
则有:

当 c1一定时,ΔE∝[-lg(c1-cPb)].据此,可建立ΔE与[-lg(c1-cPb)]的线性关系.当铅标准溶液以样品溶液取代时,可测得ΔEx,从而求得cx(以铅计).
1.2 仪器与试剂
1.2.1 仪器
pHS-3C雷磁精密pH计(上海精密科学仪器有限公司);S23-2恒温磁力搅拌器(上海司乐仪器有限公司);314型硫离子选择性电极、801型双液接甘汞电极(江苏电分析仪器有限公司);iCAP7000 原子发射光谱仪(美国赛默飞世尔公司)
1.2.2 试剂
硫代乙酰胺(A.R级,天津市大茂化学试剂厂);盐酸(G.R级,广州化学试剂厂).重金属标液及铅标准储备液1000μg/mL(北京环标科创环境科技发展有限责任公司);铅标准使用液(1.0×10-3mol/L):取20.70mL铅储备液,用水定容至100mL.临用前稀释.SAOB溶液:称取10g氢氧化钠溶解于300mL无氧蒸馏水中,后加入20g抗坏血酸粉末,再以无氧去离子水稀释至500mL,转移到密闭塑料瓶中储存,避光冷藏.硫化钠标准溶液的制备:称取硫化钠晶体 2.402 g,溶解于50 mLSAOB溶液中,转移至100.00 mL棕色容量瓶内,用SAOB溶液定容、摇匀,则为1.0×10-1mol/L储备液,经标定后避光冷藏.硫代乙酰胺(TAA)标准储备液的配制:准确称取0.7513 g硫代乙酰胺试剂晶体溶解于 50 mLSAOB溶液中,转移至100.00 mL棕色容量瓶内,用SAOB溶液定容、摇匀,即为1.0×10-1mol/L硫标准溶液,避光保存.pH3.5乙酸盐缓冲溶液:称取25.0g乙酸铵溶于25mL水中,加入45m L 6 mol/L盐酸溶液,用稀盐酸或稀氨水调解pH值至 3.5,用水定容至 100mL.去氧去离子水:去离子水煮沸10min后冷却至室温.
所有实验用水均为去氧去离子水,其他试剂均为分析纯.
1.3 实验方法
1.3.1 测定方法
将pH计功能旋钮调至电位(mv)模式,用温度计测量待测溶液温度,调温度旋钮旋至测量温度.硫离子选择电极(即工作电极)使用前活化并用去离子水清洗到空白电位约为+160mV.将工作电极和甘汞电极(即参比电极)插入待测溶液中,用盐酸溶液和氢氧化钠溶液调节pH值至 3.5,打开磁力搅拌器,设置搅拌速度420r/min,计时搅拌3min,待仪器读数稳定后,记录电位值E.
1.3.2 标准工作曲线绘制制备
6份浓度为2×10-3mol/L的TAA标准溶液100 mL和一份SAOB空白溶液,使用前水浴15 min,冷却至室温后,用移液管吸取 2×10-3mol/L的硫标准溶液 25 mL于 6个搅拌杯内.其中一份加入25mLSAOB溶液,用盐酸和氨水调节pH至一定值,按1.3实验方法测定,得到电位值E1.
准确吸取2.50,5.00,7.50,15.00,20.00mL的铅标准使用液,分别加入上述另外 5个搅拌杯内,然后分别加入 22.50,20.00,17.50,10.00,
5.00 mLSAOB 溶液,铅浓度分别为1.0×10-4、2.0×10-4、4.0×10-4、6.0×10-4、8.0×10-4mol/L,用盐酸或氨水调节pH至3.5,按1.3操作,记录反应后电位值E2,E3,…,E6,为以ΔE为纵坐标,以[-lg(10-3-cPb)]为横坐标作图,得到 ΔE-[-lg(10-3-cPb)]的工作曲线,见图1.工作曲线方程为y=30.112x-2.328,相关系数 r=0.9995,说明 ΔE与[-lg(10-3-cPb)]之间有良好的线性关系.
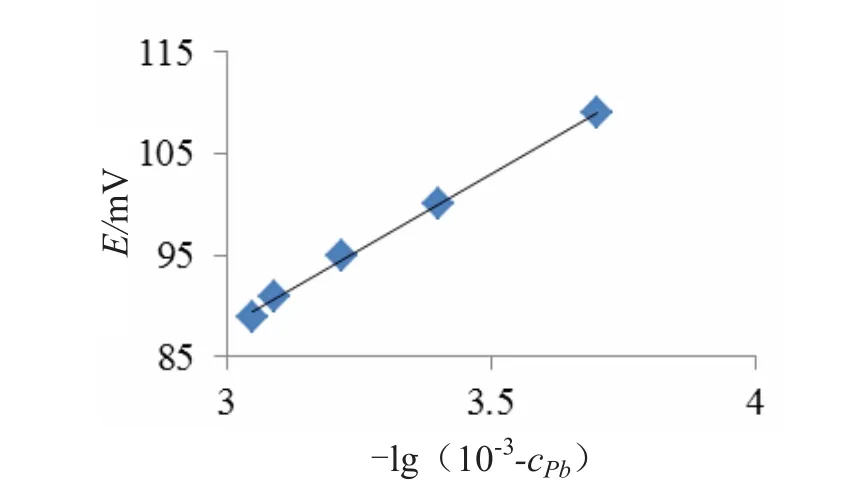
图1 不同浓度铅标液的工作曲线
2 结果与讨论
2.1 配制硫离子标准溶液试剂的选择
用硫化钠配制硫离子标准溶液,需要间接配制,标定后方可使用.标定过程繁琐、耗时,而且溶液中的硫离子极易被氧化,溶液稳定性较差.硫代乙酰胺符合基准物质的要求,可以直接配制.在 pH值≥10时,硫代乙酰胺配制的标准溶液于棕色瓶中可稳定储存480h[7].试验进一步考察了硫代乙酰胺和硫化钠作为硫化物标准溶液的稳定性,采用两种试剂分别配制硫离子浓度为 1.0×10-3mol/L的标准溶液,调节pH值=10,存储于4℃冰箱,在不同时间测定其电位值,结果见图2.由图2可见,硫代乙酰胺标液储存20 d后,溶液性能仍非常稳定,硫化钠溶液电位值有所下降,因此本文选择硫代乙酰胺配制硫离子标液.
2.2 抗坏血酸加入量的选择
抗坏血酸作为抗氧化剂可缓解硫离子的氧化,减少硫离子的氧化损失,降低实验误差.溶液中抗坏血酸的浓度对硫离子的抗氧化程度有影响,需要对SAOB溶液中抗坏血酸的浓度进行优化.选择浓度为10-2mol/L和10-3mol/L的硫代乙酰胺标准溶液为固定浓度,其中含抗坏血酸的浓度分别为0、10 、20、30、40mg/mL,测定其电位值,结果见图3.
由图3可知,当溶液中未加入抗坏血酸时,溶液的电位值偏低,随着抗坏血酸浓度的增加,当抗坏血酸浓度达到 10~40mg/mL时,浓度为1.0×10-2mol/L和1.0×10-3mol/L的硫标准溶液的电位均达到最大值,并保持基本稳定,本文选择抗坏血酸浓度为30mg/mL.
2.3 硫代乙酰胺溶液沸水浴时间的选择

图2 硫化钠标液和硫代乙酰胺标液随储存时间电位变化图
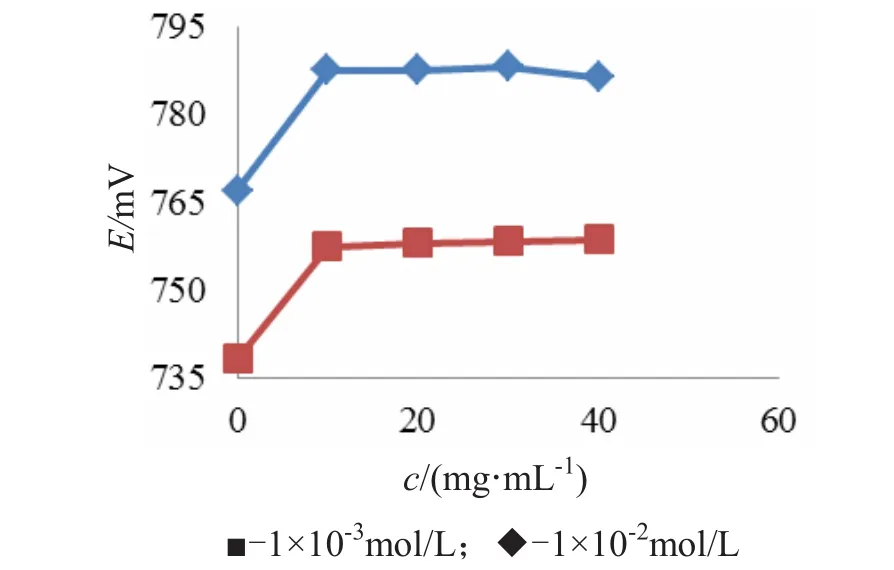
图3 抗坏血酸浓度对硫离子氧化程度的影响
在碱性条件下,由于TAA要在水浴加热后才可水解出游离硫离子,水浴时间会对硫离子的水解程度产生影响.因此,需对 TAA的水浴时间进行优化.用浓度1.0×10-3mol/L的TAA分别经过沸水浴5、10、15和20 min后,测定其浓度,结果见表1.
由表1可见,水浴时间从5~15min递增的过程中,测得硫离子的相对误差逐渐减小,水浴 15min时,相对误差最小,而当水浴时间增加至20min时,相对误差增大,可能由于水浴时间过长,导致溶液中水解出来的部分硫离子被氧化损失.所以选择加热15min作为配制硫离子标液的最佳水浴时间.
2.4 pH值的选择
金属硫化物在弱酸中的沉淀包含沉淀-溶解平衡和弱酸离解平衡,假设金属离子的初始浓度为1.0×10-3mol/L,沉淀完全的浓度为小于1.0×10-7mol/L.根据文献[8],计算可得出各种金属离子开始沉淀和沉淀完全时的 pH值,结果见表2.当溶液pH值大于开始沉淀时的pH值而小于完全沉淀时pH值时,金属离子部分沉淀;当溶液pH值大于等于完全沉淀时的pH值时,金属离子可完全沉淀.因此,可根据检测重金属离子种类的需要,选定不同的pH值,进行测定.国标法[9]检测重金属选用溶液pH值为3.5,为了与国标方法具有可比性,本方法同样选择溶液pH值为3.5.
2.5 电极响应时间选择
按最佳实验条件配制系列硫标准溶液,设置 3平行,插入电极后进行电位测定,记录各浓度溶液的响应时间,观察停止搅拌后电位的变化.结果见表3.
由表 3可见,当溶液中硫离子浓度大于1.0×10-4mol/L时,电极的响应时间较迅速,大约在10~60s之内即可读数.然而,当硫标准溶液浓度在1.0×10-5~1.0×10-7mol/L 时,其电位平衡建立较为缓慢,约在 3min内可获得稳定的电位值.因此本文选择搅拌时间3min后读数.

表1 水浴时间对TAA水解程度的影响

表2 金属离子开始沉淀与完全沉淀时的pH值

表3 硫离子浓度对电极响应时间的影响
2.6 共存离子的影响
在优化条件下考察了一些常见离子对测定的干扰情况,实验结果表明,在浓度为1.0×10-3mol/L的硫离子标准溶液中,500倍的阴离子如CI-、I-、SO4-、NO3-、HCO3-、NO2-、SO32-等均对硫化物的测定不产生干扰.1000倍的钙、镁、钡、钠、阳离子对电位测定不产生干扰.
3 方法应用
食品级氯化钙在食品加工中常用作稳定剂和凝固剂,用于豆腐生产,果蔬加工等,能够保持食品组织结构稳定[10].国标[11]规定食品级 CaCl2重金属含量需采用《GB 5009.74-2014食品添加剂重金属限量试验》进行检测,但该法只能定性检测,无法测得重金属含量的定量值,将本法应用于食品添加剂CaCl2中重金属检测,可得到其中重金属含量的定量结果,对其生产和监督能起到更好的指导作用.
3.1 食品添加剂CaCl2中重金属检测
由标准曲线可知,当铅离子的浓度在6.0×10-4~8.0×10-4mol/L之间时,检测的灵敏度最高.因此对食品添加剂CaCl2中重金属采用以下操作步骤进行测定.加入已配制好的浓度为2.0×10-3mol/L硫标准溶液25mL于搅拌杯中,然后加入10mLSOAB溶液,再加入15mL铅标准使用液(得到溶液中铅离子浓度为6.0×10-4mol/L),最后加入5gCaCl2食品添加剂,接下来按1.3实验方法测定电位值Ex.
3.2 结果计算
ΔE=Ex-E1,在标准曲线上查出ΔE对应的y值.则:cx=(c1+10y),mol/L,其中 c1=1.0×10-3mol/L,c样品=207.2( cx-6.0×10-4)(以铅计),g/L,ρ样品=207.2( cx-6.0×10-4)×50×1/5×103,mg/kg.
3.3 精密度和加标回收试验
按最佳实验条件,以某食品添加剂CaCl2为样品,选择3个不同加标量(以Pb计)做加标回收试验,每个样品重复测定7次,结果见表4.
由表4可知,本方法的相对标准偏差小于6%,加标回收率在 96.6%~106%之间,说明方法具有较好的精密度和准确度.
3.4 方法对比
取3种不同品牌的食品添加剂CaCl2作为样品,分别按照本法、国标法[9]和ICP-AES法进行重金属检测.国标法利用重金属离子与硫化氢作用,生成棕黑色,与同法处理的铅标液(cpb=20mg/kg)比较,只能给出定性结果.ICP-AES法测得值为各重金属元素的总量.检测结果见表5,由表5可见,本法与国标法结果一致,与ICP-AES法相对误差在13%以内.
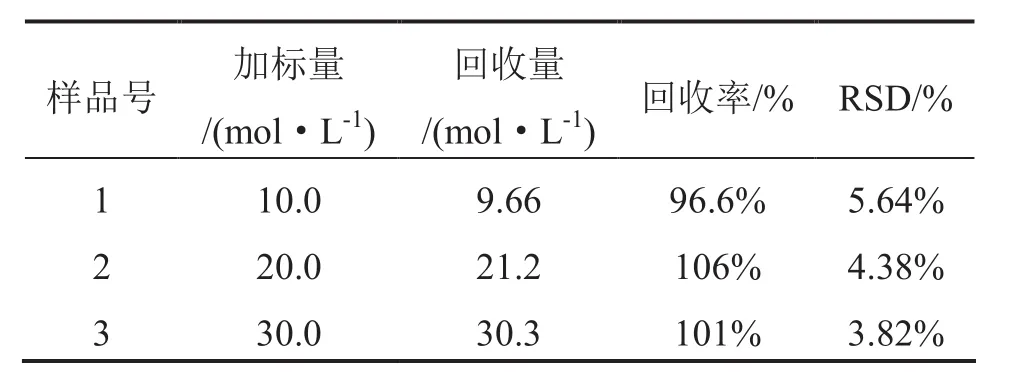
表4 样液中重金属的回收率及相对标准偏差(n=7)
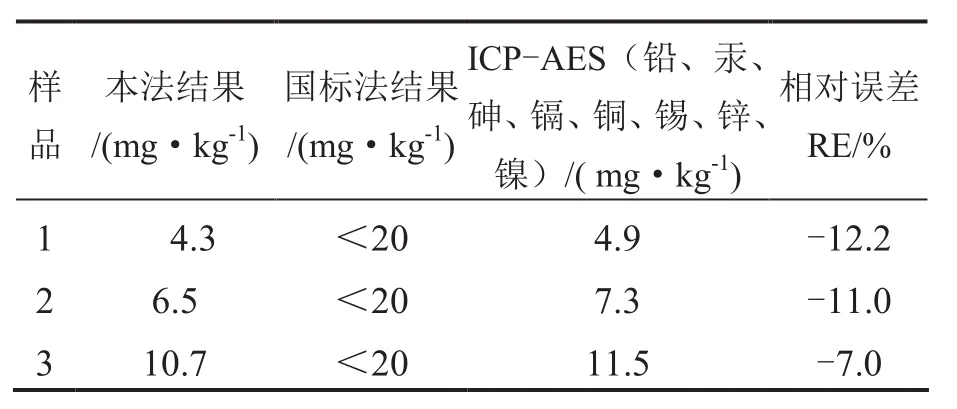
表5 2种不同方法检测食品添加剂CaCl2中重金属结果对比
[1] 张东杰.重金属危害与食品安全[M].北京:人民卫生出版社,2011:2-3.
[2] 洪欣,王晓飞,苏荣,等.电感耦合等离子体原子发射光谱法测定河流和湖泊沉积物中 11种重金属元素含量[J].理化检验(化学分册),2017,53(7):787-791.
[3] 张萍,符靓,谢华林.电感耦合等离子体质谱法直接测定蜂胶中重金属元素[J].光谱学与光谱分析,2015,35(10):2878-2881.
[4] 宋春霞,刘二东.方波阳极溶出伏安法同时测定蔬菜中铜铅含量[J].化学工程师,2010(4):27-29.
[5] 彭静,贺与平.阳极溶出伏安法同时测定高盐调味品中铅镉[J].食品工业科技,2016,37(7):274-277.
[6] 范清杰,杜国荣,涂家润.方波阳极溶出伏安法同时测定溶液中 Cd(Ⅱ)、Pb(Ⅱ)、Cu(Ⅱ)、Bi(Ⅲ)离子的多元校正方法[J].天津大学学报(自然科学与工程技术版),2013,46(2):894-899.
[7] 杜宝中,高晓泽,薛力,等.以硫代乙酰胺为基准电极法测定工业废水中硫化物[J].分析科学学报,2008,24(6):701-704.
[8] 薛泽春,王广明,李连之,等.金属硫化物在酸溶液中溶解条件的讨论[J].聊城大学学报(自然科学版),2016,29(1):43-46.
[9] GB5009.74-2014《食品添加剂中重金属限量试验》[S].北京:中华人民共和国卫生部,2014.
[10] 林春锦,徐明仙,陶雪文.食品添加剂[M].北京:化学工业出版社,2004:266.
[11] GB1886.45-2016《食品安全国家标准食品添加剂氯化钙》[S].北京:中华人民共和国卫生部,2016.
