骨小梁仿生微结构的解析与构建
2018-01-23赵小文白雪岭张东锋
赵小文 白雪岭 张 鹏 张东锋 穆 林
1(深圳市艾科赛龙科技股份有限公司 深圳 518053)
2(中国科学院深圳先进技术研究院 深圳 518055)
1 引 言
松质骨由大量骨小梁相互交织构成,呈海绵状,排列方向与骨所承受的压力和张力的方向一致,遵循用最小的骨量达到最大的骨强度的原则,起到支持、减轻重量、缓冲、容纳骨髓以及应对形变、适应形变等功能[1,2]。骨小梁在人体内分布广,虽然松质骨仅占人体骨量的 20%,但构成 80% 的骨表面,包含有胶原、矿物质以及骨组织细胞等各种不同的结构,是多种代谢发生的场所,也是血液系统的重要发源地。
骨缺损是临床上常见的疾病,也是骨科临床治疗的难题之一。目前,治疗骨缺损的方法有自体骨和异体骨移植、组织工程技术和基因治疗法及生长因子、物理治疗法的辅助治疗等。利用3D 打印技术构建多孔支架[3]是骨缺损修复的发展趋势之一,已广泛地应用于因创伤、骨肿瘤、感染、先天性骨病等所致的骨缺损[4]。多孔支架的修复缺损过程主要依靠其提供的细胞生长微环境[5],传导力学刺激实现成骨,同时复合生物材料的骨诱导性能发挥积极作用[6-8]。然而,传统骨骼缺损修复体大多采用均匀、规则的几何体,只保证了孔径和孔隙率[9,10],虽然可以满足少部分松质骨的生物力学特性和生理微环境特征,但与真实的松质骨结构和生理功能还有很大的差距,甚至会造成死腔,成为新的治疗风险。
本研究首先采用 Micro CT 扫描兔股骨近端松质骨,并分别应用 Mimics 和 Rhino 软件构建三维[11]松质骨模型并分析其几何特征;然后,基于斯特林公式对松质骨模型进行仿生建模[12-15],构建仿生骨小梁并进行 3D 打印;最后,通过几何相似性分析对比和体外细胞实验验证仿生骨小梁的有效性。骨小梁仿生微结构的解析与构建方法,可为动物骨骼的修复与重建提供建模的参考方法,对人体组织工程学的发展提供参考和方法依据。
2 材料与方法
2.1 材料
(1)样本:遴选 10 例活体兔的后肢股骨,骨龄 3 岁,骨骼发育正常、完整。
(2)硬件:Micro CT 机;图形工作站:CPU E5-2609 1.9 G,内存 128 G。
(3)软件:Mimics 19,Rhino5.0。
(4)3D 打印材料:羟基磷灰石(HA)纳米材料 100 g,聚己内酯(PCL)材料 100 g 等。
(5)艾科赛龙生物打印机 1 台。
2.2 松质骨结构解析
(1)Micro CT 扫描兔活体后肢股骨,扫描断层与后肢骨长轴垂直[16]。扫描参数[17]:层厚为0.013 872mm;电流 100 mA;电压 69 kV;共622 幅(1 000×1 000)断层图像,如图1所示。

图1 兔股松质骨显微 CT 图像Fig. 1 Micro CT image of cancellous bone of rabbit proximal femur
(2)应用 Mimics 三维重建软件,截取松质骨广泛均匀分布的关节头区域,重建三维兔后肢股骨图像,输出为 stl 文件(一种 3D 模型文件格式),结果如图2 所示。

图2 兔股骨关节头区域松质骨 stl 三维模型Fig. 2 3D stl model of cancellous bone of rabbit proximal femur
(3)将文件导入 Rhino 软件,对图像进行测量,分析骨小梁的空间直径等几何特征,并做统计分析[18,19]。

图3 容积比(V骨小梁/V立方体)Fig. 3 Volume ratio(trabecular bones/cube)
根据测量结果,对松质骨内的骨小梁性状可以总结以下几点:精确测量一组骨小梁的外径数据范围分布在 0.12~0.06mm,平均值为0.086mm;骨小梁之间的汇集交点在空间以随机的形态分布;骨小梁在空间基本呈现均匀状态分布;容积比(V骨小梁/V立方体)在 0.4~0.5,平均值为0.433,结果见图3。
2.3 骨小梁仿生微结构构建
(1)取单位体积(1mm×1mm×1mm)的松质骨样品,测量骨小梁的总体积(体积0.505mm3),结果如图4 所示。

图4 松质骨样品Fig. 4 Cancellous bone sample
(2)仿真数学算法模型。计算和优化各项空间向量指标,获得富含骨小梁微结构的松质骨结构,算法如下:
松质骨由海量不规则的多维球体单元(点)构成复杂的三维结构,每个单元为n维,将斯特林公式作为n! 的近似值(n约为 1023)。设r为半径,Kn(r)代表n维球,中心在原点,满足以下公式:
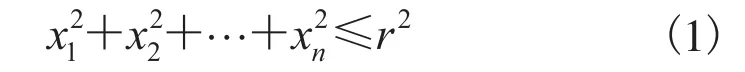

对Kn(r)的体积Vn和表面积On,满足雅可比公式:
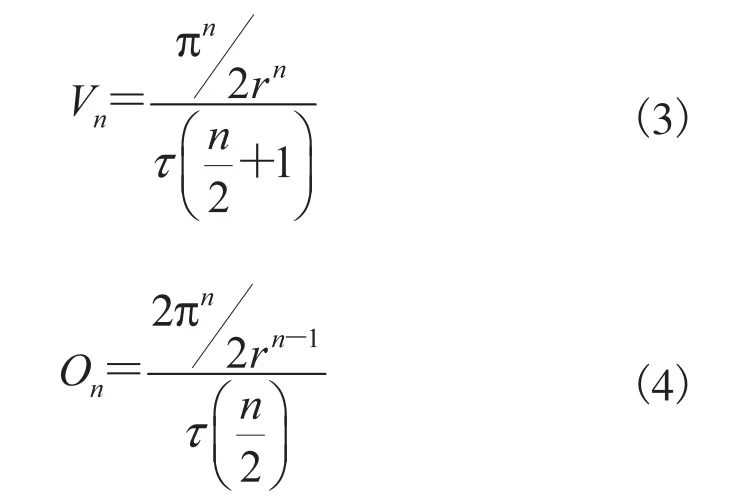
由赋予属性的各单元组成完整的空间结构,从横截面(自上而下)截取m个断层,得到断层面为三维结构的断层面积,相应算法为:

设定一个与天然骨小梁等体积等结构的空间正方体(1mm×1mm×1mm)(图5(a)),将多维度的空间点阵装入此空间,多次叠加(图5(b)),产生空间多维度连线(图5(c))[20],构建外径0.09mm 的仿生骨小梁体,应用仿真数学算法,通过容积逼近空间边际极限,最终达到二者体积相等,完成仿生松质骨构建(图5(d))。

图5 骨小梁仿真过程Fig. 5 Simulation process of trabecular bone
3 结 果
3.1 松质骨样本与仿生松质骨微结构对比分析
首先,对松质骨样本和仿生松质骨进行 0.1mm等距切割骨小梁面积对比,结果如图6 所示。仿生松质骨与天然松质骨具有很高的相似度,其中仿生松质骨骨小梁外径为 0.09mm。表1 为在x、y、z三维度做0.1mm 的等距切割对比数据。从表1 可见,松质骨样本与仿生松质骨在x、y、z三个方向 0.1mm 的等距切割骨小梁面积分别为 0.500mm2vs 0.516mm2、0.507mm2vs 0.515mm2、0.497mm2vs 0.504mm2。统计分析显示,二者无显著性差异(P>0.05),表明本文构建的仿生松质骨与真实松质骨样本模型在x、y、z三个方向 0.1mm 等距切割的骨小梁面积极其接近。
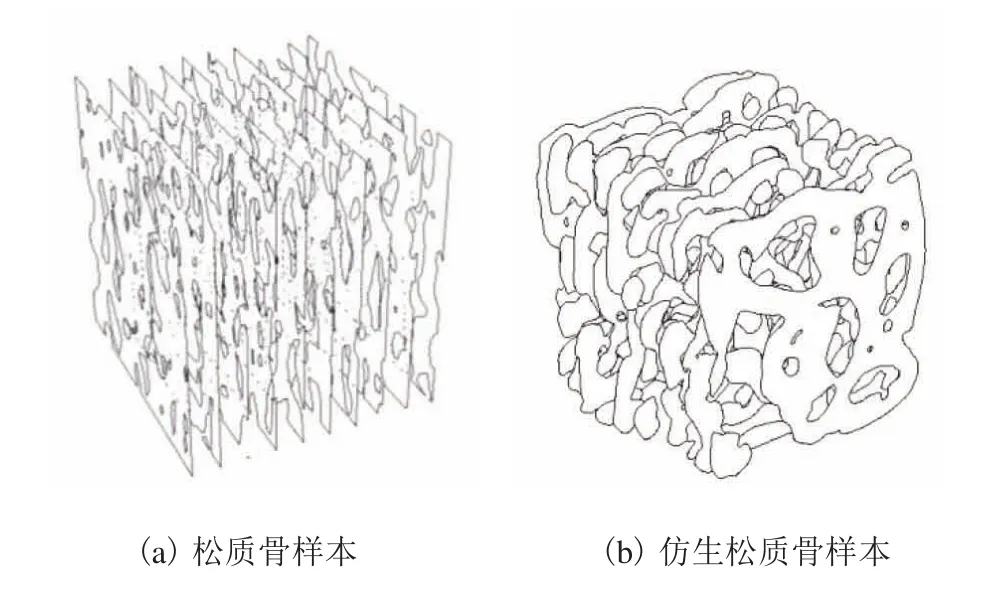
图6 松质骨样本等距切割对比Fig. 6 Comparison of cancellous bone sample
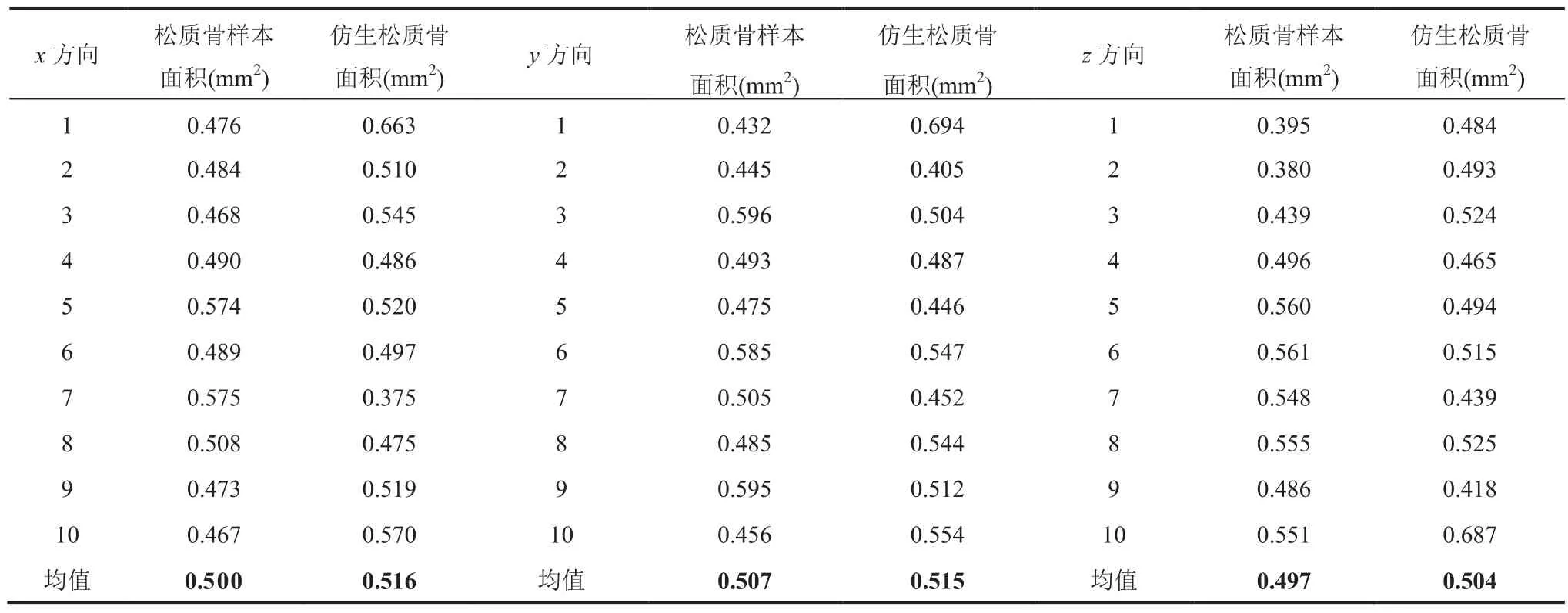
表1 松质骨样本与仿生松质骨 x、y、z 方向 0.1mm 的等距切割骨小梁面积对比Table 1 Comparison of trabeculae area between cancellous bone samples and bionic cancellous bone in x, y, and z directions under 0.1mm equidistant cutting

表2 松质骨样本与仿生松质骨 x、y、z 方向随机不等距切割骨小梁面积对比Table 2 Comparison of trabeculae area between cancellous bone samples and bionic cancellous bone in x, y, and z directions under unequidistant cutting
其次,对松质骨样本和仿生松质骨进行随机不等距切割[21],结果如图7所示。从横截面(自上而下)截取m个断层,得到断层面积计算方法如公式(5)所示。表2 为松质骨样本与仿生松质骨在x、y、z三维度随机不等距切割骨小梁面积对比数据。从表2 可见,松质骨样本与仿生松质骨在x、y、z三个方向0.1mm 的不等距切割骨小梁面积分别为 0.505mm2vs 0.543mm2、0.476mm2vs 0.534mm2、0.507mm2vs 0.491mm2。统计分析显示,二者无显著性差异(P>0.05),表明本文构建的仿生松质骨与真实松质骨样本模型的x、y、z三个方向随机不等距切割的骨小梁面积极其接近。

图7 随机不等距切割示意图Fig. 7 Random unequidistant cutting
最后,对松质骨样本和仿生松质骨进行相似性分析。
设计定量数据和定性数据的距离计算函数是常用的度量数据对象之间相似关系的方式。以下是根据解剖学的复杂程度更具针对性建立的相似性数学模型[22]。
为了计算松质骨样本和仿生松质骨的相似度,构建特征矩阵打分比较:
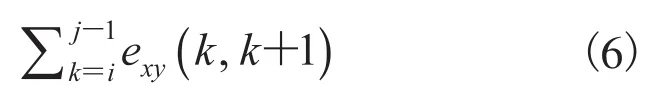
公式(6)表示(i,j)两点之间的距离之和,构建曲线上两点在x、y轴上欧氏距离与图论距离之比。

公式(7)表示(i,j)两点之间的距离之和,构建曲线上两点在z轴上欧氏距离与图论距离之比。
整体空间距离为:

如果两个对比向量具有相似性,则其欧氏距离最小。三维向量参数(γ/N)可以比较相似性分析上的差异,N为空间点的数量,则不同曲线正则化参数的向量之间的欧氏距离为:

根据公式(6)~(9),可以构建松质骨样本与仿生松质骨相似性数学模型,距离函数Da,b描述两数据对象之间的关系。如果a和b越相似,则两者距离Da,b的值越小。表3 为松质骨样本与仿生松质骨在x、y、z方向欧氏距离相似性比较结果。从表3 可知,松质骨样本与仿生松质骨在x、y、z方向欧氏距离Da,b为 0.007~0.058。统计分析显示,二者无显著性差异(P>0.05)。相似性分析表明,仿生松质骨结构与松质骨样本的生理结构具有极高的相似度。
骨小梁仿生微结构的解析与构建方法通过容积逼近构建与天然松质骨骨小梁体积相等的仿生松质骨(也即是说仿生松质骨与天然松质骨具有同样的孔隙率),并且仿生松质骨与天然松质骨结构达到很高的相似度(可达 95% 以上,见表1~3)。
3.2 3D 打印仿生松质骨
以羟基磷灰石(HA)为主要基质 3D 打印[23,24]尺寸为 20mm×10mm×10mm(长×宽×高)仿生松质骨,结果如图8所示。实验需要打印的骨小梁直径为 0.4~0.9mm、孔径为 300~500 μm,而艾科赛龙生物打印机 Nozzle 挤出材料的最小线径为 0.02mm、精度为 0.05mm,完全满足了打印仿生松质骨细微结构的要求。

表3 松质骨样本与仿生松质骨 x、y、z 方向欧氏距离相似性比较Table 3 Comparison of Euclidean distance similarity between cancellous bone samples and bionic cancellous bone in x, y, and z directions

3.3 体外实验
3.3.1 小鼠成骨细胞在仿生骨小梁结构中增殖变化
首先,选取处于对数生长期的小鼠成骨细胞(MC3T3-E1),选用 10% FBS (胎牛血清)+DMEM 培养基作为细胞培养液。将 100 μL 浓度为 8 000~10 000 个/孔的细胞悬液种植到仿生骨小梁结构中,置于 37℃、5% CO2温箱中培养,每隔两天更换培养液,同时设置空白对照组。其次,分别在培养时间的第 1、3、5 和 7天,吸去上清液,加入 20 μL MTT(噻唑蓝)溶液(5 mg/mL,即 0.5% MTT)继续培养 4 h 后吸掉上清,每孔加入 150 μL 二甲基亚砜,置摇床上低速振荡 10 min,使结晶物充分溶解。最后,应用酶联免疫检测仪测量各孔 490 nm 吸光值,计算细胞增殖率。图9 为小鼠成骨细胞在仿生骨小梁结构中的细胞分布。从图9 可见,成骨细胞沿仿生松质骨的骨小梁结构分布且随时间的增加而迅速增殖(见图10)。

图9 小鼠成骨细胞在仿生骨小梁结构中细胞分布Fig. 9 Cell distribution of MC3T3-E1 osteoblasts in bionic trabecular structure
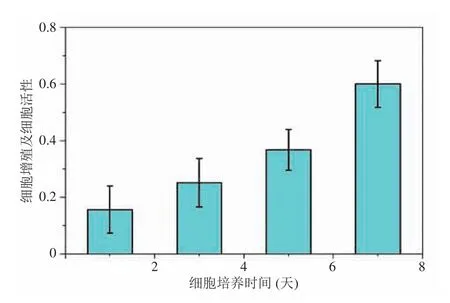
图10 小鼠成骨细胞在仿生骨小梁结构中增殖变化Fig. 10 The proliferation of MC3T3-E1 osteoblasts in bionic trabecular structure
3.3.2 仿生骨小梁区域成骨细胞聚集效应及其再生微结构功能化验证
用抗 iNOS 和抗 RANKL 抗体染色观察[25]发现,促进骨形成的一氧化氮合酶阳性细胞在骨小梁结构区域大量出现,并高表达骨重建蛋白RANKL,结果如图11 所示。把培养 4~6 周后的仿生骨小梁微结构支架切成 10mm 的片状体,在电镜下对三维微观结构进行观察(图12)。通过Micro CT(精度 0.013 872mm,扫描层厚设定为0.625mm)扫描并构建三维模型观察发现,小鼠成骨细胞逐渐形成骨小梁生理微结构和进一步功能化趋势(图13)。

图11 骨小梁结构区域一氧化氮合酶阳性细胞聚集并高表达骨重建蛋白 RANKLFig. 11 Accumulation of nitric oxide synthase positive cells in bionic trabecular structure and high expression of bone remodeling protein RANKL

图12 10mm 切片骨小梁结构电镜图像Fig. 12 10mm slice of trabecular structure with electron microscopy
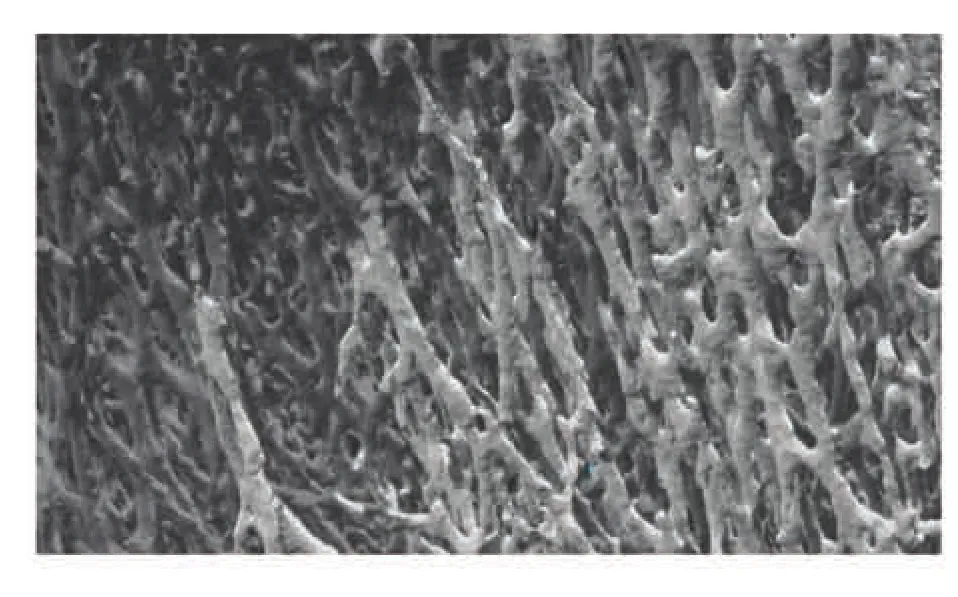
图13 三维骨小梁微结构模型Fig. 13 3D trabecular microstructure model
4 讨 论
本研究开发了一种新的骨小梁仿生微结构的解析与构建方法,成功地构建了兔仿生松质骨微结构,算法通过容积逼近空间边际极限最终达到仿生松质骨与天然松质骨骨小梁体积相等,也即是说仿生松质骨与天然松质骨具有同样的孔隙率,并且仿生松质骨与天然松质骨结构达到很高的相似度(可达 95% 以上)。传统松质骨多孔支架的制备方法(如相分离法、溶媒扩散法、气体发泡法等),随机产生连结并不能为支架的组织长入提供最理想的渗透性,也不能为再生组织的力学性能提供最大程度优化的连结性[26]。3D 打印技术能够精确地制备出外形符合要求的支架,虽然均匀孔隙率多孔支架能够在整体孔隙率逼近真实样本,但在骨小梁微结构的制造上与真实松质骨还有较大的差距[27,28]。Lui 等[29]介绍过使用传统方法制备羟基磷灰石基多孔柱状支架修复骨缺损,使用自体间充质干细胞培养和未使用间充质干细胞的组织学和形态统计分析表明,成骨数量存在显著性差异(P<0.05),复合了自体干细胞的多孔支架也仅在表面与宿主骨骨膜区的骨痂结合形成了最大厚度为 3.14mm 外层圈。而本文复合成骨细胞成功培养了尺寸为 20mm×10mm×10mm 大小的 3D 打印仿生松质骨。最新的研究但并非本文提供的方法构建的细胞生长的拓扑结构,显示了直径为 700 nm,最远柱间距为 5.6 μm的纳米柱才有利于骨形成,但在空间宽度和间距为 1~10 μm,高度为 0.35~10 μm 的格栅上,脊髓间充质干细胞(hMSC)的伸长现象并不明显且影响细胞增殖[30]。这类结构还达不到本文仿生骨小梁微结构的目的,远不如真实的骨小梁的自然三维结构。本文所采用的骨小梁仿生微结构的解析与构建方法,能够在最大程度上对松质骨骨小梁结构进行仿生建模,满足真实松质骨的微结构和生物力学特性,在骨小梁仿生设计领域具有极大的优势。
天然松质骨结构复杂,传统骨骼缺损修复体大多采用均匀、规则的几何体,只能满足少部分松质骨的生物力学特性和生理微环境特征,与真实的松质骨微结构和生理功能还有很大的差距,甚至会造成死腔。本研究通过对天然松质骨结构的解析与构建,还原出结构高度相似的仿生松质骨,虽然仿生松质骨与天然松质骨还是有差距,但通过生物活性的自身调节和修复,最终可以达到天然松质骨的性状。另外,骨小梁仿生微结构的解析与构建方法可以扩展到大尺寸松质骨的人工制造,通对大体积松质骨分布情况分析和量化,最终完成大尺寸的仿生松质骨的构建。
5 结 论
研究通过生物 3D 打印制备仿生松质骨微结构,并进行体外细胞培养实验证明,骨小梁仿生微结构的解析与构建方法可以构建与实体松质骨相似的仿生松质骨骨小梁微结构和细胞生长微环境。本研究开发的骨小梁仿生微结构的解析与构建方法,结合 3D 打印技术,可应用于人体骨缺损修复与功能重建,为植入物的骨小梁结构设计提供了思路和理论依据,为 3D 打印技术在医学研究、临床研究、临床应用提供了更真实的生理结构,为人体组织工程在微结构和微环境的研究及应用方面提供了路径参考和理论依据。
[1]Greenwood C, Clement JG, Dicken AJ, et al. The micro-architecture of human cancellous bone from fracture neck of femur patients in relation to the structural integrity and fracture toughness of the tissue [J]. Bone Reports, 2015, 3(C): 67-75.
[2]Wolff J. The Law of Bone Remodeling [M]. New York: Springer-Verlag, 1986.
[3]Agarwal T, Kabiraj P, Narayana GH, et al. Alginate bead based hexagonal close packed 3D implant for bone tissue engineering [J]. ACS Applied Materials& Interfaces, 2016, 8(47): 32132-32145.
[4]Lai YH, Cao HJ, Wang XL, et al. Porous composite scaffold incorporating osteogenic phytomolecule icariin for promoting skeletal regeneration in challenging osteonecrotic bone in rabbits [J].Biomaterials, 2018, 153: 1-13.
[5]Laurent J, Blin G, Chatelain F, et al. Convergence of microengineering and cellular self-organization towards functional tissue manufacturing [J]. Nature Biomedical Engineering, 2017: 933-956.
[6]Zhu XH, He G, Gao BZ. The application of topology optimization on the quantitative description of the external shape of bone structure[J]. Journal of Biomechanics, 2005, 38(8): 1612-1620.
[7]Thomsen JS, Laib A, Koller B, et al. Stereological measures of trabecular bone structure: comparison of 3D micro computed tomography with 2D histological sections in human proximal tibial bone biopsies [J]. Journal of Microscopy, 2005, 218(Part 2): 171-179.
[8]Yao XF, Wang P, Dai RC, et al. Microstructures and properties of cancellous bone of avascular necrosis of femoral heads [J]. Acta Mechanica Sinica, 2010,26(1): 13-19.
[9]Jiang Y, Zhao J, White DL, et al. Micro CT and micro MR imaging of 3D architecture of animal skeleton [J]. Journal of Musculoskeletal & Neuronal Interactions, 2000, 1(1): 45-51.
[10]Thomsen JS , Jensen MV, Niklassen AS, et al. Agerelated changes in vertebral and iliac crest 3D bone microstructure-differences and similarities [J].Osteoporosis International, 2014, 26(1): 219-228.
[11]Boland ED, Pawlowski KJ, Barnes CP, et al.Electrospinning of bioresorbable polymers for tissue engineering scaffolds [J]. Polymeric Nanofibers,2006, 918: 188-204.
[12]Xu P, Xie R, Liu Y, et al. Bioinspired microfibers with embedded perfusable helical channels [J].Advanced Materials, 2017, 29(34): 1701664.
[13]Gómez S, Vlad MD, López J, et al. Design and properties of 3D scaffolds for bone tissue engineering [J]. Acta Biomaterialia, 2016, 42: 341-350.
[14]Pedde RD, Mirani B, Navaei A, et al. Emerging biofabrication strategies for engineering complex tissue constructs [J]. Advanced Materials, 2017,29(19): 1606061.
[15]Yeni YN, Zinno MJ, Yerramshetty JS, et al.Variability of trabecular microstructure is age-,gender-, race and anatomic site-dependent and affects stiffness and stress distribution properties of human vertebral cancellous bone [J]. Bone, 2011,49(4): 886-894.
[16]Rossi M, Casali F, Romani D, et al. 3D micro-CT analysis of cancellous bone architecture [C]// SPIE Proceedings, 2002: 9.
[17]Sun M, Star-Lack JM. Improved scatter correction using adaptive scatter kernel superposition [J].Physics in Medicine and Biology, 2010, 55(22):6695-6720.
[18]Schneide R, Hindenlang U, Copf P. Dynamic fi nite element analysis of cancellous bone micro structure[C]// Computational Science and High Performance Computing IV, 2011: 339-347.
[19]Boyle C, Kim IY. Three-dimensional micro-level computational study of Wolff’s law via trabecular bone remodeling in the human proximal femur using design space topology optimization [J].Journal of Biomechanics, 2010, 44 (5): 935-942.
[20]Kucukkoc I, Zhang DZ. Mathematical model and agent based solution approach for the simultaneous balance and sequencing of mixed model parallel two-sided assembly lines [J]. International Journal of Production Economics, 2014, 158 (12): 314-333.
[21]Danz JC, Habegger M, Bosshardt DD, et al. Virtual tissue alignment and cutting plane de fi nition : a new method to obtain optimal longitudinal histological sections [J]. Journal of Anatomy, 2014, 224(2): 85-94.
[22]Bai X, Luo S. Combining bag of words model and information theoretic method for image clustering[C]// Lecture Notes in Electrical Engineering,2010: 423-430.
[23]Forget A, Blaeser A, Miessmer F, et al.Mechanically tunable bioink for 3D bioprinting of human cells [J]. Advanced Healthcare Materials,2017, 6(20): 1700255.
[24]Blaeser A, Duarte Campos DF, Puster U, et al.Controlling shear stress in 3D bioprinting is a key factor to balance printing resolution and stem cell integrity [J]. Advanced Healthcare Materials, 2016,5(3): 326-333.
[25]Huang R, Wang X, Zhou YH, et al. RANKL-induced M1 macrophages are involved in bone formation [J]. Bone Research, 2017, 5: 17019.
[26]Bruder SP, Kraus KH, Goldberg VM, et al.The effect of implants loaded with autologous mesenchymal stem cells on the healing of canine segmental bone defects [J]. The Journal of Bone and Joint Surgery, 1998, 80(7): 985-996.
[27]Seitz H, Rieder W, Irsen S, et al. Three-dimens ional printing of porousceramic scaffolds for bone tissue engineering [J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials,2005, 74(2): 782-788.
[28]Freed LE, Engelmayr G, Borenstein JT, et al.Advanced materials strategies for tissue engineering scaffolds [J]. Advanced Materials, 2009, 21(32-33):3410-3418.
[29]Lui H, Vaquette C, Bindra R. Tissue engineering in hand surgery: a technology update [J]. The Journal of Hand Surgery, 2017, 42(9): 727-735.
[30]Wong ST, Teo SK, Park S, et al. Anisotropic rigidity sensing on grating topography directs human mesenchymal stem cell elongation [J]. Biomech Model Mechanobiol, 2014, 13(1): 27-39.
