布鲁氏菌GMD重组蛋白表达及对昆明系小鼠的免疫效果研究
2018-01-22徐锦凤易德武易继海马旭升陈创夫
徐锦凤,王 震,易德武,易继海,马旭升,姬 祥, 张 辉,陈创夫
(1.新疆石河子大学生命科学学院,新疆石河子 832000;2.新疆石河子大学动物科技学院,新疆石河子 832000)
0 引 言
【研究意义】布鲁氏菌病(简称布病)是由布鲁氏菌引起的一种人兽共患传染病[1]。动物感染后一般表现为流产、不孕、睾丸炎及关节炎等症状,人感染后多表现为波浪热、多汗、关节痛等临床症状[2]。布病的流行严重制约畜牧业的发展并威胁公共卫生安全。鉴于布病造成的严重损失,世界上许多国家和地区制定了相应的防控和根除计划,使用疫苗免疫在此过程中具有重要意义,尤其是在布病流行形势严峻的地区。【前人研究进展】早期曾使用灭活疫苗用于人和动物的布病防控,随后被免疫效力更好的弱毒活疫苗替代[3]。但其仍具有一定的毒力,可引起怀孕家畜流产,对人具有感染性,并且无法进行鉴别诊断等缺陷。因此,对毒力更弱、安全性更高且免疫效果好的布鲁氏菌新型疫苗的研究是当下的研究热点且具有重要意义,以其加强动物布病的预防和控制。gmd是布鲁氏菌LPS的合成相关基因,位于LPS的Wbk区域,其编码O-侧链合成必须的GDP-D-甘露糖脱水酶。【本研究切入点】研究发现,gmd基因的缺失或突变将导致光滑型布鲁氏菌的表型和毒力发生改变,从而具有良好的免疫特性[4]。gmd基因可应用于布鲁氏菌亚单位疫苗的开发,而且其编码的蛋白可能会成为布病鉴别诊断的靶抗原。【拟解决的关键问题】构建布鲁氏菌gmd基因的原核表达载体, 通过表达纯化GMD蛋白进行反应原性和免疫原性的评价,并在小鼠模型上评价目的蛋白的免疫效果。为布鲁氏菌诊断方法的建立和布鲁氏菌新型疫苗的开发提供实验依据。
1 材料与方法
1.1 材 料
1.1.1 菌株与载体
羊种布鲁氏菌16M标准株由试验室分离保存,DH5α克隆菌株和DE3(BL21)表达菌株由该试验室保存,pMD19-T-vector 克隆载体、pET-28a(+)表达载体购自Takara公司。
1.1.2 酶、主要试剂、实验动物
dNTP、质粒DNA小提试剂盒、琼脂糖凝胶回收试剂盒购自北京天根生物有限公司;TaqDNA聚合酶、BamH I、XhoI限制性内切酶、T4DNA连接酶、DNA Maker均购自Takara公司;蛋白Marker、IPTG购自上海生工;辣根酶标记兔抗羊的Ig G,辣根酶标记山羊抗小鼠IgG(H+L)购自康为世纪生物技术有限公司;羊种布鲁氏菌的阳性血清为该实验室分离所得。4~6周雌性昆明系小鼠购自石河子大学实验动物中心。
1.1.3 引物
根据GenBank上公布的羊布鲁氏菌标准株16 M的gmd基因序列(序列号:BMEⅠ1413),用Primer 5.0 软件对gmd基因进行引物设计。该基因引物序列由北京六合华大基因有限公司合成,引物序列见表1。
表1 PCR引物及序列
Table 1 Nucleotide sequences of PCR primers

PrimerPrimersequences(5'-3')gmd-上游GGATCCATGAAGAAAGTCGCACTTATCA(BamHI)gmd-下游CTCGAGTTCCTTAGGGGCGAAAAAT(XhoI)
1.2 方 法
1.2.1 GMD蛋白的生物信息学
应用TMHMM Server v.2.0在线分析羊种布鲁氏菌16 M的gmd的氨基酸序列,预测其蛋白跨膜区;利用Predicting Antigenic Peptides 在线预测软件预测gmd蛋白的抗原决定簇。利用SignalP 4.1 Server预测该蛋白的信号肽。使用SOPMA在线软件分析预测该蛋白的二级结构。利用Phyre2在线服务器三维自动建模,分析蛋白质三级结构。表2
表2 生物信息学预测方法
Table 2 The methods of Bioinformatics prediction

预测功能Predictedfunction预测方法Predictedmethod预测网址PredictedURL跨膜结构预测TransmembranestructurepredictionTMHMMServerv.20http://www.cbs.dtu.dk/services/TMHMM/信号肽预测SignalpeptidepredictionSignalP41Serverhttp://www.cbs.dtu.dk/services/SignalP/抗原决定簇预测EpitopepredictionPredictingAntigenicPeptideshttp://imed.med.ucm.es/Tools/antigenic.pl蛋白二级结构预测ProteinsecondarystructurepredictionSOPMAhttps://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html蛋白质三级结构预测ProteintertiarystructurepredictionPhyre2http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index
1.2.2 PMD19-T-gmd克隆载体的构建
以羊布鲁氏菌标准株16M的灭活菌液(85℃水浴45 min)为模板,进行菌液 PCR 扩增,反应结束后PCR产物通过琼脂糖凝胶进行检测,并用琼脂糖凝胶回收试剂盒回收目的片段。
将回收的目的片段与 pMD19- T 载体在 16 ℃条件下过夜连接,构建重组质粒 pMD19- T-gmd。将重组质粒转入E.coliDH5α感受态细胞,在氨苄抗性的LB固体培养基上筛选阳性克隆,通过菌液PCR和双酶切鉴定阳性克隆,将酶切大小正确的阳性质粒送华大基因生物技术有限公司测序鉴定。
1.2.3 PET-28a-gmd表达载体的构建
用BamHⅠ和XhoⅠ对测序正确的菌株质粒和 pET-28a 载体进行双酶切,经琼脂糖凝胶回收试剂盒回收酶切后的目的片段和线性 pET-28a 载体,并将目的片段和线性pET-28a载体在T4连接酶的作用下连接(16℃水浴过夜),连接产物转化E.coliBL21(DE3)感受态细胞,用卡那抗性的LB固体培养基筛选阳性克隆,进行菌液PCR和双酶切鉴定。
1.2.4 GMD重组蛋白的诱导表达与纯化
将鉴定正确的阳性菌落接种于含卡那抗性的液体 LB 中,37℃ 培养过夜,转接到新鲜的 LB 中,至 OD600= 0.6 时加入 IPTG 至终浓度 1 mmol/L 继续培养,分别在 0、2、4、6 h 收集菌液1.0 mL,10 625×g离心2 min收集菌体。12%SDS-PAGE 进行电泳,电泳后对凝胶进行染色、脱色、观察结果。收集诱导培养6 h 后的菌体,将收集的菌体重悬于5 mL Lysis Buffer中,液氮反复冻溶处理3次;超声破碎至菌液透亮。4℃ 10 625 ×g离心30 min。采用AKTA蛋白纯化系统纯化目的蛋白,并经蔗糖浓缩后进行 SDS- PAGE电泳鉴定。纯化的蛋白经BCA蛋白定量试剂盒测定浓度后,-80℃ 保存。
1.2.5 Western Blot 检测
将SDS-PAGE凝胶上的目的蛋白通过半干式转膜仪转印到NC膜上,用western Blot 膜封闭液封闭,37℃ 作用 1 h;TBST洗涤3次,每次10 min,加入1∶500稀释的布鲁氏菌阳性血清,37℃孵育1 h;TBST洗涤3次;加入1∶2 000 稀释的辣根过氧化物酶(HRP) 标记的兔抗绵羊IgG作用1 h,TBST洗涤3次,加入DAB底物显色液进行显色,用水终止反应。
1.2.6 小鼠免疫实验
将6~8周龄昆明雄性小鼠分成实验组和PBS组,每组20只。将GMD重组蛋白与弗氏完全佐剂1∶1乳化后通过腹腔注射接种小鼠,50 μg/只。PBS组每只注射100 μL PBS 。在免疫三周后,GMD重组蛋白与弗氏不完全佐剂1∶1乳化后加强免疫,25 μg/只。小鼠免疫后第 1、2、3周进行断尾采血,分离外周血血清,-20℃保存备用。
免疫第4周后,将布鲁氏菌新疆流行株043菌液稀释成 5.0×106CFU/mL, 每组小鼠腹腔注射 0.2 mL(1.0×106CFU/mL)菌液。第6周每组分别随机选取5只,断颈处死。无菌摘除脾脏,并称取小鼠脾脏质量和体重。后用组织匀浆器研磨脾脏,10倍梯度稀释,涂布含5%马血清的布鲁氏菌鉴别固体培养基,置于37℃、 5%CO2培养箱中培养 3~4 d,开始计数。
1.2.7 间接ELISA
GMD重组蛋白(10 μg/mL)经碳酸盐缓冲液(pH 9.6)稀释后加入酶标板(100 μL/孔),置于4℃过夜,后用洗涤缓冲液 PBST洗板3次,每次3 min,于滤纸拍干。加入5%脱脂乳100 μL/孔,37℃封闭1 h,洗涤液PBST洗涤5次。后加入1∶40稀释的待检血清 100 μL/孔,37 ℃作用1 h,洗涤液PBST洗涤5次。后加入1∶4 000 稀释的辣根过氧化物酶(HRP) 标记的羊抗鼠IgG,100 μL/孔,37℃作用1 h,PBST洗涤,之后加入 TMB显色液(100 μL/孔)作用15 min,再用2 M硫酸(500 μL/孔)终止反应,酶标仪测定 OD450nm值。
依照ELISA试验的阴阳性判定标准公式: P/N=(阳性血清OD值-空白对照OD值)/(阴性血清OD值-空白对照 OD 值),如果P/N≥2.1,即为阳性。
2 结果与分析
2.1 目的蛋白的生物信息学
通过TMHMM Server v.2.0在线软件分析得出,目的蛋白无跨膜螺旋结构。Predicting Antigenic Peptides在线预测得出gmd蛋白有15个抗原决定簇(图2)。SignalP 4.1 Server对该蛋白氨基酸序列分析显示,该蛋白无信号肽(图3)。利用SOPMA在线软件分析该蛋白的二级结构,结果显示,GMD蛋白中有139个氨基酸参与形成α—螺旋,占所有氨基酸的38.4%;75个氨基酸参与延伸链的形成,占所有氨基酸的20.72%;41个氨基酸参与β-折叠的形成,占所有氨基酸的11.33%;另外,还有107个氨基酸参与无规卷曲结构的形成,占所有氨基酸的29.56%(图4)。通过Phyre2在线服务器构建出并优化目的蛋白的三维结构(图5)。图1~5
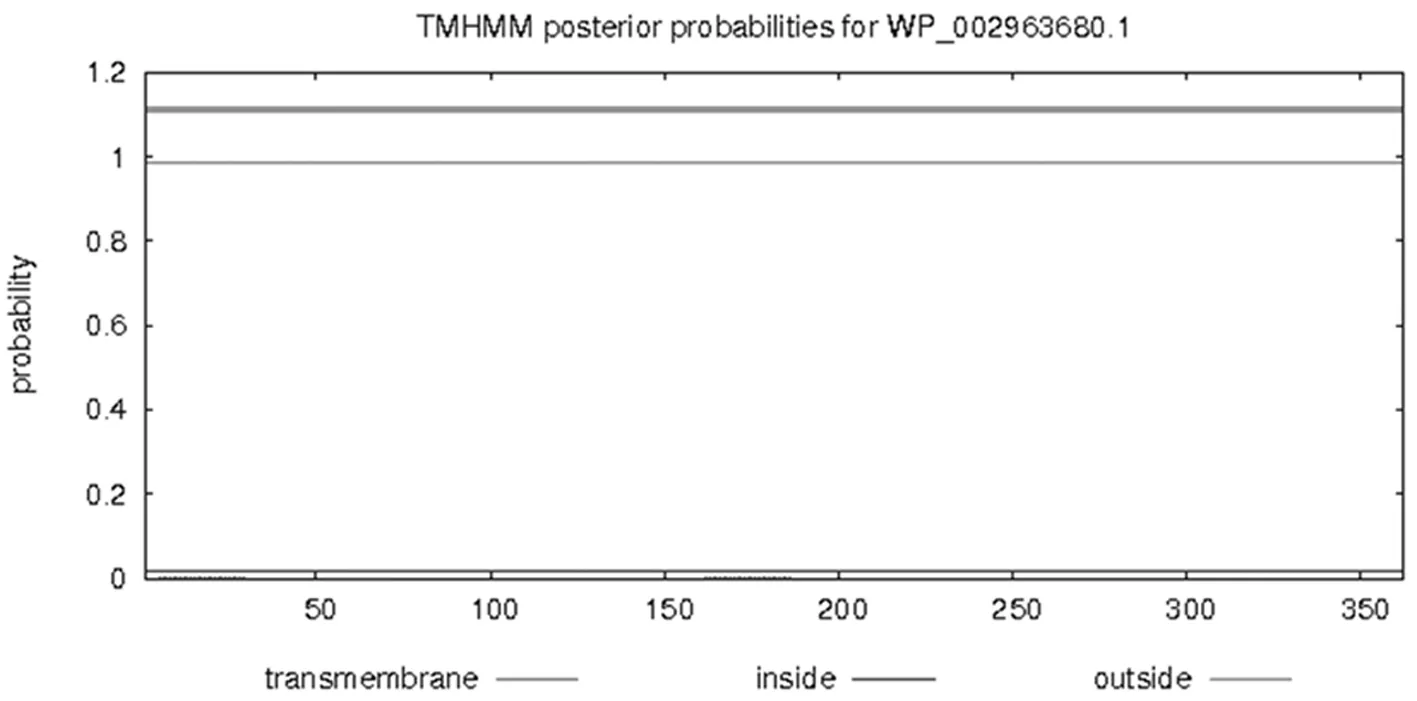
图1 GMD蛋白跨膜结构域的预测
Fig.1 The prediction of transmembrane domain of GMD protein


nStartPositionSequenceEndPosition114DGAYLAELLLQKGYAVHG31243RIDHLYHD50352HEQGVDLTLHH62467DTSSLVRIMQLVRP80582EVYNLGAQSHVAVSF966107ALGALRLLEAIR1187126TRYYQASTSELYGLVQE1428149TPFYPRSPYAAAKLYAYWITVNY1719173EAYGIYACNGILFNH18710201ITRALAR20711246PEDFVIAT25312255KQYSVREFVTLAAK26813289KTGACIVEVDP29914306EVETLLG31215325PKISFETLVSE335
图2 GMD蛋白的抗原决定簇预测
Fig.2 The prediction of Antigenic determinant of GMD protein

图3 GMD蛋白信号肽的预测
Fig.3 The prediction of Signal peptide of GMD protein

图4 GMD蛋白二级结构的预测
Fig.4 The prediction of secondary structure of GMD protein
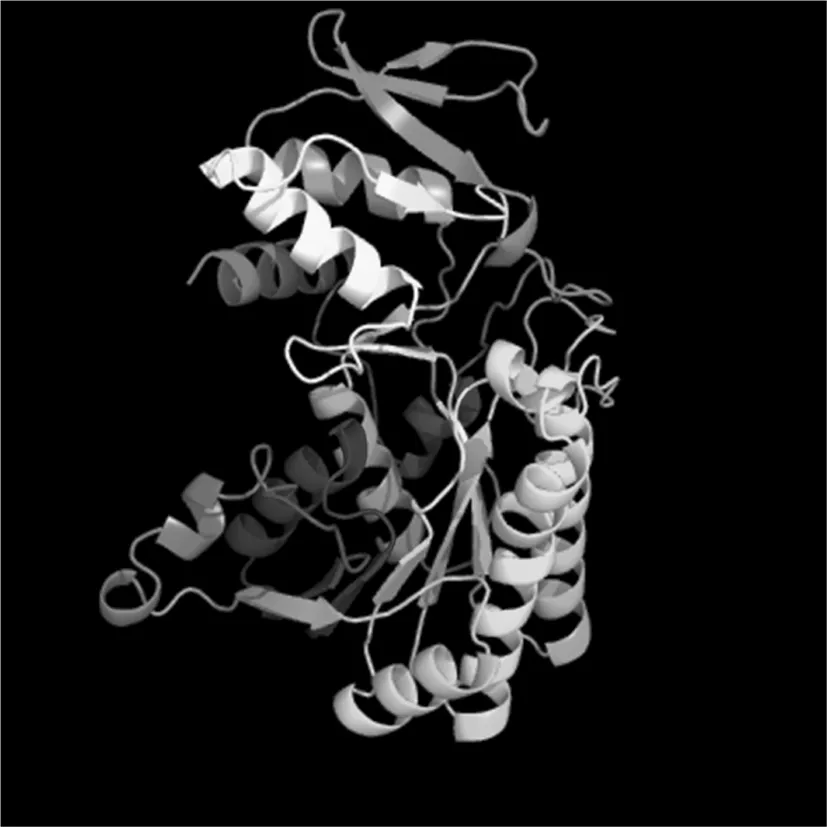
图5 GMD蛋白三级结构的预测
Fig.5 The prediction of tertiary structure of GMD protein
2.2 PMD19-T-gmd克隆载体的构建
以羊种布鲁氏菌16M为模板,通过PCR扩增gmd基因,大小为1 089 bp;经PCR和双酶切方法鉴定的阳性菌送至上海生工进行测序。测序结果表明:扩增出的gmd基因与GenBank上发表的羊种布鲁氏菌16M比较,碱基序列同源性100%。经1%琼脂糖凝胶电泳检测,与预期大小一致。图6

注:M. DNA marker DL2000; 1.阴性对照;2~4.gmdPCR产物
Note: M. DNA marker; 1. negative control; 2-4. PCR production ofgmd
图6 PCR扩增gmd基因
Fig.6 gmd gene was amplified
2.3 PET-28a-gmd表达载体的构建
BamHI和XhoI限制性内切酶37℃水浴双酶切pET-28a-gmd重组质粒,经1%琼脂糖凝胶电泳分析得出,一条带为1 089 bp,另一条带为5 369 bp,与理论值相符,表明gmd基因已成功插入表达载体中。图7
2.4 GMD重组蛋白的诱导表达与纯化
大肠杆菌DE3 (BL21)中重组质粒p ET-28a-gmd在0、2、4和6 h 的诱导表达菌经12%的SDS-PAGE凝胶电泳分析,研究表明,得到了大小为43.7 KD的GMD蛋白,与预期蛋白分子量大小一致。采用AKTA蛋白纯化系统纯化,并经蔗糖浓缩后进行 SDS- PAGE电泳鉴定。图8,图9

注:M. DNA标准 DL5000; 1~2. 双酶切产物;3.BamH I单酶切产物对照; 4.XhoI单酶切产物对照; 5. p ET28a-gmd质粒
Note: M. DNA Marker DL5000 ;1-2. Identification of pET-28a-gmdrecombinant plasmid with double enzyme identification; 3. pET-28a-gmdrecombinant plasmid withBamH I enzyme; 4. pET-28a-gmdrecombinant plasmid withXhoI enzyme; 5. PET- 28a-gmdrecombinant plasmid control
图7 重组质粒双酶切鉴定
Fig.7 The double enzyme identification of recombinant plasmid
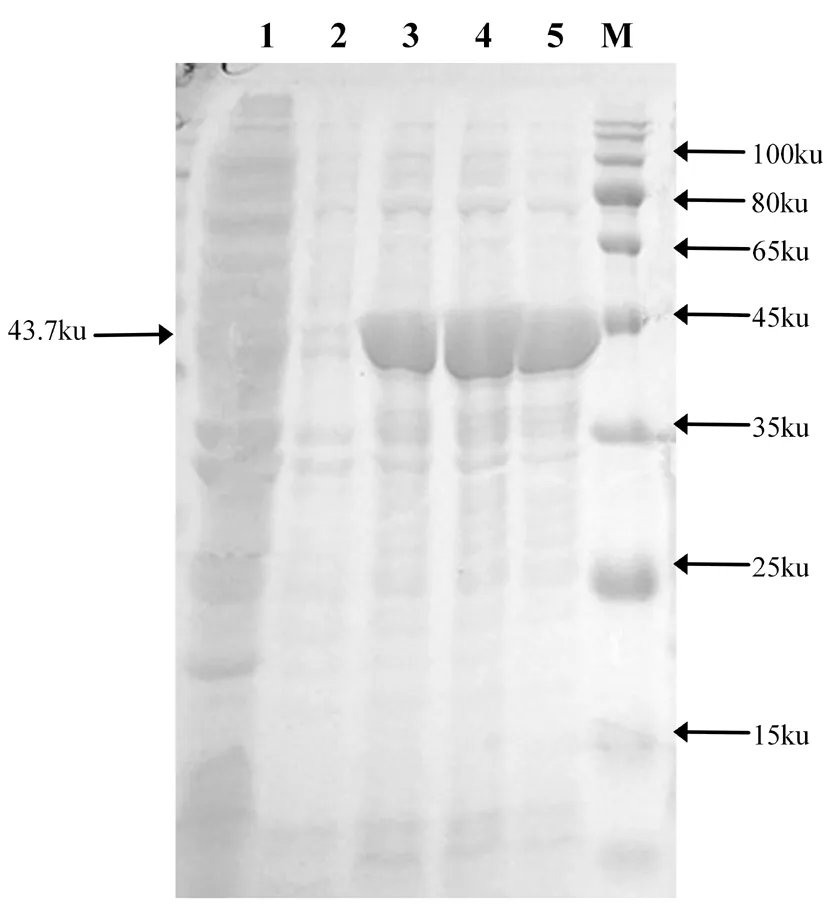
注:M.蛋白分子质量标准;1.E.coliBL21(DE3);2.IPTG诱导0 h的pET-28a-gmd;3.诱导2 h;4.诱导4 h;5.诱导6 h
Note: M. Protein Molecular Marker; 1.E.coliBL21(DE3); 2, Induced pET-28a-gmdfor 0 h by IPTG; 3.Induced 2 h ; 4.Induced 4 h ; 5. Induced 6 h
图8 重组蛋白pET-28a-gmd诱导表达
Fig.8 Induced expression of the recombinant protein pET-28a-gmd

图9 GMD蛋白纯化
Fig.9 Purification of GMD protein
2.5 Western blot 鉴定
将GMD蛋白与布鲁氏菌自然感染绵羊的阳性血清进行WB试验,结果显示表达的GMD蛋白可在43.7 Ku的位置上有一条特异的反应条带,此结果与预期一致。表明重组蛋白GMD与抗布鲁氏菌抗体发生特异性反应;说明重组GMD蛋白与相应天然蛋白具有相同的抗原性。图10

注:1.GMD蛋白与阳性血清反应; M.蛋白分子质量标准
Note: 1. The GMD protein reacts with the positive serum;M. Protein Molecular Marker
图10 GMD蛋白Western Blot 试验
Fig.10 Western Blot assay of GMD protein
2.6 小鼠血清抗体水平检测结果
用GMD蛋白作为包被抗原,通过间接ELISA法对各组小鼠血清进行抗体水平检测,最后测得各组小鼠血清的OD450值。结果显示,免疫后从第7~21 d,各组小鼠血清抗体水平都有大幅增加,并且在第21 d达到最高峰。且每次免疫后产生的抗体与PBS组对比均有极显著性差异(P≤0.01)。且第7和第21 d的抗体水平比较具有显著性差异(P≤0.05)。图11
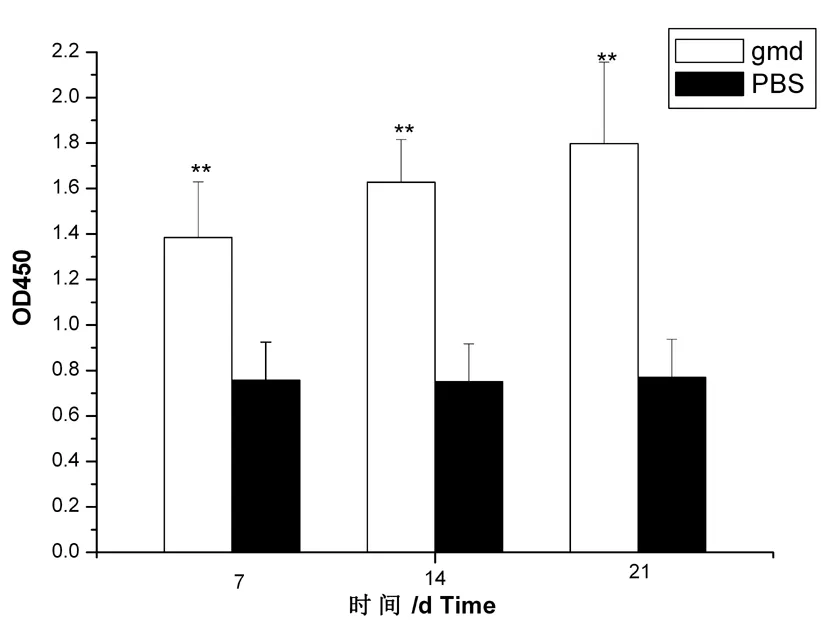
图11 小鼠血清抗体水平测定
Fig.11 The level of antibody of mouse serum immunized by indirect ELISA
依照ELISA试验的阴阳性判定标准公式换算后的结果表明,三组试验组结果均大于2.1,结果均有效,表明小鼠体内产生了特异性抗体。从表3可以看出:从第7~21 d,实验组小鼠血清抗体水平都有大幅增加,试验结果证明GMD有较好的免疫原性。表3
表3 小鼠血清 P/N 值换算结果
Table 3 The conversion result of mouse serum P/N values

组别P/N值7d14d21dGMD222630
2.7 免疫后小鼠保护力测定
将免疫6周的小鼠进行脾脏指数测定。首先,每组随机选取5只小鼠,利用电子天平进行体重测定和脾脏质量测定。最后根据公式:脾脏指数=脾脏质量/体重×100%得出结果。 在免疫第6周时,GMD组较PBS组差异极显著(P≤0.01),GMD组小鼠脾指数明显低于PBS组。图12
将免疫后6周小鼠进行脾脏 CFU 计数。将每组无菌操作取出的脾脏用组织匀浆器研磨20 min,10 倍梯度稀释,涂布含5%血清布鲁氏菌鉴别固体培养基。 结果发现,GMD组脾脏载菌量为4.7 log 单位,而PBS组脾脏载菌量为5.8 log 单位,低于PBS组且差异显著(P≤0.05)。图13
在该实验中,与注射PBS的小鼠相比,保护被定义为小鼠用毒力菌株043攻击后免疫小鼠的脾指数的降低和脾脏中的细菌数目的显著减少。结果表明,GMD组脾指数和脾脏载菌量均显著低于PBS组,GMD蛋白在小鼠模型上发挥了免疫保护的作用。

图12 小鼠脾脏指数测定
Fig.12 The determination of murine splenic index
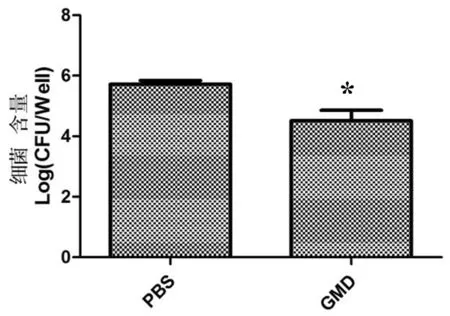
图13 小鼠脾脏 CFU
Fig.13 The CFU of murine spleen
3 讨 论
羊种布鲁氏菌、牛种布鲁氏菌、猪种布鲁氏菌是人畜共患病感染的最常见的致病因素,因此是全球最重要的临床重要病原体[5]。在家禽和野生动物中,布鲁杆菌感染主要在妊娠晚期导致女性堕胎,男性睾丸炎和附睾炎[6]。因此布鲁氏菌病在世界许多地区仍然是一个重大的人类健康威胁。其完整的基因组测序和分析以及新型生物技术的出现有助于开发改进可用疫苗和制备新型疫苗的方法。对于人类布鲁氏菌病预防,重组蛋白疫苗,亚单位疫苗,外膜囊泡和载体疫苗的开发是潜在的选择[7]。
目前, 针对与布鲁氏菌 LPS合成有关的基因进行研究成为进一步改造疫苗或建立诊断方法的新方向。LPS 是布鲁氏菌重要的毒力因子之一[8]。LPS含有O-链多糖,使得现在的疫苗因存在血清学干扰而无法推广使用。Godfroid最先分析了参与羊种布鲁氏菌O抗原合成的关键基因,初步揭示了wbkA,gmd,wzm,wzt,wbkB,wbkC等基因在O-侧链合成中的作用[9]。gmd编码与光滑型布鲁氏菌脂多糖的O -链合成相关的GDP甘露糖脱水酶。gmd在O抗原合成中发挥着重要作用,其缺失株会导致菌株缺乏O 抗原合成的能力成为粗糙型[10]。
4 结 论
大量的布鲁氏菌亚单位组分作为重组蛋白疫苗已经在小鼠模型上被评价,并且已经证明一些重组蛋白具有保护作用[11]。研究通过生物信息学分析对布鲁氏菌脂多糖蛋白ManB进行生物信息学分析,初步预测其结构和功能。GMD蛋白没有跨膜结构,其蛋白可能不参与胞内外信号转导。研究抗原表位预测结果显示该蛋白有一定数量的抗原决定簇,这表明其作为抗原可能引起良好的免疫应答反应。该蛋白没有信号肽,意味着该蛋白属于非分泌性蛋白,不能被分泌到胞外发挥作用。GMD蛋白二级结构主要以α-螺旋为主,其是通过骨架上的羰基和酰胺基团之间形成的氢键维持的。研究对该gmd基因进行了原核表达和重组蛋白纯化,通过Western Blot验证了GMD蛋白良好的反应原性,并在小鼠模型上进一步验证了该蛋白良好的免疫原性,且具有一定免疫保护力。证实了该蛋白具有成为布鲁氏菌亚单位疫苗优势抗原的潜力。
)
[1] Moreno, E. (2014). Retrospective and prospective perspectives on zoonotic brucellosis.FrontiersinMicrobiology, 5(2): 213.
[2] Galińska, E. M., & Zagórski, J. (2013). Brucellosis in humans--etiology, diagnostics, clinical forms.AnnalsofAgricultural&EnvironmentalMedicineAaem, 20(2):233-238.
[3] 景志刚, 严家瑞, 范伟兴. 布鲁氏菌病疫苗研究进展[J]. 中国人兽共患病学报, 2016, 32(2):188-199.
JING Zhi-gang, YAN Jia-rui, FAN Wei-xing. (2016). Research progress of brucellosis vaccines [J].ChineseJournalofZoonoses, 32(2):188-199. (in Chinese)
[4] Cloeckaert, A., Grayon, M., Verger, J. M., Letesson, J. J., & Godfroid, F. (2000). Conservation of seven genes involved in the biosynthesis of the lipopolysaccharide o-side chain in brucella spp.ResearchinMicrobiology, 151(3): 209-216.
[5] Dahouk, S. A., Neubauer, H., & Sprague, L. D. (2014). Brucella (B. abortus, B. melitensis, and B. suis) Sascha Al Dahouk, Heinrich Neubauer, and Lisa D. Sprague.ManualofSecuritySensitiveMicrobesandToxins.
[6] ENRIGHT, F.M. (1990): The Pathogenesis and pathobiology of Brucella infection in domesticanimals.Animalbrucellosis, (55):301-320.
[7] Wang, Z., & Wu, Q. (2014). Research progress in live attenuated brucella vaccine development.CurrentPharmaceuticalBiotechnology, 14(10): 887.
[8] Lapaque, N., Moriyon, I. E., & Gorvel, J. (2005). Brucella lipopolysaccharide acts as a virulence factor.CurrentOpinioninMicrobiology, 8(1): 60-66.
[9] Godfroid, F., Cloeckaert, A., Taminiau, B., Danese, I., Tibor, A., & Bolle, X. D., et al. (2000). Genetic organisation of the lipopolysaccharide o-antigen biosynthesis region of brucella melitensis, 16m ( wbk ).ResearchinMicrobiology, 151(8): 655-668.
[10] 易德武.羊种布鲁氏菌015株gmd、per和manb缺失株的构建及诊断抗原反应原性评价研究[D]. 石河子:石河子大学, 2015.
YI De-wu. (2015).ResearchonConstrulctionandImmunogenicityofgmd,perandmanbMutantStrainsofBurcellaMelitensis015 [D]. Master Thesis. Shihezi University, Shihezi. (in Chinese)
[11] Oliveira, S. C., Giambartolomei, G. H., & Cassataro, J. (2011). Confronting the barriers to develop novel vaccines against brucellosis.ExpertReviewofVaccines, 10(9): 1,291-1,305.
