不同形态硼对油菜幼苗铝毒的缓解效应及其FTIR特征分析
2018-01-22姜存仓MuhammadRiaz吴秀文卢晓佩杜晨晴王宇函
闫 磊 姜存仓 Muhammad Riaz 吴秀文 卢晓佩 杜晨晴 王宇函
不同形态硼对油菜幼苗铝毒的缓解效应及其FTIR特征分析
闫 磊 姜存仓*Muhammad Riaz 吴秀文 卢晓佩 杜晨晴 王宇函
华中农业大学资源与环境学院 / 微量元素研究中心, 湖北武汉 430070
采用水培法, 以油菜品种Cao 221167为试验材料, 设置无机态硼酸(BA)和有机态山梨醇硼(SB)及不同Al3+(0、100、200和500 µmol L–1)处理, 研究不同形态硼(B)对油菜幼苗铝(Al)毒的缓解作用及不同形态B之间的缓解效应差异, 以及利用FTIR (傅里叶红外光谱)技术分析叶片各物质含量的变化。结果表明, Al毒胁迫下, 不同形态B (BA和SB)处理, 显著提高植株生物量和根系长度(0、100、200和500 µmol L–1Al毒胁迫下BA处理根长分别增加了52.15%、101.45%、366.70%和18.73%; SB处理分别增加了46.80%、133.98%、261.36%和10.77%), 提高色素含量和SOD活性, 而降低了Al含量、MDA含量和POD活性。不同形态B处理下, 油菜幼苗在200 µmol L–1Al3+处理下长势、生物量及色素含量最高。在500 µmol L–1Al3+处理下, 油菜幼苗株高、根长、总干鲜重及色素含量显著低于无Al处理; FTIR分析表明, Al毒胁迫下油菜叶片中蛋白质和低聚糖等含量明显上升, 加硼明显降低了蛋白质和低聚糖的含量, 且BA处理降低幅度明显高于SB处理。说明不同形态B (BA和SB)的添加均明显缓解Al毒, 且BA对Al毒缓解效果优于SB, 这为农业生产中施用何种硼肥来缓解Al毒起到一定的指导作用。
油菜; 不同形态硼; 铝毒胁迫; FTIR; 缓解效应
铝(Al)是地壳中含量最丰富的金属元素, 其含量约占地壳的8%[1]。世界约40%、中国约21% 的耕作土壤中的作物受到Al毒严重影响[2]。Al毒是酸性土壤限制作物生长的最重要因素, 然而土壤中的Al对植物的影响并不取决于总量, 而是与其存在形式和化学形态紧密相关[3-4], 在酸性土壤(pH < 5.5)中, 主要以Al3+或Al(H2O)63+的形式存在[5], 微摩尔水平的Al3+就能对植物产生严重的毒害效应[6], 且随着Al作用时间的增加, 植物根、茎的Al毒害症状更为明显[7]。
硼(B)是高等植物生长和发育的必需元素, 植株缺B生长缓慢, 根系发育不良, 根茎膨大, 主侧根均变粗变短[8]。Al毒使植物根系表现出典型的中毒症状, 根系生长明显受阻, 根毛短小, 出现畸形卷曲, 脆弱易断[9]。B和Al毒的作用位点都在根尖[10], Blevins等[11]研究发现Al对植物的毒害与B的含量和植物种类有关。Lenoble等[12]报道指出B可以减轻Al毒, 或许是B通过改善Al胁迫条件下Al和其他营养物的吸收模式, 减轻了Al对植物生长的毒害,但其具体作用机制并不很清楚。目前关于Al毒对油菜生理指标的影响已有不少报道[13], 但关于Al毒的缓解机制还不明确。Yang等[14]研究发现B的添加可以明显缓解Al毒从而促进大豆幼苗的生长。Yu等[15]在豌豆研究中也发现B具有缓解Al毒的作用。说明B不仅单纯对植物起作用, 而且还与Al之间具有某种交互作用。前人研究B对Al毒的缓解重点仅仅集中于无机态硼酸, 而关于有机态B研究鲜有报道。徐建明等[16]在小麦研究中得出有机态山梨醇硼较无机态硼酸更能提高小麦幼苗根及叶片中B浓度。Duan等[17]探究发现有机态B相比无机态硼酸能够提高油菜幼苗体内B含量和促进油菜幼苗的生长发育。傅里叶红外光谱(FTIR)技术可以更好地探测脂类、核酸、碳水化合物等分子的相对含量及其构象变化等信息, 因此该技术已广泛应用于包括植物生物学在内的许多领域[18-19]。金婷婷等[20]利用 FTIR对外源柠檬酸协同Al胁迫下的大豆根组织干燥粉末直接测定发现, Al处理下大豆根1057、1602、2927和3297 cm–1左右的吸收峰区别明显, 反应出蛋白质、糖类以及核酸等有机物的含量变化。外源柠檬酸的加入使不同处理的红外吸收峰形及峰强差异降低, 说明在某种程度上能够反映外源柠檬酸对Al胁迫下大豆根的缓解效应, 此方法也为本研究提供了有益参考。
油菜种植在中性和微碱性土壤上含油量较高, 在酸性土壤上次之, 在碱性土壤上含油量最低[21]。目前, 我国油菜种植面积已突破720万公顷, 大部分分布在我国南方酸性土壤区[22]。酸性土壤的Al毒害已成为我国油菜生产的重要限制因子。本研究借助FTIR技术, 分析不同形态B对Al毒胁迫下油菜叶片内部化学成分的变化, 探究其对油菜Al毒的缓解效应及效应差异, 旨在提高油菜抗Al毒能力, 为农业生产中B肥施用及解决Al毒害提供理论基础。
1 材料与方法
1.1 试验材料
选用发芽率较高的油菜()品种Cao 221167, 该种子由华中农业大学作物遗传改良国家重点实验室提供。
1.2 试验设计
于2016年7月在华中农业大学光照培养室, 油菜种子经1%次氯酸钠消毒30 min, 用去离子水冲洗后浸种24 h, 挑选大小一致的种子置于纱网上以超纯水催芽培养7 d。然后将幼苗移植到1.5 L含有Al营养液黑色塑料遮光盒中。Hoagland营养液配方为0.51gL–1KNO3; 0.14gL–1K2HPO4; 1.18 gL–1Ca(NO3)2·4H2O; 0.49 g L–1MgSO4·7H2O; 0.05 g L–1Fe-EDTA。采用Arnon (1950)微量元素配方, 即1.78 mg L–1MnCl2·4H2O; 0.0749 mg L–1CuSO4·5H2O; 0.230 mg L–1ZnSO4·7H2O; 0.242 mg L–1Na2MoO4·2H2O。设置Al3+(Al源用AlCl3· 6H2O)为0、100、200、500 µmol L–1(0.5 mmol L–1CaCl2, pH 4.5), 无机态硼酸(BA)和有机态山梨醇硼(Sorbitol与Boric acid物质的量1∶1络合反应[17], 简写SB) 2种外源B类型, 缺B (0.25 μmol L–1)和正常B (25 μmol L–1)共16个处理, 以缺B (0.25 μmol L–1)处理为对照(CK), 各处理重复4次。试剂为分析纯, 使用一级水(B含量< 0.5 μmol L–1)。每5 d更换一次营养液, 第1次使用1/4当量, 第2次使用1/2当量, 以后均用全量营养液, 每次更换营养液时将不同浓度Al3+和外源B单独添加到不同处理的营养液中。幼苗培养温度和光照条件为18~25°C、50 μmol m–2s–1, 光照16 h; 黑暗8 h。处理35 d出现严重Al毒症状时收获。
1.3 样品采集与测定
将幼苗从营养液中取出, 分为根系、地上部两部分, 以重蒸水反复冲洗。用带有刻度直尺精确测量幼苗株高和主根长。
用分光光度法测鲜样叶片色素含量; 采用硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量[23]; 采用愈创木酚法测定过氧化物酶(POD)活性[23]; 依据SOD抑制NBT (氮蓝四唑)在光下的还原程度来确定超氧化物歧化酶(SOD)活性。活性单位以抑制NBT光化还原的50%为1个酶活性单位(U)[23]。
其他样品收获后经105°C烘箱杀青30 min, 75°C烘干至恒重, 粉碎过筛称其干重。将粉碎样品灰化后使用0.1 mol L–1的HCl溶液浸提, 取滤液用姜黄素比色法测B含量[24]。样品经马弗炉中灰化, 氢氧化钠熔融, 络天青-S显色, 于560 nm测吸光值检测植物根系中Al含量[25]。
选取待测油菜幼苗叶片用溴化钾压片法, 以样片和光谱纯溴化钾1/10的质量比用玛瑙研钵研磨均匀后, 采用美国布鲁克公司生产的VERTEX70型傅里叶变换红外光谱仪测定4000~700 cm–1区域, 扫描32次, 分辨率4 cm–1。样品测定前对背景进行扫描, 得到红外光谱气氛补偿, 排除CO2和H2O的干扰。重复6次。
1.4 数据处理
采用Microsoft Excel软件和Omnic 8.0软件对不同样品的FTIR谱图进行数据处理, 以Origin 8.6 (USA, Origin Lab Corp)作图, 应用统计分析软件SAS 9.1.3对各处理试验数据进行均值、标准差、差异显著性分析。
2 结果与分析
2.1 不同形态B对Al胁迫下油菜幼苗长势的影响
由图1可以看出, 缺B条件下, 植株长势随着Al3+的增加而逐渐降低。油菜幼苗在100 µmol L–1Al3+处理已达被毒害, 200 µmol L–1Al3+处理几乎死亡, 500 µmol L–1Al3+处理已完全死亡。相比缺B处理, BA和SB的添加均明显促进了油菜幼苗的生长。说明B对Al毒有一定的缓解作用。100、200 µmol L–1Al3+处理油菜幼苗并未遭受Al毒, 且200 µmol L–1Al3+处理植株长势明显优于0、100 µmol L–1Al3+处理。500 µmol L–1Al3+处理油菜植株矮小, 叶片暗绿色甚至发黑, 根系伸长明显受到抑制。
2.2 不同形态B对Al胁迫下油菜幼苗株高、根长以及总干鲜重的影响
缺B条件下, 油菜幼苗对Al毒更加敏感, 特别是根系生长首先受到抑制。低Al3+(100 µmol L–1)就能使植株受到Al毒害, 且植株株高、根长以及总干鲜重随Al3+的增加逐渐降低(表1), BA和SB的添加可以显著提高油菜幼苗株高、根长以及总干鲜重。100µmol L–1Al3+处理油菜幼苗株高、根长以及总干鲜重与Al-0相比并无明显差异, 而200 µmol L–1Al3+处理的这3个参数明显高于Al0处理, BA处理则分别增加19.51%、26.39%、63.54%和42.03%; SB处理分别增加21.83%、27.20%、49.56%和31.31%。500 µmol L–1Al3+处理油菜幼苗株高、根长以及总干鲜重相对于Al-0处理均显著降低, 说明高Al毒胁迫下尽管加B对Al毒起到缓解作用, 但还是出现Al毒。0、100、200和500 µmol L–1Al3+胁迫下, 相比于缺B处理, 添加BA根长分别增加了52.15%、101.45%、366.70%和18.73%; 添加SB分别增加了46.80%、133.98%、261.36%和10.77%。

图1 不同形态B对Al胁迫下油菜幼苗长势的影响
BA: 无机态硼酸处理; SB: 有机态山梨醇硼处理。
BA: inorganic boric acid treatment; SB: organic sorbitol boron treatment.

表1 不同形态B对Al胁迫下油菜幼苗株高、根长以及总干鲜重的影响
同一列标以不同小写字母的值处理间在0.05的水平上差异显著。–BA: 0.25 μmol L–1无机态硼酸处理; +BA: 25 μmol L–1无机态硼酸处理; –SB: 0.25 μmol L–1有机态山梨醇处理; +SB: 25 μmol L–1有机态山梨醇处理。
FW: fresh weight; DW: dry weight; TW: total weight; TFW: total fresh weight; TDW: total dry weight; Values followed by different letters are significantly different at<0.05 as determined by LSD. –BA: 0.25 μmol L–1inorganic boric acid treatment; +BA: 25 μmol L–1inorganic boric acid treatment; –SB: 0.25 μmol L–1organic sorbitol boron treatment; +SB: 25 μmol L–1organic sorbitol boron treatment.
2.3 不同形态B对Al胁迫下油菜幼苗根系中B和Al含量的影响
缺B条件下, 各处理之间根系B含量并无明显差异。加BA和SB处理, 根系中B含量显著高于缺B处理, 但两种形态B处理之间B含量并无明显差异(图2)。另外可以明显看出BA和SB处理B含量在200 µmol L–1Al3+处理下均明显高于0、100和500 µmol L–1Al3+处理下, 但差异不显著。无论有无B处理, 根系中Al含量都随着Al3+的增加而逐渐升高, 但相比缺B处理, 加B处理均明显降低Al含量。相对于缺B处理, BA处理根系中的Al含量在100、200和500 µmol L–1Al3+处理下分别降低了62.49%、43.18%和22.86%, SB处理根系中Al含量分别降低了64.74%、79.54%和31.35%。
2.4 不同形态B对Al胁迫下油菜幼苗叶片色素、MDA含量以及抗氧化酶活性的影响
表2表明, 缺B条件下, 100 µmol L–1Al3+处理叶绿素、叶绿素以及类胡萝卜素含量较Al-0处理明显减少。BA和SB处理下, 100 µmol L–1Al3+处理各色素含量相对于缺B处理均显著增加, 200 µmol L–1Al3+处理叶绿素和叶绿素含量明显高于其他Al3+处理, 500 µmol L–1Al3+处理各色素含量均明显低于Al-0处理。
丙二醛(MDA)是植物抗逆性的常用指标。缺B处理下, 100 µmol L–1Al3+处理相对于Al-0处理, 明显引起细胞膜过氧化反应, 导致油菜幼苗叶片中的MDA含量显著升高。Al胁迫对幼苗SOD活性的影响与POD相反, 缺B处理下, 100 µmol L–1Al3+处理相对于Al-0处理叶片中POD活性明显提高而SOD活性显著下降。BA和SB处理明显降低叶片POD活性, 提高SOD活性。100 µmol L–1Al浓度下添加BA和SB较缺B处理MDA含量分别降低了37.69%和40.89%; POD活性分别降低了31.57%和35.03%; SOD活性分别提高了164.45%和193.60%。在0、100和200 µmol L–1Al3+处理之间叶片MDA含量、POD和SOD活性并无明显差异, 但MDA含量及POD活性均显著低于500 µmol L–1Al3+处理, SOD活性显著高于500 µmol L–1Al3+处理。

图2 不同形态B对Al胁迫下油菜幼苗根系中B和Al含量的影响
不同小写字母表示缺B与加B以及不同形态B处理之间的差异在0.05水平上显著。缩写同图1。
Values followed by different letters are significantly different at the 0.05 probability level. Abbreviations are the same as those given in Fig. 1.

表2 不同形态B对Al胁迫下油菜幼苗叶片色素、MDA含量以及抗氧化酶活性的影响
同一列不同小写字母表示处理之间差异显著。缩写同表1。
Values within a column followed by different letters are significantly different at< 0.05 as determined by LSD. Abbreviations are the same as those given in Table 1.
2.5 不同形态B对Al胁迫下油菜幼苗叶片的FTIR图谱分析
图3显示, 不同Al3+浓度处理各特征峰并未出现位移且无新特征峰出现, 只是在1076、1244、1384、1649、2918和3411 cm–1位置出现一定程度的峰强变化, 结合表3红外光谱特征峰归属, 表明Al胁迫油菜幼苗叶片主要物质成分无明显改变, 只是在含量上发生了变化。缺B条件下, 各特征峰吸光度值随Al3+的增加而增加。且1649、2918和3411 cm–1左右特征峰吸光度值在100 µmol L–1和200 µmol L–1Al3+处理下增加比较明显。而在500 µmol L–1Al3+处理下, 1649 cm–1和2918 cm–1吸收峰的吸光度值无明显升高甚至有稍微的下降。BA和SB处理下, 100 µmol L–1和200 µmol L–1Al3+处理的1076、1244、1649、2918和3411 cm–1左右特征峰吸光度值明显低于缺B处理。

图3 不同形态B对Al胁迫下油菜幼苗叶片的4000~700 cm–1FTIR图谱分析
a: +BA Al-0; b: +BA Al-100; c: +BA Al-200; d: +BA Al-500; e: –BA Al-0; f: –BA Al-100; g: –BA Al-200; h: –BA Al-500;
i: +SB Al-0; j: +SB Al-100; k: +SB Al-200; l: + SB Al-500; m: –SB Al-0; n: –SB Al-100; o: –SB Al-200; p: –SB Al-500.

表3 红外光谱特征峰归属表
吸光度值的高低侧面反映此特征峰所代表官能团物质含量的高低。从表4可知, 随着Al3+增加, 各特征峰吸光度值呈上升趋势。1076 cm–1左右特征峰吸光度主要是碳水化合物分子中C-O的伸缩振动, 反映Al毒胁迫下油菜幼苗叶片中可溶性糖等有机物含量的变化。相对于缺B处理, 外源B添加明显降低了可溶性糖等有机物的含量, 100 µmol L–1和200 µmol L–1Al3+处理下, 添加BA吸光度值分别降低了37.80%和49.50%, 添加SB吸光度值分别降低了23.23%和34.17%; 1244 cm–1附近代表了Al毒胁迫下油菜幼苗叶片核酸含量的变化, 100和200 µmol L–1Al3+处理下, 相对于缺B处理, BA处理特征峰吸光度值分别降低了41.12%和52.57%, SB处理分别降低了5.33%和32.73%; 2918 cm–1附近是饱和C-H键的伸缩振动吸收, 主要代表蛋白质、膳食纤维、油脂、磷脂、碳水化合物、维生素和各种膜及细胞壁的组织等成分, 外源B添加显著降低各类物质的含量, 100 µmol L–1和200 µmol L–1Al3+处理下, 相对于缺B处理, BA处理特征峰吸光度值分别降低了51.56%和48.95%, SB处理分别降低了23.99%和35.39%。加B处理下, 500 µmol L–1Al3+处理各特征峰吸光度值有所降低, 但均明显高于100 µmol L–1和200 µmol L–1Al3+处理。
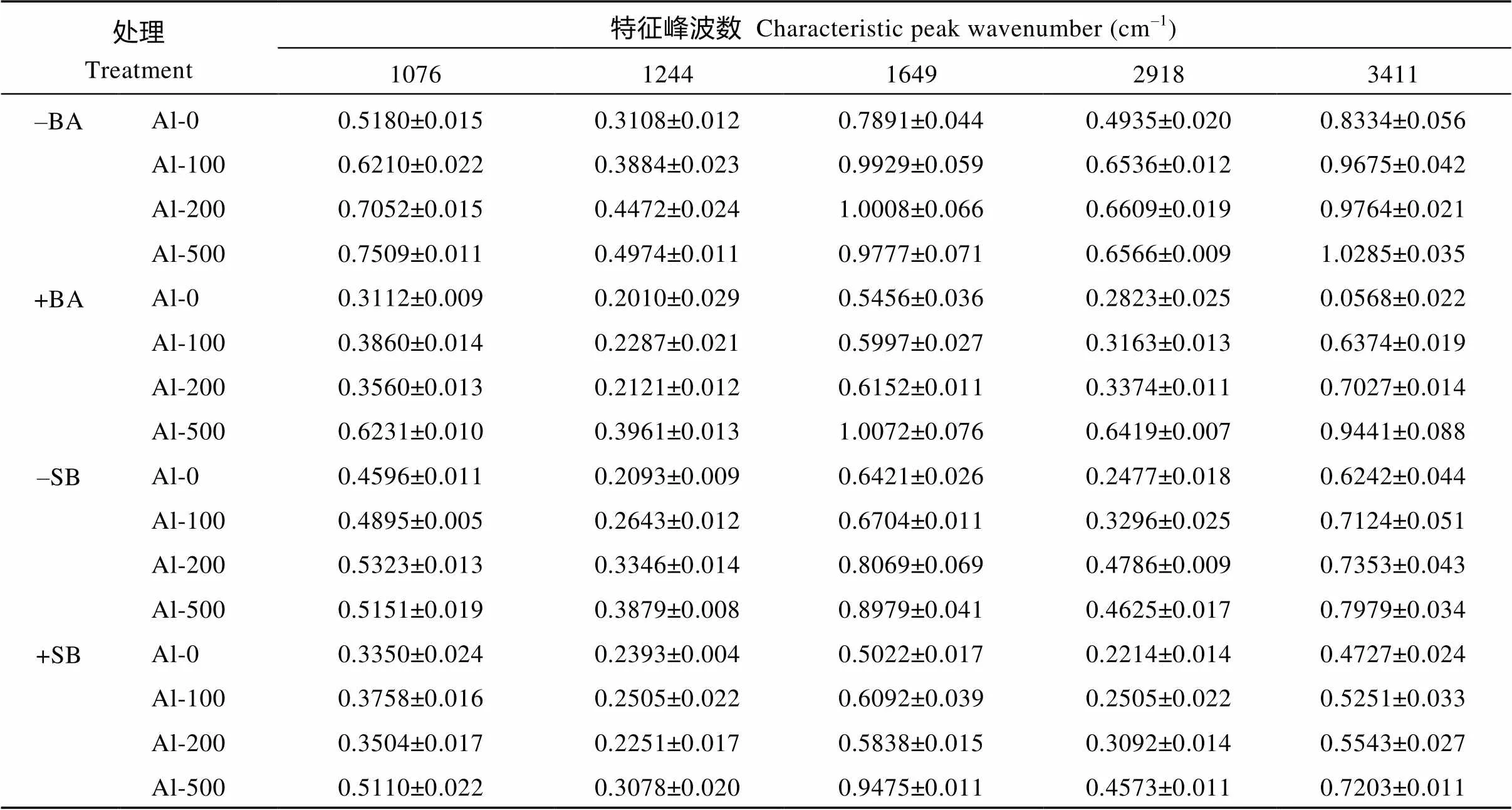
表4 不同形态B对Al胁迫下油菜幼苗叶片的4000~700 cm–1FTIR图谱特征峰吸光度值
缩写同表1。Abbreviations are the same as those given in Table 1.
3 讨论
3.1 不同形态B对Al胁迫下油菜幼苗表型、生理特性及根系Al含量的影响
Al毒对植物的影响首先表现在最早与Al源接触的根部, Al毒胁迫下根尖细胞透性增加、细胞结构破坏, 并显著降低根部生物量[26]。试验结果表明, Al毒胁迫下油菜幼苗生物量、色素含量逐渐降低, MDA含量、POD活性明显升高, 且由于保护酶对活性氧的清除能力降低, 已不能阻止自由基在细胞内的积累, 导致膜系统的伤害, 这时细胞内多种功能受到破坏, 造成生理代谢紊乱[27], 使得SOD活性明显下降。BA和SB处理可以明显缓解Al毒导致的油菜幼苗株高、根长、总干鲜重以及色素含量的降低, 同时BA和SB处理降低油菜幼苗细胞膜脂过氧化水平, 加强了清除O2–的能力, 通过调节活性氧代谢使细胞膜结构维持稳定, 有效减轻Al对油菜幼苗的毒害从而降低了MDA含量、POD活性, 增加了SOD活性。张芬琴等[28]研究表明, Al毒胁迫下外源B的添加不同程度提高小麦幼苗干物质积累, 同时添加外源B之后可以降低因Al毒导致的小麦幼苗中MDA含量的升高, 对Al毒有一定的缓解作用[28]。
不同形态B (BA和SB)处理油菜幼苗在200 µmol L–1Al3+处理下长势、生物量及色素含量均高于其他处理, 可能外源B的添加增加了植物体内阳离子浓度而降低Al3+离子的活度, 并通过与Al3+离子直接竞争结合位点消除或缓解Al3+离子的毒害[20, 28]。同时200 µmol L–1Al3+处理下B含量明显高于0、100和200 µmol L–1Al3+处理, 可能也是在200 µmol L–1Al浓度下油菜幼苗长势最好的原因。Yang等[29]还发现在低Al (2 mmol L–1)胁迫下, B可明显地提高包括根长在内的生长特性而缓解Al毒, 但在5 mmol L–1Al毒胁迫下, 根长的抑制并没有因为B的存在而缓解。本试验结果也显示, 加B条件下, 相对于0、100和200 µmol L–1Al3+处理, 500 µmol L–1Al3+处理油菜幼苗株高、根长、总干鲜重以及色素含量明显降低, 并引起活性氧代谢紊乱, 油菜幼苗质膜稳定性产生了明显的破坏, 使得油菜幼苗叶片MDA含量、POD活性明显升高, SOD活性明显下降。说明高浓度(500 µmol L–1) Al毒胁迫下加B能起到缓解作用, 但是由于Al浓度过高使植株受到Al毒害。另外, 相比缺B处理, 500 µmol L–1Al3+处理下BA处理油菜幼苗株高、根长、总干鲜重分别提高了300%、18.73%、1016.67%和577.14%; SB处理分别提高271.60%、10.77%、475.00%和324.39%, 说明高Al处理下, BA的添加对Al毒缓解效果优于SB。
BA和SB处理明显降低油菜幼苗根系中的Al含量, 且100、200和500 µmol L–1Al浓度胁迫下SB处理根系中Al含量降低趋势优于BA处理, 可能是有机态SB相比BA处理能提高植物中B含量[17], 而B与果胶RG-II交联减小了细胞壁孔径[30]或促进果胶二聚体形成, 屏蔽了Al在果胶上的结合位点以降低根系中Al3+含量[31]。
3.2 不同形态B对Al胁迫下油菜幼苗叶片的FTIR图谱分析
FTIR技术可以帮助判断分子中含有何种官能团, 更重要的是可比较不同处理的样品的红外光谱差异, 从而反映样品在植物化学组成上的差异程度[32]。蛋白质是研究逆境植物生理中的重要指标之一, 在干旱、Al毒等胁迫下, 细胞内可溶性糖含量就会随之增加, 同时可诱导细胞内可溶性糖及核酸类物质的产生[33]。本研究发现, 缺B条件下, 1076 cm–1和1244 cm–1特征峰吸光度值随Al3+增加而增加。1649、2918和3411 cm–1特征峰吸光度值在100 µmol L–1和200 µmol L–1Al3+处理下表现为明显增加趋势。可能是Al刺激下, 细胞产生了大量的蛋白质、多糖和脂类等物质用于细胞壁和细胞膜, 以抵抗和适应Al毒胁迫[33], 同时Al3+诱导了几种基因的表达, 增加原始蛋白质的合成, 或是高浓度Al3+诱导抗Al蛋白所致[34]。张亚楠等也指出荞麦根、茎和叶的FTIR特征峰值随着Al3+的升高而增加[33], 与本研究结果相似。Al毒胁迫对油菜幼苗叶片的物质代谢产生了很大的影响, 需要产生更多的酶类、氨基酸、碳水化合物等来缓解Al胁迫[35]。BA和SB处理下, 100 µmol L–1和200 µmol L–1Al毒胁迫油菜幼苗叶片FTIR特征峰强度与Al0相比并无明显差异, 但明显低于缺B处理。原因是B对植物体内可溶性糖的运输必不可少, 同时B是合成含氮碱基的尿嘧啶必需之物, 而尿嘧啶二磷酸葡萄糖(UDPG)是蔗糖合成的前体, 所以B有利于蔗糖合成和糖的外运, 从而降低Al胁迫下油菜幼苗叶片中的可溶性糖含量[36]。
4 结论
Al毒胁迫下, 不同形态B (BA和SB)的添加显著提高了油菜生物量、色素含量和SOD活性, 降低了根系Al含量、叶片MDA含量和POD活性, 缓解了Al毒胁迫。Al毒胁迫下油菜幼苗叶片中低聚糖、核酸和蛋白质等含量明显上升, 而外源添加BA和SB处理的幼苗叶片中低聚糖、核酸和蛋白质含量均降低, 进一步说明BA和SB能明显缓解Al毒, 且BA处理对Al毒的缓解效果优于SB处理。因此农业生产中我们可以通过添加外源B以降低植株体内Al含量以及糖类、核酸和蛋白质含量从而缓解Al毒害, 促进植株的生长。
[1] Delhaize E, Ryan P R. Aluminum toxicity and tolerance in plants., 1995, 107: 315–321
[2] Kochian L V. Cellular mechanisms of aluminum toxicity and resistance in plants., 2003, 46: 237–260
[3] 沈仁芳. Al在土壤-植物中的行为及植物的适应机制. 北京: 科学出版社, 2008. pp 75–79 Shen R F. The Behavior of Aluminum in Soil Plants and the Adaptation Mechanism of Plants. Beijing: Science Press, 2008. pp 75–79 (in Chinese)
[4] 肖厚军, 王正银, 何桂芳, 苟久兰. 贵州黄壤Al形态及其影响因素研究. 土壤通报, 2009, 40: 1044–1048 Xiao H J, Wang Z Y, He G F, Gou J L. Aluminum forms and their effect factors in yellow soils in Guizhou., 2009, 40: 1044–1048 (in Chinese with English abstract)
[5] 应小芳, 刘鹏, 徐根娣. 土壤中的Al及其植物效应的研究进展. 生态环境学报, 2003, 12: 237–239 Ying X F, Liu P, Xu G D. The advance in the research of aluminum in soil and its influence on plant., 2003, 12: 237–239 (in Chinese with English abstract)
[6] 刘鹏, 徐根娣, 姜雪梅, 应小芳. Al对大豆幼苗膜脂过氧化和体内保护系统的影响. 农业环境科学学报, 2004, 23: 51–54 Liu P, Xu G D, Jiang X M, Ying X F. Effects of aluminum on membrane lipid peroxidation and endogenous protective systems of soybean seedling., 2004, 23: 51–54 (in Chinese with English abstract)
[7] 蔡妙珍, 刘鹏, 徐根娣, 吕庭君. 钙、硅对Al胁迫下荞麦光合生理的影响. 水土保持学报, 2008, 22(2): 206–208 Cai M Z, Liu P, Xu G D, Lyu T J. Effect of calcium and silicon on photosynthetic physiology of buckwheat under aluminum stress., 2008, 22(2): 206–208 (in Chinese with English abstract)
[8] 韩配配, 秦璐, 李银水, 廖祥生, 徐子先, 余常兵, 胡小加, 谢立华, 廖红. 不同营养元素缺乏对甘蓝型油菜苗期生长和根系形态的影响. 中国油料作物学报, 2016, 38: 88–97 Han P P, Qin L, Li Y S, Liao X S, Xu Z X, Yu C B, Hu X J, Xie L H, Liao H. Effects of different nutrient deficiencies on growth and root morphological changes of rapeseed seedlings (L)., 2016, 38: 88–97 (in Chinese with English abstract)
[9] 杨国会, 王莉莹, 刘伟, 王一. 铝毒对大豆根系生长的影响. 安徽农业科学, 2009, 37: 1439–1440 Yang G H, Wang L Y, Liu W, Wang Y. Effects of aluminum toxicity on growth of soybean root., 2009, 37: 1439–1440
[10] 许苗苗, 喻敏, 王昌全, 徐彩娟, 萧洪东, 冯英明. 硼对豌豆根尖铝毒的影响. 土壤, 2007, 39(6): 154–157 Xu M M, Yu M, Wang C Q, Xu C J, Xiao H D, Feng Y M. Influence of boron on aluminum toxicity in root tip of pea ().,2007, 39(6): 154–157 (in Chinese with English abstract)
[11] Blevins D G, Lukaszewski K M. Boron in plant structure and function.1998, 49: 481–500
[12] Lenoble M E, Blevins D G, Sharp R E, Cumbie B G. Prevention of aluminum toxicity with supplemental boron. I. Maintenance of root elongation and cellular structure., 1996, 19: 1132–1142
[13] 王志颖, 刘鹏, 李锦山, 吴慧芳, 刘莹, 芦伯鑫. 铝胁迫下外源有机酸对油菜根系形态及叶绿素荧光特性的影响. 江苏农业学报, 2011, 27: 756–762 Wang Z Y, Liu P, Li J S, Wu H F, Liu Y, Lu B X. Effects of exogenous organic acids on root morphology and chlorophyll fluorescence characteristics of oilseed rape under aluminum stress., 2011, 27: 756–762 (in Chinese with English abstract)
[14] Yang Y H, Zhang H Y. Boron amelioration of aluminum toxicity in mungbean seedlings., 1998, 21: 1045–1054
[15] Yu M, Shen R F, Xiao H D, Xu M M, Wang H Z, Wang H Y, Zeng Q L, Bian J F. Boron alleviates aluminum toxicity in pea ()., 2009, 314: 87–98
[16] 徐建明, 汪鑫, 罗玉明, 李师默, 孙国荣, 陈刚. 两种形态硼对小麦幼苗叶绿素荧光参数保护酶活性的影响. 华北农学报, 2010, 24(2): 149–155 Xu J M, Wang X, Luo Y M, Li S M, Sun G R, Chen G. Effects of two forms of boron on antioxidant enzymes and chlorophyll fluorescence parameters of wheat seedlings., 2010, 24(2): 149–155 (in Chinese with English abstract)
[17] 段蔚. 多元醇络合硼对油菜幼苗生长及营养元素吸收的功效. 南京农业大学硕士学位论文, 江苏南京, 2012 Duan W. Effects of Polyol-Chelated Boron Fertilizers on Seedling growth and Uptake of Mineral Nutrients in Rape. MS Thesis of Nanjing Agricultural University, Nanjing, China, 2012 (in Chinese with English abstract)
[18] 薛生国, 朱锋, 叶晟, 王钧, 吴雪娥. 紫茉莉对铅胁迫生理响应的FTIR研究. 生态学报, 2011, 31: 6143–6148 Xue S G, Zhu F, Ye C, Wang J, Wu X E. Physiological response ofLinn. to lead stress by FTIR spectroscopy.2011, 31: 143–6148 (in Chinese with English abstract)
[19] 龚宁, 李荣华, 孟昭福, 杨公明. Cd对小白菜萌发生理影响的FTIR-ATR研究. 农业环境科学学报, 2010, 29(1): 9–14 Gong N, Li R H, Meng Z F, Yang G M. Physiological response ofLseeds in germination to cadmium toxicity by FTIR-ATR pectroscopy., 2010, 29(1): 9–14 (in Chinese with English abstract)
[20] 金婷婷, 刘鹏, 张志祥, 徐根娣, 赵莉莉. 外源柠檬酸缓解大豆根系短期Al胁迫的FTIR特征分析光谱学与光谱分析. 光谱学与光谱分析, 2009, 29: 367–371 Jin T T, Liu P, Zhang Z X, Xu G D, Zhao L L. Analysis of roots of soybean (Merrill) treated with exogenous citric acid plus short-time aluminum stress by direct determination of FTIR spectrum., 2009, 29: 367–371 (in Chinese with English abstract)
[21] 张子龙, 李加纳, 唐章林, 谌利, 王瑞. 环境条件对油菜品质的调控研究. 中国农学通报, 2006, 22(2): 124–124 Zhang Z L, Li J N, Tang Z L, Chen L, Wang R. The research progress of the effect of environmental factors on quality characters of rapeseed., 2006, 22(2): 124–124 (in Chinese with English abstract)
[22] 余礼明, 吴谋成. 油菜籽脱壳与分离设备研究注. 中国粮油学报, 2002, 17(5): 40–43 Yu L M, Wu M C. Developing equipment for dehulling and separation of rapeseed., 2002, 17(5): 40–43 (in Chinese with English abstract)
[23] 王学奎.植物生理生化实验原理和技术(第2版).北京: 高等教育出版社, 2006. pp 167–280Wang X K. Principles and Techniques of Plant Physiological Biochemical Experiment, 2nd edn. Beijing: Higher Education Press, 2006. pp 167–280 (in Chinese)
[24] 鲍士旦. 土壤农化分析(第3版). 北京: 中国农业出版社, 2000. pp 276–278Bao S D. Soil and Agricultural Chemistry Analysis, 3rd edn. Beijing: China Agriculture Press, 2000. pp 276–278 (in Chinese)
[25] 攸玉仙. 植物样品中Al的测定. 物探与化探, 1997, 21: 475–477 You Y X. Determining aluminum of plant specimen., 1997, 21: 475–477 (in Chinese with English abstract)
[26] Delhaize E. Uptake on environmental stress: aluminum toxicity and tolerance in plants.1995, 107: 315–321
[27] 徐芬芬. 柠檬酸对Al胁迫下大豆根系生长和生理特性的影响. 生物加工过程, 2015, (4): 75–78 Xu F F. Effects of citric acid on root growth and physiological characteristics of soybean under aluminum stress, 2015, (4): 75–78 (in Chinese with English abstract)
[28] 张芬琴, 徐新建. 外源硼对Al胁迫小麦幼苗的缓解效应. 植物生理学通讯, 2001, 37(1): 21–24 Zhang F Q, Xu X J. Mitigative effect of exogenous boron on the wheat seedlings under aluminum stress., 2001, 37(1): 21–24 (in Chinese with English abstract)
[29] Yang Y H, Gu H J, Fan W Y, Abdullahi B A. Effects of boron on aluminum toxicity on seedlings of two soybean cultivars., 2004, 154: 239–248
[30] Heidarabadi M D, Ghanati F, Fujiwara T. Interaction between boron and aluminum and their effects on phenolic metabolism ofLroots., 2011, 49: 1377–1383
[31] 李梅, 喻敏. 硼对果胶Al吸附解吸特性的影响. 中国农业科学, 2013, 46: 1595–1602 Li M, Yu M. Characteristics of adsorption and desorption of aluminum in pectin as influenced by boron., 2013, 46: 1595–1602 (in Chinese with English abstract)
[32] 王成, 蒋泽平, 李文青, 邵文静, 张婷, 季峻峰. FTIR-NIR研究镉胁迫对构树试管幼苗生长的影响与机理. 农业环境科学学报, 2014, 33: 673–679 Wang C, Jiang Z P, Li W Q, Shao E J, Zhang T, Ji J F. FTIR-NIR spectrum study on response and mechanism ofsprout under cadmium stresses.2014, 33: 673–679 (in Chinese with English abstract)
[33] 张亚楠, 王赢, 陈奇, 黄庶识, 李昆志. 不同品种荞麦耐Al性的FTIR鉴别. 浙江大学学报(农业与生命科学版), 2010, 36: 683–690 Zhang Y N, Wang Y, Chen Q, Huang S S, Li K Z. Endurance determination of different buckwheat cultivars to aluminum by FTIR spectrum.(Agric Life Sci Edn), 2010, 36: 683–690 (in Chinese with English abstract)
[34] Snowden K C, Richards K D, Gardner R C. Aluminum induced genes induction by toxic metals, low-calcium, and wounding and pattern of expression in root tips., 1995, 107: 341–348
[35] Yang Q S, Wang Y Q, Zhang J J. Identification of aluminum- responsive proteins in rice roots by a proteomic approach: cysteine synthase as a key player in Al response., 2007, 7: 737
[36] 张争艳, 刘鹏, 陈微微, 陈传奇, 贾佳. 不同品种大豆耐Al性的FTIR分析研究. 光谱学与光谱分析, 2009, 29: 372–377 Zhang Z Y, Liu P, Chen W W, Chen C Q, Jia J. FTIR study of the endurance to Al of different soybean cultivars.,2009, 29: 372–377 (in Chinese with English abstract)
Mitigative Effect of Different Forms of Boron on Aluminum Toxicity of Rape Seedlings and Its FTIR Characteristics
YAN Lei, JIANG Cun-Cang*, Muhammad Riaz, WU Xiu-Wen, LU Xiao-Pei, DU Chen-Qing, and WANG Yu-Han
Institute of Resource and Environmental Sciences, Huazhong Agricultural University, Wuhan 430070, China
An experiment was conducted in hydroponics using rape cultivar Cao 221167. Two treatment of Boron (B), inorganic borate (BA) and organic boron sorbitol (SB) along with different concentrations of Al3+(0, 100, 200, and 500 µmol L–1). The effects of different forms of B on activities of antioxidant enzyme of leaves in rape seedlings were studied, and the changes of leaf component were analyzed by Fourier Transform Infrared Spectroscopy (FTIR) technique. Under Al toxicity, the addition of BA or SB could alleviate Al toxicity in plant, and significantly increase plant biomass and root length. The root length increased by 52.15%, 101.45%, 366.70%, and 18.73% in BA treatments and 46.80%, 133.98%, 261.36%, and 10.77% in SB treatments under 0, 100, 200, and 500 µmol L–1Al3+toxicity stress, respectively. B treatments increased pigment content and SOD activity and reduced contents of Al, MDA, and POD activity. Under the addition of boron (BA or SB), the growth, biomass and pigment content of rape seedlings were higher in 200 µmol L–1Al3+treatment than in other treatments. In the 500 µmol L–1Al3+treatment, biomass and pigment content of rape seedling were significantly lower than those without Al application. The results from FTIR indicated that the contents of protein and oligosaccharide in leaves of rape seedling significantly increased under Al toxicity, however, significantly decreased when was added boron (BA or SB). In conclusion, the addition of different forms of B (BA or SB) could alleviate Al toxicity and the effect of BA is better than that of SB. The information provided by this study will facilitate alleviating Al toxicity in plant through applying a kind of B fertilizer in agricultural production.
Rape; Different forms of boron; Aluminum toxicity stress; FTIR; Mitigation effect
10.3724/SP.J.1006.2017.01817
本研究由国家自然科学基金项目(41271320)资助。
This study was supported by the National Natural Science Foundation of China (41271320).
姜存仓, E-mail: jcc2000@mail.hzau.edu.cn
E-mail: 421655346@qq.com
2017-03-06; Accepted(接受日期): 2017-07-19; Published online(网络出版日期): 2017-08-07.
http://kns.cnki.net/kcms/detail/11.1809.S.20170807.1816.004.html
