结核抗体蛋白芯片技术与TB-IGRA对结核病活动度及疗效的监测价值*
2018-01-15冯英凯黄正谷赵小莉
冯英凯,王 勇,黄正谷,赵小莉,刘 英
(1.重庆市中医院道门口院部呼吸内科 400011;2.重庆市公共卫生医疗救治中心普内科 400036;3.重庆市公共卫生医疗救治中心检验科 400036;4.重庆市结核病防治所 400050)
结核病防控形势依然严峻[1]。由于抗结核疗程较长,结核化疗药物不良反应严重,部分患者服药依从性较差,特别是西部欠发达地区,经济及文化落后,患者往往一旦自觉症状改善即自行停药,导致治疗失败或产生耐药。同时,活动性结核不使用或非正规使用抗结核药物,容易导致结核播散、病情恶化,产生呼吸衰竭等一系列并发症,而无指征盲目使用抗结核药物或对耐药结核使用常规抗结核治疗,可造成药物资源浪费,加重患者经济负担,更严重的是,抗结核药长期大剂量使用所致的肝、肾损害等不良反应严重损害机体,甚至摧毁机体免疫系统,危及生命。探寻与结核活动度及疗效相适应的预警指标,实时监测结核病情变化与治疗效果,对提高结核治愈率、减少复发率具有重要的现实意义。
本研究前期对蛋白芯片技术、γ-干扰素释放试验(TB-IGRA)、TB DNA的聚合酶链反应检测法(TB-PCR)、集菌涂片法、结核菌培养法等几种常用的结核监测指标进行平行对比分析,以筛选理想的结核病活动度及疗效的监测指标。结果提示,蛋白芯片技术和TB-IGRA作为诊断结核灵敏度及特异度均较高的检测技术,二者取长补短,优势互补,可用于抗结核疗效监测的备选方法(另文发表)。本研究将应用蛋白芯片技术、TB-IGRA比较抗结核疗程中不同时相点检测阳性率的动态变化,并与集菌涂片法结果进行同步比较分析,以明确上述两项检测技术对结核病活动度和疗效的监测价值。现报道如下。
1 资料与方法
1.1一般资料 收集2013年7月至2016年7月在重庆市公共卫生医疗救治中心门诊及住院的结核病患者655例,其中男372例、女283例,平均年龄(40.29±12.47)岁。所有病例均依据病史、临床表现、细菌学、影像学、病理检查或抗结核治疗有效而明确诊断。其中肺结核患者432例,作为肺结核组;肺外结核患者146例,含结核性胸膜炎94例、结核性腹膜炎21例、结核性心包炎4例、结核性脑膜炎3例、淋巴结核9例、骨关节结核9例、肾结核6例,作为肺外结核组;肺结核并肺外结核77例,含结核性胸膜炎35例、结核性腹膜炎3例、淋巴结结核25例、骨关节结核14例。选择同期非结核病患者248例作为非结核对照组,其中男125例,女123例;平均年龄(42.20±12.20)岁;急性扁桃体炎21例,急性支气管炎65例,肺炎35例,泌尿系感染40例,慢性支气管炎13例,慢性阻塞性肺疾病56例,支气管扩张18例。所有研究对象均无HIV感染、妊娠、使用免疫抑制剂或增强剂。结核组与非结核对照组间性别、年龄差异无统计学意义(P>0.05),具有可比性。
1.2仪器与试剂 PBT-X2蛋白芯片阅读仪及结核分枝杆菌IgG抗体检测试剂盒(蛋白芯片)(南京大渊生物技术工程有限公司);人结核分枝杆菌γ-干扰素(TB-IGRA)酶联免疫分析试剂盒(QuantiFERON-TB Gold,德国凯杰公司)。
1.3方法
1.3.1治疗方法 初治行2HRZE/4H3R3方案,即强化期:异烟肼(H)、利福平(R)、吡嗪酰胺(Z)和乙胺丁醇(E),顿服,2个月;巩固期:异烟肼(H)、利福平(R),每周3次,4个月;观察期间复发者用2SHRZE/6H3R3E3方案,即强化期:链霉素(S)、异烟肼(H)、利福平(R)、吡嗪酰胺(Z)和乙胺丁醇(E),2个月;巩固期:异烟肼(H)、利福平(R)和乙胺丁醇(E),每周3次,6个月。治疗前及初治满1~6个月每月、复治满2~8个月每2个月、治疗结束后6个月、12个月留取肺结核、肺外结核相应标本(静脉血、痰液、胸腔积液、关节液等)。治疗前、治疗过程中及治疗结束后6个月、12个月标本行蛋白芯片技术、TB-IGRA、集菌涂片法平行检测。
1.3.2标本采集 根据不同的结核类型,采集不同标本,如血清、痰液、支气管肺泡灌洗液(BALF)、骨髓液、淋巴结、脓液、尿液、胸腔积液等。血标本采集:以真空采血管抽取清晨空腹静脉血4 mL,于3 000 r/min下离心3 min,分离血清,新鲜血清标本在2~8 ℃环境下存放不超过48 h,长期保存的标本在-20 ℃以下冻存,避免反复冻融。每例患者收集3份痰标本(当日即时痰、夜间痰、次日晨痰)。采集的胸腔积液、腹水、关节液,经离心(13 000 r/min,5 min),使纤维蛋白原等干扰成分分离,取上清液检测或保存于-40 ℃冰箱内,1周内检测。
1.3.3结核蛋白芯片技术 遵照结核分枝杆菌IgG抗体检测试剂盒(蛋白芯片)说明书提供的标本要求和试验方法进行操作。
1.3.4TB-IGRA检测 遵照人结核分枝杆菌γ-干扰素(TB-IGRA)酶联免疫分析试剂盒使用说明书进行。结果判定标准:设定待测样品孔(T)水平值=a,空白孔(N)水平值=b,标准孔(P)水平值=c。若b≤400,试验有意义;当a-b≥14,并且≥25%b,不管c-b为任何值,均为阳性;当a-b≥14,但<25%b,或<14时,此时c-b≥20均为阴性;若a-b<14,c-b<20或a-b≥14,但<25%b,且c-b<20时,试验结果为不确定。最后结果以阳性、阴性及不确定3种定性方式表达。
1.3.5集菌涂片法检测 按文献[2]应用萋-尼法进行抗酸染色。
1.4统计学处理 采用SPSS17.0软件进行统计学处理。计数资料以百分率或例数表示,组间比较采用χ2检验;以P<0.05为差异有统计学意义。
2 结 果
2.1两种检测方法在抗结核治疗中阳性率的动态变化比较 结果如表1和图1、图2所示。研究结果表明,随着抗结核治疗的进行,蛋白芯片技术和TB-IGRA检出阳性率均呈下降趋势。蛋白芯片技术阳性率在初治满3个月前均低于TB-IGRA,在初治满4个月时开始下降,但下降幅度低于TB-IGRA,此后下降幅度逐渐增大,在治疗结束后6个月时阳性率仍高达18.78%,治疗结束后12个月时阳性率仍为15.27%。TB-IGRA阳性率在初治满2个月时即有明显下降,下降幅度高于蛋白芯片技术,在复治满8个月时阳性率降至8.85%,治疗结束后6个月时阳性率降至6.26%,治疗结束后12个月时阳性率降至3.82%,明显低于同时相点蛋白芯片技术。
2.2蛋白芯片技术和TB-IGRA 两种检测方法与涂片结果的符合情况比较 蛋白芯片技术与TB-IGRA 两种检测方法与涂片阳性结果的符合情况见表2、图3所示。在初治满4个月之前,蛋白芯片技术与涂片结果的诊断符合率明显高于TB-IGRA,差异有统计学意义(P<0.05),在初治满5个月时略下降,之后,随着疗程的进展,蛋白芯片技术与涂片结果的诊断符合率逐渐增高,但幅度均低于TB-IGRA。TB-IGRA与涂片结果的诊断符合率在初治满3个月前较低,此后随着疗程的进展,诊断符合率逐渐增高。

表1 两种检测方法在抗结核治疗中阳性率的动态变化比较[n(%)]
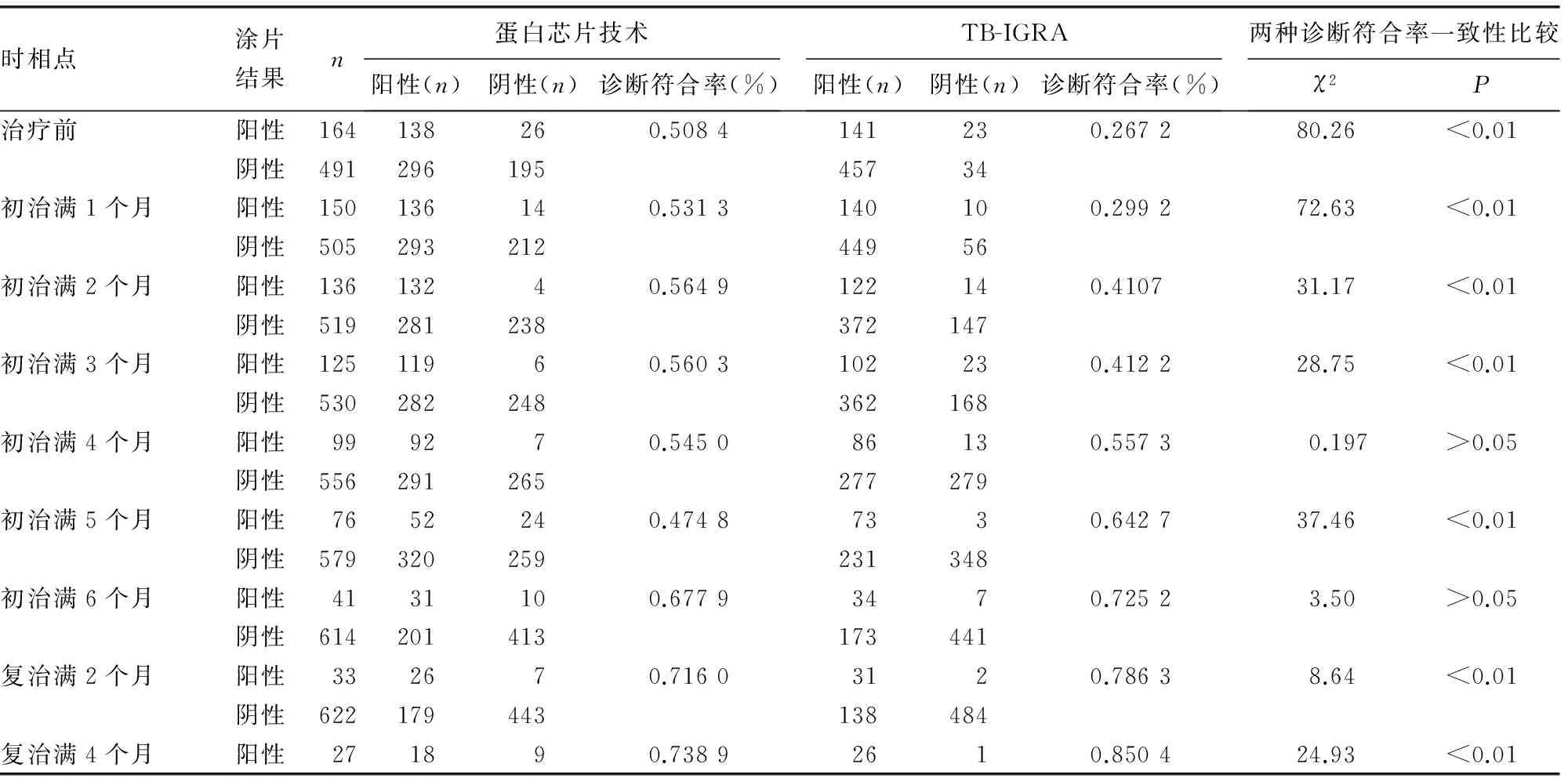
表2 蛋白芯片技术和TB-IGRA检测结果与涂片结果的符合情况比较

续表2 蛋白芯片技术和TB-IGRA检测结果与涂片结果的符合情况比较

图1 两种检测方法在抗结核治疗中阳性率的动态变化

图2 两种检测方法在抗结核治疗中阳性率的变化趋势
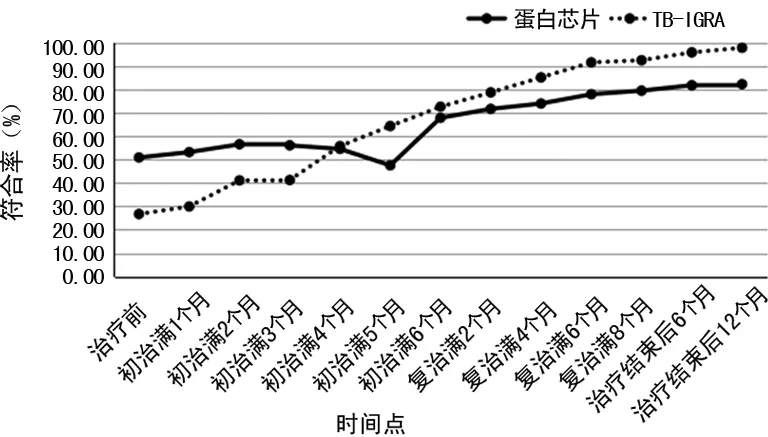
图3 两种检测方法与涂片结果的诊断符合率比较
3 讨 论
目前国内外学者对结核病疗效监测技术和指标做了大量的研究[2]。最经典的肺结核疗效判定方法为痰或呼吸道分泌物涂片抗酸杆菌检查、传统改良罗氏培养法、红细胞沉降率、结核菌素试验及胸部X线片检查。但这些方法有其不足之处,如体内细菌数量的测定时间耗费太长,红细胞沉降率特异性差,结核菌素试验无法区别既往及现患结核,X线片检查缺乏明确的评价标准等。除了上述传统的痰菌法、胸部X线片检查、结核菌素试验等,近年来,如核酸检测技术、生物蛋白芯片技术、基因芯片技术、RNA恒温扩增实时检测技术[3-4]等新兴的实验室诊断技术已逐步应用于结核病的临床诊断领域,其中蛋白芯片技术及干扰素释放试验[5-6]值得关注。
脂阿拉伯甘露糖(LAM)抗原是一种与分枝杆菌细胞壁有关的复合糖脂类,正在生长的结核分枝杆菌能大量产生。约有75%的人群感染结核菌后会产生针对LAM的特异性抗体。结核分枝杆菌38 000抗原与16 000抗原是结核分枝杆菌所特有的抗原,它与其他分枝杆菌和非结核分枝杆菌不存在交叉反应,其诊断的特异性度较高。蛋白芯片技术即是采用上述3种抗原通过检测血清中相应抗体(结核菌蛋白LAM、16 000和38 000特异性抗体),对结核病患者作出早期诊断。
结核分枝杆菌感染引起的细胞免疫属于带菌免疫,当人或动物感染了结核分枝杆菌后,具有免疫活性的T淋巴细胞(效应记忆T淋巴细胞)识别ESAT-6及CFP-10,并产生高水平的γ-干扰素,γ-干扰素能特异性地反映机体结核分枝杆菌的感染情况。该效应记忆T淋巴细胞只在人体内存在结核分枝杆菌时产生,当结核病治愈后即消失,故抗原特异性IFN-γ体外释放测定只与体内结核分枝杆菌负荷量即结核活动性呈正相关,而不受既往结核感染的影响,从而成为评估抗结核治疗疗效的理想指标[7-9]。
本研究在前期试验的基础上,对比分析了蛋白芯片技术、TB-IGRA在抗结核疗程中不同时相点检测阳性率的动态变化,并与集菌涂片法结果进行同步比较。本研究采用的蛋白芯片技术与TB-IGRA选用不同类型的结核菌抗原(蛋白芯片技术选用结核菌蛋白LAM、重组16 000和38 000抗原;TB-IGRA选用ESAT-6及CFP-10),针对机体不同的免疫状态,采用不同的测定原理,对抗结核疗程中不同时相点的疗效进行评估,推测二者有良好的互补作用。
结果显示,随着抗结核治疗的进行,蛋白芯片技术和TB-IGRA检出阳性率均呈下降趋势。蛋白芯片技术阳性率在初治满3个月前均低于TB-IGRA,在初治满4个月时开始下降,但下降幅度低于TB-IGRA,此后下降幅度逐渐增大,在治疗结束后6个月时阳性率仍高达18.78%,治疗结束后12个月时阳性率仍为15.27%。TB-IGRA阳性率在初治满2个月时即有明显下降,下降幅度高于蛋白芯片技术,在复治满8个月时阳性率降至8.85%,治疗结束后6个月时阳性率降至6.26%,治疗结束后12个月时阳性率降至3.82%,明显低于同时相点蛋白芯片技术。在初治满4个月之前,蛋白芯片技术与涂片结果的诊断符合率高于TB-IGRA,在初治满5个月时略下降,之后随着疗程的进展,蛋白芯片技术与涂片结果的诊断符合率逐渐增高,但幅度均低于TB-IGRA。TB-IGRA与涂片结果的诊断符合率在初治满3个月前较低,此后随着疗程的进展,诊断符合率逐渐增高。提示蛋白芯片技术与TB-IGRA对结核疗效均有监测价值,初治满4个月之前,蛋白芯片技术监测价值高于TB-IGRA;初治满4个月之后,蛋白芯片技术监测价值低于TB-IGRA。经结果分析,蛋白芯片技术监测疗效,其阳性率下降有一定的滞后性,但在结核病早期与集菌涂片法的诊断符合率较高,表明蛋白芯片技术在抗结核早期监测价值较高,TB-IGRA的高灵敏度弥补了蛋白芯片技术阳性率低的不足;而在抗结核治疗中、后期,TB-IGRA与集菌涂片法的诊断符合率较高,其监测价值更高。
总体而言,虽然蛋白芯片技术阳性率随治疗的进行、疗程的推进有逐渐下降趋势,但对结核病早期疗效判定存在滞后性;另一方面,结核菌蛋白LAM、16 000和38 000特异度抗体在血中持续时间较长(9~12个月),即使结核病已然治愈(阴转治愈或满疗程),蛋白芯片技术仍部分为阳性,即不能同步反映恢复期疗效,所以其对抗结核治疗疗效的监测有参考作用,但价值有限。TB-IGRA灵敏度和特异度高,阴性基本排除结核,阳性提示患者目前处于结核感染的状态,但是不可区分潜伏和活动,诊断潜伏性结核有一定局限性,阳性结果需要结合临床,单一指标阳性不足以诊断结核病或判定抗结核疗效。且IGRAs对试验技术和试验条件要求较高,价格昂贵,操作程序复杂,标本检测时限短,难以实现高通量,因而限制了其在中低收入国家的应用[10]。
综上所述,蛋白芯片技术与TB-IGRA各有优缺点,二者结合有良好的互补效应,蛋白芯片技术与TB-IGRA联合检测对结核病活动度评估和抗结核疗效监测有较高的临床价值。
[1]MESQUITA E D,GIL-SANTANA L,RAMALHO D,et al.Associations between systemic inflammation,mycobacterial loads in sputum and radiological improvement after treatment initiation in pulmonary TB patients from Brazil:a prospective cohort study[J].BMC Infect Dis,2016,16:368-372.
[2]陆震宇,杨明芳,陈纬.结核病实验室诊断技术评价及其研究进展[J].中国卫生检验杂志,2017,27(2):301-304.
[3]申明莉,王玉华.SAT技术用于快速检测肺结核的临床意义[J].中国继续医学教育,2016,8(9):18-19.
[4]王静,刘立宾,岳永宁,等.RNA 恒温扩增实时检测技术与荧光定量 PCR联合检测肺泡灌洗液对痰涂阴性肺结核的快速诊断价值[J].中华医院感染学杂志,2017,27(2):300-304.
[5]王长征,张平安,梅冰,等.γ-干扰素释放试验在肺结核诊断中的应用[J].公共卫生与预防医学,2015,26(1):49-52.
[6]李锋,卢水华.γ干扰素释放试验在儿童结核病和潜伏结核感染中的诊断价值[J].中国防痨杂志,2015,37(7):732-735.
[7]张腊红,洪理泉,罗贤,等.结核分支杆菌相关IFN-γ释放试验在结核病诊断及疗效监测中的应用[J].放射免疫学杂志,2013,26(6):760-764.
[8]SAHARIA K K,PETROVAS C,FERRANDO-MARTINEZ S,et al.Tuberculosis therapy modifies the cytokine profile,maturation state,and expression of inhibitory molecules on mycobacterium tuberculosis-specific CD4+T-Cells[J].PLoS One,2016,11(7):e0158262.
[9]SAUZULLO I,MENGONI F,ERMOCIDA A,et al.Interferon-gamma release assay in HIV-infected patients with active tuberculosis:impact of antituberculous drugs on host immune response[J].New Microbiologica,2014,37(2):153-161.
[10]中华医学会结核病学分会,《中华结核和呼吸杂志》编辑委员会.γ-干扰素释放试验在中国应用的建议[J].中华结核和呼吸杂志,2014,37(10):744-747.
