松嫩盐碱草地2种优势丛枝菌根真菌对紫花苜蓿耐盐性的影响
2018-01-12岳英男杨春雪
王 娜, 陈 飞, 岳英男, 杨春雪
(东北林业大学园林学院,黑龙江哈尔滨 150040)
松嫩草地生态系统是以多年生草本植物为主要生产者的陆地生态系统,地处半湿润半干旱过渡带,是世界三大苏打草原盐碱地之一的松嫩盐碱草地。目前,盐碱地面积已超过370万hm2,且以每年1.4%的速度扩展,松嫩草地生态系统正逐步走向衰老[1]。菌根是某些真菌侵染植物根部形成的共生体。菌根真菌菌丝由根部向土中伸展的长度远大于根毛的长度,因此扩大了根对土壤养分吸收的范围,而真菌则直接从植物中获得碳水化合物,两者互利互惠共同生活。丛枝菌根(Arbuscularmycorrhizae,简称AM)真菌是分布最广泛、最普遍的一类土壤微生物,能与90%以上的植物根系形成菌根共生体[2]。研究发现,菌根真菌广泛存在于盐碱地中,几乎所有的植物均具有菌根结构。菌根真菌不仅能够增强植物在盐碱土中的耐盐碱能力和促进植物生长、发育,还能够改善盐碱土的土壤结构[3-4]。
紫花苜蓿(Medicagosativa)是豆科、苜蓿属多年生草本植物,其株茎高挺、花色艳丽,常被作为园林背景材料广泛应用。近年来,紫花苜蓿和AM真菌的共生体系逐渐受到研究者的关注,研究表明,紫花苜蓿能与多种AM真菌在自然条件下形成共生体系[4]。本试验首先确定松嫩盐碱草地上的优势AM真菌菌种,并设置3种盐胁迫水平(0、0.5%、1.0% NaCl),研究在不同盐胁迫水平下,优势AM真菌对紫花苜蓿生长状况的影响,并从植物生长和生理变化角度初步探讨AM真菌提高羊草耐盐性的作用机制,可为松嫩盐碱草原退化生态系统的生物修复与重建提供科学的理论依据,同时扩大紫花苜蓿在有一定盐度园林绿地中的应用范围,对盐碱地的绿化具有重要的意义。
1 材料与方法
1.1 盐胁迫及接种菌剂试验设计
试验设3个盐胁迫水平,分别为0、0.5%、1.0% NaCl;同一盐胁迫水平下设4种接种处理:(1)每盆接种18 g灭菌的菌剂;(2)每盆接种18 g根内球囊霉(Glomusintraradices,简称GI)菌种;(3)每盆接种18 g地表球囊霉(Glomusversiforme,简称GV)菌种;(4)每盆接种18 g混合菌种(GI×GV,简称GIV)。共12个处理,每个处理重复6次。在东北林业大学光照培养室培养,温度为20~25 ℃,光照时间为 08:00—18:00,共 10 h。其中,紫花苜蓿种子购于黑龙江省农业科学院研究所;菌剂均购于北京农林科学院植物营养与资源研究所国家基金资助“中国丛枝菌根真菌种质资源库(简称BGC)”,其中GI是松嫩盐碱草地的优势菌种,GV是松嫩盐碱草地的常见菌种[5]。
1.2 AM真菌侵染率的测定
播种30 d后,取部分新鲜紫花苜蓿根部样品用于测定紫花苜蓿根系的菌根侵染情况。采用改良Phillips和Hayman染色法,用台盼蓝对根系进行染色,在MOTIC-BA400显微镜下镜检,计算菌根侵染率[6]。菌根侵染率=(侵染根段长/观察根段长)×100%。
1.3 植物生理指标的测定
植物生理指标的测定参照《植物生理学实验指导》[7]和《植物生理生化实验原理和技术》[8]的方法进行。个体生物量采用电子天平称质量法测定;叶绿素含量采用95%乙醇提取法测定;丙二醛(简称MDA)含量利用硫代巴比妥酸显色法测定;细胞膜透性采相对电导率表示;蛋白质含量采用考马斯亮蓝法测定。
1.4 数据统计分析
采用SPSS 17.0软件进行Duncan’s多重比较分析(P<0.05);采用SigmaPlot 10.0对数据进行分析和绘图。
2 结果与分析
2.1 不同浓度的NaCl溶液处理下菌根侵染率的变化
由图1可知,没有接种AM真菌的紫花苜蓿(CK)菌根侵染率为0,而接种处理的紫花苜蓿菌根均有不同程度的侵染。接种的菌剂不同,紫花苜蓿菌根的侵染率也有所不同。随着NaCl浓度的增加,相同菌剂接种时紫花苜宿的侵染率呈下降趋势。同一NaCl浓度处理下,接种GIV紫花苜蓿菌根的侵染率最高,接种GV的次之,接种GI最低。接种GIV的紫花苜蓿菌根在0、0.5%、1.0% NaCl溶液处理下,侵染率分别为45.77%、41.20%、37.77%,显著高于GV和GI菌剂同浓度NaCl溶液处理的菌根侵染率(P<0.05)。同一菌种在不同浓度NaCl处理下,菌根侵染率差异不显著,说明NaCl胁迫对植株侵染率的影响不明显。
2.2 不同浓度的NaCl溶液处理下个体生物量的变化
由图2可知,同一NaCl浓度胁迫下,接种AM真菌能明显减轻NaCl对紫花苜蓿个体生物量的胁迫,并表现出显著性差异(P<0.05)。接种GIV菌种的紫花苜蓿个体生物量显著高于不接种AM真菌植株的个体生物量(P<0.05),显著高于接种GI、GV菌种的植株的个体生物量。在0、0.5%、1.0% NaCl浓度下,接种GIV紫花苜蓿的个体生物量分别为2.30、1.86、1.33 g,比接种GV菌剂的紫花苜蓿的个体生物量分别高0.05、0.08、0.07 g,比接种GI菌剂的紫花苜蓿的个体生物量分别高0.16、0.27、0.21 g;紫花苜蓿个体生物量受NaCl溶液胁迫的影响较大,随着NaCl浓度的增加,个体生物量明显降低。
2.3 不同浓度的NaCl溶液处理下叶绿素含量的变化
叶绿体对盐分胁迫的感知十分灵敏,由于外界盐分过高,叶片水势降低,叶绿素会随之降解,从而抑制植物的生长和发育。由图3可知,在没有盐胁迫时,接种GIV菌剂能显著提高苜蓿中的叶绿素含量,达5.13 mg/g,比不接种菌剂、接种GI、GV分别高1.11、0.88、0.26 mg/g;随着NaCl浓度的升高,接种与未接种的紫花苜蓿叶绿素含量均明显降低;接种GIV和GV植株中的叶绿素含量显著高于未接种植株(P<0.05),且显著高于GI接种处理(P<0.05);在含盐量为 0.5% 时,NaCl胁迫对紫花苜蓿叶绿素含量的影响表现出差异显著性(P<0.05)。

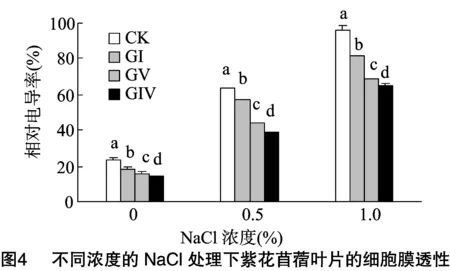
2.4 不同浓度的NaCl处理下细胞膜透性的变化
用相对电导率来表示苜蓿叶片的细胞膜透性,相对电导率越高,说明苜蓿细胞膜透性越强,受盐胁迫伤害越大。由图4可知,同一盐浓度下,接种AM真菌与不接种AM真菌的紫花苜蓿的相对电导率具有显著性差异(P<0.05);不同盐浓度下,接种GIV和GV的相对电导率显著低于对照的相对电导率(P<0.05),在0、0.5%、1.0% NaCl浓度处理下接种GIV的相对电导率分别比对照的相对电导率降低 40.00%、39.11%、32.72%,接种GV分别比对照降低 32.91%、31.26%、28.66%。无论是否接种AM真菌,随着盐浓度的增加,紫花苜蓿均表现出相对电导率明显增加的趋势。
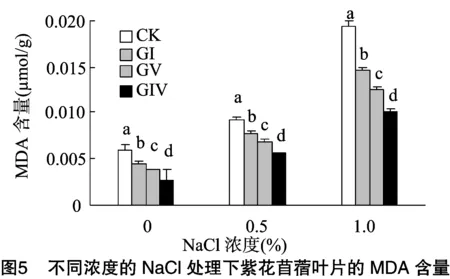
2.5 不同浓度的NaCl溶液处理下MDA含量的变化
MDA是反映膜质透性的重要指标,可反映细胞膜系统的损伤程度[9]。由图5可知,随着胁迫程度的加强,紫花苜蓿叶片的MDA含量明显增高;在没有NaCl胁迫的情况下,接种和未接种AM真菌的紫花苜蓿叶片中MDA的含量相差不大。在NaCl浓度为1.0%时,接种AM真菌能够降低MDA的含量且与对照差异显著(P<0.05),接种GIV菌种MDA的含量为0.010 2 μmol/g,比接种GV和GI植株叶片的MDA含量分别降低 18.02%、31.23%,比未接种植株的MDA含量降低47.32%; 随着盐浓度的增加, 接种AM真菌的紫花苜蓿叶片中MDA含量增加的幅度明显低于未接种植株叶片中MDA含量增加的幅度;随着NaCl盐胁迫程度的增强,AM真菌降低盐胁迫下紫花苜蓿叶片中MDA含量越明显。
3 结论与讨论
侵染率是植物根系受AM真菌侵染程度的指标,同时也反映了AM真菌的侵染力,进而体现AM真菌与植物互惠共生的亲和力程度。研究表明,逆境能够抑制AM真菌的形成,随着胁迫程度的加强,AM真菌的菌根侵染率随之降低,在盐胁迫下,AM真菌的菌根侵染率与NaCl含量表现为负相关关系,这是因为土壤中盐分过多会抑制AM真菌孢子芽管的萌发,从而影响菌丝的形成[10-12],本试验的研究结果与之一致。杨海霞等研究表明,混合接种摩西球囊霉(Glomusmosseae)和GI菌剂的白三叶草比单一接种2种菌剂的侵染率高[13],本试验的研究结果与之一致。
试验结果表明,相同NaCl水平下接种AM真菌对紫花苜蓿幼苗的生物量有明显的促进作用,其中接种混合菌剂的紫花苜蓿的个体生物量显著高于单一接种GV和GI菌剂的紫花苜蓿的个体生物量,这说明在盐胁迫环境下混合菌剂与紫花苜蓿幼苗形成的菌根共生体更有利于抵抗盐胁迫。植物生物量提高后向地下部分配,有利于提高紫花苜蓿根系对盐胁迫的耐受力,从而提高紫花苜蓿的生存力,这一结果与冯固等的研究结果[14]一致。
许多研究表明,土壤中盐浓度的增加会降低植物体内叶绿素的含量[15-16]。胡彦江等研究发现,接种摩西球囊霉的花生植株叶绿素含量明显增加[17],本试验结果也表明与未接种AM真菌的紫花苜蓿相比,接种AM真菌的植株能明显缓解盐胁迫对叶绿素的伤害,提高紫花苜蓿体内叶绿素的含量(P<0.05)。盐胁迫环境下,植物由于渗透作用导致细胞胞液外渗,使细胞外的电导率增大,因此,电导率是反映细胞膜受损状况的直观生理指标。本试验中,接种AM真菌能显著降低植物叶片的膜质透性(P<0.05),缓解盐胁迫所造成的生理影响,这一结果与Garg等的研究结果[18]一致。
MDA是膜脂过氧化的终产物之一,能够反映细胞受胁迫的程度[19]。盛敏等研究表明,接种AM真菌植株叶片中的MDA含量低于未接种植株叶片中的MDA含量,可以缓解盐胁迫对玉米的伤害,并提高玉米的耐盐性[20]。试验结果表明,随着NaCl胁迫的增强,紫花苜蓿体内MDA的含量显著升高,接种AM真菌的紫花苜蓿体内MDA含量的增幅较小,其中以接种混合菌剂的植株体内MDA含量的增幅最小,在NaCl浓度为1.0%时效果最明显。这说明,混合接种能有效降低紫花苜蓿体内的MDA含量,降低植物细胞质膜受损害的程度,在一定程度上提高植物的耐盐性。
紫花苜蓿在0、0.5%、1.0% NaCl胁迫处理后,生长发育明显受到抑制,个体生物量随胁迫程度的加强逐渐降低,接种AM真菌抑制了盐胁迫对叶片、膜保护系统的伤害,降低了叶片的相对电导率和MDA的含量,促进了个体生物量的积累,增加了叶绿素含量。接种3种AM真菌的植株的菌根侵染率随NaCl浓度的增加而下降,侵染能力表现为GIV>GV>GI,混合菌剂的接种效果明显高于单一菌剂。此研究结果可为松嫩盐碱草地退化生态系统的生物修复与重建提供科学的理论依据,同时扩大紫花苜蓿在有一定盐度园林绿地中的应用范围,对盐碱地的绿化具有重要的意义。
[1]武羡慧,杨 进. 半干旱平原盐碱区浅部地层基本物质成分的粒度结构与极化率的相关性研究[C]. 中国地球科学联合学术年会,2014:1448-1449.
[2]袁维风,徐德聪. 丛枝菌根在植被恢复中的应用研究进展[J]. 广东农业科学,2011(7):161-163.
[3]Bonfim J A,Vasconcellos R L F,Gumiere T,et al. Diversity ofArbuscularmycorrhizalfungi in aBrazilianatlanticforest toposequence[J]. Microbial Ecology,2016,71(1):164-177.
[4]宰学明,郝姗姗,邵志广,等. 摩西球囊霉对NaCl胁迫下竹柳苗叶绿素含量和荧光参数的影响[J]. 江苏农业科学,2013,41(8):175-178.
[5]杨春雪,陈 飞,岳英男,等. 松嫩盐碱草地26种植物根围丛枝菌根真菌多样性特征[J]. 草业科学,2015,32(12):2008-2020.
[6]杨春雪,岳英男. 松嫩盐碱草地土壤理化特性与丛枝菌根真菌侵染的相关性[J]. 草业科学,2014,31(8):1437-1444.
[7]张志良,瞿伟菁. 植物生理学实验指导[M]. 3版. 北京:高等教育出版社,2003:70.
[8]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[9]宋丹华,黄俊华,王 丰,等. 铃铛刺苗期对持续干旱胁迫的生理响应[J]. 江苏农业科学,2016,44(5):292-295,525.
[10]Yang Y H,Chen Y N,Li W H.Arbuscularmycorrhizalfungi infection in desert riparian forest and its environmental implications:a case study in the lower reach of Tarim River[J]. Progress in Natural Science,2008,18(8):983-991.
[11]刘润进,陈应龙. 菌根学[M]. 北京:科学出版社,2006:19-26.
[12]Selvakumar G,Krishnamoorthy R,Kim K,et al. Propagation technique ofArbuscularmycorrhizalfungi isolated from coastal reclamation land[J]. European Journal of Soil Biology,2016,74:39-44.
[13]杨海霞,李士美,李 敏,等. 丛枝菌根真菌对白三叶耐盐性的影响[J]. 青岛农业大学学报(自然科学版),2014,31(2):85-90.
[14]冯 固,张福琐. 丛枝菌根真菌对棉花耐盐性的影响研究[J]. 中国生态农业学报,2003,11(2):21-24.
[15]Karimi G,Ghorbanli M,Heidari H,et al. The effects of NaCl on growth,water relations,osmolytes and ion content inKochiaprostrata[J]. Biologia Plantarum,2005,49(2):301-304.
[16]Athar H,Zafar Z U,Ashraf M. Glycinebetaine improved photosynthesis in canola under salt stress:evaluation of chlorophyll fluorescence parameters as potential indicators[J]. Journal of Agronomy and Crop Science,2015,201(6):428-442.
[17]胡彦江,杨德翠. 摩西球囊霉促进花生光合作用的机制[J]. 江苏农业科学,2016,44(5):145-148.
[18]Garg N,Bhandari P. Interactive effects of silicon andArbuscularmycorrhizain modulating ascorbate-glutathione cycle and antioxidant scavenging capacity in differentially salt-tolerantCicerarietinumL. genotypes subjected to long-term salinity[J]. Protoplasma,2016,253(5):1325-1345.
[19]Siddiqui M H,Al‐Whaibi M H,Faisal M,et al. Nano‐silicon dioxide mitigates the adverse effects of salt stress onCucurbitapepoL.[J]. Environmental Toxicology and Chemistry,2014,33(11):2429-2437.
[20]盛 敏,唐 明,张峰峰,等. 盐胁迫下接种AM真菌对玉米耐盐性的影响[J]. 西北植物学报,2011,31(2):332-337.
