溃疡性结肠炎患者肠道菌群变化与细胞因子、TLRs分子表达的相关性研究
2018-01-11李琳,钟青
李 琳,钟 青
溃疡性结肠炎患者肠道菌群变化与细胞因子、TLRs分子表达的相关性研究
李 琳,钟 青
目的探讨溃疡性结肠炎患者肠道菌群变化与细胞因子、TOLL样受体(Toll-like receptors,TLRs)分子表达的相关性。方法将2015年6月—2016年12月在山东省医学科学院第三附属医院确诊并接受治疗的溃疡性结肠炎患者78例作为试验组,同时选择未患溃疡性结肠炎的80例健康者作为对照组。分别对试验组和对照组进行肠道菌群检测,肠黏膜TLR2、TLR4、TLR5、TLR9分子表达检测和外周血IL-4、IL-6、IL-17、IL-23、TNF-α等炎性细胞因子表达检测,分析炎性细胞因子和TLRs表达与肠道菌群变化的关系。结果试验组双歧杆菌、乳杆菌含量明显低于对照组(P均<0.05),拟杆菌、肠杆菌、肠球菌、梭杆菌含量明显高于对照组(P均<0.05);试验组肠黏膜组织中TLR2、TLR4、TLR5、TLR9表达明显高于对照组(P均<0.05);试验组外周血IL-4表达低于对照组,IL-6、IL-17、IL-23、TNF-α等炎性细胞因子表达高于对照组(P均<0.05)。Pearson相关性分析显示,TLR2、TLR4、TLR5、TLR9表达与拟杆菌、肠杆菌、肠球菌含量呈正相关,与双歧杆菌、乳杆菌含量呈负相关;与IL-6、IL-17、IL-23、TNF-α表达呈正相关,与IL-4表达呈负相关。结论溃疡性结肠炎患者正常肠道菌群平衡被打破,促炎因子表达增加,抑炎因子表达减少,TLRs分子表达增加。肠道菌群紊乱可能通过增强TLRs分子表达来促进促炎因子的分泌,介导肠黏膜炎性反应。
溃疡性结肠炎;肠道菌群;炎性细胞因子;炎症反应
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性炎症性肠道疾病,主要临床特征有腹痛、腹泻和黏液脓血便,大肠黏膜和黏膜下层是主要病变区域,病情迁延不愈、反复发作,给患者造成巨大的痛苦和心理压力。UC发病机制尚未完全阐明,但有研究证实其发作与环境、遗传、免疫功能及肠道菌群密切相关[1]。肠道菌群数量巨大、种类繁多,在正常情况下主要参与肠道内物质的分解和代谢,能够维持肠道正常的生理功能和抑制疾病的发生。一旦发生慢性疾病,肠道菌群的数量和种类都会发生改变,在内源性肠道感染和抑制免疫系统中发挥作用[2]。免疫应答紊乱和细胞炎性反应是造成UC的关键病理环节[3],而肠道菌群的失调是造成免疫应答紊乱和细胞炎性反应的关键因素。因此,许多研究认为肠道菌群的改变与UC的发生息息相关[4]。关于肠道菌群失调导致肠黏膜损伤的机制尚未明确。本次研究就UC患者肠道菌群变化与细胞因子、TOLL样受体(Tolllike receptors,TLRs)表达的相关性展开研究,为临床治疗提供新思路。
1 对象与方法
1.1 对象 2015年6月—2016年12月在山东省医学科学院第三附属医院确诊并接受治疗的UC患者78例为试验组,同时选择80例未患UC的健康者为对照组。对照组男43例,女37例,年龄18~70岁,平均年龄(48.7±13.5)岁,经肠镜检查确认排除肠道疾病,临床体征证实身体健康,3个月内无抗生素服用记录。试验组男42例,女36例,年龄20~70岁,平均年龄(49.1±12.8)岁,经肠镜检查和病理学检查确诊为UC,排除3个月内有抗生素、激素和免疫抑制剂服用记录的患者,以及肠结核、寄生虫感染等感染性结肠炎患者。试验组与对照组在性别、年龄方面差异无统计学意义(P>0.05),见表1。
表1 2组患者基本情况比较(±s)Table 1 Comparison of general information between 2 groups(±s)
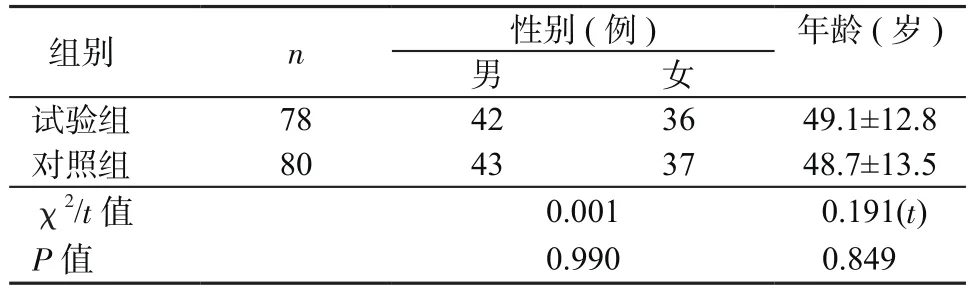
表1 2组患者基本情况比较(±s)Table 1 Comparison of general information between 2 groups(±s)
组别 n 性别(例) 年龄(岁)男女试验组 78 42 36 49.1±12.8对照组 80 43 37 48.7±13.5 χ2/t值 0.001 0.191(t)P值 0.990 0.849
1.2 诊断标准 根据《炎症性肠病诊断与治疗的共识意见(2012年·广州)》[5]中UC诊断部分中相关标准。临床表现:腹泻、腹痛、黏液脓血便持续反复发作,伴有不同程度的全身症状,病程4周以上。结肠镜辅助检查:①多发性、弥漫性溃疡或糜烂;②黏膜血管纹理不清晰,有充血、水肿、紊乱等;③结肠袋囊变钝、变浅甚至消失,假息肉或桥形黏膜。
1.3 方法
1.3.1 肠道菌群检测 2组研究对象均随机挑取0.5 g新鲜粪便,电子称重后加入4.5 ml稀释液稀释,取10 μl接种于相应的培养基上。根据不同菌种使用培养基,37℃温箱内培养48 h后,细菌革兰染色,计算菌落平均数,计算每克粪便中含有的菌群数目。使用MALDI Biotyper系统(德国BRUKER公司)进行细菌质谱鉴定。采用鲎试剂三肽显色基质偶氮法检测内毒素。
1.3.2 细胞因子检测 采用ELISA法对人体外周血IL-4、IL-6、IL-17、IL-23和TNF-α细胞因子含量进行测定。所有研究对象均取清晨空腹外周静脉血5 ml,血清分离后于-70℃保存待检。使用ELISA试剂盒(美国Genzyme公司)检测血清,严格遵循试剂盒操作说明书执行。
1.3.3 TLRs分子表达检测 进行肠镜检查时,取适量试验组患者病变肠黏膜组织和对照组健康者正常肠黏膜组织,加入RIPA裂解液(上海基尔顿生物有限公司)后充分匀浆,离心分离上清,使用ELISA试剂盒(上海酶联生物公司)测定TLR2、TLR4、TLR5以及TLR9蛋白表达量,抗体购于英国abcam公司。采用BCA试剂盒(美国Thermo Fisher Scientific公司)测定总蛋白含量,并计算每毫克蛋白中TLRs蛋白含量。
1.4 统计学处理 将所得数据输入SPSS 17.0统计学软件,采用 Shapiro-Wilk 进行正态性检验,样本均满足正态分布,用±s表示,2组比较用独立样本t检验(方差齐)。相关性分析采用 Person相关分析。P<0.05表示差异有统计学意义。
2 结 果
2.1 2 组肠道菌群含量比较 2组双歧杆菌、乳杆菌、拟杆菌、肠杆菌、肠球菌、梭杆菌含量差异有统计学意义(P均<0.05),其中试验组双歧杆菌、乳杆菌含量明显低于对照组,拟杆菌、肠杆菌、肠球菌、梭杆菌含量明显高于对照组,见表2。
表2 2组肠道菌群含量比较(CFU/g,±s)Table 2 Comparison of intestinal microflora contents between 2 groups(CFU/g,±s)
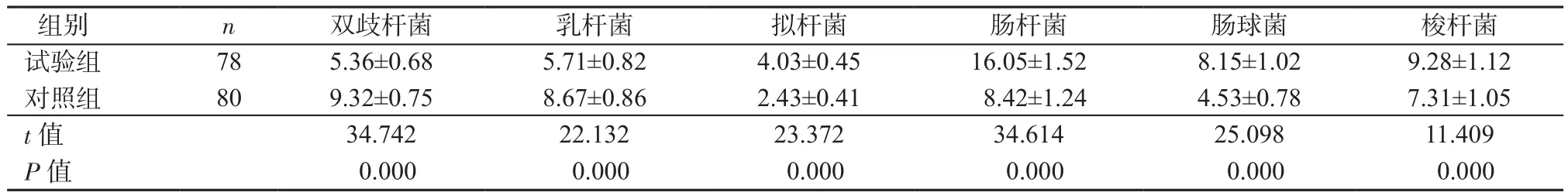
表2 2组肠道菌群含量比较(CFU/g,±s)Table 2 Comparison of intestinal microflora contents between 2 groups(CFU/g,±s)
组别 n 双歧杆菌 乳杆菌 拟杆菌 肠杆菌 肠球菌 梭杆菌试验组 78 5.36±0.68 5.71±0.82 4.03±0.45 16.05±1.52 8.15±1.02 9.28±1.12对照组 80 9.32±0.75 8.67±0.86 2.43±0.41 8.42±1.24 4.53±0.78 7.31±1.05 t值 34.742 22.132 23.372 34.614 25.098 11.409 P值 0.000 0.000 0.000 0.000 0.000 0.000
2.2 2组肠黏膜中TLRs表达比较 试验组肠黏膜组织中TLR2、TLR4、TLR5、TLR9表达均明显高于对照组(P均<0.05),见表3。Pearson相关性分析显示,病变黏膜中TLR2、TLR4、TLR5、TLR9表达与拟杆菌(r=0.623,P=0.015)、肠杆菌(r=0.634,P=0.013)、肠球菌(r=0.652,P=0.010)、梭杆菌(r=0.545,P=0.024)含量呈正相关,与双歧杆菌(r=-0.681,P=0.015)、乳杆菌(r=-0.652,P=0.018)含量呈负相关。
表3 2组肠黏膜中TLR2、TLR4、TLR5、TLR9表达比较(μg/mg,±s)Table 3 Comparison of TLR2,TLR4,TLR5,TLR9 expressions in intestinal mucosa between 2 groups(μg/mg,±s)
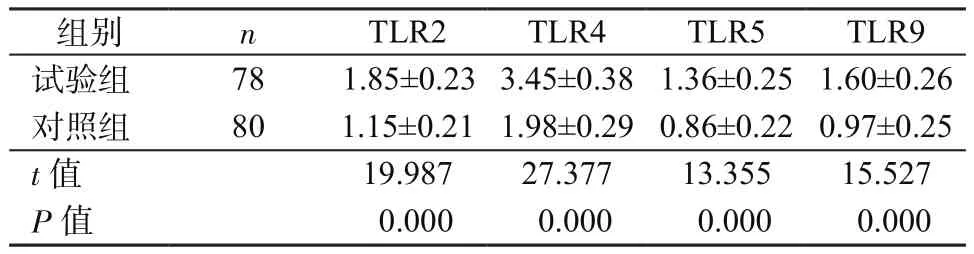
表3 2组肠黏膜中TLR2、TLR4、TLR5、TLR9表达比较(μg/mg,±s)Table 3 Comparison of TLR2,TLR4,TLR5,TLR9 expressions in intestinal mucosa between 2 groups(μg/mg,±s)
组别 n TLR2 TLR4 TLR5 TLR9试验组 78 1.85±0.233.45±0.381.36±0.25 1.60±0.26对照组 80 1.15±0.21 1.98±0.290.86±0.22 0.97±0.25 t值 19.987 27.377 13.355 15.527 P值 0.000 0.000 0.000 0.000
2.3 2组外周血细胞因子表达比较 2组外周血IL-4、IL-6、IL-17、IL-23及 TNF-α表达差异有统计学意义(P均<0.05),其中试验组IL-4表达明显低于对照组(P<0.05),IL-6、IL-17、IL-23及TNF-α表达明显高于对照组(P均<0.05),见表4。Pearson相关性分析显示,病变黏膜中TLR2、TLR4、TLR5、TLR9表达与IL-6(r=0.478,P=0.028)、IL-17(r=0.511,P=0.011)、IL-23(r=0.605,P=0.008)及 TNF-α(r=0.658,P=0.006)表达呈正相关,与IL-4(r=-0.687,P=0.013)表达呈负相关。
表4 2组外周血L-4、IL-6、IL-17、IL-23、TNF-α表达比较(ng/ml,±s)Table 4 Comparison of IL-4,IL-6,IL-17,IL-23,TNF-α expressions in peripheral blood between 2 groups(ng/ml,±s)
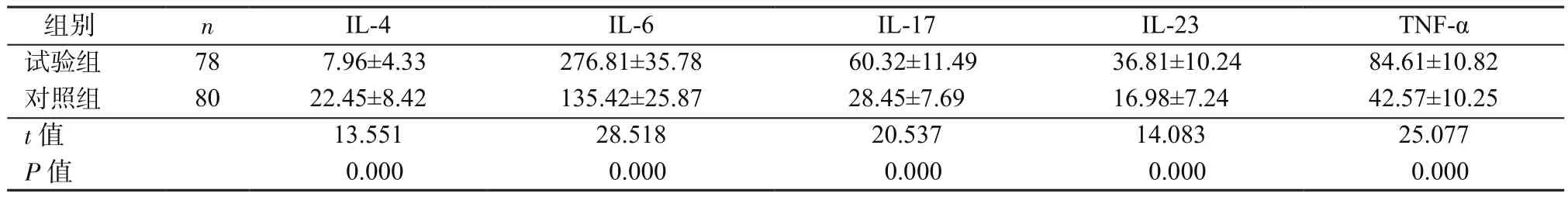
表4 2组外周血L-4、IL-6、IL-17、IL-23、TNF-α表达比较(ng/ml,±s)Table 4 Comparison of IL-4,IL-6,IL-17,IL-23,TNF-α expressions in peripheral blood between 2 groups(ng/ml,±s)
组别 n IL-4 IL-6 IL-17 IL-23 TNF-α试验组 78 7.96±4.33 276.81±35.78 60.32±11.49 36.81±10.24 84.61±10.82对照组 80 22.45±8.42 135.42±25.87 28.45±7.69 16.98±7.24 42.57±10.25 t值 13.551 28.518 20.537 14.083 25.077 P值 0.000 0.000 0.000 0.000 0.000
3 讨 论
正常人体肠道内含有大量细胞,且种类繁多,数量巨大,主要集中在结肠和小肠末端。肠道菌群按照一定的比例组合,各菌种之间互相依存、互相制约,在质量和数量上形成一个总体的生态平衡[6]。按照种类划分,肠道菌群可以分为以下3种[7]:①与人体共生细菌。此类细菌能够参与到分解、代谢,调节免疫力等作用中来,被称为肠道优势菌群,主要代表有双歧杆菌、拟杆菌等。②机会致病菌。此类细菌正常情况下在肠道内数量较少,一旦机体免疫功能下降就会大量增殖,引起炎症反应等,被称为非优势菌群,主要有肠杆菌和肠球菌等。③病原菌。此类细菌不在肠道内长期定植,大部分为过路菌,如变形杆菌等。各组细菌相互依存,共同维系着消化道的稳定与平衡。一旦发生菌群失调,就会引发多种消化道疾病。大肠杆菌等致病菌在菌群失调时侵袭能力增强,对肠黏膜造成损伤[8]。双歧杆菌和乳杆菌则能对抗致病菌的侵袭。在本次研究中发现,与对照组相较,试验组UC患者的双歧杆菌、乳杆菌含量明显降低(P均<0.05),拟杆菌、肠杆菌、肠球菌含量明显提高(P均>0.05)。肠道菌群在物质代谢和免疫功能维持方面发挥着重要的作用[9],肠道内致病菌和病原菌较少,在正常范围时不会致病,一旦数量超过正常范围就会致病。UC的发生、迁延不愈以及反复发作与肠道菌群失调有密切的关系[10]。
肠道菌群失调和UC发展之间的相关性研究开展较多,但其引起肠黏膜炎症性损伤的分子机制尚不能明确。众多研究结果均显示TLRs对UC的发生与发展都有着重要的影响[11]。TLRs是一种先天形成的免疫蛋白,对细菌和病毒进行识别是其主要功能,同时也在机体免疫系统中发挥重要作用。TLR4是较早发现的TLRs之一,主要功能是识别脂多糖,同时能够产生传通信号穿过细胞膜加快炎症因子的增殖[12]。为了明确UC发展过程中TLRs发挥的作用,本研究就试验组病变肠黏膜组织和对照组正常肠黏膜组织内TLRs的表达进行了对比分析,结果显示:试验组患者病变肠黏膜组织中TLR2、TLR4、TLR5以及TLR9表达均明显高于对照组(P均<0.05)。通过相关性分析发现,TLR2、TLR4、TLR5以及TLR9蛋白的表达与拟杆菌、肠杆菌以及肠球菌的含量呈正相关,与双歧杆菌和乳杆菌的含量呈负相关。本次研究结果表明,TLRs的高表达可能与UC的发生关系密切,UC患者肠道菌群失调能够增强肠黏膜中TLR2、TLR4、TLR5以及TLR9蛋白的表达,介导炎性反应。
TNF-α是炎症启动因子,在炎症发生发展过程中必不可少。IL-4为抗炎因子,可以下调炎症细胞因子基因的转录和分泌,具有抗炎和免疫调节的作用,是肠道免疫的重要因子[13]。IL-6是一种促炎细胞因子,可以介导炎性反应,具有多重免疫调节功能,对机体生理平衡的维持至关重要。IL-17由Th17细胞分泌得到的促炎因子,对肠黏膜的炎症性损伤具有直接介导作用[14]。IL-23是由B淋巴细胞和单核巨噬细胞分泌得到的促炎因子,对Th17细胞具有激活作用,可加剧肠黏膜的炎性反应[15]。在本研究中,试验组外周血IL-4表达明显低于对照组(P<0.05),IL-6、IL-17、IL-23以及TNF-α表达明显高于对照组(P均<0.05)。通过相关性分析发现,TLR2、TLR4、TLR5以及TLR9蛋白的表达与IL-4表达呈负相关,与IL-6、IL-17、IL-23及TNF-α表达呈正相关。研究结果表明,TLRs的高表达促进IL-4等抑炎因子水平下降,促进IL-6、IL-17、IL-23及TNF-α等促炎因子水平提高,通过其来介导炎性反应。
综上所述,UC患者正常肠道菌群平衡被打破,促炎因子表达增加,抑炎因子表达减少,TLRs分子表达增加。肠道菌群紊乱可能会通过增强TLRs分子表达来促进促炎因子的分泌,介导肠黏膜炎性反应。
[1]张莹,熊晶晶,黄永坤,等.美沙拉秦、蒙脱石散和酪酸梭菌对溃疡性结肠炎大鼠血细胞因子的影响[J].中国免疫学杂志,2015,31(2):240-246,249.
[2]Li SQ.Detection of intestinal flora levels as well as cytokine and TLRs molecule expression in patients with ulcerative colitis[J].海南医科大学学报(英文版),2017,23(5):95-98.
[3]闫曙光.乌梅丸及其拆方对溃疡性结肠炎大鼠细胞因子、炎性介质及TLR4/NF-κB信号通路影响的实验研究[D].成都:成都中医药大学,2012.
[4]刘淑清.TLR2介导TB10.4激活RAW264.7通路及细胞因子表达的研究[D].北京:中国农业科学院,2014.
[5]中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2012年·广州)[J].中华内科杂志,2012,51(10):818-831.
[6]黄坤,吴丽丽,杨云生.肠道微生态与人类疾病关系的研究进展[J].传染病信息,2017,30(3):133-137.
[7]Fernandes P,MacSharry J,Darby T,et al.Differential expression of key regulators of Toll-like receptors in ulcerative colitis and Crohn's disease:a role for Tollip and peroxisome proliferatoractivated receptor gamma?[J].Clin Exp Immunol,2016,183(3):358-368.
[8]Tan Y,Zou KF,Qian W,et al.Expression and implication of tolllike receptors TLR2,TLR4 and TLR9 in colonic mucosa of patients with ulcerative colitis[J].J Huazhong Univ Sci Technolog Med Sci,2014,34(5):785-790.
[9]邹颖,迟宏罡,欧阳霖芮,等.黄芩苷对实验性结肠炎小鼠TLRs/MyD88通路的作用研究[J].天然产物研究与开发,2014,26(6):952-956.
[10]崔路佳,王裕宣.溃疡性结肠炎患者肠道菌群改变与炎性指标的相关性研究[J].海南医学,2014,25(20):3014-3016.
[11]刘伟,刘翔,林漫鹏,等.溃疡性结肠炎患者正常与病变肠段肠道菌群比较[J].湖北民族学院学报(医学版),2011,28(1):4-6.
[12]刘志威,王学群,李甜甜.溃疡性结肠炎患者肠道菌群变化的临床意义[J].胃肠病学和肝病学杂志,2016,25(5):554-556.
[13]安婷婷,朱西杰,张蔷,等.复方蜥蜴散不同微粒组合剂干预大鼠溃疡性结肠炎模型TLRs/MyD88信号通路及下游炎症因子的实验研究[J].上海中医药杂志,2016,50(11):82-88.
[14]蒋曼,姚萍,杨涛,等.实时荧光定量PCR法研究溃疡性结肠炎患者肠道双歧杆菌属、柔嫩梭菌属及拟杆菌属量的变化[J].中国微生态学杂志,2013,25(11):1245-1249,1254.
[15]单佩英.溃疡性结肠炎患者肠道菌群多样性及炎症细胞因子变化的研究[D].大连,大连医科大学,2012.
Correlation of intestinal microflora with cytokines and Toll-like receptors expression in patients with ulcerative colitis
Li Lin,ZHONG Qing*
Digestive System Department, Shandong Institule of Parasitical Disease,Shandong Academy of Medical Science,Jining 272033,China
*Corresponding author,E-mail:o1r1tp@163.com
ObjectiveTo investigate the correlation of the changes of intestinal flora with the expression of cytokines and Tolllike receptors (TLRs) molecules in patients with ulcerative colitis.MethodsFrom June 2015 to December 2016,78 patients with ulcerative colitis diagnosed and treated in the Third Affiliated Hospital of Shandong Academy of Medical Sciences were selected as the experimental group,and 80 healthy subjects were chosen as the control group.The intestinal flora detection,expression of TLR2,TLR4,TLR5,TLR9 molecules in intestinal mucosa, expression of IL-4,IL-6,IL-17,IL-23,TNF-α and other inflammatory cytokines in peripheral blood in the experimental group and control group were analyzed respectively.The correlation of inflammatory cytokines and the expression of TLRs with the change of intestinal flora was also analyzed.ResultsThe contents of bifidobacterium and lactobacillus in the experimental group were significantly lower than those in the control group (P<0.05),while the contents of bacteroides,enterobacter,enterococcus and fusobacterium were significantly higher (P<0.05).The expressions of TLR2,TLR4,TLR5 and TLR9 in intestinal mucosa of the experimental group were significantly higher than those of the control group (P<0.05).The expression of IL-4 in peripheral blood of the experimental group was lower than that of the control group,and the expressions of IL-6,IL-17,IL-23,TNF-α and other inflammatory cytokines were higher than that of the control group (P<0.05).Pearson correlation analysis showed that TLR2,TLR4,TLR5,TLR9 expressions were positively correlated with the contents of bacteroides,enterobacter and enterococcus,and negatively correlated with bifidobacterium and lactobacillus; it was also positively correlated with IL-6,IL-17,IL-23,TNF-α expression and negatively correlated with IL-4 expression.ConclusionsNormal intestinal flora balance of ulcerative colitis patients is broken,the expression of proinflammatory cytokines increases,the expression of proinflammatory factors decreases,and the expression of TLRs molecules increases.The disorder of intestinal flora promotes the secretion of proinflammatory cytokines by enhancing the expression of TLRs molecules and mediates the inflammatory response of the intestinal mucosa.
ulcerative colitis; intestinal flora; inflammatory cytokines; inflammatory response
R574.62;R378
A
1007-8134(2017)06-0361-04
10.3969/j.issn.1007-8134.2017.06.012
272033 济宁,山东省医学科学院 山东省寄生虫病防治研究所消化内科(李琳);650041,昆明市第三人民医院肝病二科(钟青)
钟青,E-mail:o1r1tp@163.com
(2017-11-20 收稿 2017-12-14 修回)
(本文编辑 赵雅琳)
